Похожие презентации:
Фенолы
1.
ФенолыГидроксильная группа связана с ароматическим яддром
OH
OH
OH
HO
OH
OH
Фенол,
одноатомный
фенол
1,4-Дигидроксибензол
Гидрохинон,
двухатомный фенол
Флюроглюцин,
трехатомный
фенол
1
2.
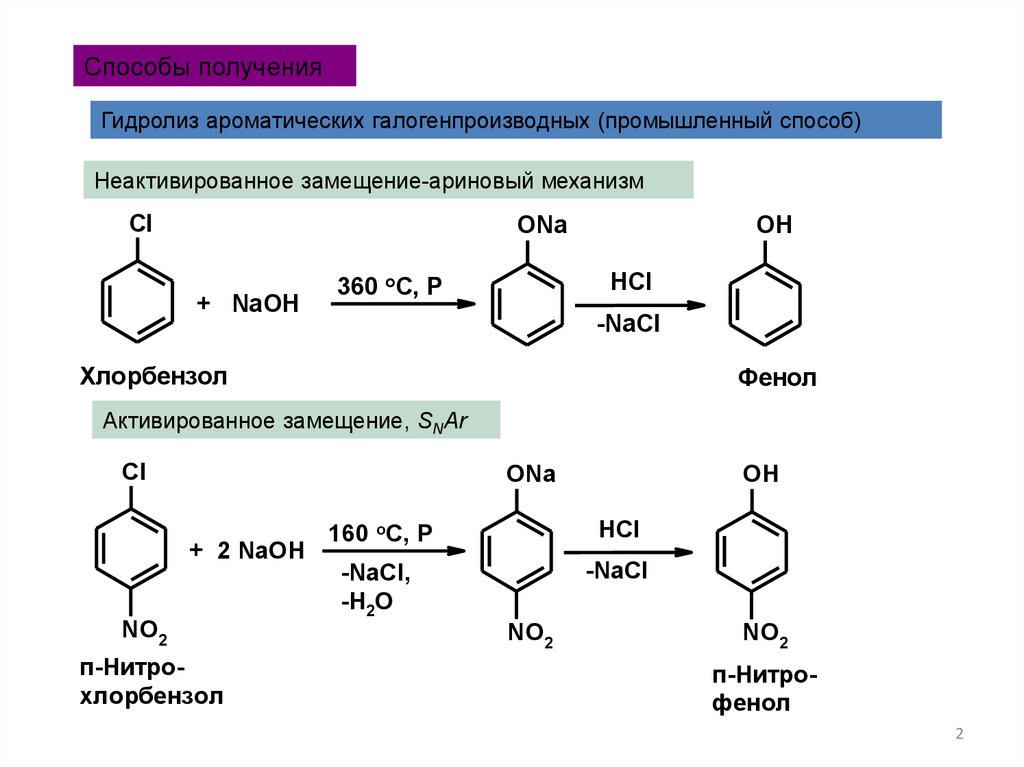
Способы полученияГидролиз ароматических галогенпроизводных (промышленный способ)
Неактивированное замещение-ариновый механизм
Cl
ONa
+ NaOH
OH
HCl
360 oC, P
-NaCl
Хлорбензол
Фенол
Активированное замещение, SNAr
Cl
ONa
+ 2 NaOH
NO2
п-Нитрохлорбензол
OH
160 oC, P
HCl
-NaCl,
-H2O
-NaCl
NO2
NO2
п-Нитрофенол
2
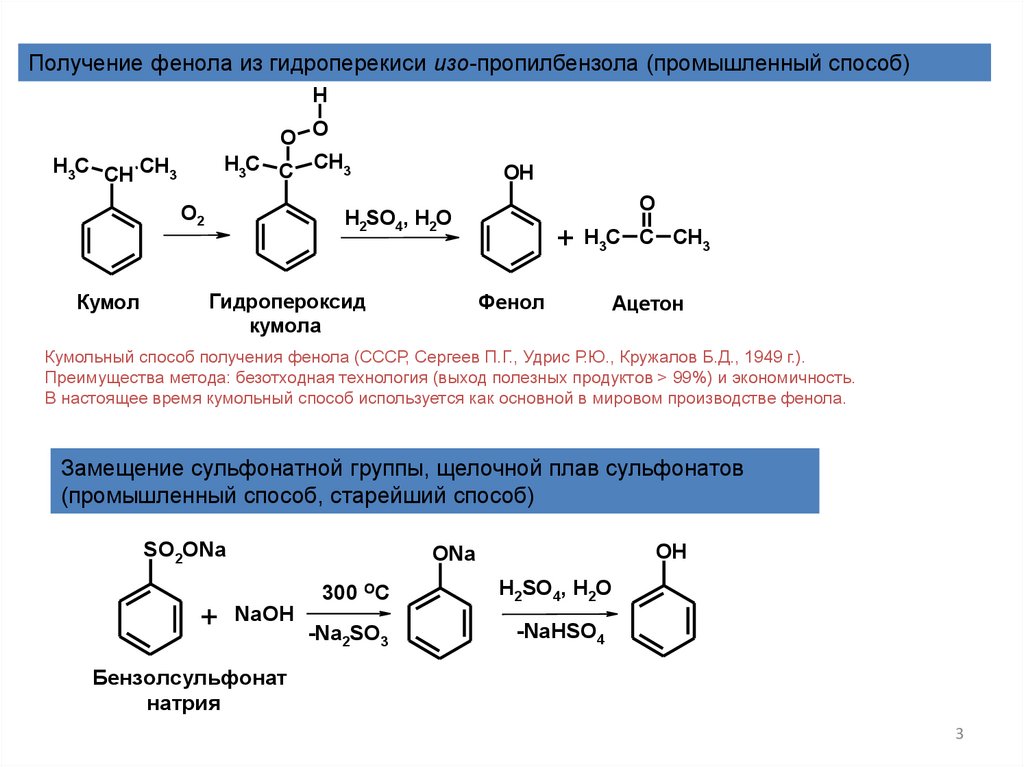
3.
Получение фенола из гидроперекиси изо-пропилбензола (промышленный способ)H
O O
H3C C CH3
H3C CH CH3
О2
Кумол
OH
O
Н2SO4, H2O
Гидропероксид
кумола
+
H3C C CH3
Фенол
Ацетон
Кумольный способ получения фенола (СССР, Сергеев П.Г., Удрис Р.Ю., Кружалов Б.Д., 1949 г.).
Преимущества метода: безотходная технология (выход полезных продуктов > 99%) и экономичность.
В настоящее время кумольный способ используется как основной в мировом производстве фенола.
Замещение сульфонатной группы, щелочной плав сульфонатов
(промышленный способ, старейший способ)
SO2ONa
300 OC
+
OH
ONa
NaOH
-Na2SO3
H2SO4, Н2О
-NaHSO4
Бензолсульфонат
натрия
3
4.
Замещение диазогруппы на гидроксил+
NH2
N2OSO3H
NaNO2 + 2H2SO4
H2O
+ N2 + H2SO4
5 oC
Анилин
OH
Фенилдиазоний
гидросульфат
Мировые мощности по производству фенола в 2011 г находились на уровне 8,5 млн. тонн.
Фенолы в природе
Ванилин
Гвоздичное
масло
Тимьян
4
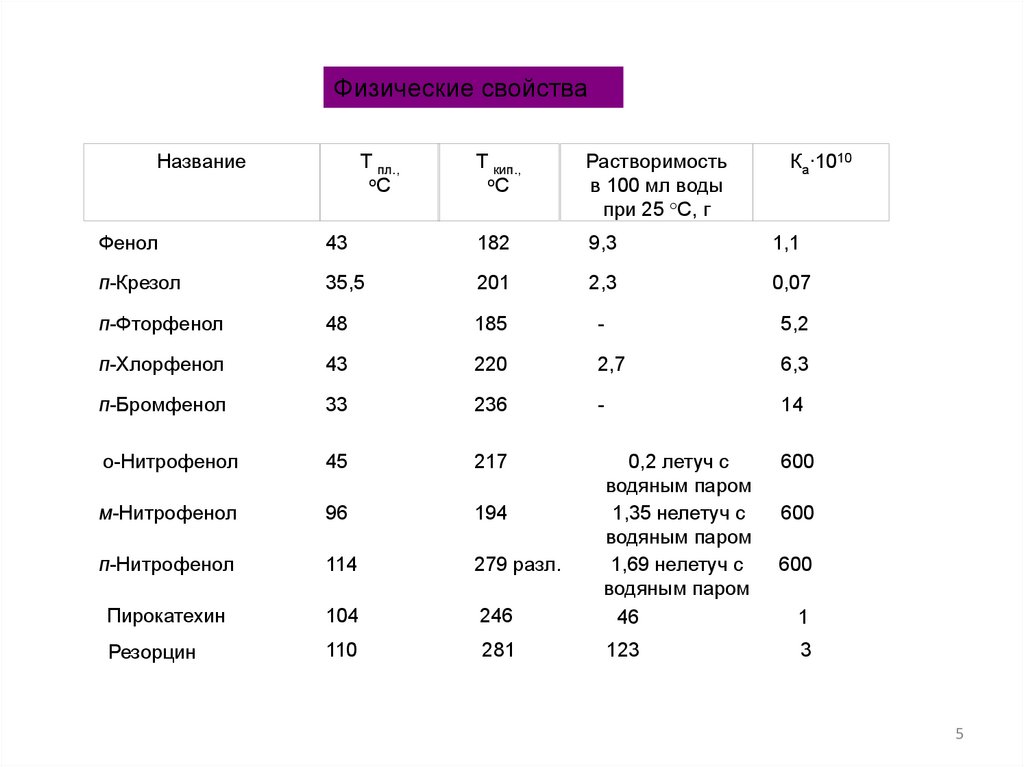
5.
Физические свойстваНазвание
Т пл.,
оС
Т кип.,
оС
Растворимость
в 100 мл воды
при 25 °С, г
Ка∙1010
Фенол
43
182
9,3
1,1
п-Крезол
35,5
201
2,3
0,07
п-Фторфенол
48
185
-
5,2
п-Хлорфенол
43
220
2,7
6,3
п-Бромфенол
33
236
-
14
о-Нитрофенол
45
217
м-Нитрофенол
96
194
п-Нитрофенол
114
279 разл.
Пирокатехин
104
246
0,2 летуч с
водяным паром
1,35 нелетуч с
водяным паром
1,69 нелетуч с
водяным паром
46
Резорцин
110
281
123
600
600
600
1
3
5
6.
ORGANIC CHEMISTRY, EIGHTH EDITIONFrancis A. Carey (University of Virginia), Robert M. Giuliano (Villanova University)
6
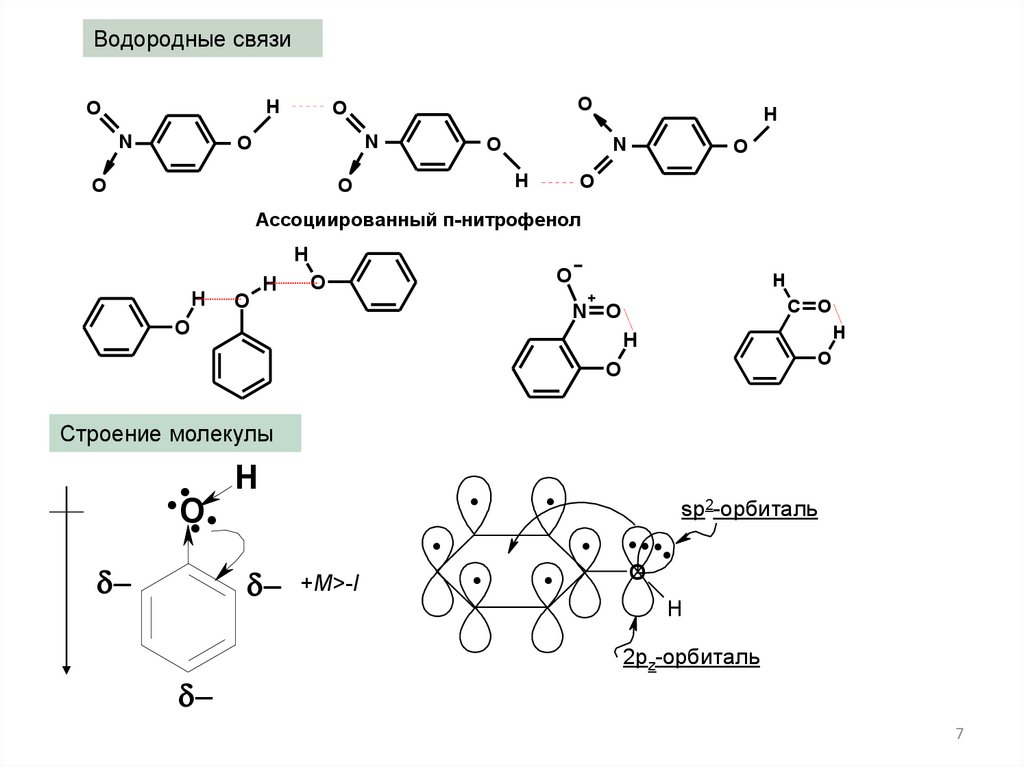
7.
Водородные связиH
O
N
O
O
N
O
O
O
N
H
O
H
O
O
Ассоциированный п-нитрофенол
H
H
O
H
O
O
H
+
C O
N O
O
H
H
O
O
Строение молекулы
..O. H
.
.
+M>-I
.
.
.
.
. ....
O
sp2-орбиталь
H
2pz-орбиталь
7
8.
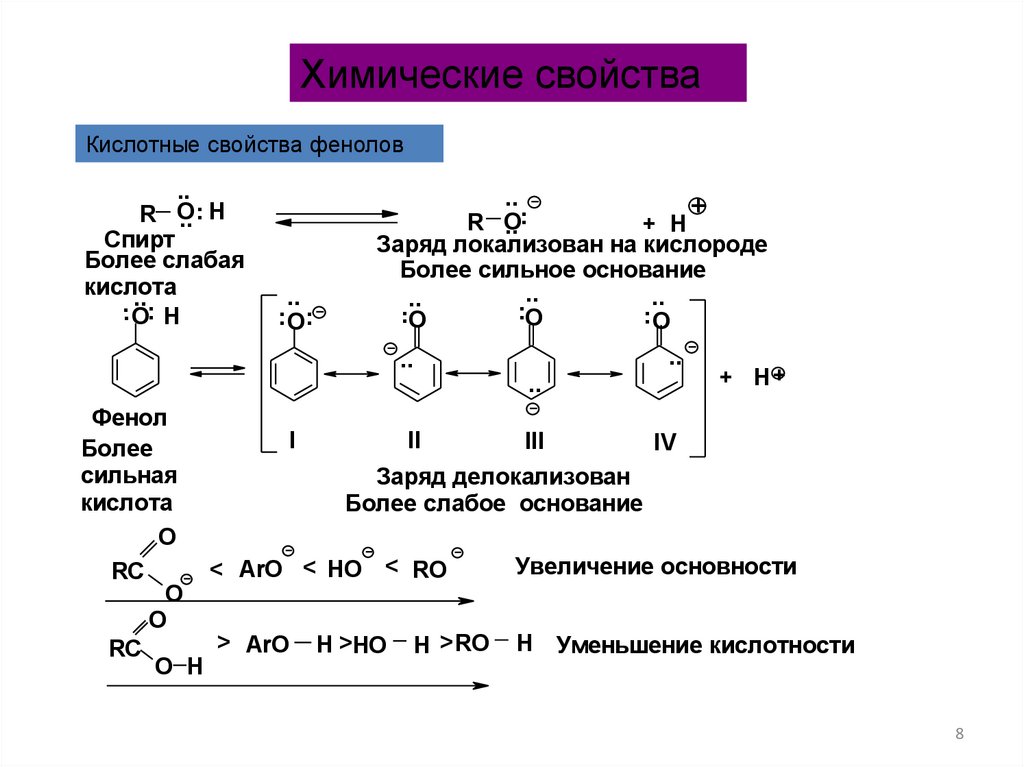
Химические свойстваКислотные свойства фенолов
..
O
R .. .. H
Спирт
Более слабая
кислота
.. ....
O H
.. .. ..
O
.. .
+
R O
+ H
.. .
Заряд локализован на кислороде
Более сильное основание
..
....
....
.
.O
O
O
..
..
..
+ H+
Фенол
I
II
III
IV
Более
сильная
Заряд делокализован
кислота
Более слабое основание
O
Увеличение основности
< ArO < HO < RO
RC
O
O
> ArO H >HO H > RO H Уменьшение кислотности
RC
O H
8
9.
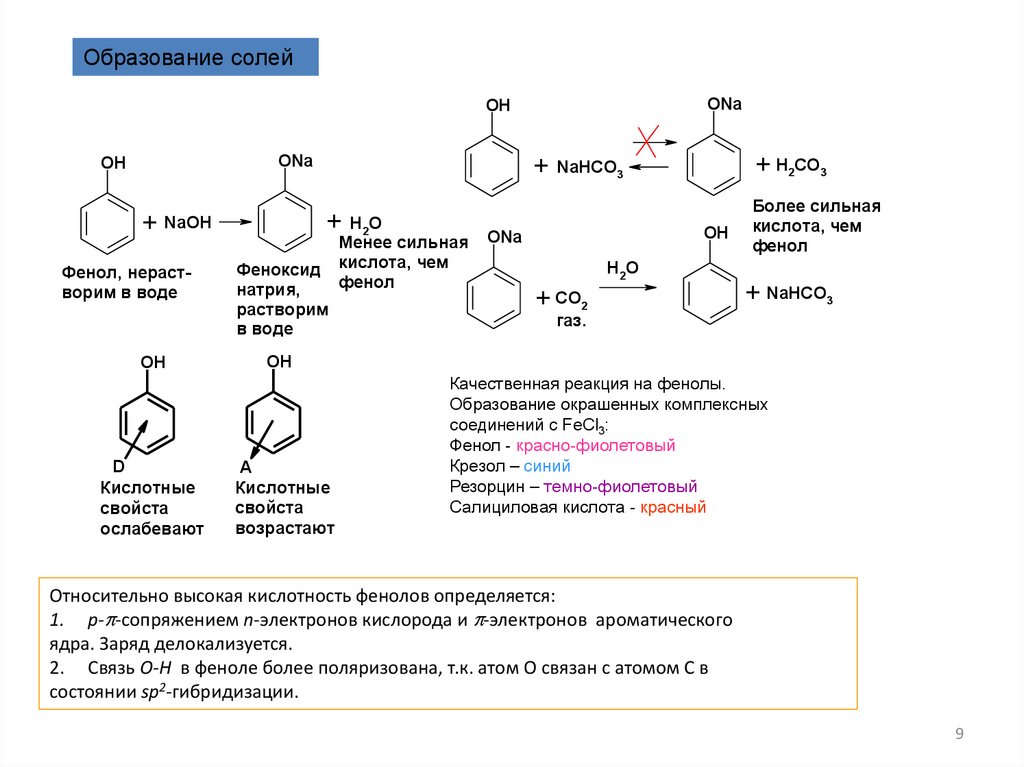
Образование солейONa
OH
+
+ H2O
NaOH
Фенол, нерастворим в воде
OH
D
Кислотные
свойста
ослабевают
+ H2CO3
+ NaHCO3
ONa
OH
Феноксид
натрия,
растворим
в воде
Менее сильная
кислота, чем
фенол
OH
ONa
H2O
+ CO2
Более сильная
кислота, чем
фенол
+ NaHCO3
газ.
OH
A
Кислотные
свойста
возрастают
Качественная реакция на фенолы.
Образование окрашенных комплексных
соединений с FeCl3:
Фенол - красно-фиолетовый
Крезол – синий
Резорцин – темно-фиолетовый
Салициловая кислота - красный
Относительно высокая кислотность фенолов определяется:
1. p-p-сопряжением n-электронов кислорода и p-электронов ароматического
ядра. Заряд делокализуется.
2. Связь О-Н в феноле более поляризована, т.к. атом О связан с атомом С в
состоянии sp2-гибридизации.
9
10.
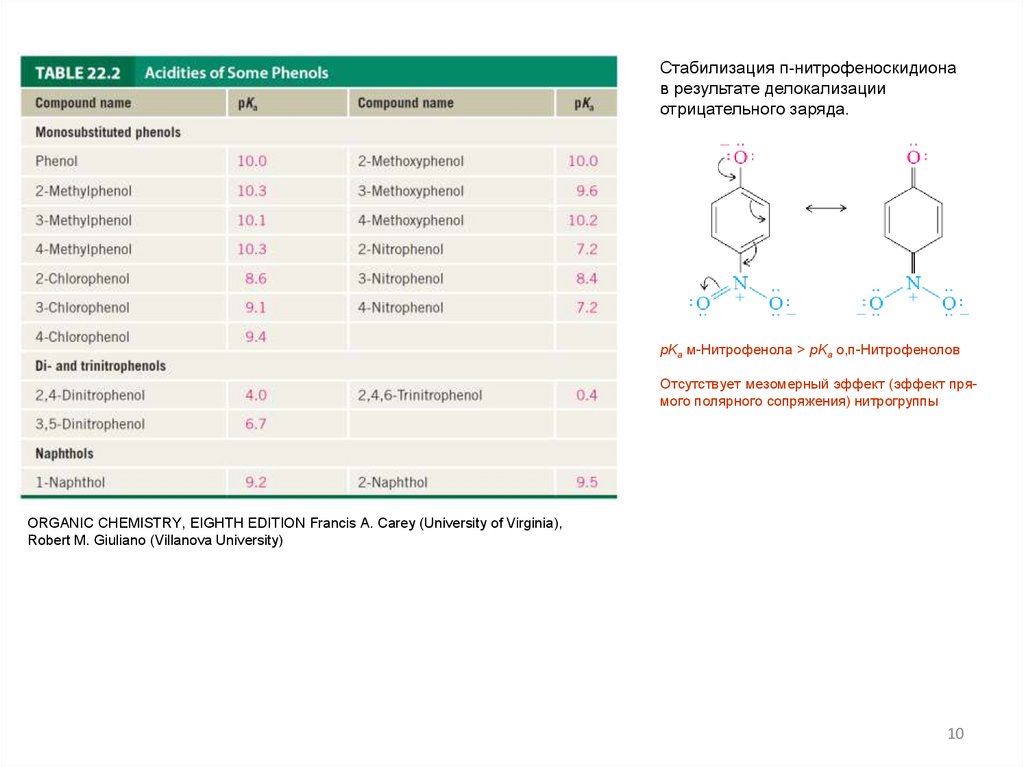
Стабилизация п-нитрофеноскидионав результате делокализации
отрицательного заряда.
pKa м-Нитрофенола > pKa о,п-Нитрофенолов
Отсутствует мезомерный эффект (эффект прямого полярного сопряжения) нитрогруппы
ORGANIC CHEMISTRY, EIGHTH EDITION Francis A. Carey (University of Virginia),
Robert M. Giuliano (Villanova University)
10
11.
O-Алкилирование феноксид-ионов.CH3I
- NaI
OH
NaOH
+
ONa
CH3
SN2
H3C O SO2 O CH3
O
Метоксибензол
Анизол
+
- Na OSO2OCH3
С-Алкилирование феноксид-ионов.
Феноксид-ион – амбидентный нуклеофил
O CH2 CH CH2
SN
CH2 CH CH2 Br
ацетон
аллилоксибензол
О-алкилирование
Апротонный полярный
растворитель хорошо
сольватирует катионы
щелочных металлов
(Na+),активируя феноксид
анион (О-)
+
ONa
ONa
SN
CH2 CH CH2 Br
CH2CH CH2
бензол
2-аллилфеноксид натрия
С-алкилирование
За счет блокирования
кислородного реакционного
центра в феноксид анионе (О-)
противоионом (Na+)
11
12.
O-Ацилирование феноксид-ионов (SN).O
H3C C
..
HO
..
O
H3C C
+
OH
+
O
..
HO
..
O
CH2 CH3
+
H3C C
H2O HO=+1,5 ккал/моль
H2O HO=-4,6 ккал/моль
O CH2 CH3
O
H3C
NaOH,
Н2О
OH
Нейтральная
молекуласлабый
нуклеофил
C
Cl
H3C CO O CO CH3 , H+
O
H3C
C
O
+
O Na
SO2Cl
Анионсильный
нуклеофил
Фенилaцетат
SO2 O
Фенилбензолсульфонат
12
13.
Перегруппировка ФрисаO
H3C
C
O
O
OH
OH
AlCl3, T
CH3
+
SEAr
о-Гидроксиацетофенон
Фенилацетат
H3C
O
п-Гидроксиацетофенон
Схема реакции
AlCl3
O
OC(O)CH3
+
O
C
H3C
OC(O)CH3
+
C O
H3C
O
C6H5OH
OC(O)CH3 + HO
C
CH3
13
14.
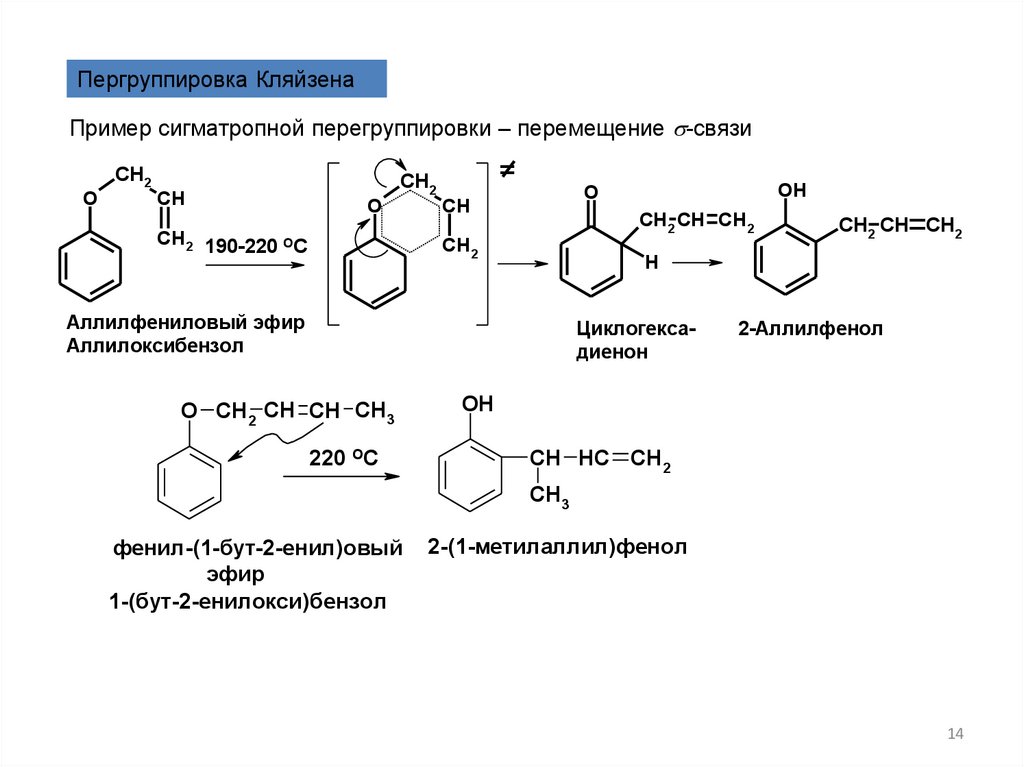
Пергруппировка КляйзенаПример сигматропной перегруппировки – перемещение s-связи
O
CH2
CH
O
CH2
CH2 190-220 OC
=
OH
O
CH
CH2 CH CH2
CH2
H
Аллилфениловый эфир
Аллилоксибензол
Циклогексадиенон
O CH2 CH CH CH3
220 ОС
CH2 CH CH2
2-Аллилфенол
OH
CH HC CH2
CH3
фенил-(1-бут-2-енил)овый
эфир
1-(бут-2-енилокси)бензол
2-(1-метилаллил)фенол
14
15.
Электрофильное замещение SEArOH
OH
OH
E
+ E+
+
+
о-изомер
H
+
E
п-изомер
Реакции SEAr в феноксид-анионе
O
O
O
E
+
E+
H
+
E
H
s-комплекс
s-комплекс – нейтральная частица,
обладает повышенной устойчивостью
15
16.
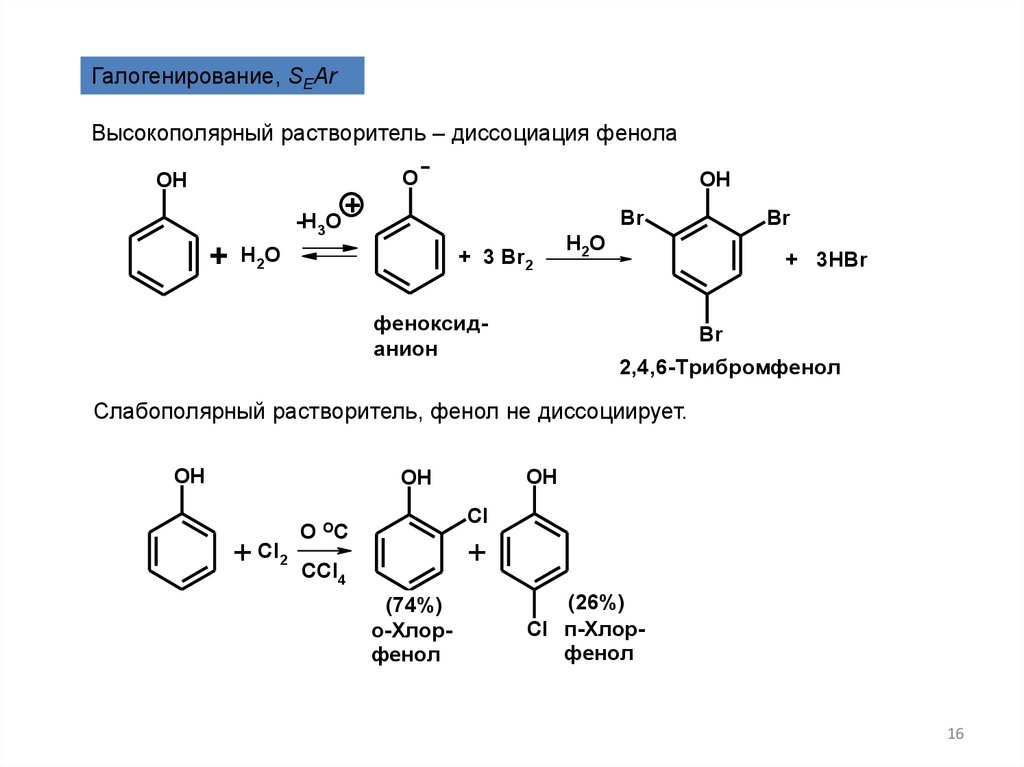
Галогенирование, SEArВысокополярный растворитель – диссоциация фенола
OH
+
-H3O
+
O
OH
Br
H 2O
+ 3 Br2
феноксиданион
Br
H2O
+ 3HBr
Br
2,4,6-Трибромфенол
Слабополярный растворитель, фенол не диссоциирует.
OH
OH
OH
+ Cl2
Cl
O OC
+
CCl4
(74%)
о-Хлорфенол
(26%)
Cl п-Хлорфенол
16
17.
Механизм бромирования феноксид-ионаO
O
H
Br2, 5 OC
OH
O
Br
Br
Br
Br
-HBr
Br
...
H2 O
Br
2,4,6-трибромфенол
OH
о-Бромфенол более
сильная кислота, чем
фенол, бромирование
ускоряется
Br
Галогенирование фенола в присутствии сильной кислоты
OH
OH
+
Br2,
HBr , 5 OC
H 2O
+
HBr
Полностью подавлена
диссоциация фенола
(81%)
Br
4-бромфенол
17
18.
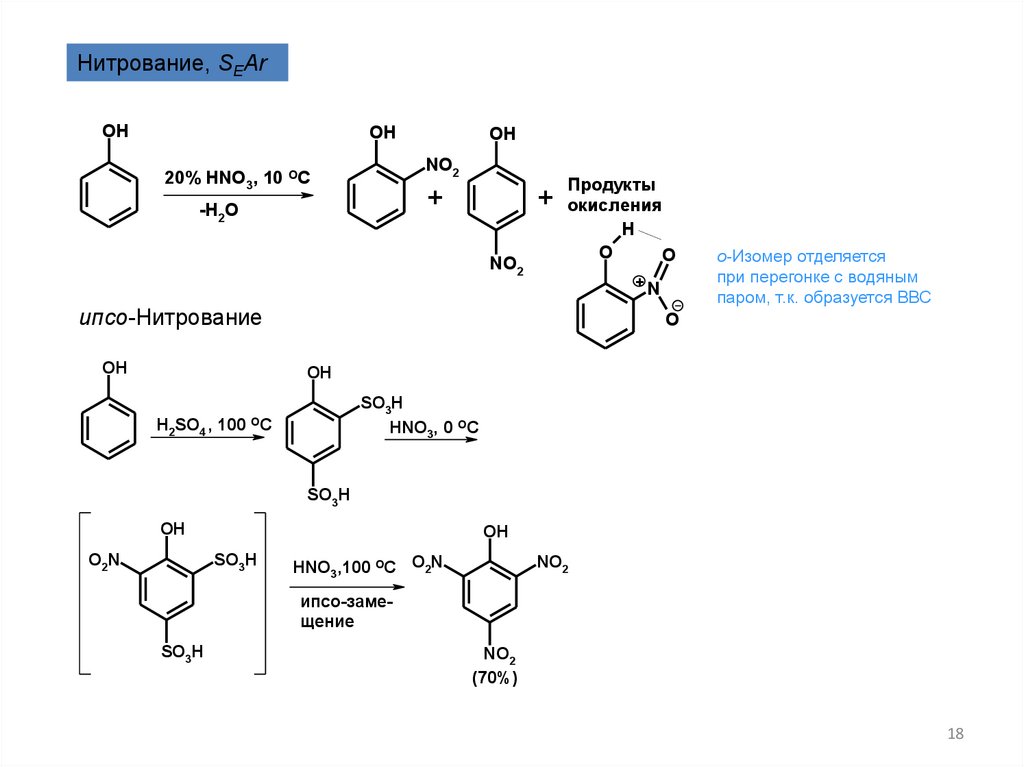
Нитрование, SEArOH
OH
OH
NO2
20% HNO3, 10 OC
+
+
-H2O
NO2
Продукты
окисления
H
O
O
+N
ипсо-Нитрование
OH
_
о-Изомер отделяется
при перегонке с водяным
паром, т.к. образуется ВВС
O
OH
H2SO4 , 100
SO3H
HNO3, 0 OC
OC
SO3H
OH
O2N
OH
SO3H
HNO3,100 OC O2N
NO2
ипсо-замещение
SO3H
NO2
(70%)
18
19.
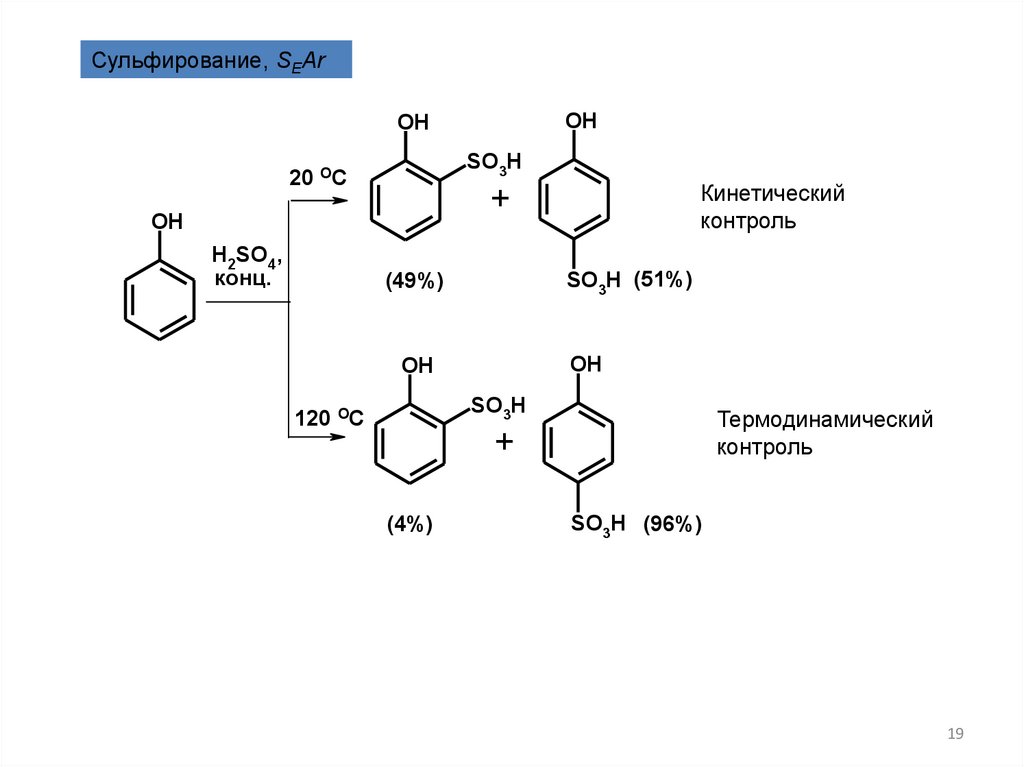
Сульфирование, SEArOH
OH
SO3H
20 OC
+
OH
H2SO4,
конц.
Кинетический
контроль
SO3H (51%)
(49%)
OH
OH
SO3H
120 OC
Термодинамический
контроль
+
(4%)
SO3H (96%)
19
20.
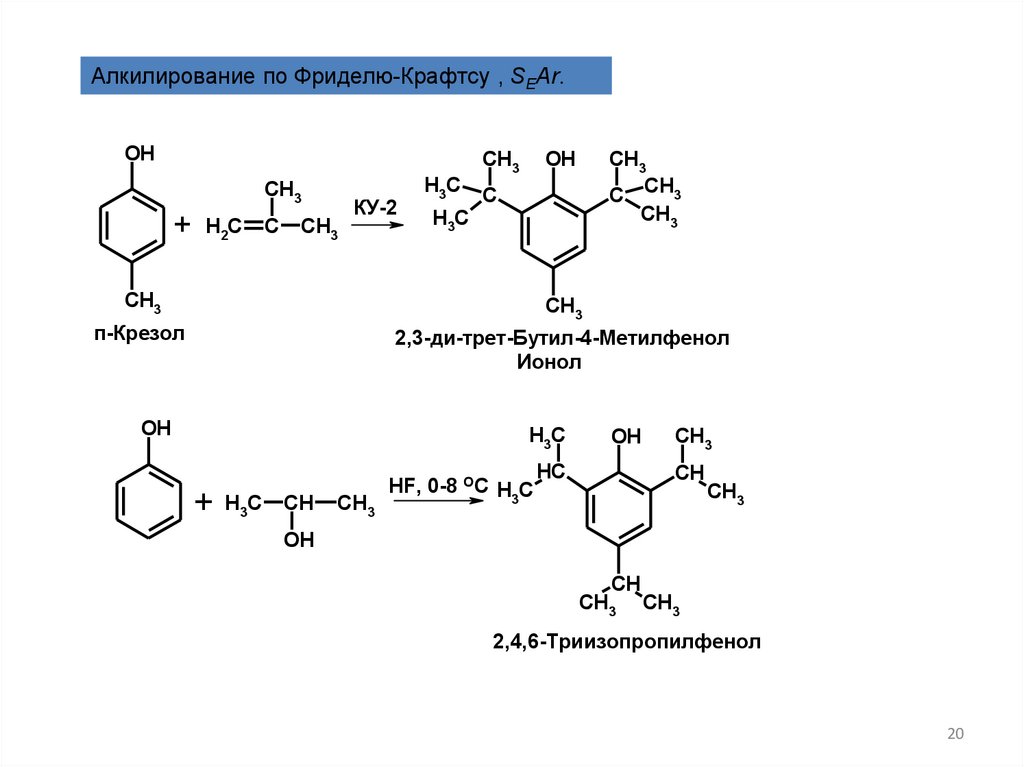
Алкилирование по Фриделю-Крафтсу , SEAr.OH
CH3
+
H2C
C
CH3
КУ-2
H3C
H3C
CH3
CH3
C CH3
CH3
OH
C
CH3
CH3
п-Крезол
2,3-ди-трет-Бутил-4-Метилфенол
Ионол
OH
H3C
+
H3C
CH
CH3
HF, 0-8 OC H C
3
OH
HC
CH3
CH
CH3
OH
CH
CH3
CH3
2,4,6-Триизопропилфенол
20
21.
Ацилирование по Фриделю-Крафтсу, SEArO
OH
H3C
+
C
O
H3C
C
O
AlCl3; 140 OC
O
H2SO4
CH3 Перегруппировка Фриса
40-50 oC
O
CH3
O
O
+
HO
HO
CH3
1-(2-Гидроксифенил)этанон
1-(4-Гидроксифенил)этанон
Селективное С-ацилирование фенолов
OH
+
CH3COOH BF3
20
OC
O
C
HO
CH3
(95%)
21
22.
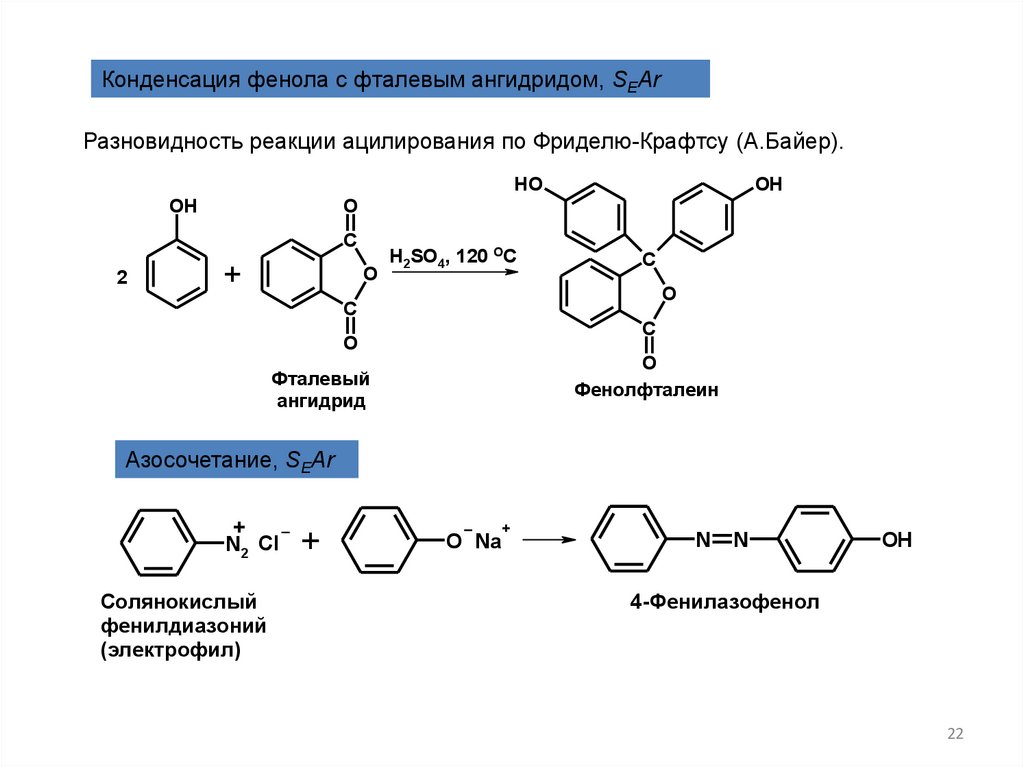
Конденсация фенола с фталевым ангидридом, SEArРазновидность реакции ацилирования по Фриделю-Крафтсу (А.Байер).
OH
HO
O
OH
C
2
+
O
H2SO4, 120 OC
C
O
C
C
O
O
Фенолфталеин
Фталевый
ангидрид
Азосочетание, SEAr
+
N2 Cl
Солянокислый
фенилдиазоний
(электрофил)
+
O Na
+
N
N
OH
4-Фенилазофенол
22
23.
Формилирование фенолов.Реакция Реймера-Тимана. (Reimer–Tiemann)
OH
OH
60 OC
OH
CHCl3 OHCl
+
+ CHCl3 + NaOH CHCl -H O
3
O
+
+ .CCl2
2
(20%)
о-ГидроксиO (10%)
бензальдегид
H2O
+ .CCl3
Дихлоркарбен электрофил, не
имеющий заряда.
Углерод имеет
6 электронов
Формилирование фенолов другими реагентами
OH
OH
+
HCN
+
ZnCl2
HCl
бензол, 40 ОС
4-Оксибензальдегид
(30%)
O
OH
OH
O
+
H
C
N
CH3
CH3
POCl3
ДМФА, 20
4-Оксибензальдегид
ОС
(85%)
ДМФА
O
23
24.
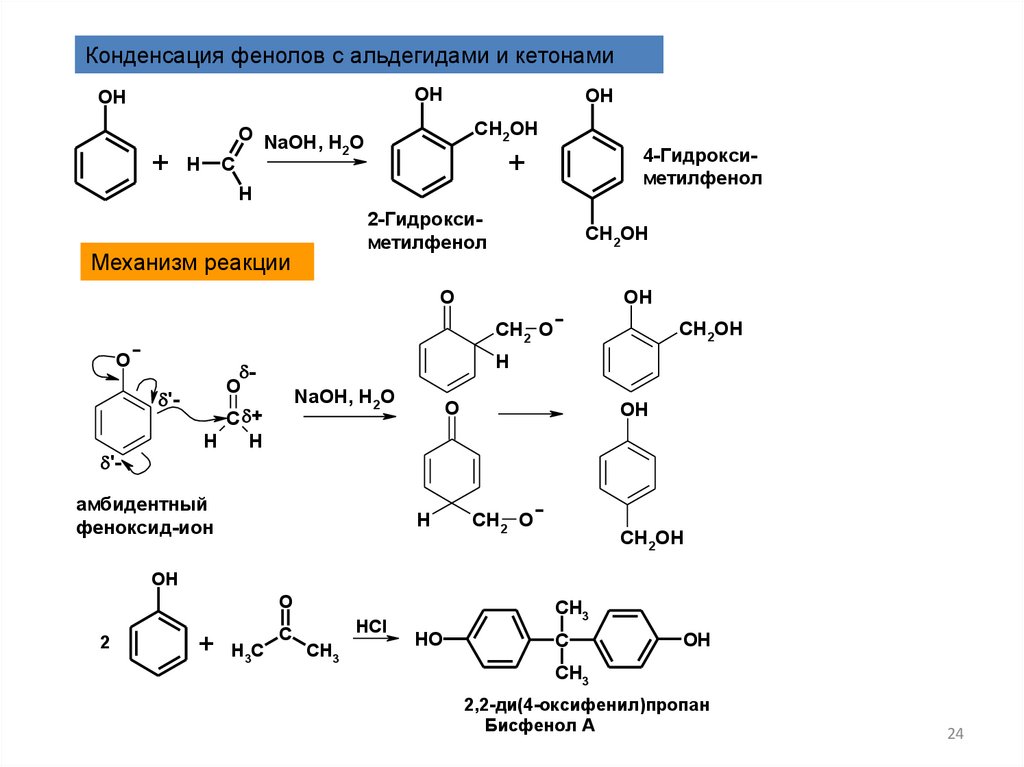
Конденсация фенолов с альдегидами и кетонамиOH
OH
+
H
C
OH
CH2OH
O NaOH, H O
2
4-Гидроксиметилфенол
+
H
2-Гидроксиметилфенол
Механизм реакции
CH2OH
OH
O
CH2OH
CH2 O
O
' '-
H
O
NaOH, H2O
C +
H
H
амбидентный
феноксид-ион
O
H
OH
CH2 O
CH2OH
OH
O
2
+
H3C
C
HCl
CH3
CH3
HO
C
OH
CH3
2,2-ди(4-оксифенил)пропан
Бисфенол А
24
25.
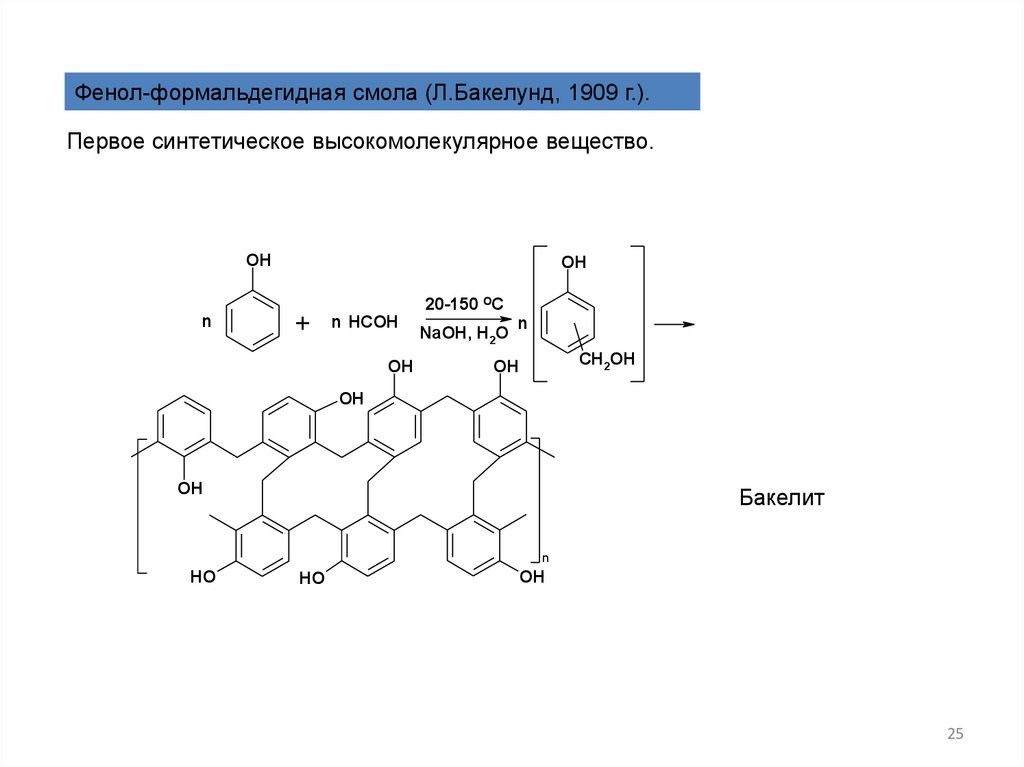
Фенол-формальдегидная смола (Л.Бакелунд, 1909 г.).Первое синтетическое высокомолекулярное вещество.
OH
n
OH
+
n HCOH
OH
20-150 OC
NaOH, H2O
n
CH2OH
OH
OH
OH
Бакелит
n
HO
HO
OH
25
26.
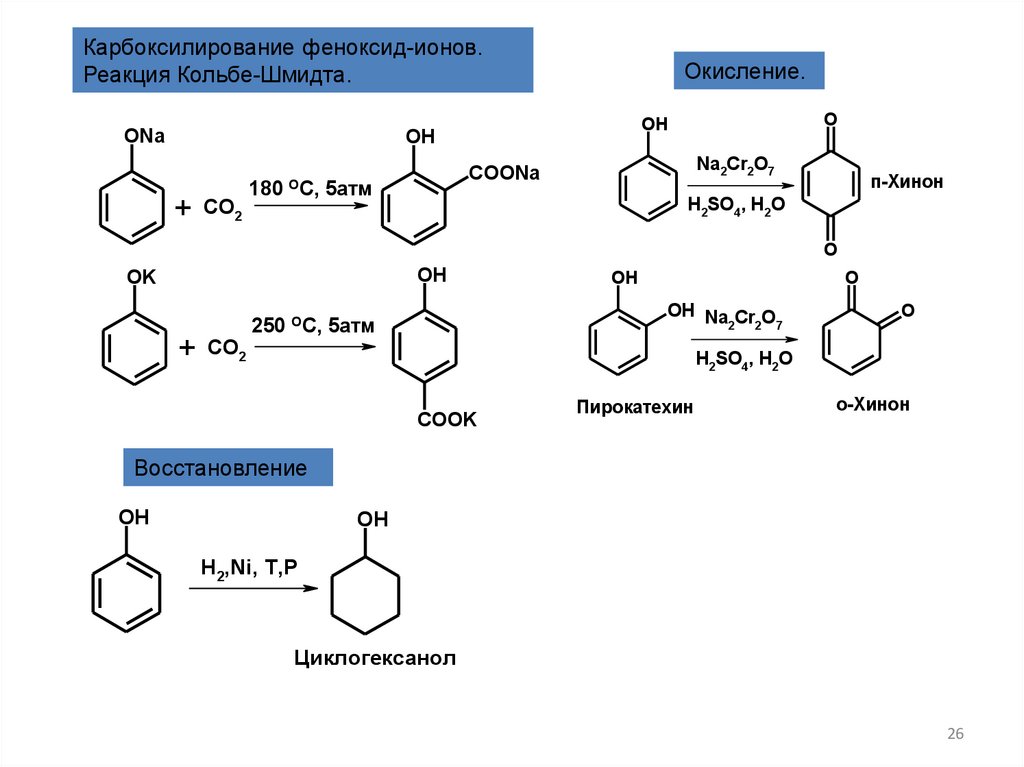
Карбоксилирование феноксид-ионов.Реакция Кольбе-Шмидта.
ONa
Окисление.
+
CO2
180
OC,
O
OH
OH
Na2Cr2O7
COONa
5атм
п-Хинон
H2SO4, H2O
O
OH
OK
+
CO2
O
OH
OH Na Cr O
2
2 7
250 OC, 5атм
O
H2SO4, H2O
COOK
Пирокатехин
о-Хинон
Восстановление
OH
OH
H2,Ni, T,P
Циклогексанол
26
27.
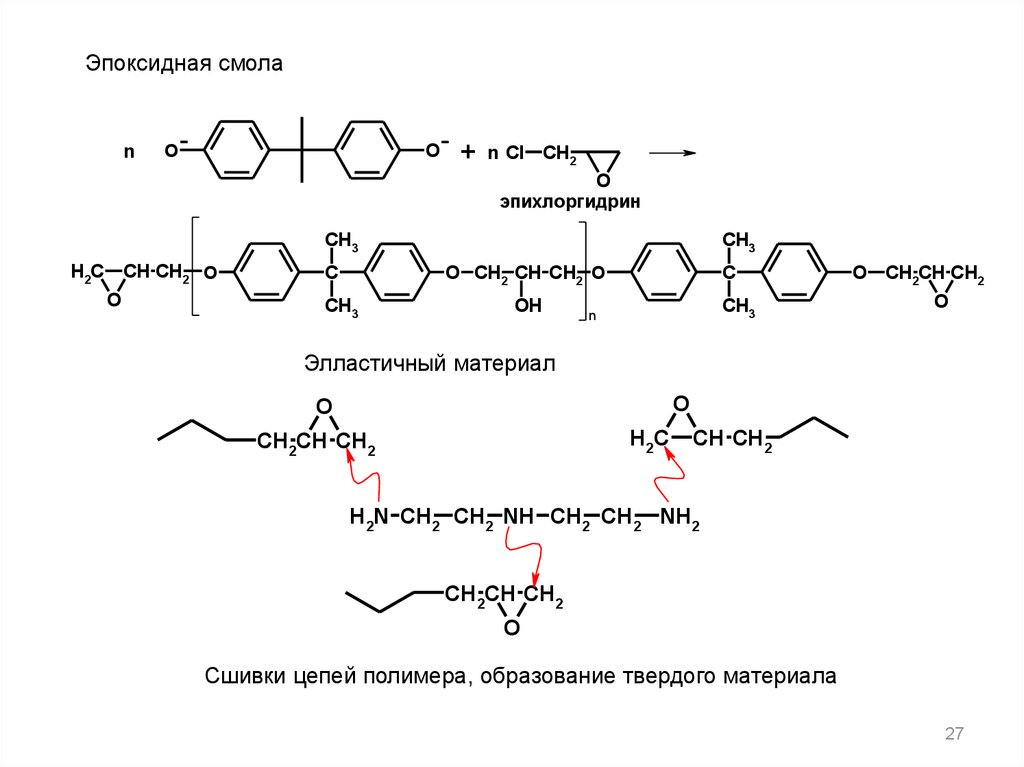
Эпоксидная смолаn
O
O
+
n Cl
CH2
O
эпихлоргидрин
CH3
H2C
CH CH2 O
O
C
CH3
C
O CH2 CH CH2 O
CH3
OH
CH3
n
O
CH2CH CH2
O
Элластичный материал
O
O
H2C
CH2CH CH2
CH CH2
H2N CH2 CH2 NH CH2 CH2 NH2
CH2CH CH2
O
Сшивки цепей полимера, образование твердого материала
27










 Химия
Химия








