Похожие презентации:
Водородные и кислородные соединения неметаллов. Галогеноводороды. Соляная кислота
1.
Водородные икислородные
соединения
неметаллов.
Галогеноводороды.
Соляная кислота.
2.
Цели урокаЗнание о соединениях неметаллов: водородных
соединениях, оксидах и гидроксидах,
галогенводородах.
Умение оценивать правильность выполнения
учебной задачи, собственные возможности ее
решения.
3.
4.
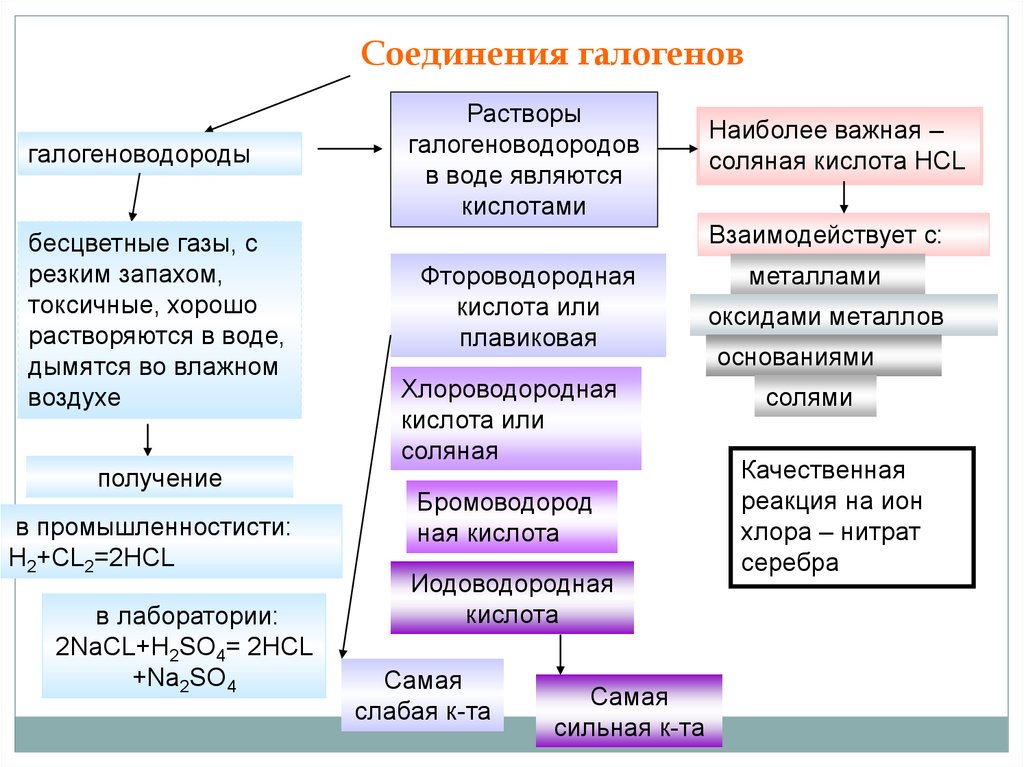
Соединения галогеновгалогеноводороды
бесцветные газы, с
резким запахом,
токсичные, хорошо
растворяются в воде,
дымятся во влажном
воздухе
получение
в промышленностисти:
Н2+CL2=2HCL
в лаборатории:
2NaCL+H2SO4= 2HCL
+Na2SO4
Растворы
галогеноводородов
в воде являются
кислотами
Наиболее важная –
соляная кислота HCL
Взаимодействует с:
Фтороводородная
кислота или
плавиковая
Хлороводородная
кислота или
соляная
Бромоводород
ная кислота
Иодоводородная
кислота
Самая
слабая к-та
Самая
сильная к-та
металлами
оксидами металлов
основаниями
солями
Качественная
реакция на ион
хлора – нитрат
серебра
5.
Соединения хлораХлороводород HCl - бесцветный
удушливый ядовитый газ, тяжелее
воздуха, хорошо растворим в воде с
образованием соляной кислоты.
Концентрированная соляная кислота
«дымит» на воздухе, т. к. выделяющийся
из неё хлороводород притягивает пары
воды.
Растворимость хлороводорода очень
высокая – 1лН2О : 450л НСl
6.
7.
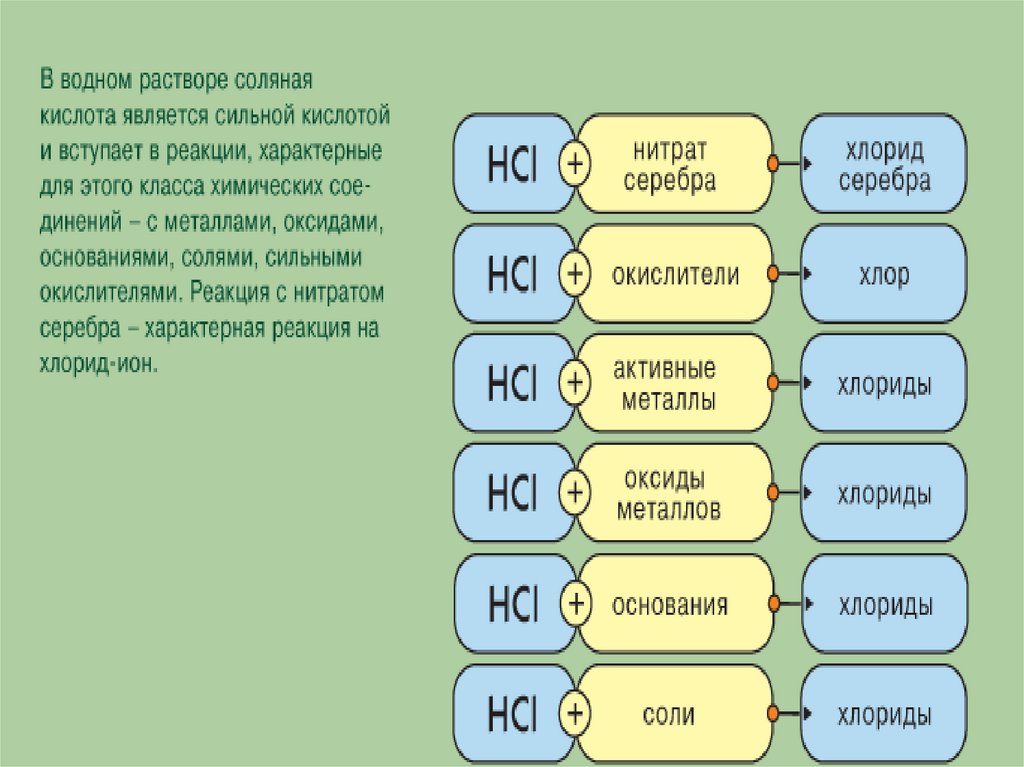
Свойства соляной кислотыСоляная
кислота
–
сильная,
одноосновная,
взаимодействует
с металлами, стоящими в ряду
напряжений до водорода, например:
Zn + 2HCl = ZnCl2 + H2
Как
восстановитель
реагирует
с
оксидами
и
гидроксидами многих металлов:
FeO + 2HCl = FeCl2 + Н2О
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
NaOH + HCl = NaCl + H2O
Соли соляной кислоты – хлориды, хорошо растворимы в
воде.
Образование осадка AgCl при взаимодействии ионов Сl- с
ионами Ag+ используется в качественном анализе.
HCl + AgNO3 = HNO3 + AgCl (белый творожистый осадок)
8.
Все галогеноводороды хорошо растворимы вводе. Водные растворы их обладают кислотными
свойствами и носят название
галогеноводородных кислот. Объясняется это
сильной полярностью связей Н — Г.
9.
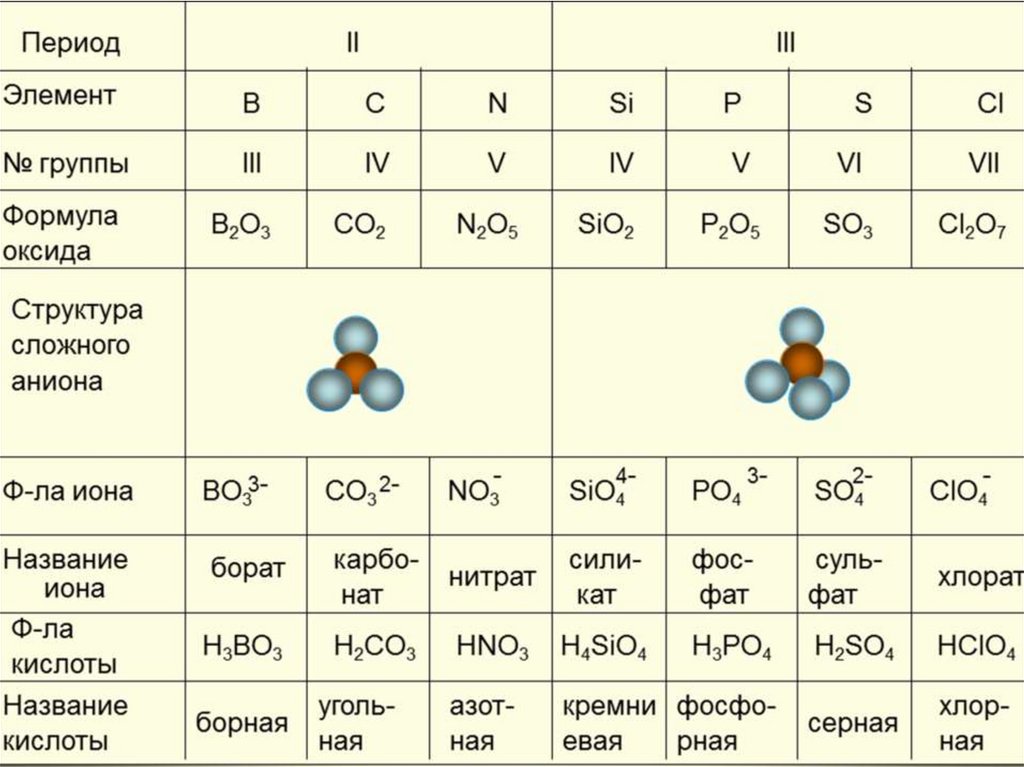
ХлорноватистаяHClO
гипохлориты
Хлористая
HClO2
хлориты
Хлорноватая
HClO3
хлораты
Хлорная
HClO4
перхлораты
10.
Домашнее задание§ 14, №3-9(б),3-31







 Химия
Химия








