Похожие презентации:
Общая характеристика галогенов на основе положения химических элементов в периодической системе
1. Тема урока:
26 октября 2011 годТема урока:
«Общая характеристика галогенов
на основе положения химических
элементов в периодической
системе »
Цель урока:
Сформировать умения учащихся
давать общую характеристику
элементов подгруппы на основе их
положения в Периодической
системе
2.
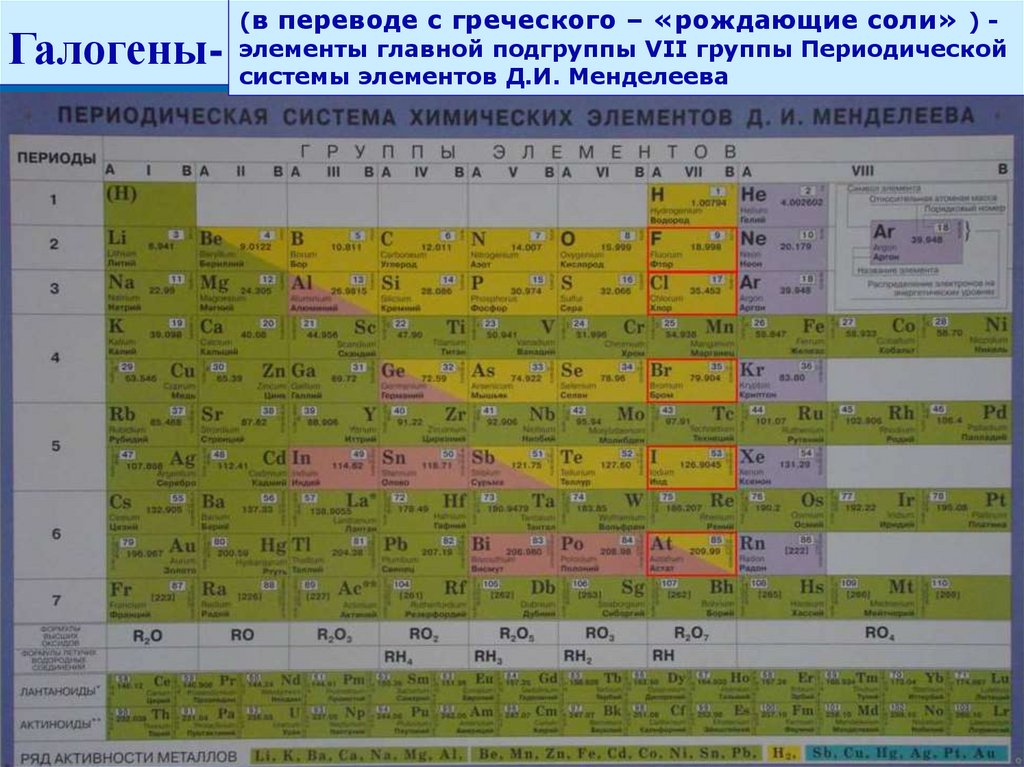
Галогены-(в переводе с греческого – «рождающие соли» ) элементы главной подгруппы VII группы Периодической
системы элементов Д.И. Менделеева
3.
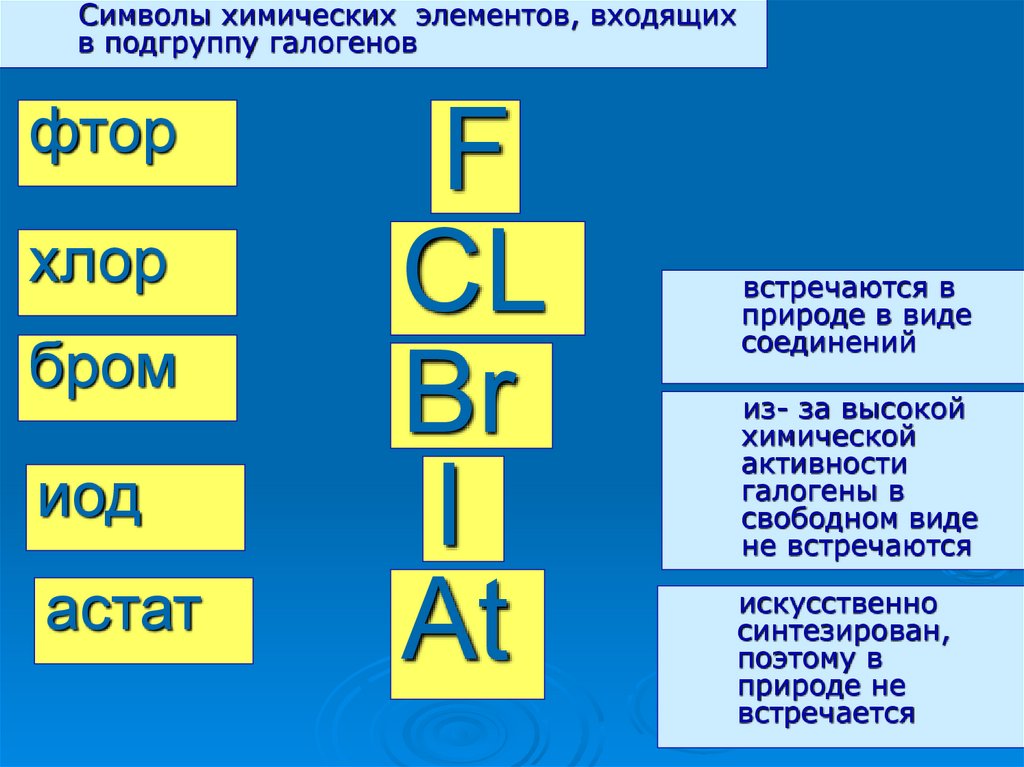
Символы химических элементов, входящихв подгруппу галогенов
фтор
хлор
бром
иод
астат
F
CL
Br
I
At
встречаются в
природе в виде
соединений
из- за высокой
химической
активности
галогены в
свободном виде
не встречаются
искусственно
синтезирован,
поэтому в
природе не
встречается
4.
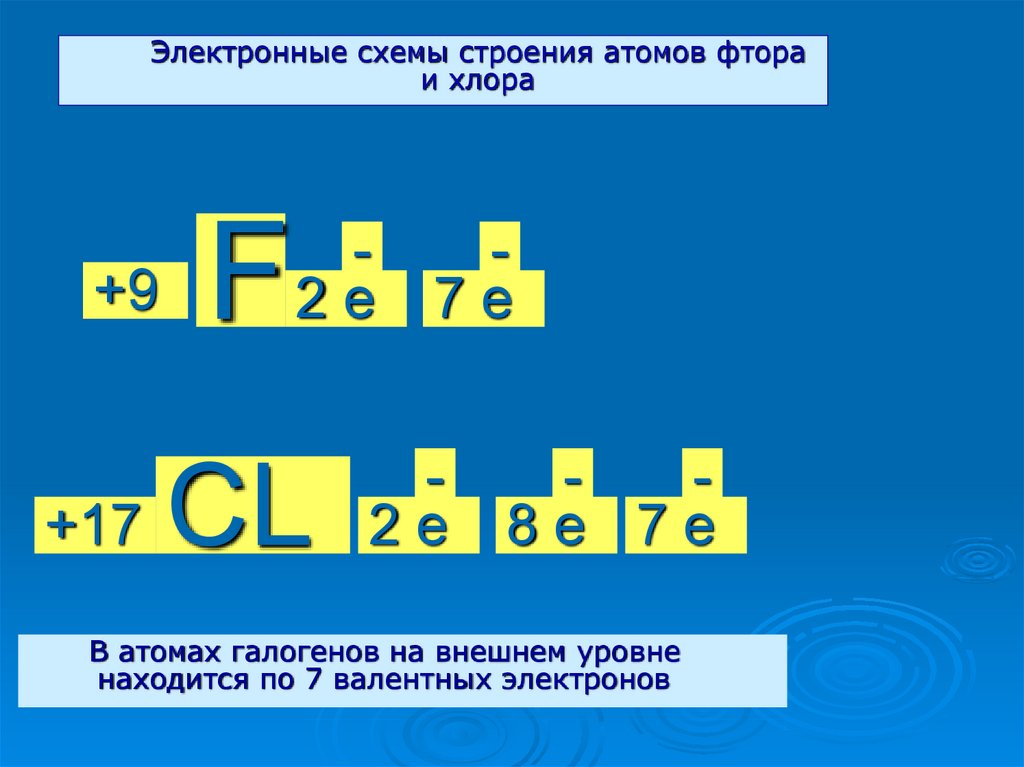
Электронные схемы строения атомов фтораи хлора
+9
+17
F
2е
CL
7е
2е
8е 7е
В атомах галогенов на внешнем уровне
находится по 7 валентных электронов
5.
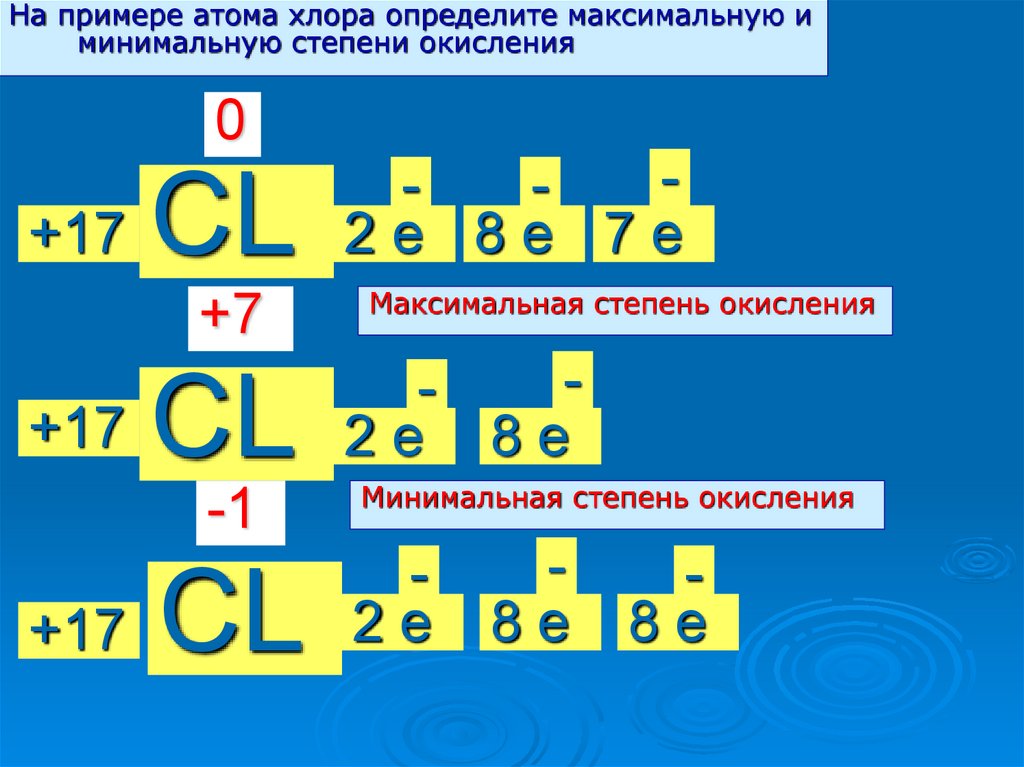
На примере атома хлора определите максимальную иминимальную степени окисления
0
+17
CL
+7
+17
CL
-1
+17
CL
2е 8е 7е
Максимальная степень окисления
2е 8е
Минимальная степень окисления
2е
8е
8е
6.
Общая характеристика галогенов на основе строения ихатомов и положения в Периодической системе:
F CL Br I
Значение
Радиус
электроотрицательности
атомов увеличивается
уменьшается
Сходства:
Различия:
7 валентных электронов на внешнем
уровне
Максимальная степень окисления +7,
минимальная степень окисления -1
Радиус атомов увеличивается
от фтора к иоду
Значение электроотрицательности
уменьшается от фтора к иоду
7.
Общая характеристика соединений галогенов на основеих положения в Периодической системе:
F CL
Br I
Кислотные свойства оксидов и их гидроксидов уменьшаются
Г- галоген
Общая формула
высшего оксида:
+7
Г2O7
+7
Общая формула
высшего гидроксида:
Общая формула летучего
водородного соединения:
HГO4
HГ
8.
Галогены – простые вещества.Г2
Общая молекулярная формула
галогенов
.. ..
:Г : Г:
.. ..
Общая электронная формула
галогенов
Г- Г
Общая структурная формула
галогенов
9.
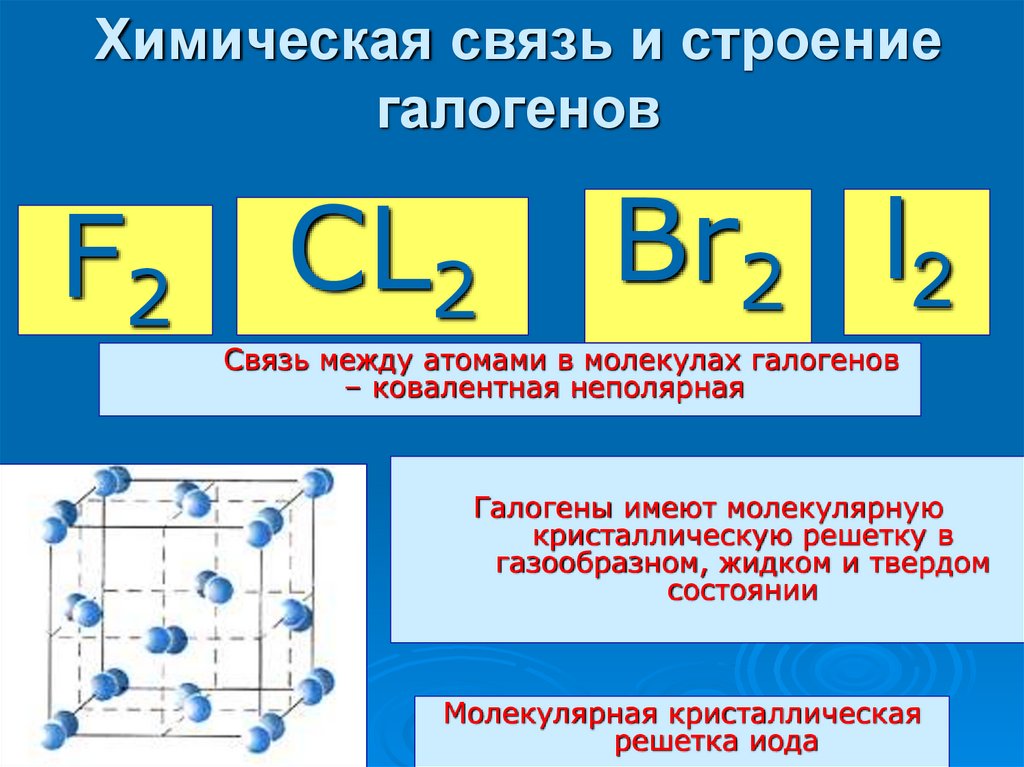
Химическая связь и строениегалогенов
F2 CL2
Br2 I2
Связь между атомами в молекулах галогенов
– ковалентная неполярная
Галогены имеют молекулярную
кристаллическую решетку в
газообразном, жидком и твердом
состоянии
Молекулярная кристаллическая
решетка иода
10.
Физические свойства галогеновF2
Cl2
Br2
I2
Ядовитый газ светлоTзеленого
Т кип = -187,99С°; =1696кг/м3
пл.=-219,47 С°;
цвета
хлор
С увеличением
Ядовитый легко
атомной массы
Тсжижающийся
-33,82С°;
газ
желтопл =-100,83С°; Т кип =
галогенов
3
=3214кг/м
зеленого цвета
окраска
фтор
становится
бром
ТТоксичная
= 3123кг/м3
более темной,
пл. = -7,1С°; Т тяжелая
кип = 58,93С°;
жидкость
возрастают
красно-бурого цвета
температуры
иод
Твердое кристаллическое вещество с
плавления и
металлическим блеском, даже при слабом
кипения, а также
Т пл. = 113,7С°; Т кип = 184,5С°; = 4930кг/м3
нагревании легко переходит в пар
плотность
интенсивно фиолетового цвета, который при
охлаждении снова превращается в
кристаллы
Переход веществ при нагревании из твердого состояния в
газообразное, минуя жидкое, называется возгонкой
11.
Все галогены обладают оченьрезким запахом. Вдыхание их
даже в небольших количествах
вызывает сильное раздражение
дыхательных путей и воспаление
слизистой оболочки. Более
значительные количества могут
вызвать тяжелое отравление
Галогены малорастворимы в воде
F2
CL2 Br2 I2
растворимость в воде уменьшается
Бром и иод лучше растворяются в органических
растворителях (бензин, хлороформ, спирт и т. д.)
12.
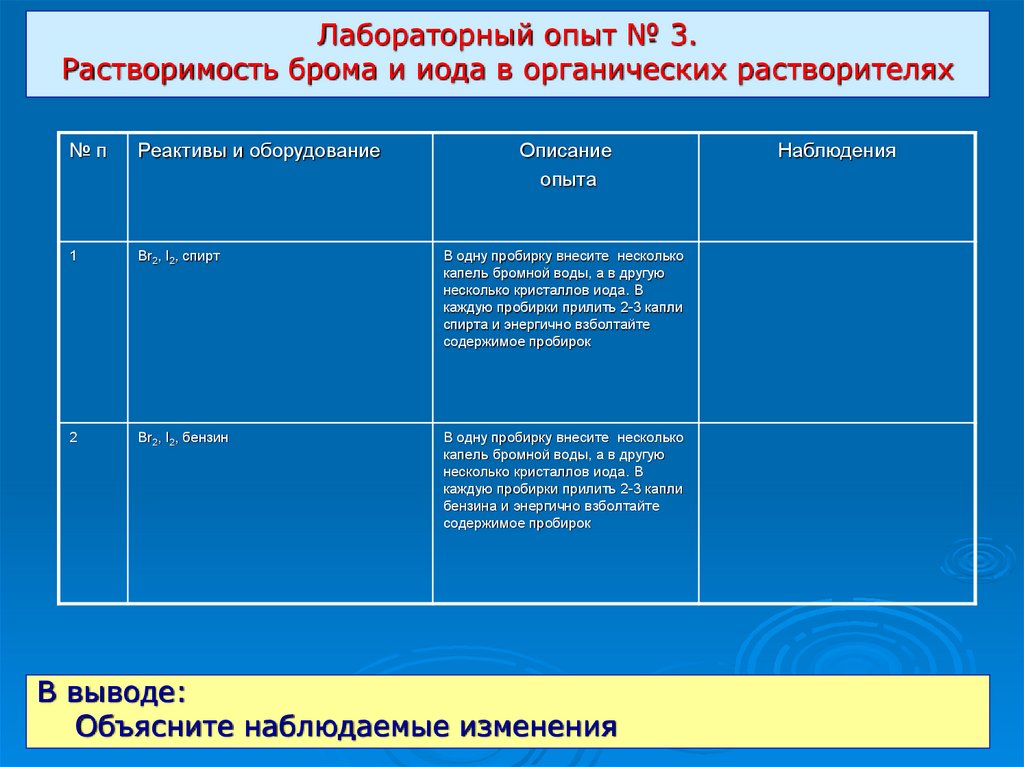
Лабораторный опыт № 3.Растворимость брома и иода в органических растворителях
№п
Реактивы и оборудование
Описание
опыта
1
Br2, I2, спирт
В одну пробирку внесите несколько
капель бромной воды, а в другую
несколько кристаллов иода. В
каждую пробирки прилить 2-3 капли
спирта и энергично взболтайте
содержимое пробирок
2
Br2, I2, бензин
В одну пробирку внесите несколько
капель бромной воды, а в другую
несколько кристаллов иода. В
каждую пробирки прилить 2-3 капли
бензина и энергично взболтайте
содержимое пробирок
В выводе:
Объясните наблюдаемые изменения
Наблюдения
13.
Бланк оформления лабораторного опыта № 3.Растворимость брома и иода в органическом растворителе
Фамилия имяученика/цы____________________
класс___________________
Дата проведения____________________
№п
Реактивы и оборудование
Описание
опыта
1
Br2, I2, спирт
В одну пробирку внесите несколько
капель бромной воды, а в другую
несколько кристаллов иода. В
каждую пробирки прилить 2-3 капли
спирта и энергично взболтайте
содержимое пробирок
2
Br2, I2, бензин
В одну пробирку внесите несколько
капель бромной воды, а в другую
несколько кристаллов иода. В
каждую пробирки прилить 2-3 капли
бензина и энергично взболтайте
содержимое пробирок
Наблюдения
Вывод:
_____________________________________________________
_____________________________________________
14.
Химические свойства галогенов иих соединений
Атомы галогенов проявляют окислительные свойства:
0
-1
I
2KI
+
+
2K
Br
Br
=
Г2 + 22е = 2Г 2
K Br + I2
F2 CL2 Br2 I2
Но
0
(восстановление, Г2 - окислитель)
Галогены –
типичные окислители и
неметаллы
Окислительные и неметаллические свойства
уменьшаются
15.
Лабораторный опыт № 4.Вытеснение одних галогенов другими из соединений (галогенидов)
№
п
Реактивы и
оборудование
Описание
опыта.
1
KBr, KI, хлорная
вода,
крахмальный
клейстер
В пробирку № 1 внесите несколько
капель раствора бромида калия, в
пробирку № 2 – такой же объем
раствора иодида калия. В обе
пробирки добавьте по 2-3 капли
хлорной воды. В пробирку № 2
добавьте крахмальный клейстер.
2
KCL, KI,
бромная вода,
крахмальный
клейстер
В пробирку № 1 внесите несколько
капель раствора хлорида калия, в
пробирку № 2 – такой же объем
раствора иодида калия. В обе
пробирки добавьте по 2-3 капли
хлорной воды. В пробирку № 2
добавьте крахмальный клейстер.
Наблюдения:
отметьте, в каких
пробирках
изменилась
окраска.
Уравнения реакций
Составьте
схемы
электронного
баланса
KBr+CL2
KI +CL2
KCL+Br2
KI + Br2
В выводе:
1. Расположите галогены в порядке их способности вытеснять друг
друга из соединений.
2. Объясните на основании радиуса атома и
электроотрицательности галогенов их различную активность
16.
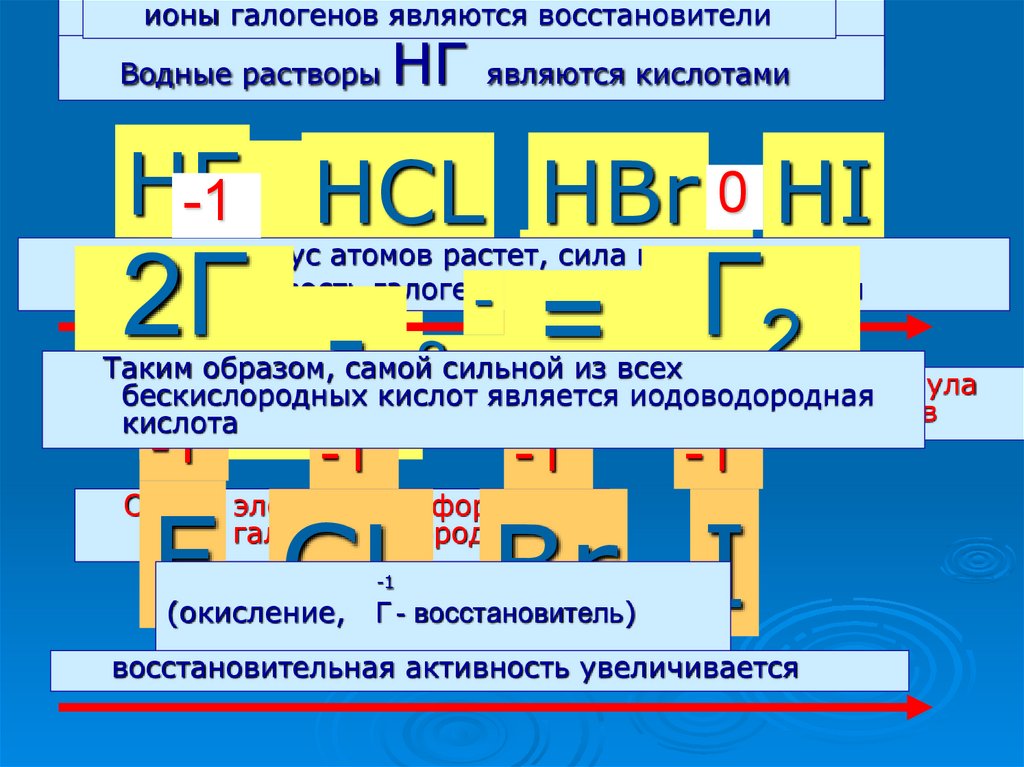
С ионыводородом
галогенов
галогены
являются
образуют
восстановители
летучие
водородные соединения НГ
Водные растворы
являются кислотами
НГ
НF
-1 ..
НCL НBr 0 НI
- Н - Г
Н :Г:
2Г
Г
- 2е = 2
..
-1
-1
-1
-1
радиус атомов растет, сила кислот растет,
Устойчивость галогеноводородов уменьшается
Таким образом, самой сильной из всех
Общаяиодоводородная
электронная формула
бескислородных кислот является
галогеноводородов
кислота
F CL Br I
Общая электронная формула
галогеноводородов
-1
(окисление,
Г - восстановитель)
восстановительная активность увеличивается
17.
Таким образом, сходствосвойств галогенов
определяется одинаковым
строением внешнего уровня, а
различия объясняется разным
радиусом их атомов
Домашнее задание: параграф 13,
задание № 1 (письменно) страница 64










 Химия
Химия








