Похожие презентации:
Галогенпроизводные углеводородов
1. Тема: Галогенпроизводные углеводородов
Министерство науки и высшего образования РФФГБОУ ВО
«Самарский государственный технический университет»
Химико-технологический факультет
Кафедра органической химии
Органическая химия
Направление подготовки
18.03.01 «Химическая технология»
04.03.02 «Химия, физика и механика
материалов»
Лекция №14
Тема: Галогенпроизводные углеводородов
Преподаватель: д.х.н., профессор Климочкин Ю.Н.
Самара
2.
I. КлассификацияПо типу атома C – Hal:
Сsp3 (обычная реакционная способность):
алкил
Cl
2
sp
CH 2Cl
3
sp
CH 2Cl
Сsp3 – Сsp2 (повышенная подвижность):
аллил
бензил
Cl
Сsp2 (сниженная подвижность):
винил
Cl
арил
23
3.
КлассификацияПо количеству атомов галогенов: моно/ди/три/тетра …
По типу галогена: бромиды, йодиды, фториды, хлориды
По типу атома С, с которым связан галоген: первичные,
вторичные, третичные.
33
4.
НоменклатураНоменклатура - по JUPAC или рац.:
бромид/хлорид, например этилхлорид.
радикал
+
Нумерация заместителя, который первый по алфавиту, в
случае исчерпывающего галогенирования – приставка пер-,
например, перфторэтан.
43
5.
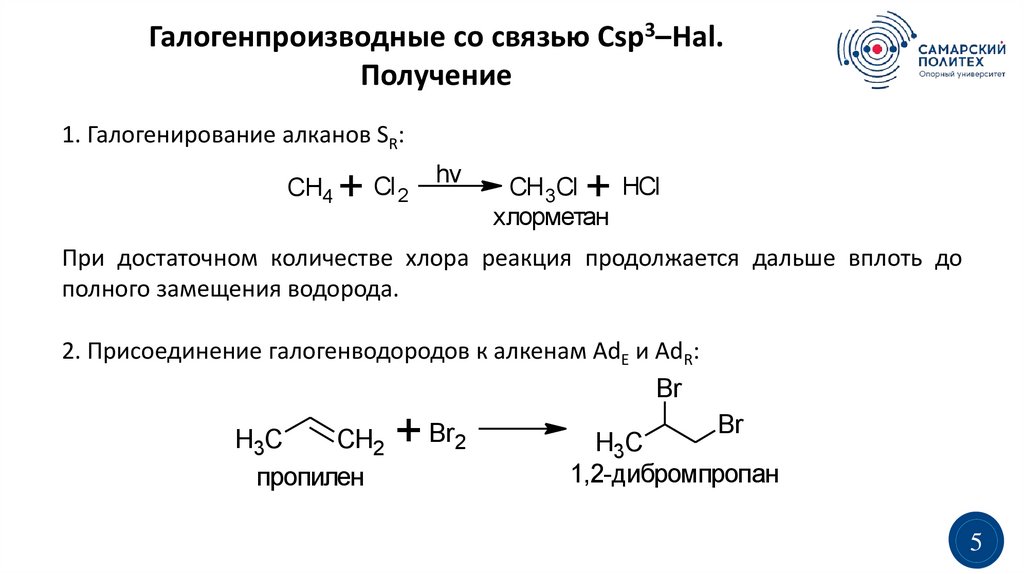
Галогенпроизводные со связью Сsp3–Hal.Получение
1. Галогенирование алканов SR:
CH4
+
Cl 2
hv
+
HCl
CH 3Cl
хлорметан
При достаточном количестве хлора реакция продолжается дальше вплоть до
полного замещения водорода.
2. Присоединение галогенводородов к алкенам AdE и AdR:
Br
CH2 + Br2
H3C
пропилен
Br
H3C
1,2-дибромпропан
53
6.
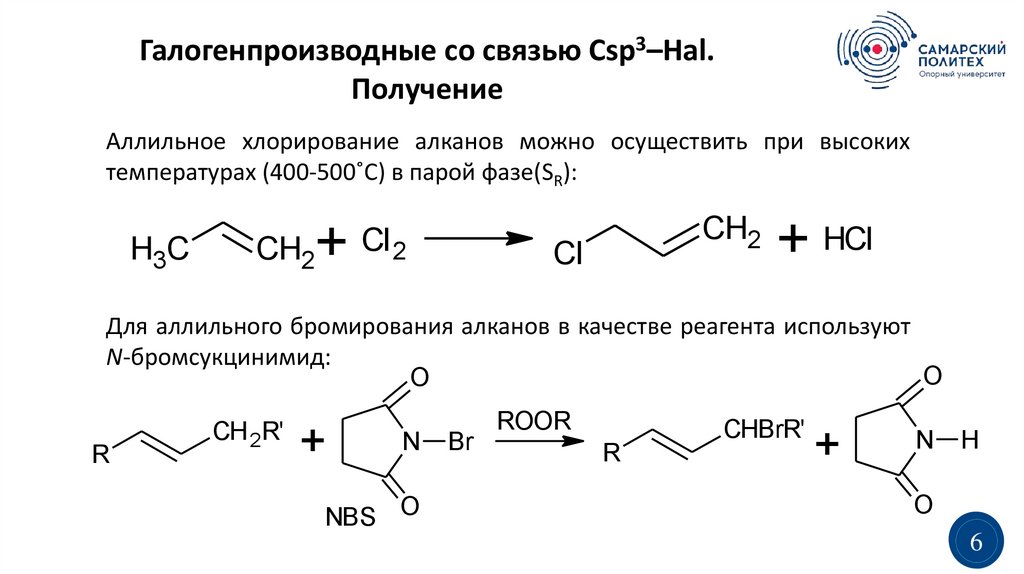
Галогенпроизводные со связью Сsp3–Hal.Получение
Аллильное хлорирование алканов можно осуществить при высоких
температурах (400-500˚C) в парой фазе(SR):
H3C
+
CH2
Cl 2
CH2
Cl
+ HCl
Для аллильного бромирования алканов в качестве реагента используют
N-бромсукцинимид:
O
O
R
CH 2R'
+
N
NBS O
Br
ROOR
R
CHBrR'
+
N
H
O
63
7.
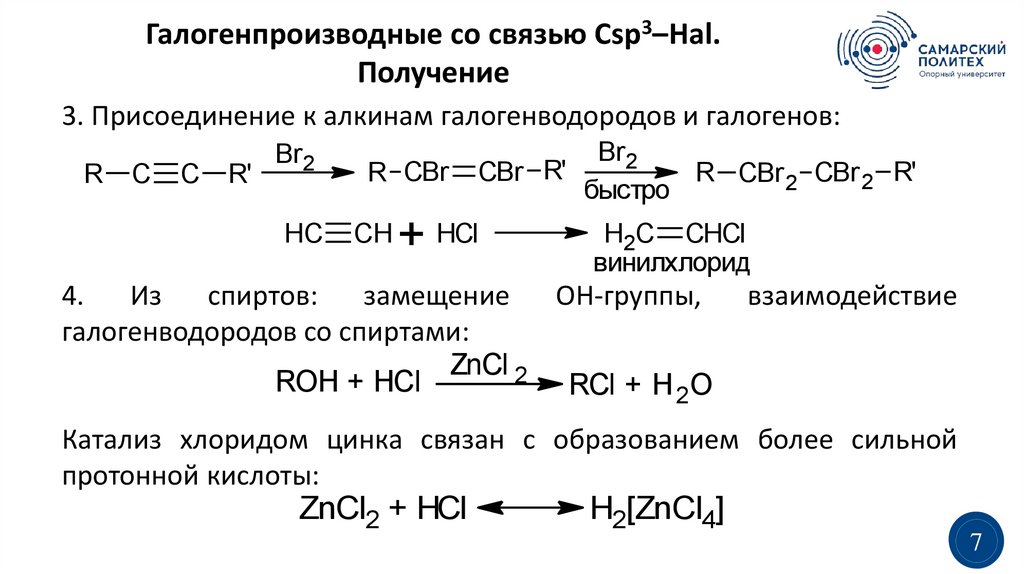
Галогенпроизводные со связью Сsp3–Hal.Получение
3. Присоединение к алкинам галогенводородов и галогенов:
R
C
C
R'
Br2
HC
R CBr
CH
Br2
CBr R'
R CBr 2 CBr 2 R'
быстро
+ HCl
H2C CHCl
винилхлорид
4.
Из
спиртов:
замещение
ОН-группы,
галогенводородов со спиртами:
ZnCl 2
ROH + HCl
RCl + H 2O
взаимодействие
Катализ хлоридом цинка связан с образованием более сильной
протонной кислоты:
ZnCl2 + HCl
H2[ZnCl4]
73
8.
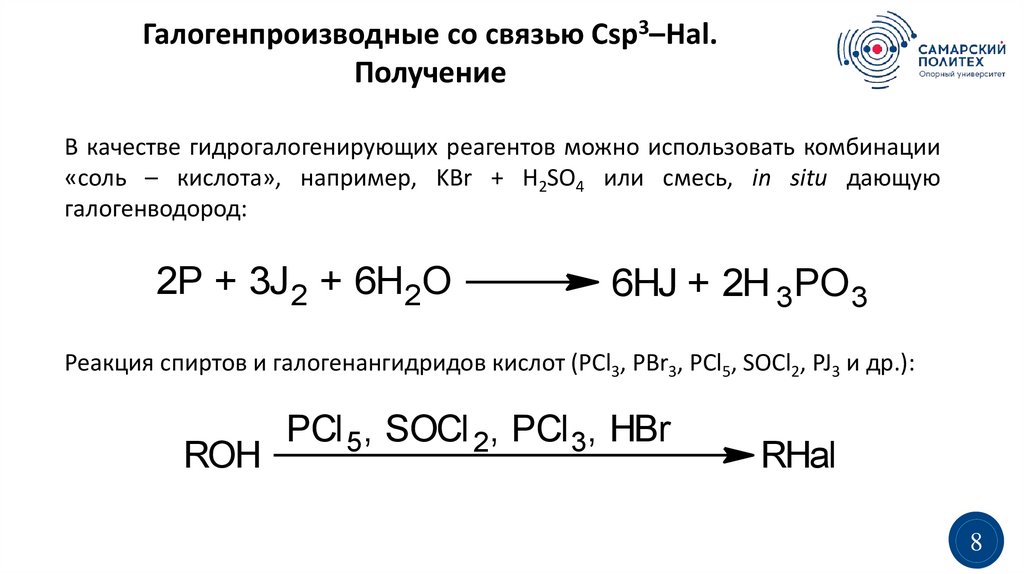
Галогенпроизводные со связью Сsp3–Hal.Получение
В качестве гидрогалогенирующих реагентов можно использовать комбинации
«соль – кислота», например, KBr + H2SO4 или смесь, in situ дающую
галогенводород:
2P + 3J 2 + 6H2O
6HJ + 2H 3PO3
Реакция спиртов и галогенангидридов кислот (PCl3, PBr3, PCl5, SOCl2, PJ3 и др.):
ROH
PCl 5, SOCl 2, PCl 3, HBr
RHal
83
9.
Галогенпроизводные со связью Сsp3–Hal.Получение
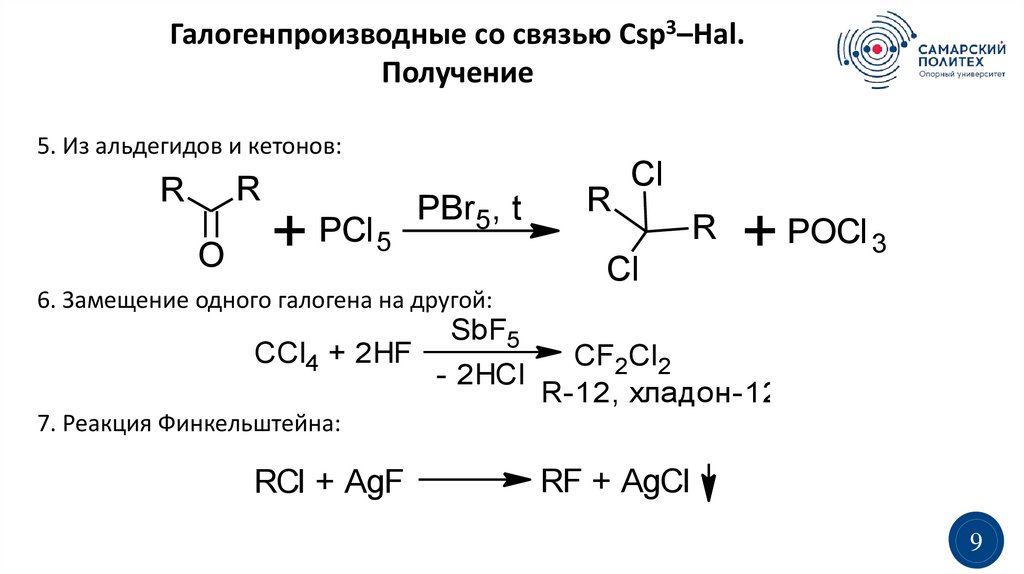
5. Из альдегидов и кетонов:
R
R
O
+ PCl 5
PBr5, t
R
Cl
Cl
R
+ POCl 3
6. Замещение одного галогена на другой:
CCl4 + 2HF
SbF5
CF2Cl2
- 2HCl
R-12, хладон-12
7. Реакция Финкельштейна:
RCl + AgF
RF + AgCl
93
10.
Фреоны (хладоны)Фреоны (хладоны) — галогеноалканы, фтор- и хлорсодержащие
производные насыщенных углеводородов (главным образом
метана и этана), используемые как хладагенты в холодильных
машинах.
Кроме атомов фтора, в молекулах фреонов содержатся обычно
атомы хлора, реже — брома. Название «фреон» фирмы DuPont
(США). В СССР и РФ укоренился термин «хладоны».
10
3
11.
Физические и химические свойствафреонов
Фреоны — бесцветные газы или жидкости, без запаха. Хорошо
растворимы в неполярных органических растворителях, очень
плохо — в воде и полярных растворителях.
Фреоны очень инертны в химическом отношении, поэтому они не
горят на воздухе, невзрывоопасны даже при контакте с открытым
пламенем. Устойчивы к действию кислот и щелочей.
11
3
12.
Номенклатура фреоновПо международному стандарту ISO № 817-74 техническое
обозначение фреона (хладона) состоит из буквенного
обозначения R (от слова refrigerant) и цифрового обозначения:
первая цифра справа — это числа атомов фтора в соединении;
вторая цифра справа — это число атомов водорода в соединении
плюс единица;
третья цифра справа — это число атомов углерода в соединении
минус единица (для соединений метанового ряда нуль
опускается);
12
3
13.
Номенклатура фреоновчисло атомов хлора в соединении находят вычитанием суммарного числа
атомов фтора и водорода из общего числа атомов, которые могут
соединяться с атомами углерода;
для циклических производных в начале определяющего номера ставится
буква C;
в случае, когда на месте хлора находится бром, в конце определяющего
номера ставится буква B и цифра, показывающая число атомов брома в
молекуле.
в случае, когда на месте хлора находится иод, в конце определяющего
номера ставится буква I и цифра, показывающая число атомов иода в
молекуле.
13
3
14.
Некоторые представители1) Тетрафторметан CF4 — фреон-14, хладон-14.
В микроэлектронике, отдельно, или в сочетании с кислородом применяется как
плазменный протравливатель на кремнии, диоксиде кремния или нитриде кремния.
2) Дифтордихлорметан CCl2F2. (фреон-12, хладон-12, CFC-12, R-12. Используется как
холодильный агент и в качестве пропеллента в аэрозольных баллонах.
3) Фторотан CF3CHClBr (международное наименование —галотан) — мощное
средство для ингаляционного наркоза.
14
3
15.
III. Физические свойстваρ > 1, возрастает от F к I. Газы: F: С1-С4; Cl: С2-С3; Br: С2.
Остальные — жидкости. Тпл растёт с увеличением порядкового
номера Hal. Высшие — твёрдые вещества. В воде практически
нерастворимы.
15
3
16.
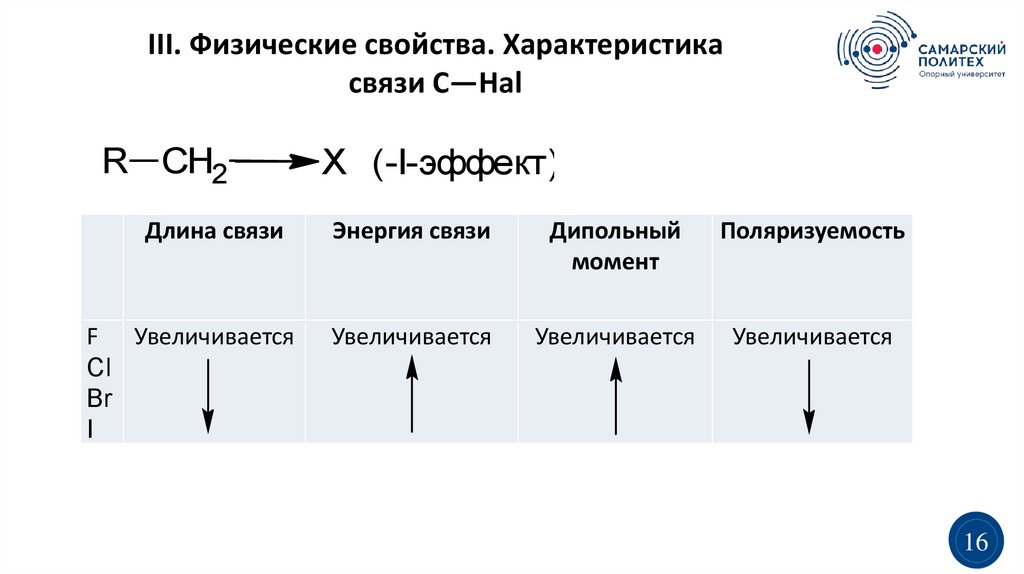
III. Физические свойства. Характеристикасвязи C—Hal
R CH2
Длина связи
F Увеличивается
Cl
Br
I
X (-I-эффект)
Энергия связи
Дипольный
момент
Поляризуемость
Увеличивается
Увеличивается
Увеличивается
16
3
17.
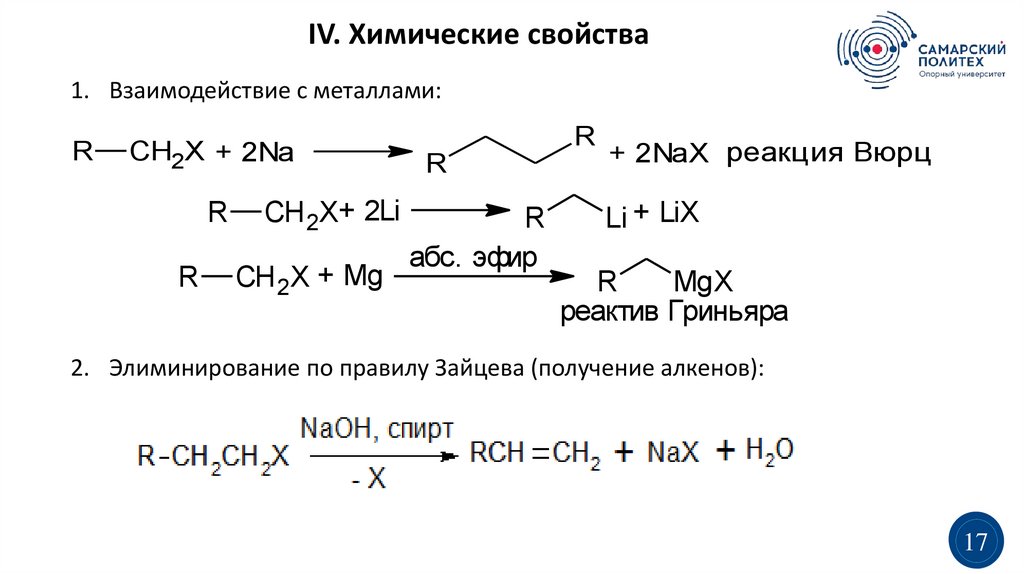
IV. Химические свойства1. Взаимодействие с металлами:
R
CH2X + 2Na
R
R
CH 2X+ 2Li
CH 2X + Mg
R
R
R
абс. эфир
+ 2NaX реакция Вюрца
Li + LiX
R
MgX
реактив Гриньяра
2. Элиминирование по правилу Зайцева (получение алкенов):
17
3
18.
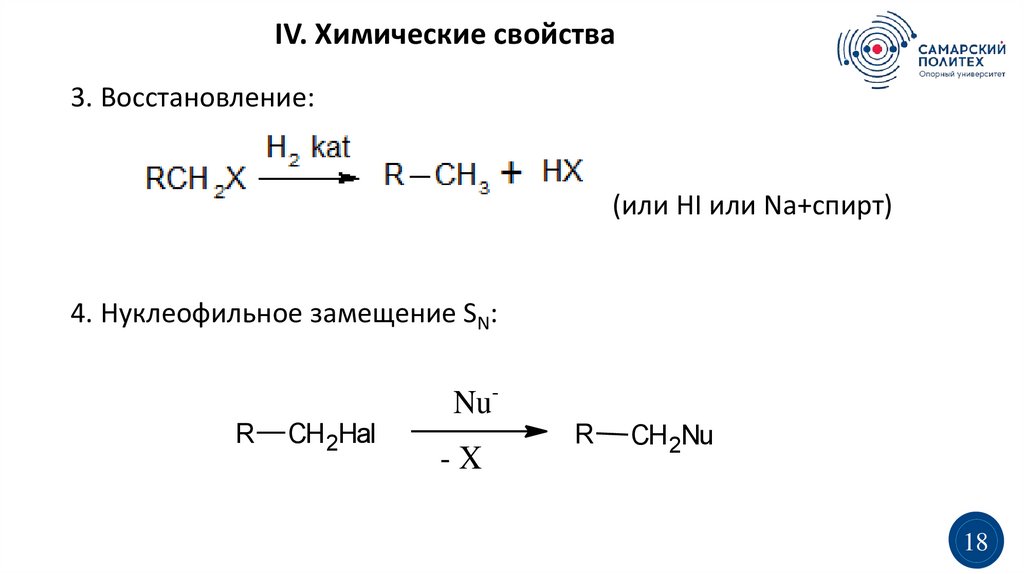
IV. Химические свойства3. Восстановление:
(или HI или Na+спирт)
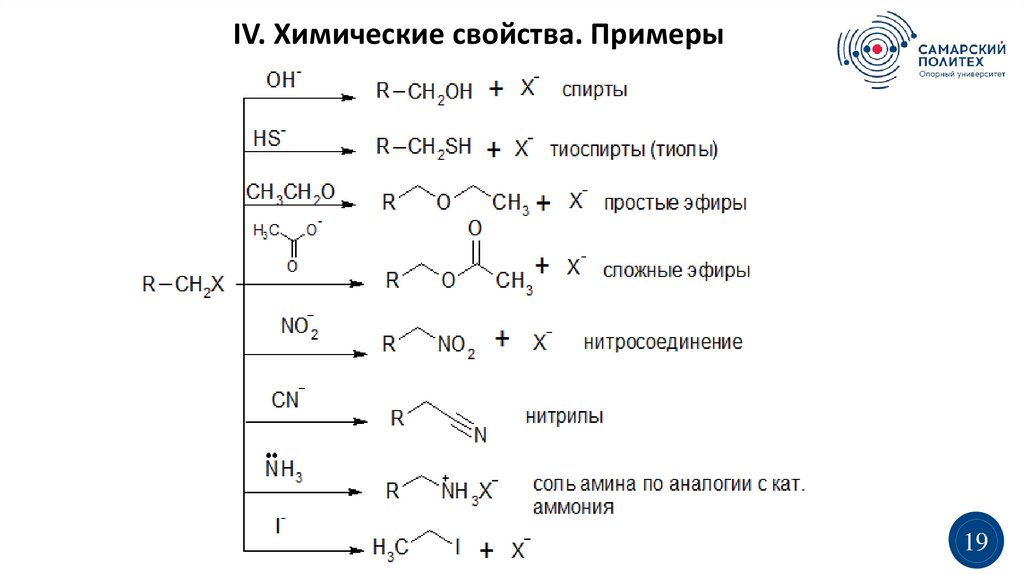
4. Нуклеофильное замещение SN:
NuR
CH 2Hal
-X
R
CH 2Nu
18
3
19.
IV. Химические свойства. Примеры19
3
20.
IV. Химические свойстваНуклеофилом называется атом или частица, которая может отдать ēпару любому элементу, отличному от водорода.
+
-
R CH 2X
Nu
субстрат нуклеофил
RCH 2Nu
-
+X
уходящая группа
Нуклеофилы:
1. OH-, SH-, CN-, NO2-, C2H5O-, CH3COO2. Нейтральные молекулы: NH3, H2O, C2H5OH и т.д.
20
3
21.
IV. Химические свойстваНуклеофильные свойства зависят от ē-плотности на атоме и от его
поляризуемости, т.е. от положения атома в ПС. Чем правее в периоде, тем
больше способность ē-пары участвовать в образовании связи.
CH3->NH2->OH-
увеличение нуклеофильных свойств
Сверху вниз нуклеофильность увеличивается:
I->Br->Cl->Fē-донорные
уменьшают.
группы
увеличивают
нуклеофильность,
SCN->I->CN->OH->Br->Cl->H2O
ē-акцепторные
—
21
3
22.
Химические свойства. Нуклеофильное замещениеНуклеофильное замещение может протекать по механизмам SN1 и SN2.
SN2: (первичные и часть вторичных):
22
3
23.
Химические свойства. Нуклеофильноезамещение
23
3
24.
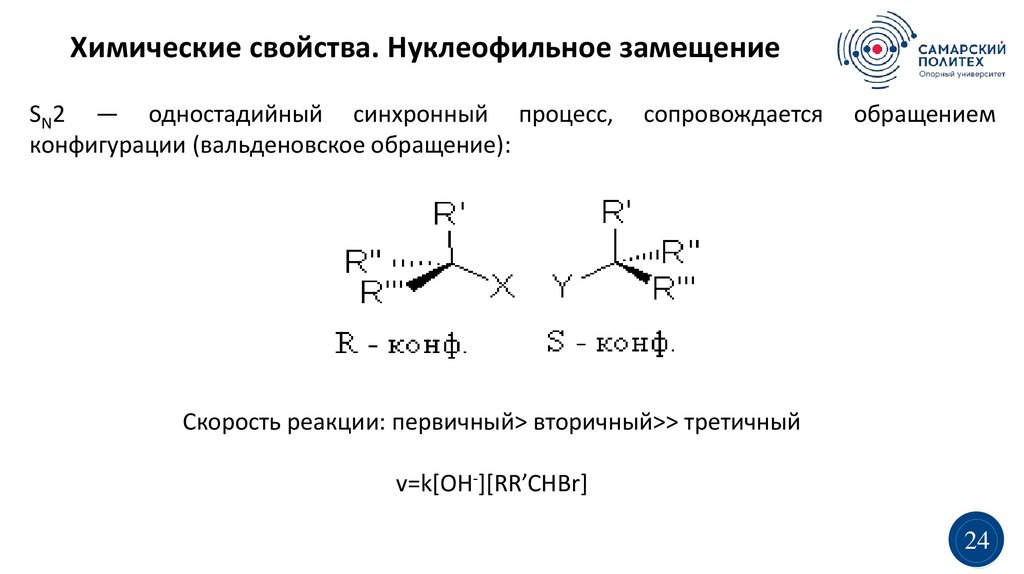
Химические свойства. Нуклеофильное замещениеSN2 — одностадийный синхронный процесс,
конфигурации (вальденовское обращение):
сопровождается
обращением
Скорость реакции: первичный> вторичный>> третичный
v=k[OH-][RR’CHBr]
24
3
25.
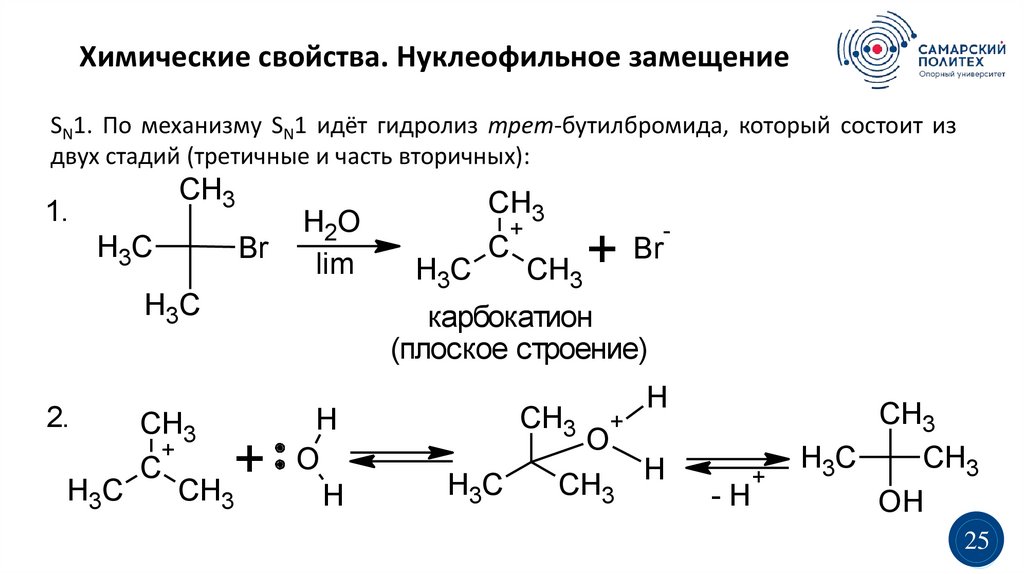
Химические свойства. Нуклеофильное замещениеSN1. По механизму SN1 идёт гидролиз трет-бутилбромида, который состоит из
двух стадий (третичные и часть вторичных):
CH3
1.
H3C
Br
H2O
lim
H3C
CH3
+
C
H3C
CH3
+ Br
-
карбокатион
(плоское строение)
2.
CH3
+
C
H3C
CH3
+
H
O
H
CH3
H3C
+
H
O
H
CH3
-H
+
CH3
H3C
CH3
OH
25
3
26.
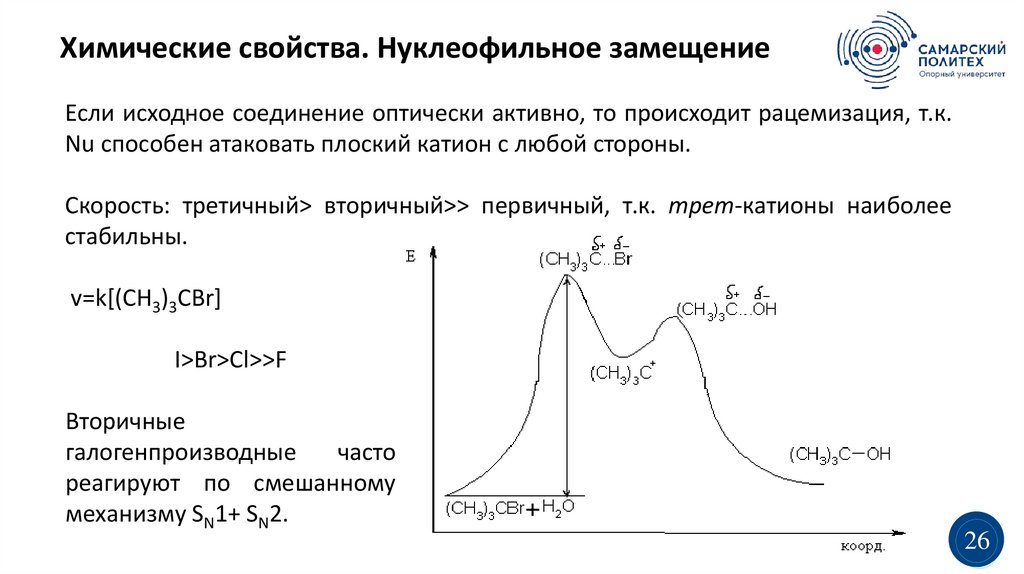
Химические свойства. Нуклеофильное замещениеЕсли исходное соединение оптически активно, то происходит рацемизация, т.к.
Nu способен атаковать плоский катион с любой стороны.
Скорость: третичный> вторичный>> первичный, т.к. трет-катионы наиболее
стабильны.
v=k[(CH3)3CBr]
I>Br>Cl>>F
Вторичные
галогенпроизводные
часто
реагируют по смешанному
механизму SN1+ SN2.
26
3
27.
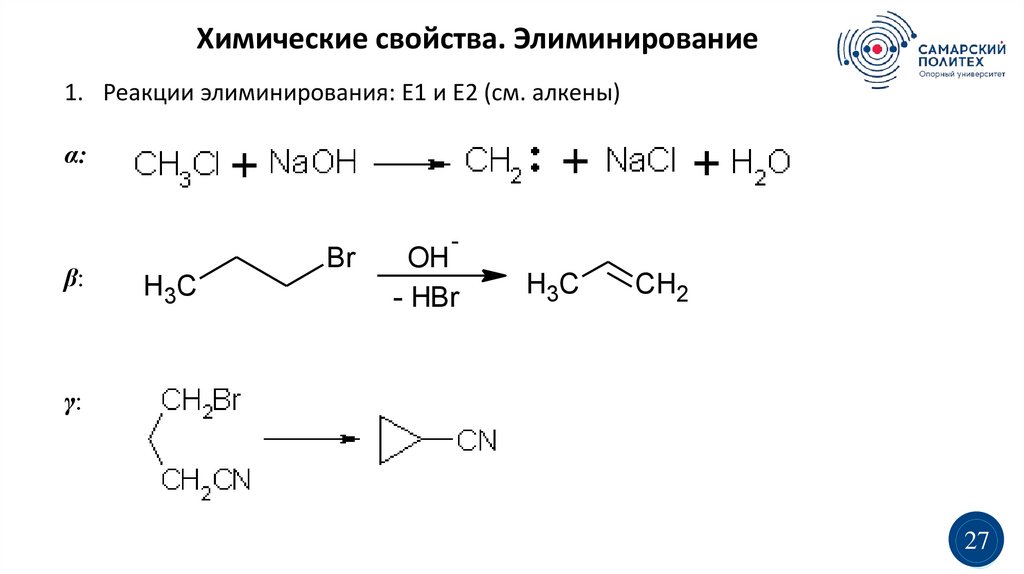
Химические свойства. Элиминирование1. Реакции элиминирования: Е1 и Е2 (см. алкены)
α:
β:
Br
H3C
-
OH
- HBr
H3C
CH2
γ:
27
3
28.
Химические свойства. Конкурированиенуклеофильного замещения и элиминирования
Конкурирующие реакции — Е2 и SN2.
Реакции Е2 и SN2 протекают одновременно.
На соотношение влияют следующие факторы:
1. Сильные основания: NH2-, EtO- способствуют протеканию реакции Е2, а
сильные нуклеофилы (более слабые основания: J-, NH3) – протеканию SN2.
2. Увеличение объёма Nu способствует протеканию Е2.
3. В более полярных растворителях протекает SN2. В спиртовом растворе
щёлочи — Е2.
4. Повышение t° увеличивает скорость отщепления.
28
3
29.
Химические свойства. Конкурированиенуклеофильного замещения и элиминирования
Конкуренция Е1 и SN1:
1. Увеличение числа и объёма заместителей затрудняет SN1 и делает более
выгодной Е1.
2. Протонные растворители (вода, спирты, кислоты: CH3COOH, HCOOH) ускоряют Е1.
3. Чем выше t°С, тем более выгодна реакция Е1.
Полигалогенпроизводные — самостоятельное изучение.
29
3
30.
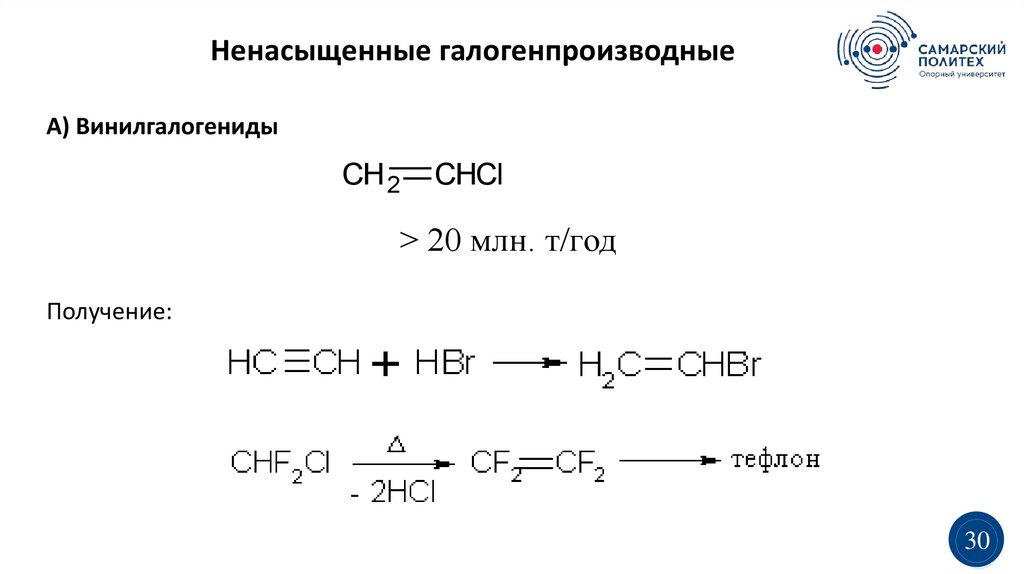
Ненасыщенные галогенпроизводныеА) Винилгалогениды
CH 2
CHCl
> 20 млн. т/год
Получение:
30
3
31.
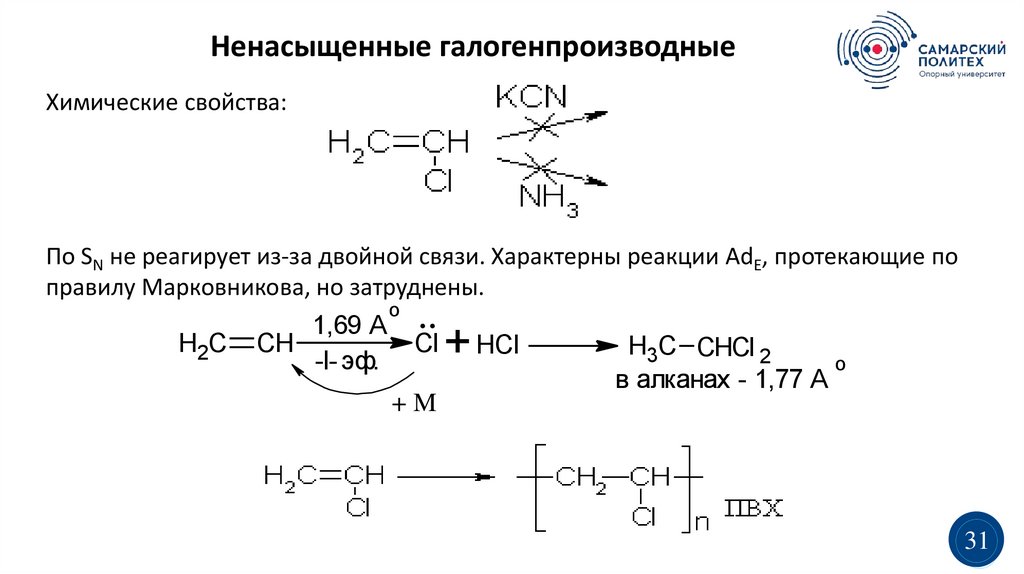
Ненасыщенные галогенпроизводныеХимические свойства:
По SN не реагирует из-за двойной связи. Характерны реакции AdE, протекающие по
правилу Марковникова, но затруднены.
H2C
1,69 A
CH
-I- эф.
o
..
Cl
+M
+ HCl
H3C CHCl 2
о
в алканах - 1,77 А
31
3
32.
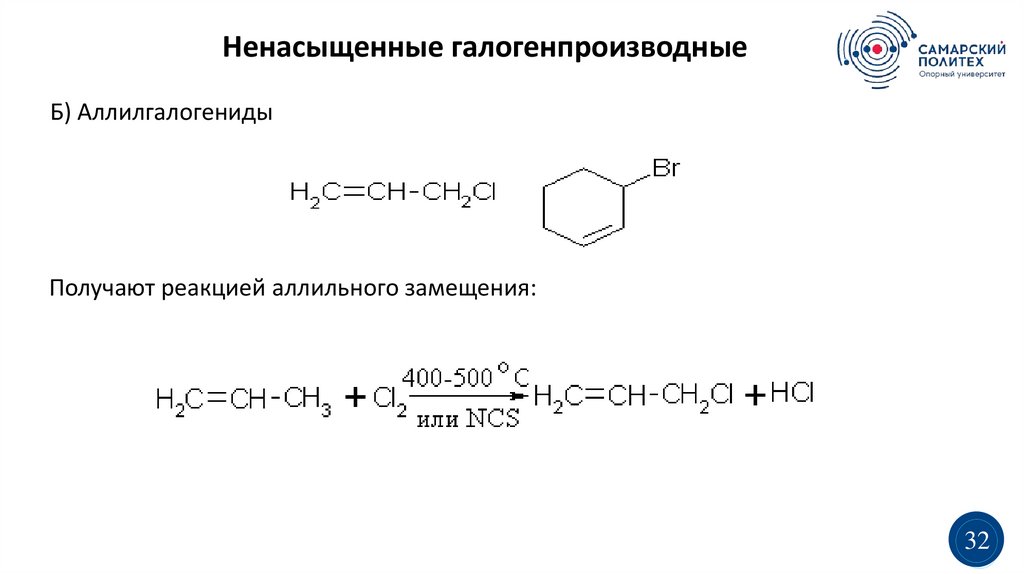
Ненасыщенные галогенпроизводныеБ) Аллилгалогениды
Получают реакцией аллильного замещения:
32
3
33.
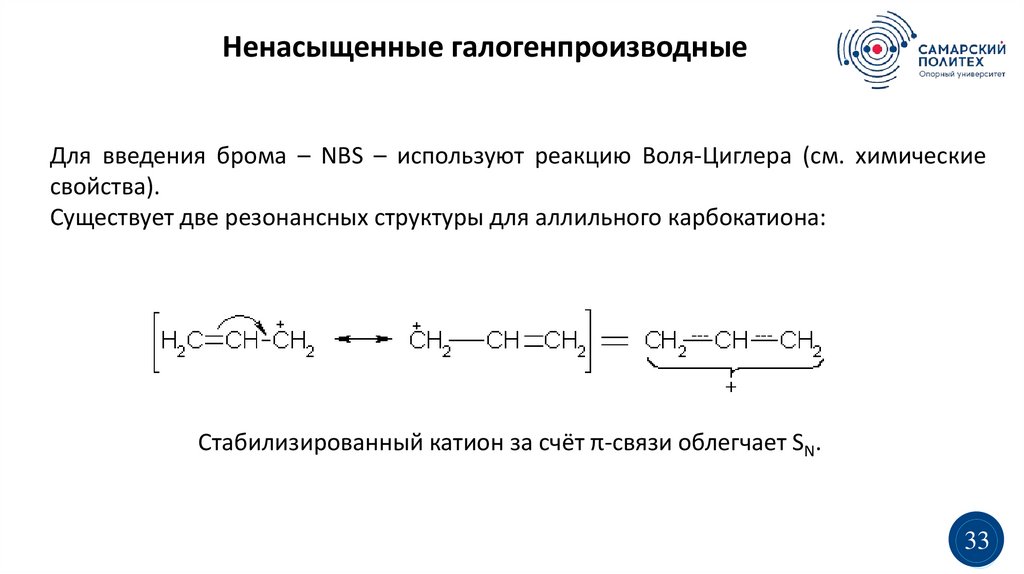
Ненасыщенные галогенпроизводныеДля введения брома – NBS – используют реакцию Воля-Циглера (см. химические
свойства).
Существует две резонансных структуры для аллильного карбокатиона:
Стабилизированный катион за счёт π-связи облегчает SN.
33
3
34.
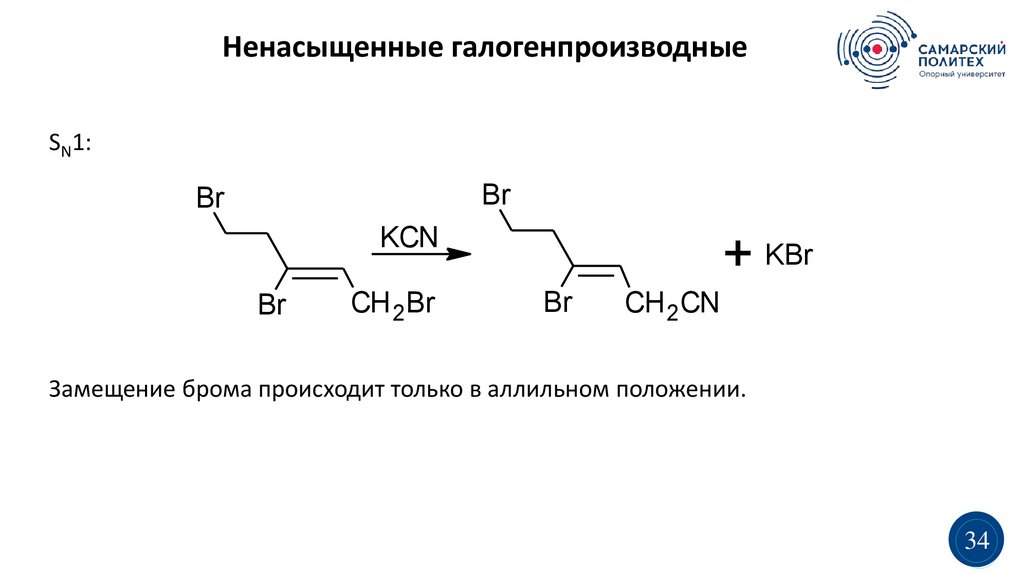
Ненасыщенные галогенпроизводныеSN1:
Br
Br
KCN
Br
CH 2Br
+ KBr
Br
CH 2CN
Замещение брома происходит только в аллильном положении.
34
3
35.
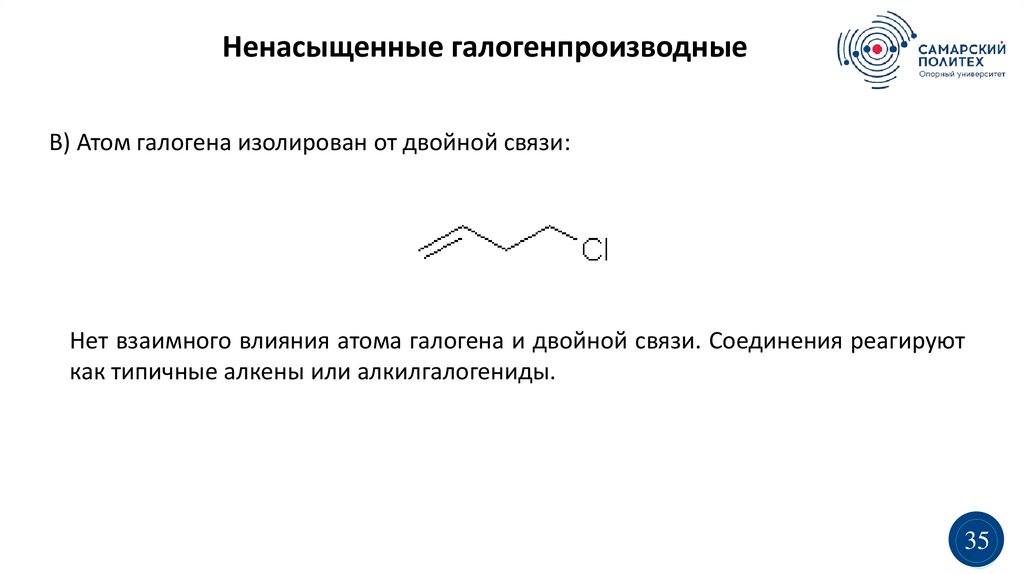
Ненасыщенные галогенпроизводныеВ) Атом галогена изолирован от двойной связи:
Нет взаимного влияния атома галогена и двойной связи. Соединения реагируют
как типичные алкены или алкилгалогениды.
35
3
36.
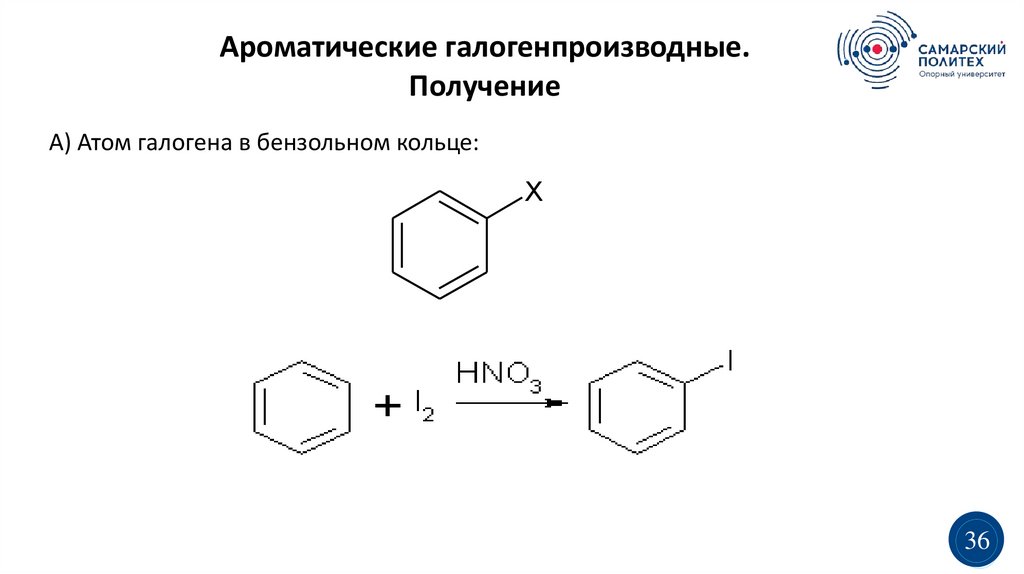
Ароматические галогенпроизводные.Получение
А) Атом галогена в бензольном кольце:
X
36
3
37.
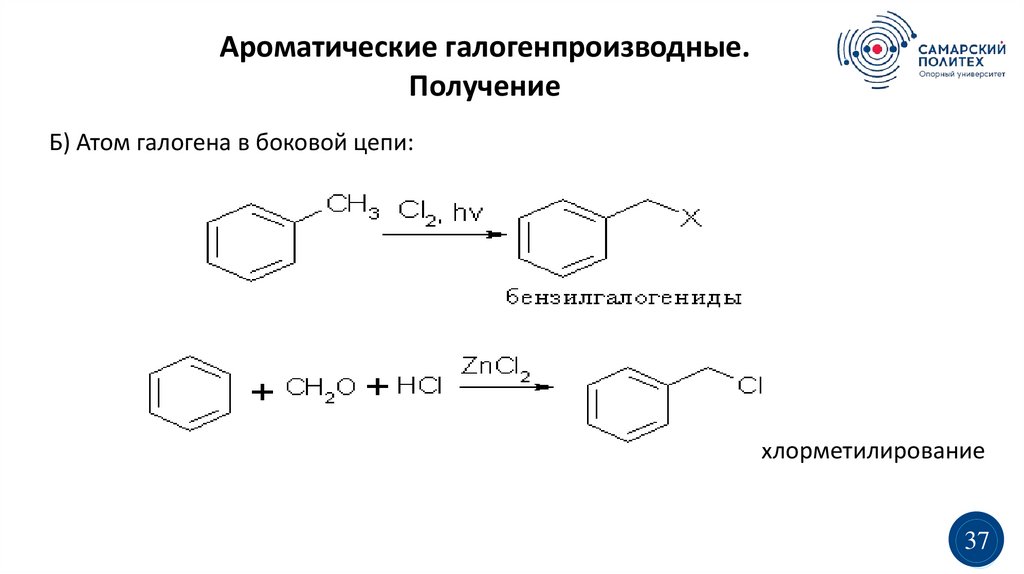
Ароматические галогенпроизводные.Получение
Б) Атом галогена в боковой цепи:
хлорметилирование
37
3
38.
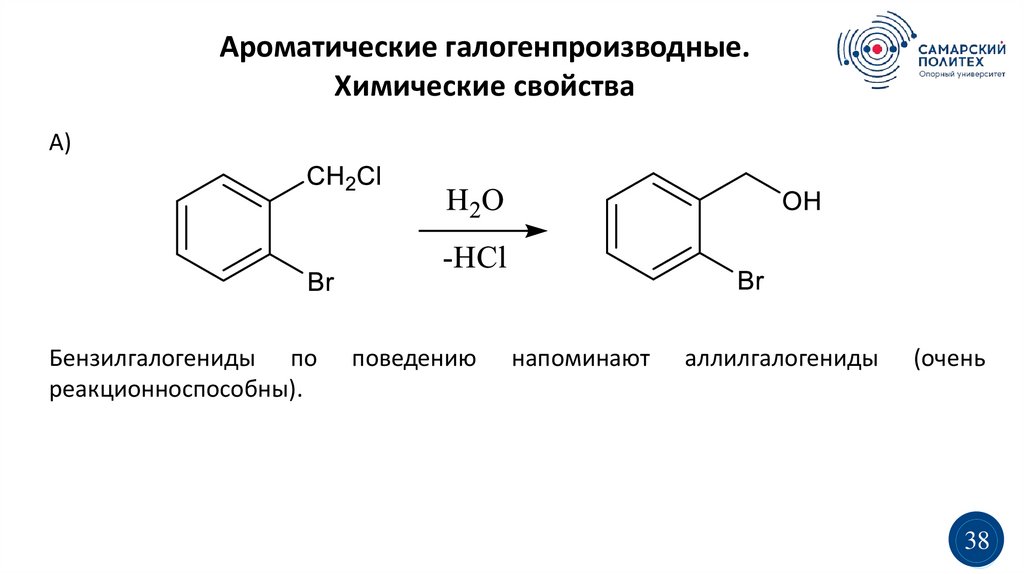
Ароматические галогенпроизводные.Химические свойства
А)
Бензилгалогениды по
реакционноспособны).
поведению
напоминают
аллилгалогениды
(очень
38
3
39.
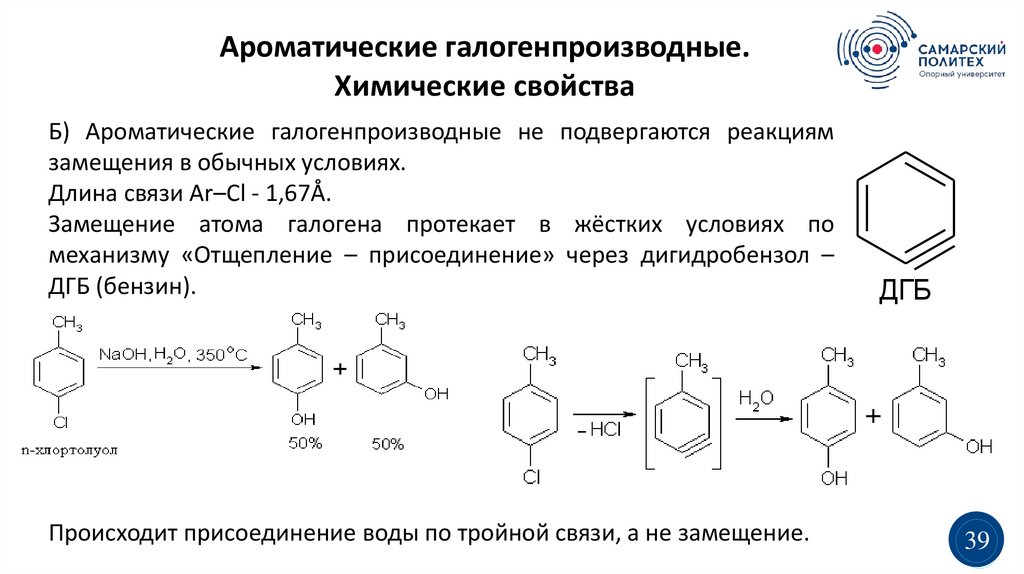
Ароматические галогенпроизводные.Химические свойства
Б) Ароматические галогенпроизводные не подвергаются реакциям
замещения в обычных условиях.
Длина связи Ar–Cl - 1,67Å.
Замещение атома галогена протекает в жёстких условиях по
механизму «Отщепление – присоединение» через дигидробензол –
ДГБ (бензин).
Происходит присоединение воды по тройной связи, а не замещение.
ДГБ
39
3
40.
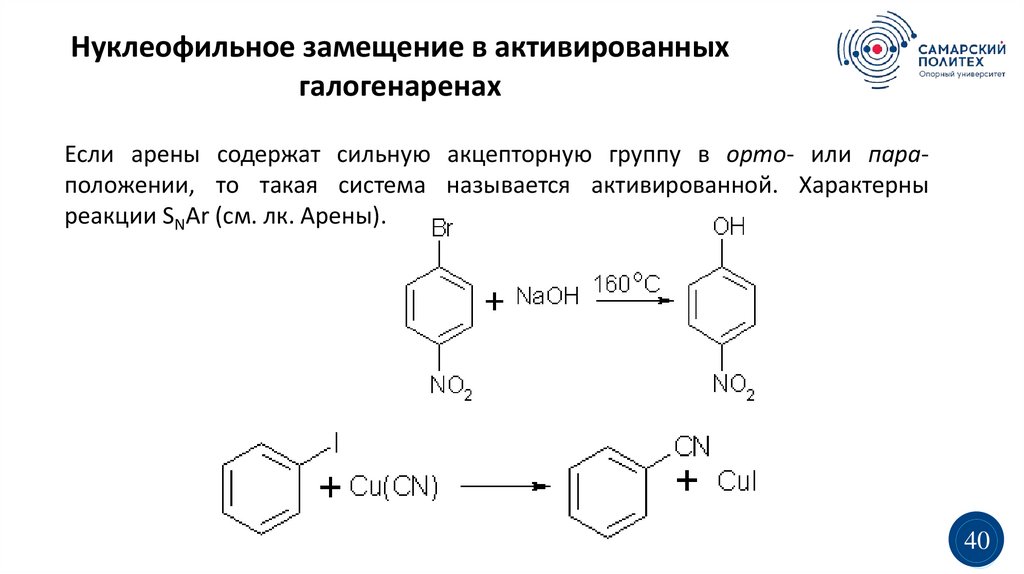
Нуклеофильное замещение в активированныхгалогенаренах
Если арены содержат сильную акцепторную группу в орто- или параположении, то такая система называется активированной. Характерны
реакции SNAr (см. лк. Арены).
40
3
41.
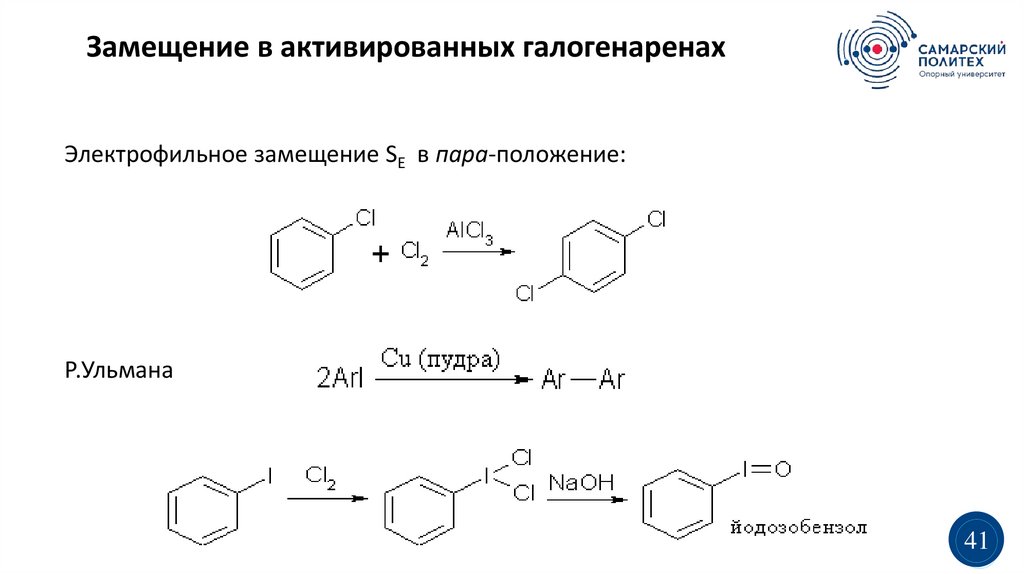
Замещение в активированных галогенаренахЭлектрофильное замещение SE в пара-положение:
Р.Ульмана
41
3
42.
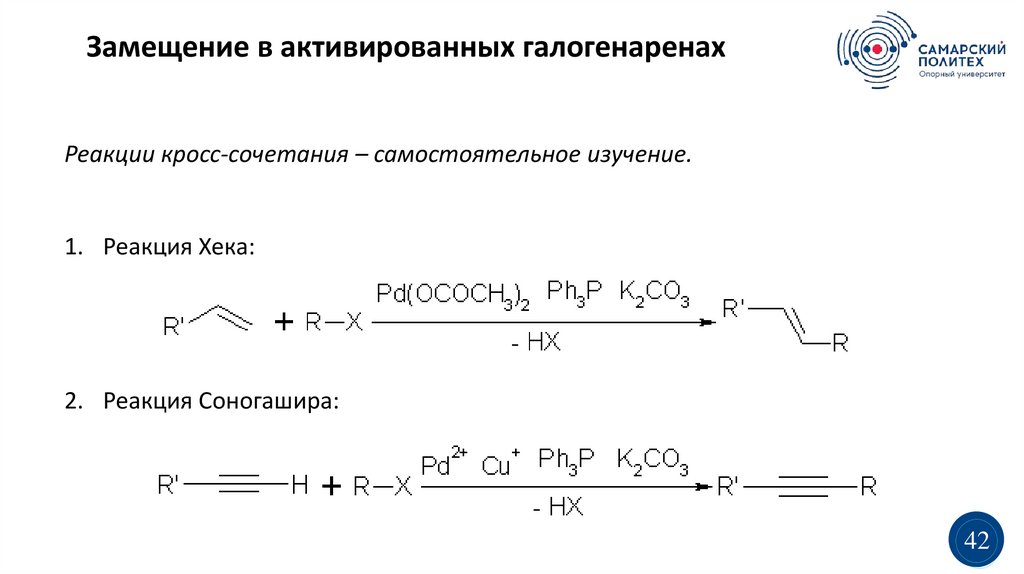
Замещение в активированных галогенаренахРеакции кросс-сочетания – самостоятельное изучение.
1. Реакция Хека:
2. Реакция Соногашира:
42
3
















 Химия
Химия








