Похожие презентации:
Органическая химия. Фенолы
1. Органическая химия
Центр дистанционного обученияОрганическая химия
ФИО преподавателя: Коновалова Надежда Валерьевна
e-mail: nadejda_73@mail.ru
Online-edu.mirea.ru
online.mirea.ru
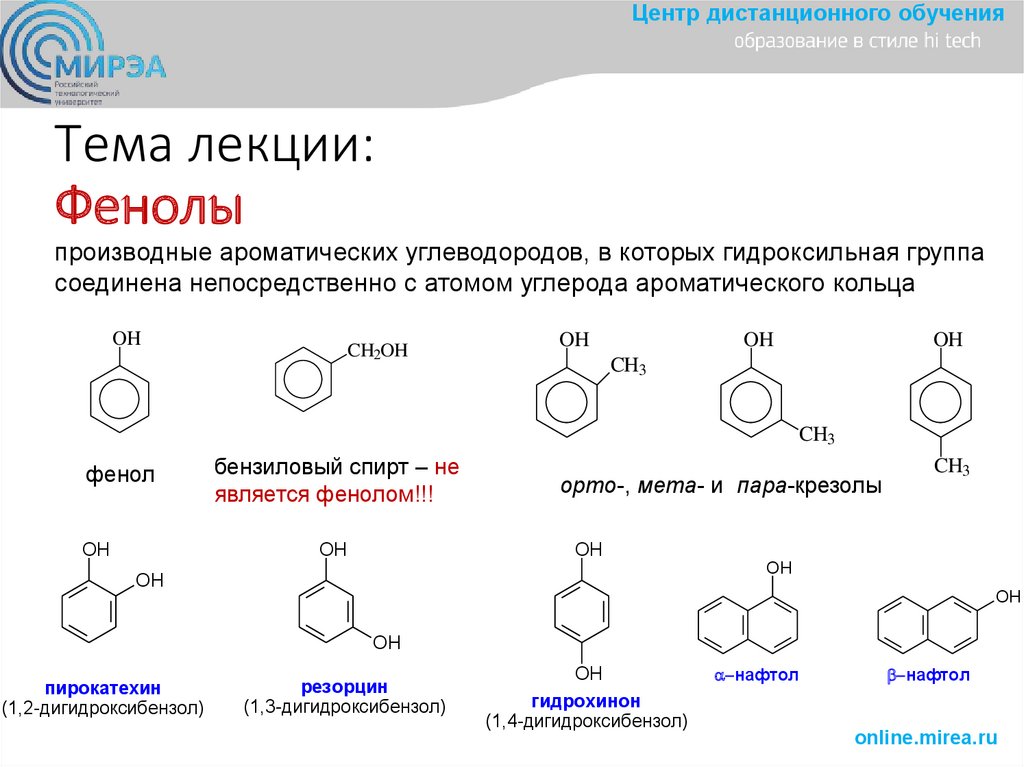
2. Тема лекции: Фенолы
Центр дистанционного обученияТема лекции:
Фенолы
производные ароматических углеводородов, в которых гидроксильная группа
соединена непосредственно с атомом углерода ароматического кольца
OH
CH2OH
OH
OH
OH
CH3
CH3
фенол
ОН
бензиловый спирт – не
является фенолом!!!
OH
орто-, мета- и пара-крезолы
OH
ОН
CH3
ОН
ОН
OH
пирокатехин
(1,2-дигидроксибензол)
резорцин
(1,3-дигидроксибензол)
OH
гидрохинон
(1,4-дигидроксибензол)
нафтол
нафтол
online.mirea.ru
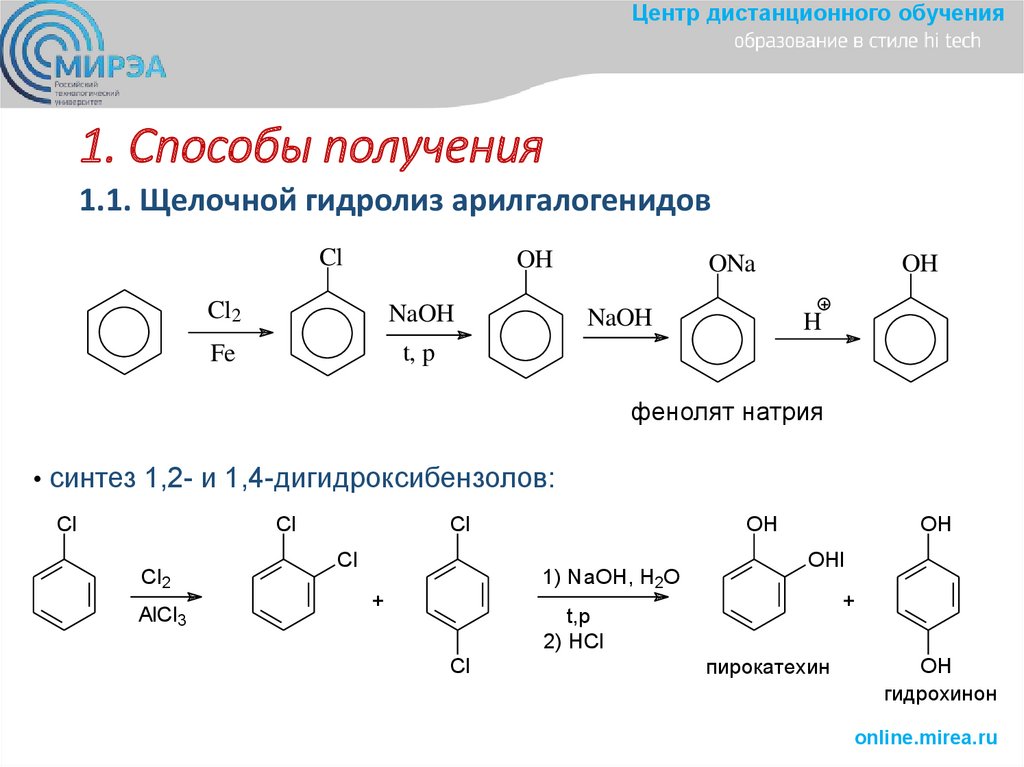
3. 1. Способы получения
Центр дистанционного обучения1. Способы получения
1.1. Щелочной гидролиз арилгалогенидов
Cl
OH
Cl2
NaOH
Fe
t, p
ONa
NaOH
OH
H
фенолят натрия
• синтез 1,2- и 1,4-дигидроксибензолов:
Cl
Cl
Cl2
AlCl3
Cl
Cl
OH
1) NaOH, H2O
+
OH
OHl
+
t,p
2) HCl
Cl
пирокатехин
OH
гидрохинон
online.mirea.ru
4.
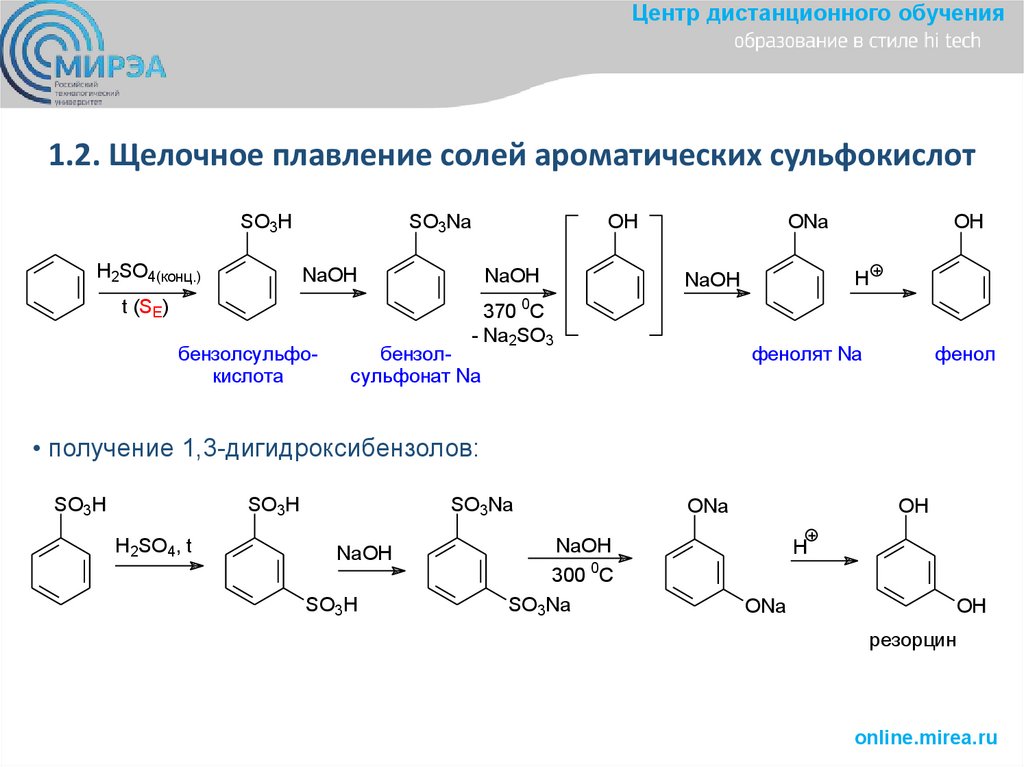
Центр дистанционного обучения1.2. Щелочное плавление солей ароматических сульфокислот
SO3H
H2SO4(конц.)
SO3Na
OH
NaOH
t (SE)
бензолсульфокислота
NaOH
ONa
H
NaOH
370 0С
- Na2SO3
бензолсульфонат Na
OH
фенолят Na
фенол
• получение 1,3-дигидроксибензолов:
SO3H
SO3H
H2SO4, t
SO3Na
NaOH
SO3H
NaOH
300 0C
SO3Na
ONa
OH
H
ONa
OH
резорцин
online.mirea.ru
5.
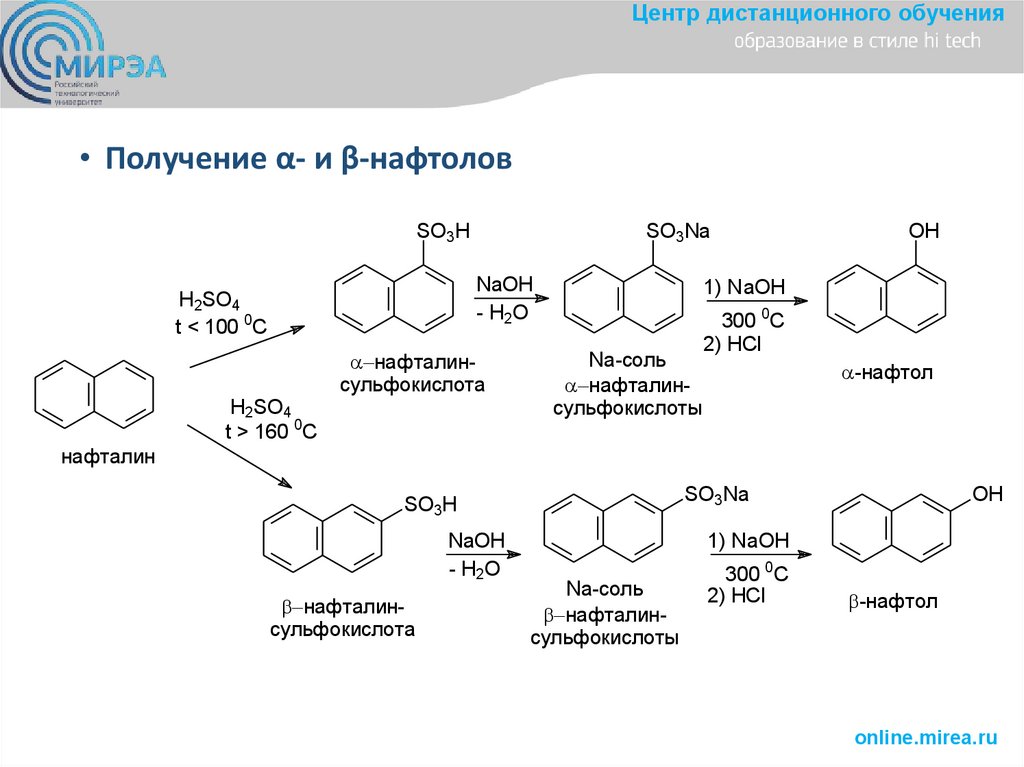
Центр дистанционного обучения• Получение α- и β-нафтолов
SO3H
SO3Na
NaOH
- H2O
H2SO4
t < 100 0C
H2SO4
t > 160 0C
нафталинсульфокислота
OH
1) NaOH
Na-соль
нафталинсульфокислоты
300 0C
2) HCl
-нафтол
нафталин
SO3Na
SO3H
NaOH
- H 2O
нафталинсульфокислота
OH
1) NaOH
Na-соль
нафталинсульфокислоты
300 0C
2) HCl
-нафтол
online.mirea.ru
6.
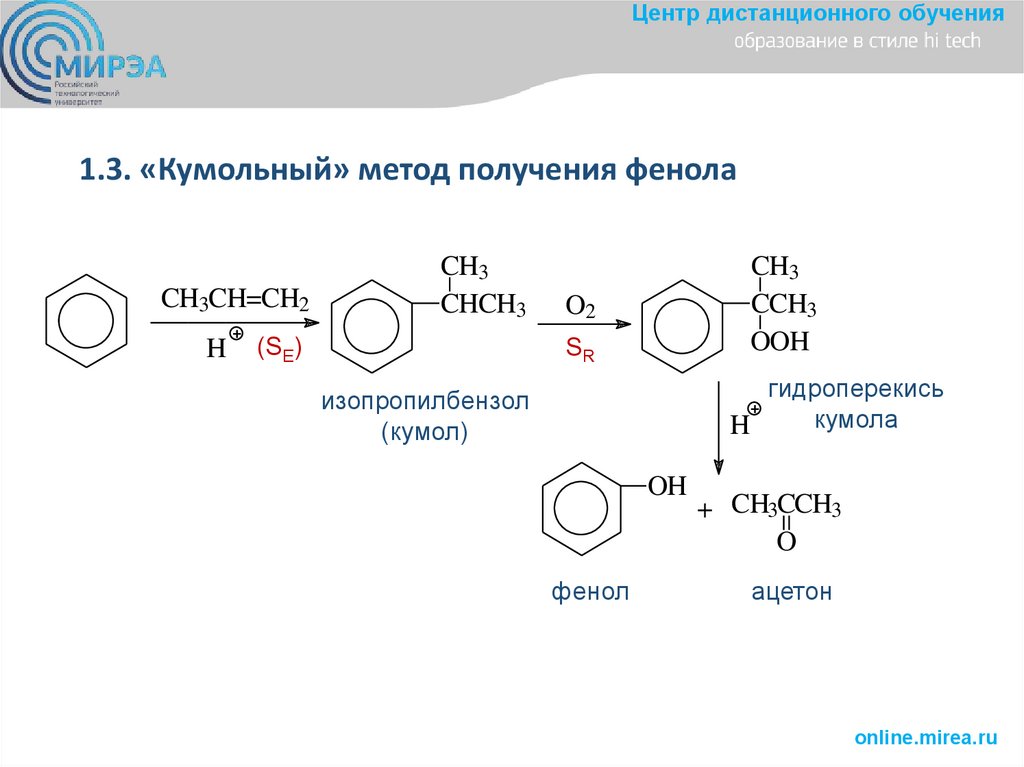
Центр дистанционного обучения1.3. «Кумольный» метод получения фенола
CH3CH=CH2
H
CH3
CHCH3
(SE)
CH3
CCH3
OOH
O2
SR
гидроперекись
кумола
H
изопропилбензол
(кумол)
OH
фенол
+ CH3CCH3
O
ацетон
online.mirea.ru
7.
Центр дистанционного обучения1.4. Восстановление хинонов
O
OH
NaBH4
O
OH
п-хинон
гидрохинон
1.5. Гидролиз солей фенилдиазония
Cl N N
NH2
анилин
OH
NaNO2/HCl
H2O
- 2 H2O
t
хлорид
фенилдиазония
+
N2 + HCl
фенол
online.mirea.ru
8. 2. Строение и реакционная способность
Центр дистанционного обучения2. Строение и реакционная способность
H
R
С
O
H
-I
H
O
H
- I < +M
• Повышается кислотность фенолов по сравнению с
алифатическими спиртами;
• Повышается нуклеофильность бензольного ядра по
сравнению с бензолом (скорость реакций SE выше);
• Понижаются основность и нуклеофильность кислорода;
• Повышается прочность связи С‒О за счет р‒ -сопряжения
→ реакции замещения ОН-группы не идут!
online.mirea.ru
9. Химические свойства
Центр дистанционного обученияХимические свойства
2.1. Кислотно-основные свойства фенолов
O
B
- BH
H
- I < +M
O
+I, +M
O
O
O
рКа ~10
pKa (C2H5OH) ~ 18
OH
O Na
+ NaOH
рКа ~10
фенолят Na
OH
+ H2O
рКа ~16
O Na
+ C2H5OH
+ C2H5O Na
рКа ~10
фенолят Na
рКа ~18
online.mirea.ru
10.
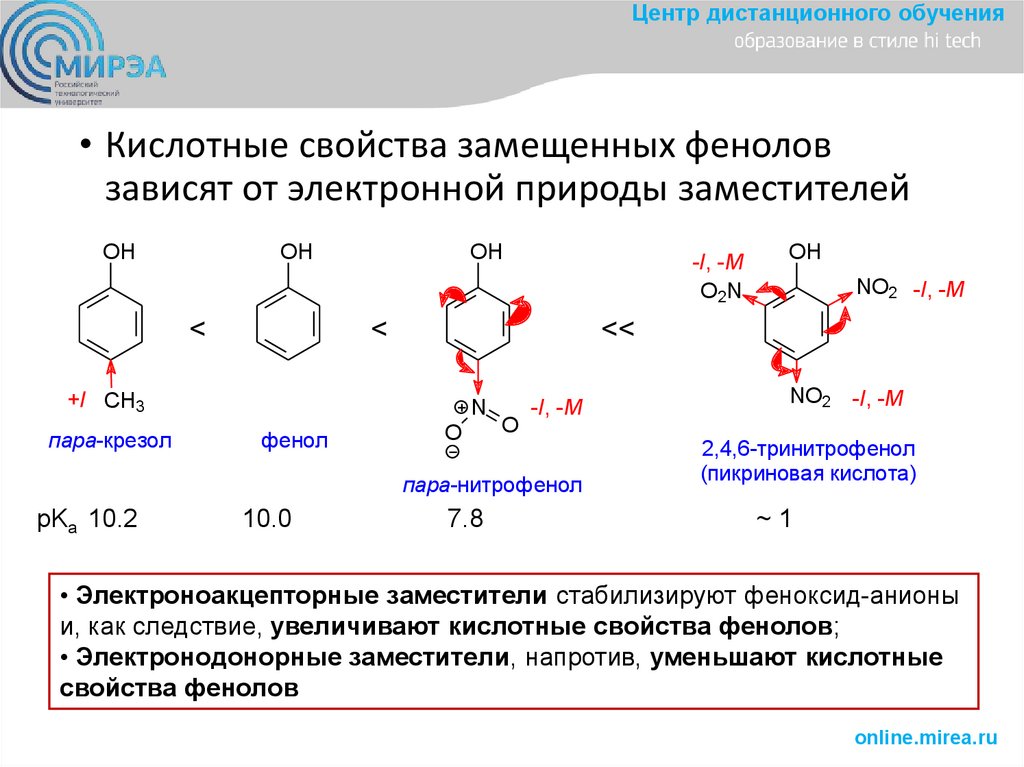
Центр дистанционного обучения• Кислотные свойства замещенных фенолов
зависят от электронной природы заместителей
OH
OH
<
OH
<
N
фенол
O
O
-I, -M
пара-нитрофенол
pKa 10.2
10.0
OH
NO2 -I, -M
<<
+I CH3
пара-крезол
-I, -M
O2N
7.8
NO2 -I, -M
2,4,6-тринитрофенол
(пикриновая кислота)
~1
• Электроноакцепторные заместители стабилизируют феноксид-анионы
и, как следствие, увеличивают кислотные свойства фенолов;
• Электронодонорные заместители, напротив, уменьшают кислотные
свойства фенолов
online.mirea.ru
11.
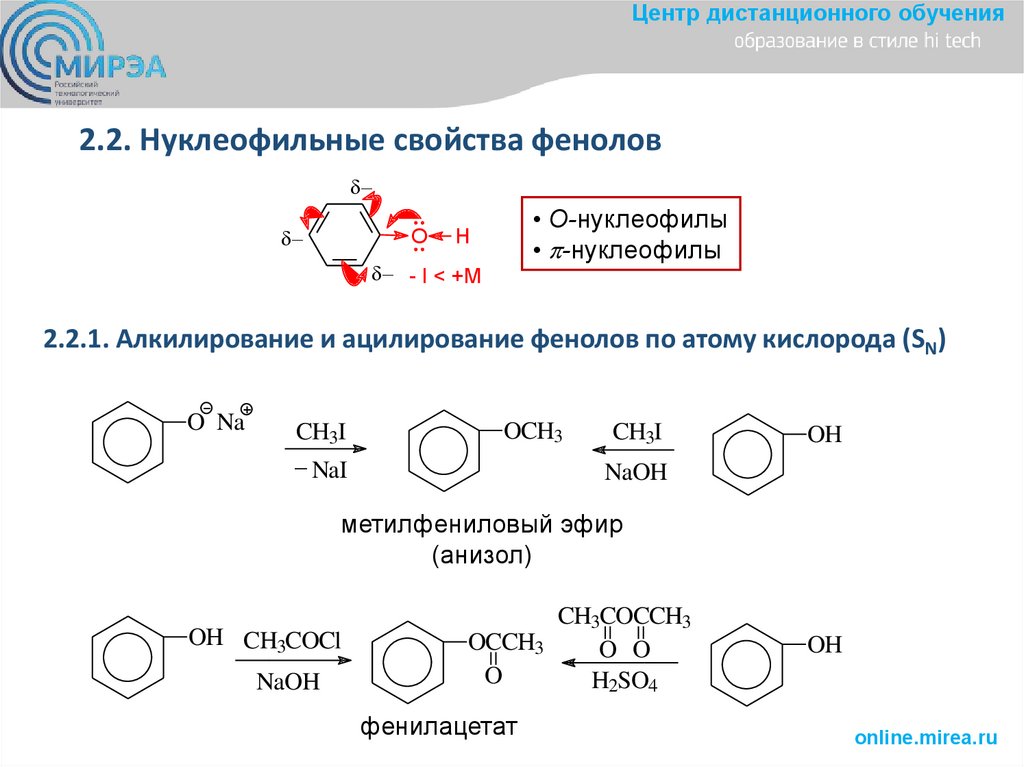
Центр дистанционного обучения2.2. Нуклеофильные свойства фенолов
O
• О-нуклеофилы
• -нуклеофилы
H
- I < +M
2.2.1. Алкилирование и ацилирование фенолов по атому кислорода (SN)
O Na
CH3I
_ NaI
OCH3
CH3I
OH
NaOH
метилфениловый эфир
(анизол)
OH CH3COCl
NaOH
CH3COCCH3
OCCH3
O O
O
H2SO4
фенилацетат
OH
online.mirea.ru
12.
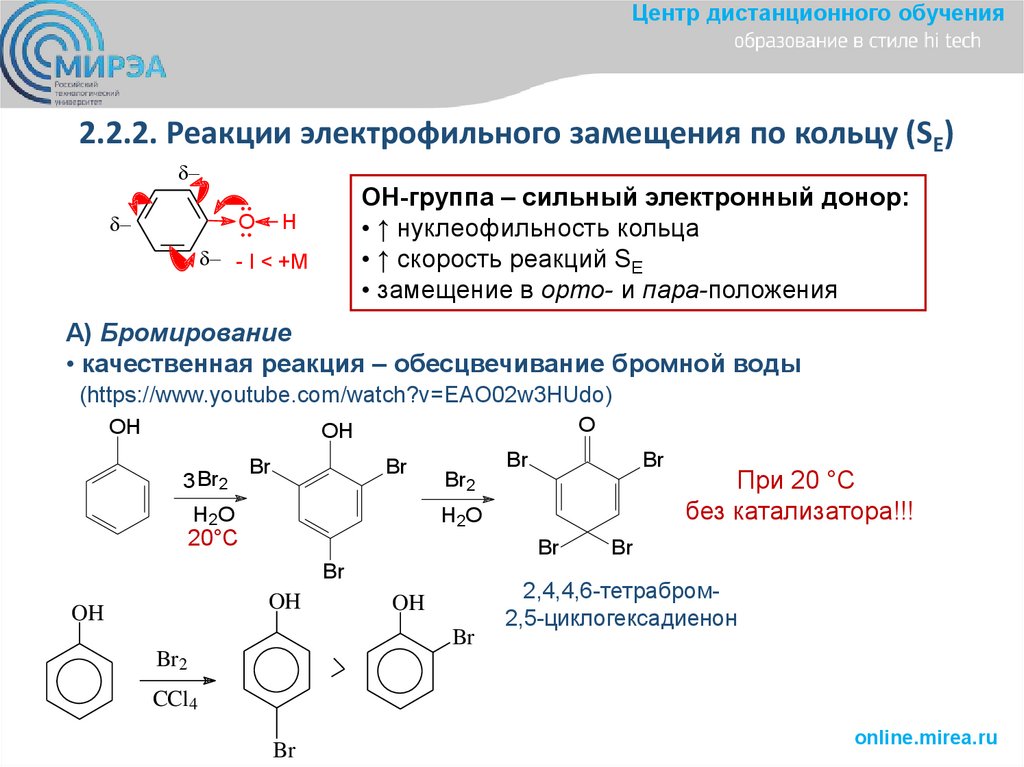
Центр дистанционного обучения2.2.2. Реакции электрофильного замещения по кольцу (SE)
O
ОН-группа – сильный электронный донор:
• ↑ нуклеофильность кольца
• ↑ скорость реакций SE
• замещение в орто- и пара-положения
H
- I < +M
А) Бромирование
• качественная реакция – обесцвечивание бромной воды
(https://www.youtube.com/watch?v=EAO02w3HUdo)
OH
O
OH
3 Br2
Br
Br
H2O
Br
H2O
20°С
Br
Br
OH
OH
Br
Br2
OH
Br
При 20 °С
без катализатора!!!
Br
2,4,4,6-тетрабром2,5-циклогексадиенон
Br2
CCl4
Br
online.mirea.ru
13.
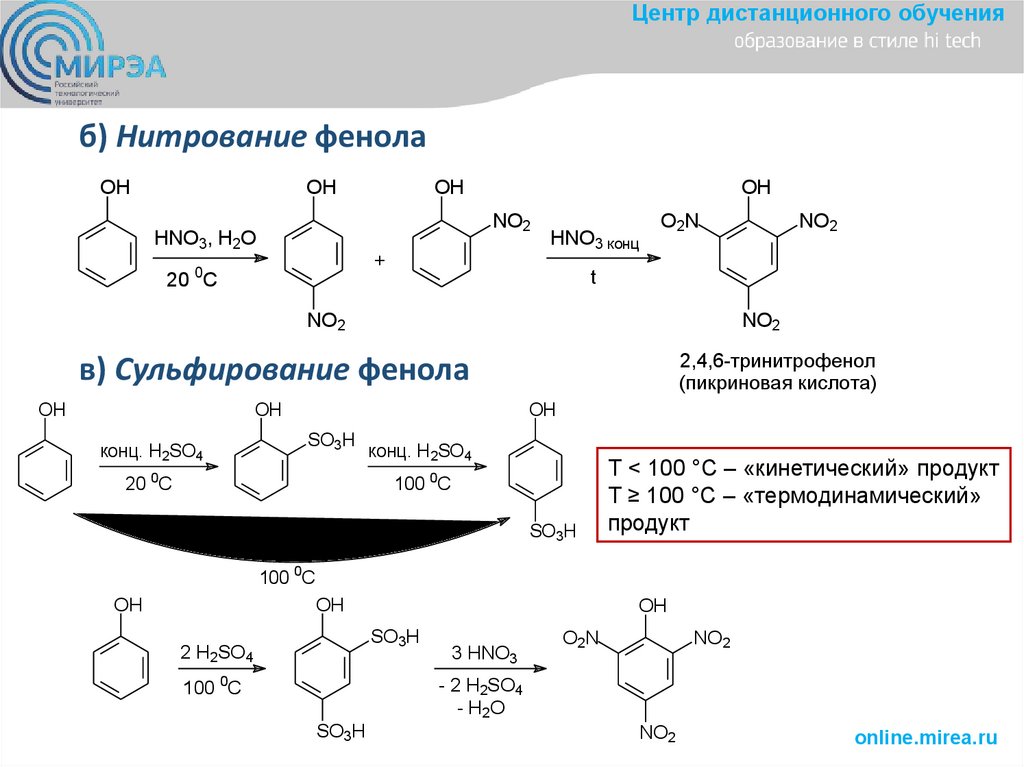
Центр дистанционного обученияб) Нитрование фенола
OH
OH
OH
OH
NO2
HNO3, H2O
+
20 0C
HNO3 конц
O2N
t
NO2
NO2
2,4,6-тринитрофенол
(пикриновая кислота)
в) Сульфирование фенола
OH
OH
OH
SO3H
конц. H2SO4
NO2
20 0C
конц. H2SO4
100 0C
SO3H
конц. H2SO4
T < 100 °C – «кинетический» продукт
T ≥ 100 °C – «термодинамический»
продукт
100 0C
OH
OH
OH
SO3H
2 H2SO4
100 0C
SO3H
3 HNO3
O2N
NO2
- 2 H2SO4
- H2O
NO2
online.mirea.ru
14.
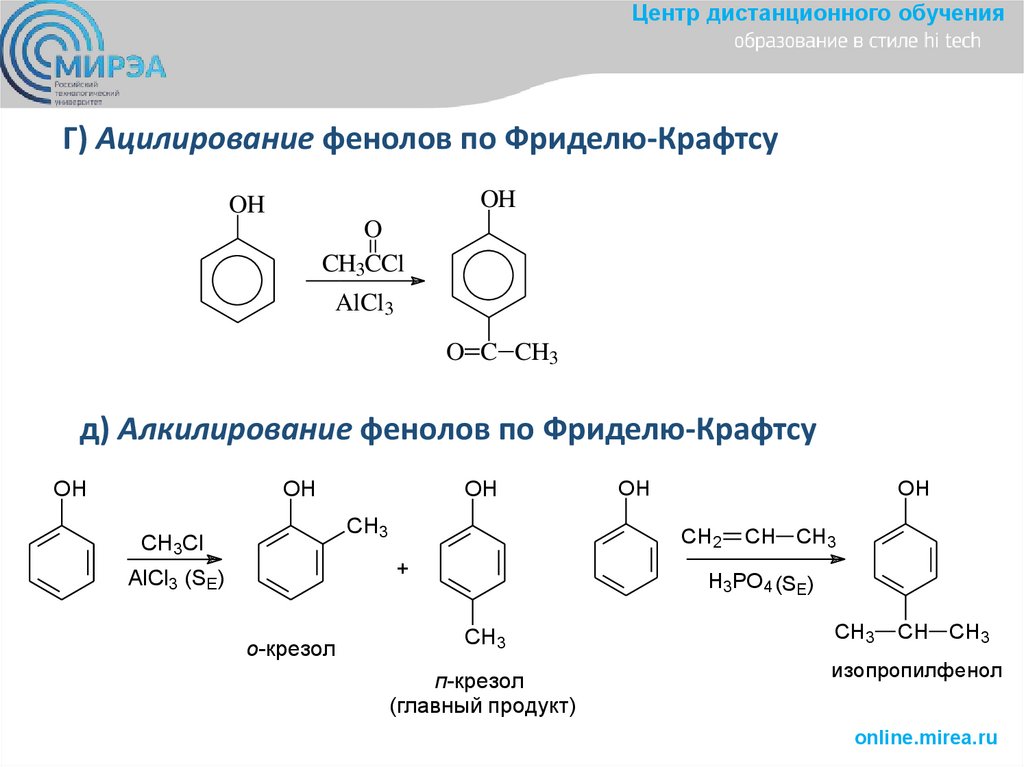
Центр дистанционного обученияГ) Ацилирование фенолов по Фриделю-Крафтсу
OH
OH
O
CH3CCl
AlCl3
O C CH3
д) Алкилирование фенолов по Фриделю-Крафтсу
OH
OH
OH
CH3
CH3Cl
о-крезол
OH
CH2
+
AlCl3 (SE)
OH
CH CH3
H3PO4 (SE)
CH3
п-крезол
(главный продукт)
CH3
CH CH3
изопропилфенол
online.mirea.ru
15.
Центр дистанционного обученияЕ) Взаимодействие фенолов с альдегидами и кетонами
OH
OH
OH
CH2OH
CH2=O
+
H (SE)
орто-гидроксибензиловый
CH2OH
(салициловый) спирт
пара-гидроксибензиловый
спирт
Генерация электрофила:
CH2=O
H
CH2 OH
Продолжение реакции:
OH
OH
CH2OH
H
OH
H
CH2OH
CH2
_H O
2
бензильный катион online.mirea.ru
16.
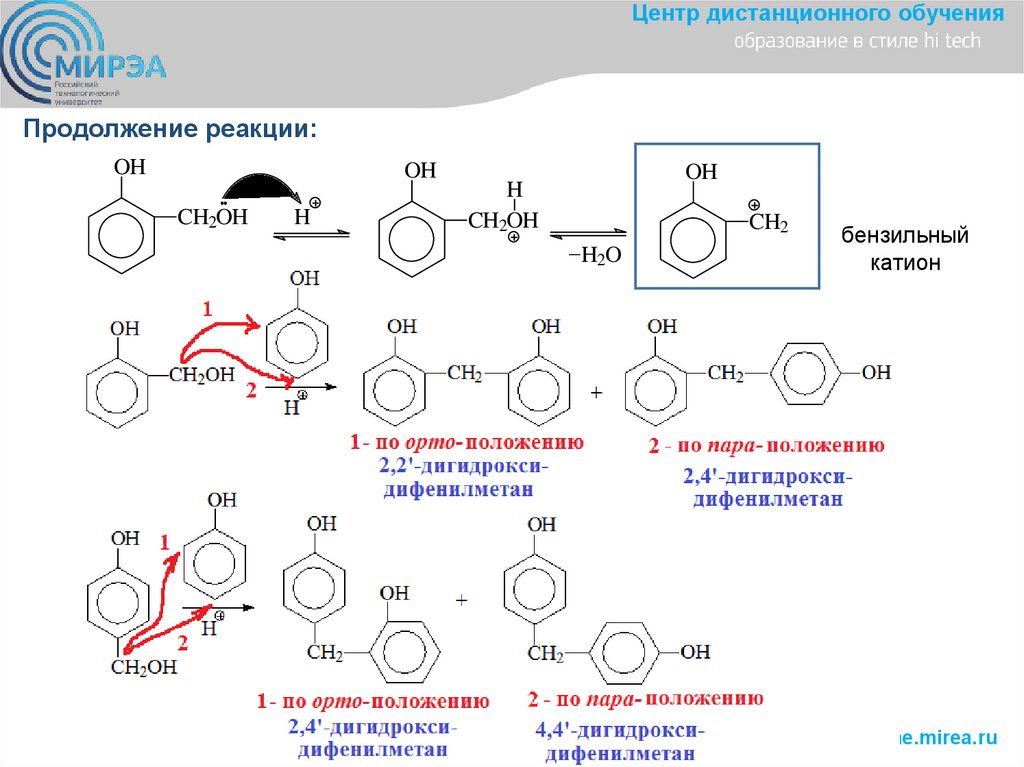
Центр дистанционного обученияПродолжение реакции:
OH
OH
CH2OH
H
OH
H
CH2OH
CH2
_H O
2
бензильный
катион
online.mirea.ru
17.
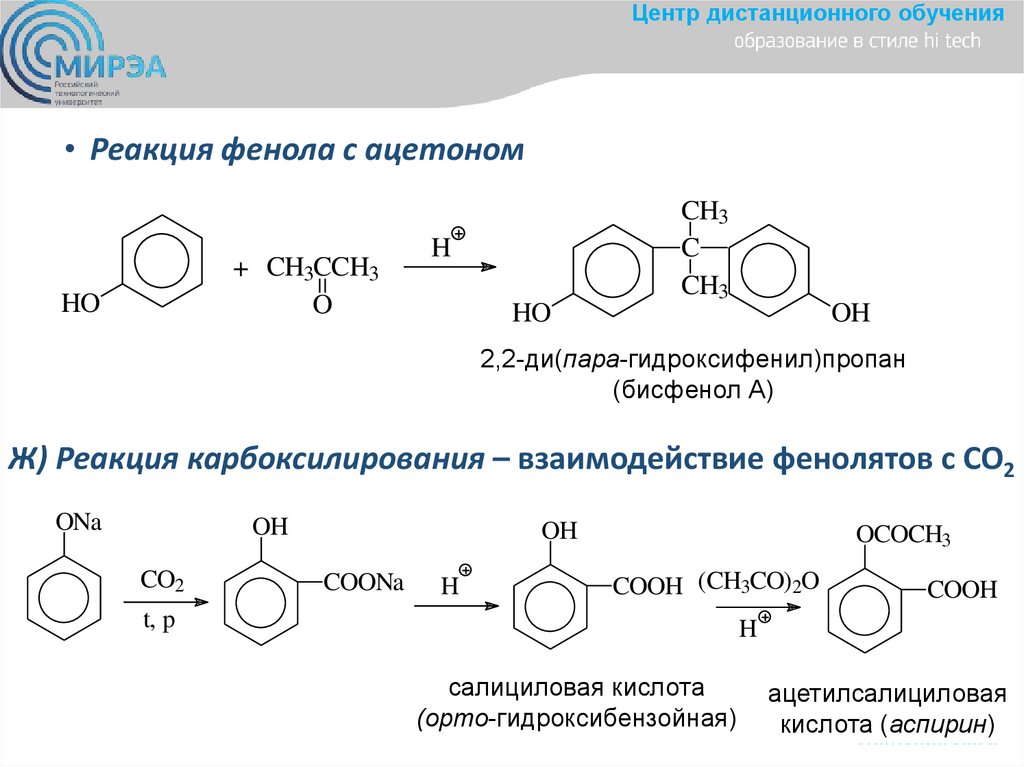
Центр дистанционного обучения• Реакция фенола с ацетоном
+ CH3CCH3
O
HO
H
HO
CH3
C
CH3
OH
2,2-ди(пара-гидроксифенил)пропан
(бисфенол А)
Ж) Реакция карбоксилирования – взаимодействие фенолятов с СО2
ONa
OH
CO2
OH
COONa
H
OCOCH3
COOH (CH3CO)2O
t, p
COOH
H
салициловая кислота
(орто-гидроксибензойная)
ацетилсалициловая
кислота
(аспирин)
online.mirea.ru
18.
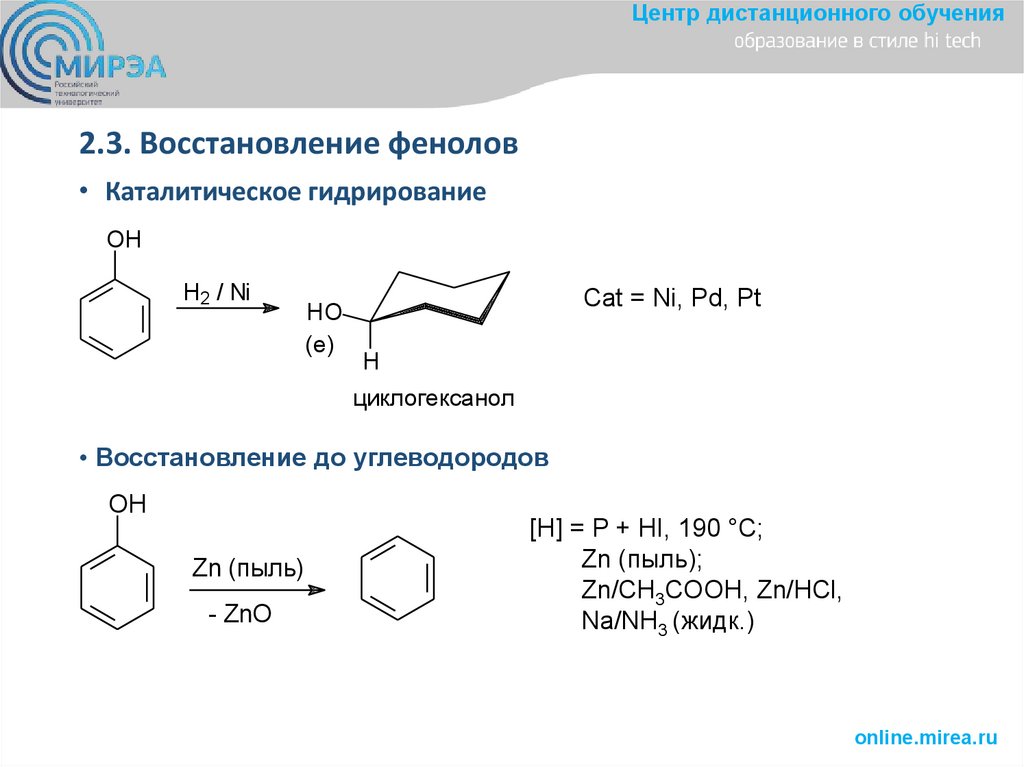
Центр дистанционного обучения2.3. Восстановление фенолов
• Каталитическое гидрирование
OH
H2 / Ni
HO
(e)
Cat = Ni, Pd, Pt
H
циклогексанол
• Восстановление до углеводородов
OH
Zn (пыль)
- ZnO
[H] = P + HI, 190 °С;
Zn (пыль);
Zn/CH3COOH, Zn/HCl,
Na/NH3 (жидк.)
online.mirea.ru
19.
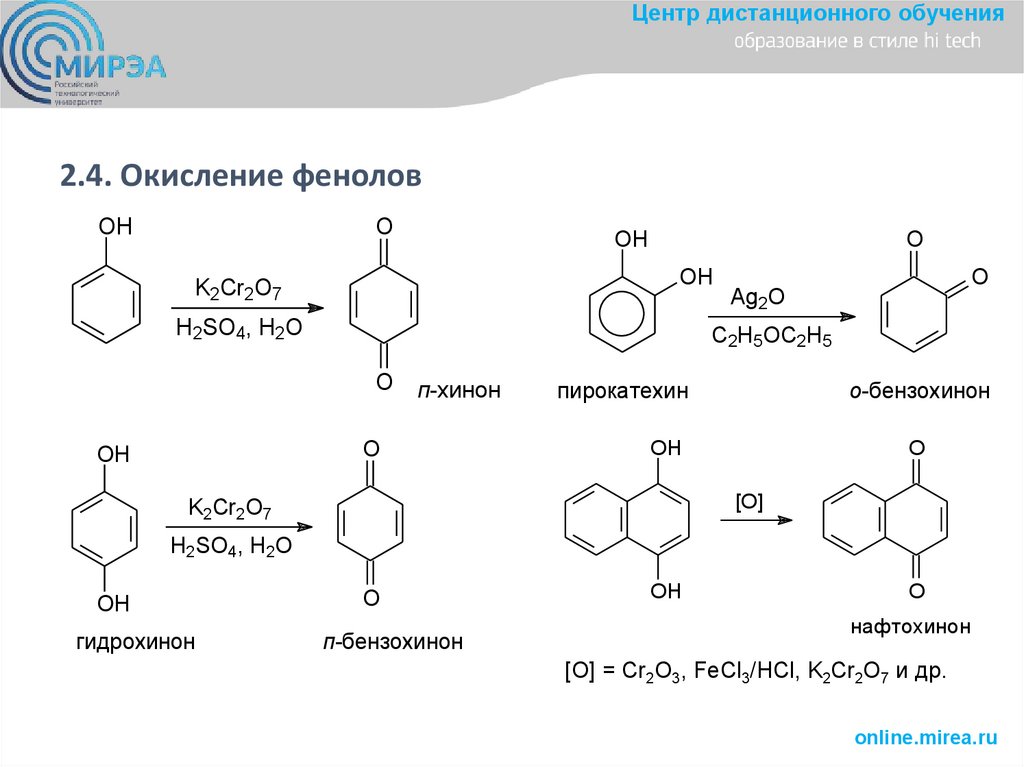
Центр дистанционного обучения2.4. Окисление фенолов
OH
O
OH
O
OH
K2Cr2O7
H2SO4, H2O
C2H5OC2H5
O
п-хинон
O
OH
O
Ag2O
пирокатехин
о-бензохинон
OH
O
[O]
K2Cr2O7
H2SO4, H2O
OH
гидрохинон
O
п-бензохинон
OH
O
нафтохинон
[O] = Cr2O3, FeCl3/HCl, K2Cr2O7 и др.
online.mirea.ru
20. Список литературы
Центр дистанционного обученияСписок литературы
• Реутов, О. А. Органическая химия : учебник : в 4 частях / О.
А. Реутов, А. Л. Курц, К. П. Бутин. — 6-е изд. — Москва :
Лаборатория знаний, [б. г.]. — Часть 3 — 2017. — 547 с. —
ISBN 978-5-00101-508-6. — Текст : электронный // Лань :
электронно-библиотечная система. — URL:
https://e.lanbook.com/book/94166 (дата обращения:
07.04.2020). — Режим доступа: для авториз. пользователей.
online.mirea.ru
21. Спасибо за внимание!
Центр дистанционного обученияСпасибо за внимание!
online.mirea.ru







 Химия
Химия