Похожие презентации:
Ароматические оксисоединения. Фенолы
1. Ароматические оксисоединения
Фенолы2.
Фенолы - это ароматические углеводороды,содержащие одну, две или большее количество
гидроксильных групп.
Кроме фенолов существуют ароматические спирты,
которые содержат гидроксильную группу в боковой
цепи, например:
бензиловый спирт
3. В зависимости от количества гидроксильных групп различают по атомности:
одноатомные;
двухатомные;
трехатомные;
четырехатомные.
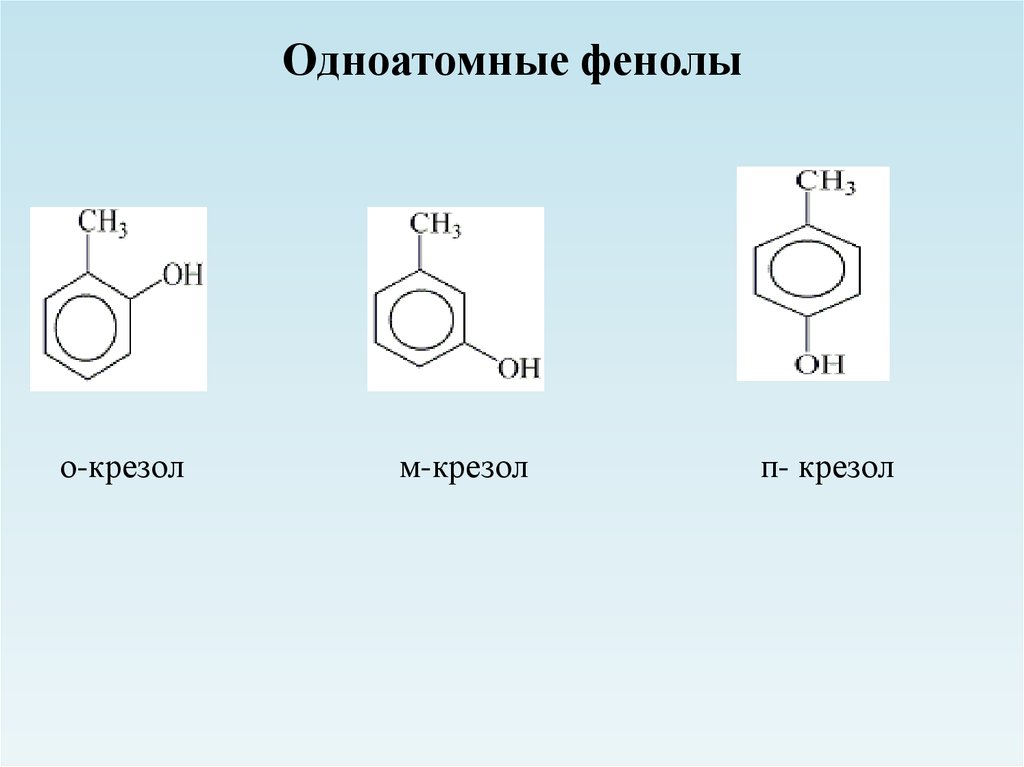
4. Одноатомные фенолы
о-крезолм-крезол
п- крезол
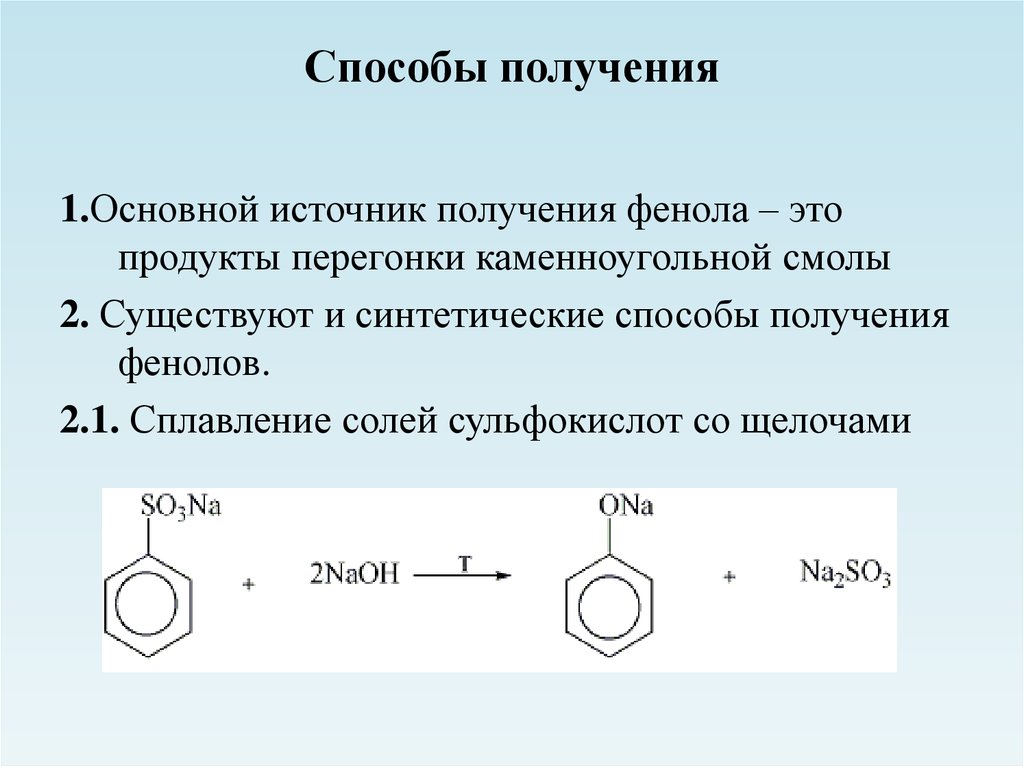
5. Способы получения
1.Основной источник получения фенола – этопродукты перегонки каменноугольной смолы
2. Существуют и синтетические способы получения
фенолов.
2.1. Сплавление солей сульфокислот со щелочами
6.
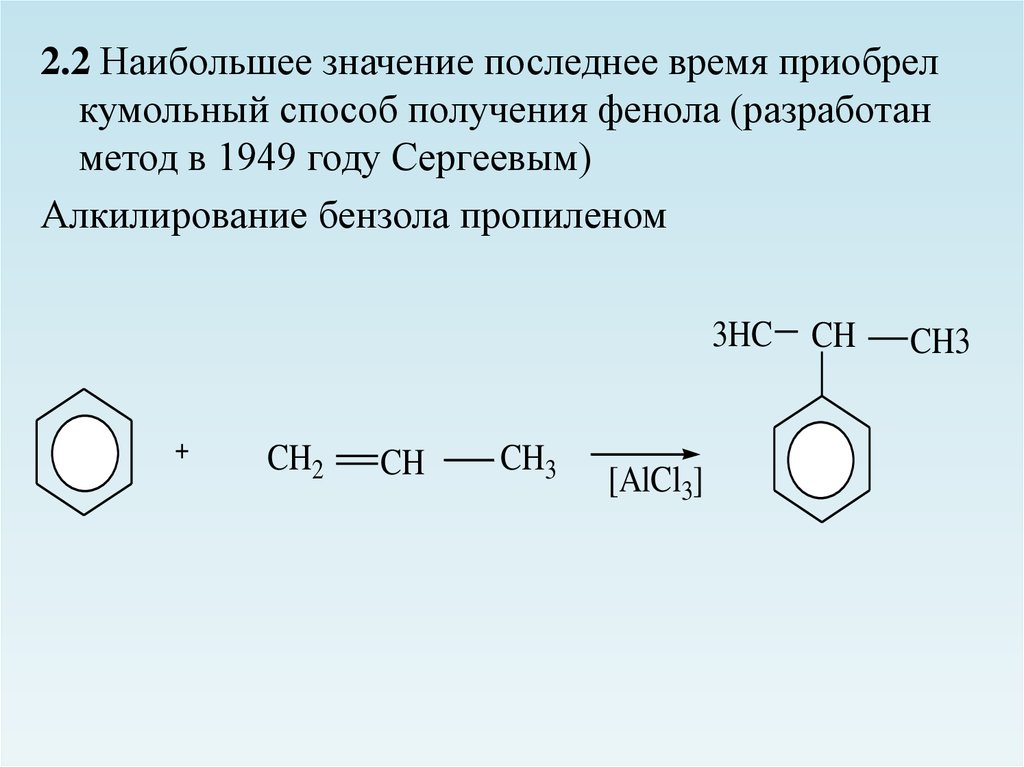
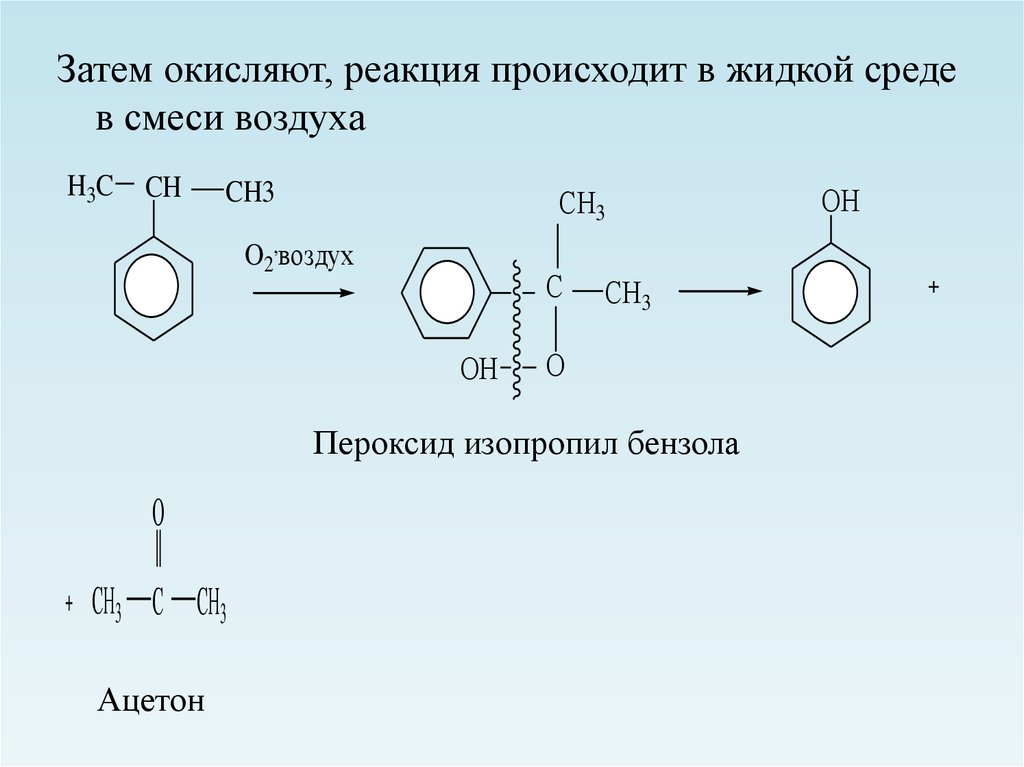
2.2 Наибольшее значение последнее время приобрелкумольный способ получения фенола (разработан
метод в 1949 году Сергеевым)
Алкилирование бензола пропиленом
3HC
CH2
CH
CH3
[AlCl3]
CH
CH3
7.
Затем окисляют, реакция происходит в жидкой средев смеси воздуха
H3C
CH
CH3
СН3
O2,воздух
С
ОН
СН3
О
Пероксид изопропил бензола
О
СН3 С СН3
Ацетон
ОН
8.
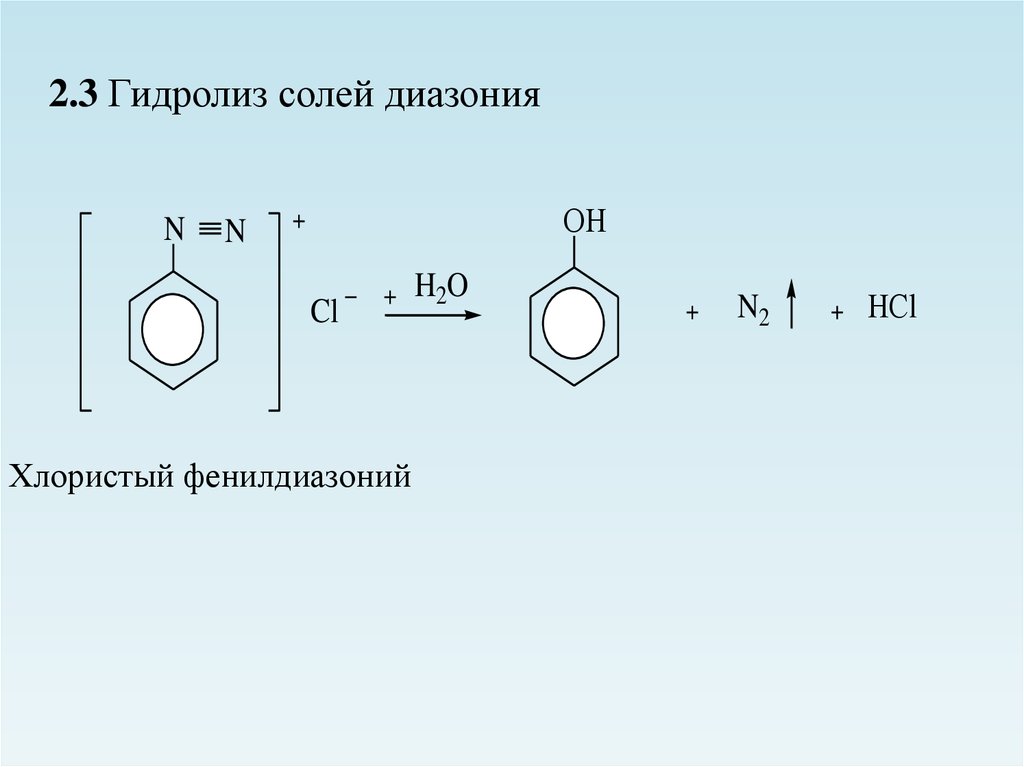
2.3 Гидролиз солей диазонияN
ОН
N
Cl
Хлористый фенилдиазоний
H2O
N2
НСl
9. Физические свойства
Фенолы – это бесцветные кристаллическиевещества, трудно растворимые в воде, обладают
характерным запахом, а так же обладают сильным
антисептическим действием.
При попадание на кожу вызывает долго
незаживающие ожоги! ЯДОВИТ!!!
10. Химические свойства
Химические свойства фенола определяютсяналичием двух функциональных групп:
• гидроксильная группа;
• ароматическое кольцо.
Из-за взаимного влияния этих функциональных
групп не все химические свойства спиртов и
фенолов совпадают.
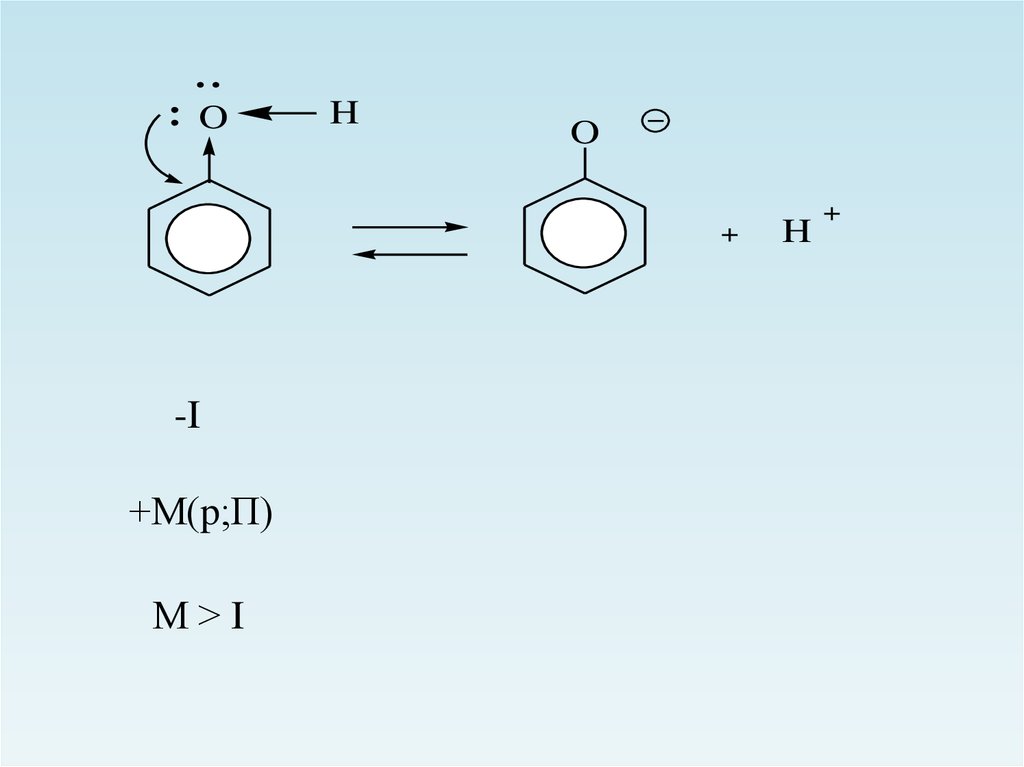
11.
OH
O
H
-I
+М(p;П)
М>I
12.
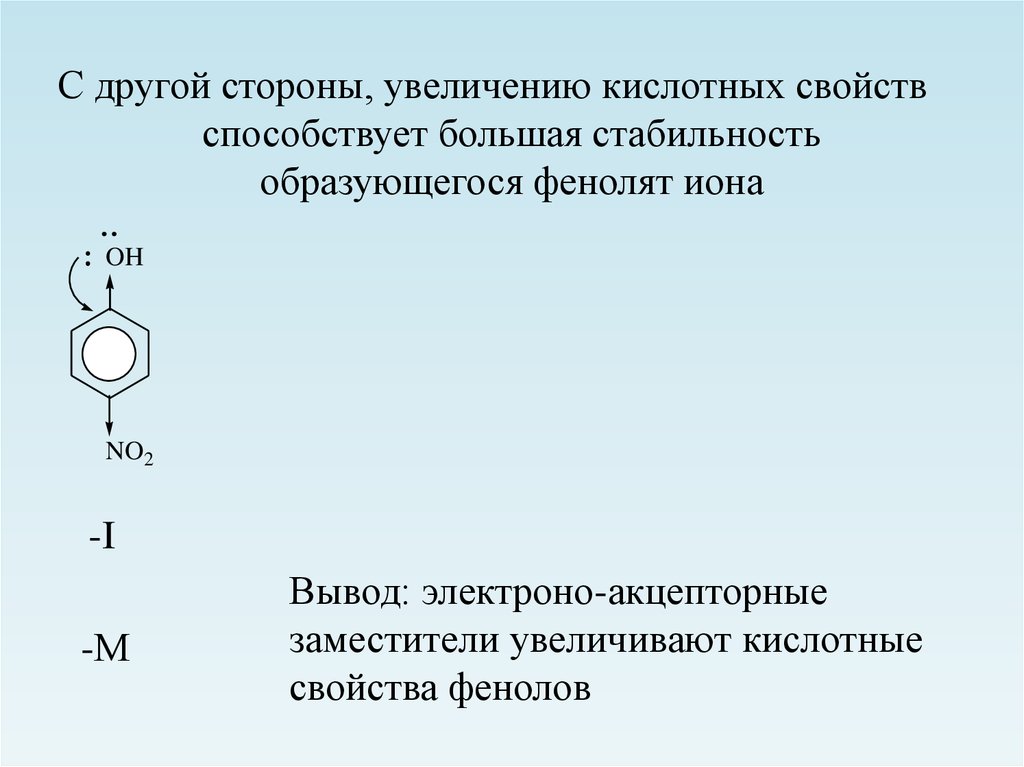
С другой стороны, увеличению кислотных свойствспособствует большая стабильность
образующегося фенолят иона
OH
NO2
-I
-М
Вывод: электроно-акцепторные
заместители увеличивают кислотные
свойства фенолов
13.
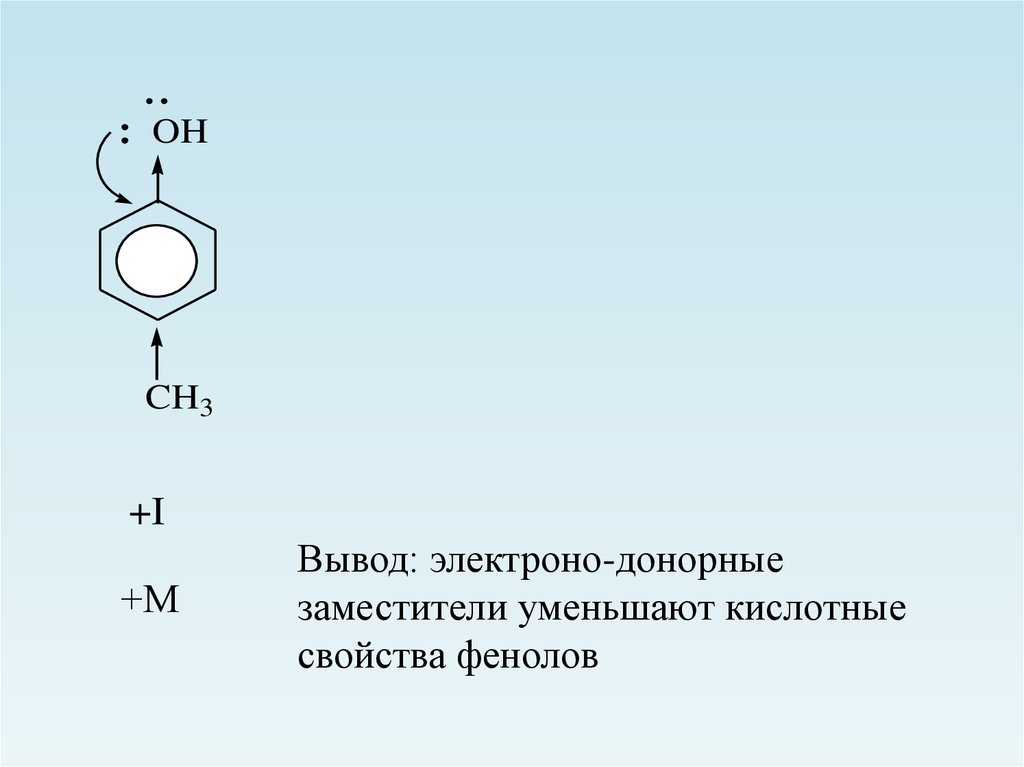
OHCH3
+I
+М
Вывод: электроно-донорные
заместители уменьшают кислотные
свойства фенолов
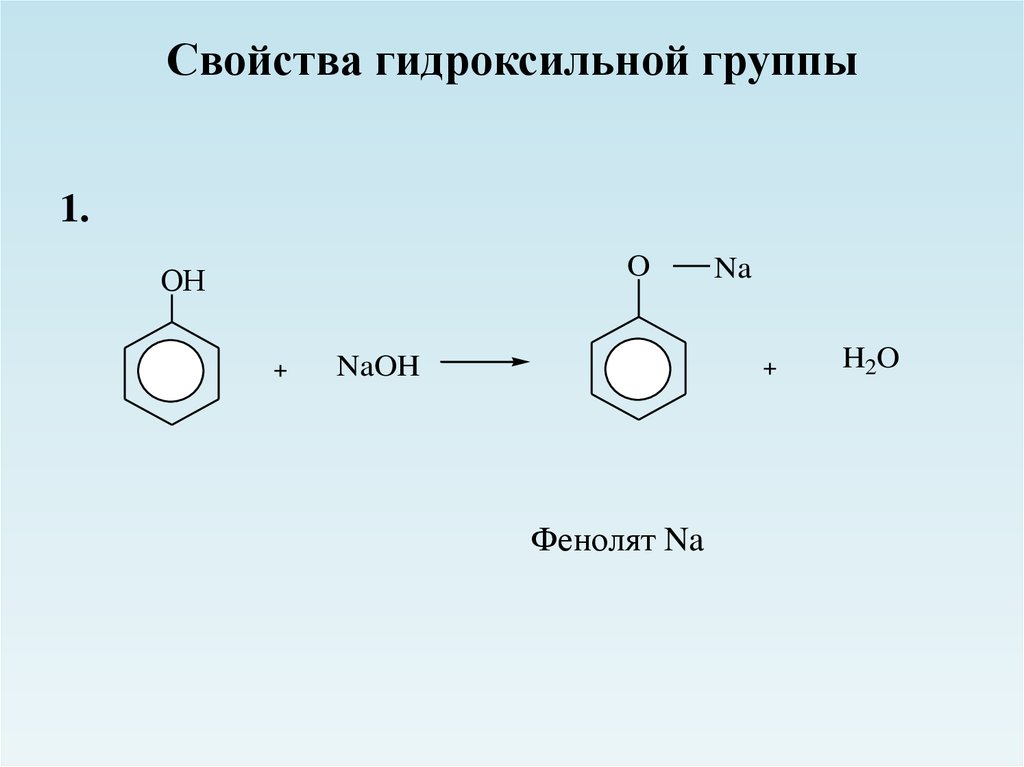
14. Свойства гидроксильной группы
1.O
ОН
Na
H2O
NaOH
Фенолят Na
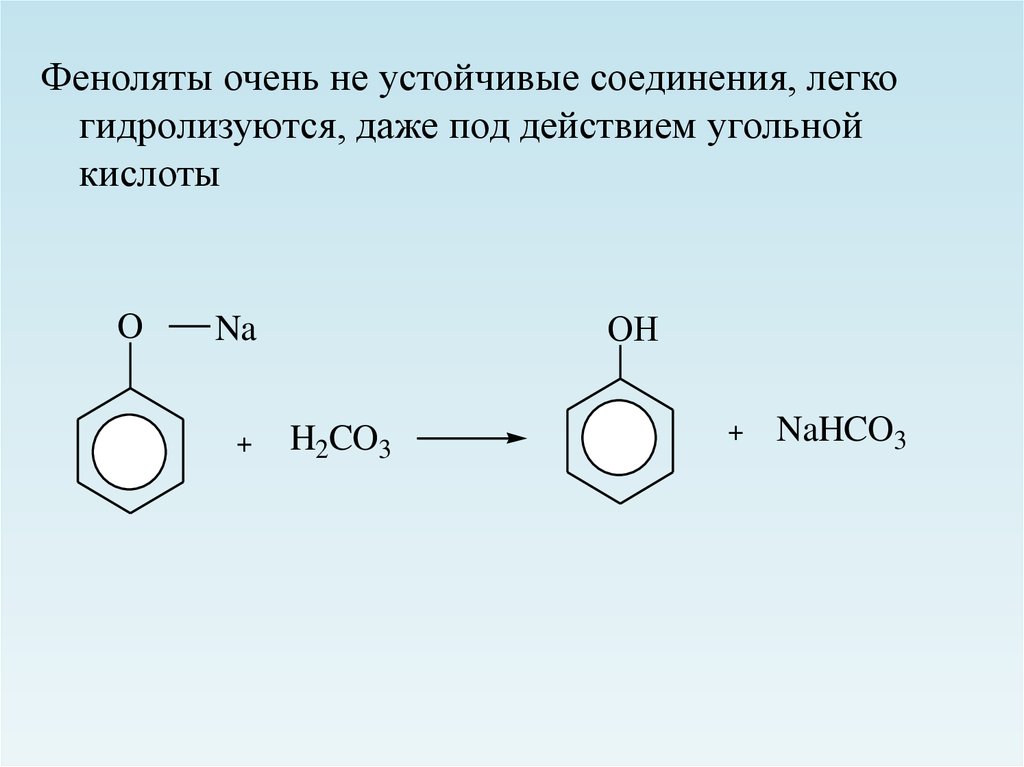
15.
Феноляты очень не устойчивые соединения, легкогидролизуются, даже под действием угольной
кислоты
O
ОН
Na
H2CO3
NaHCO3
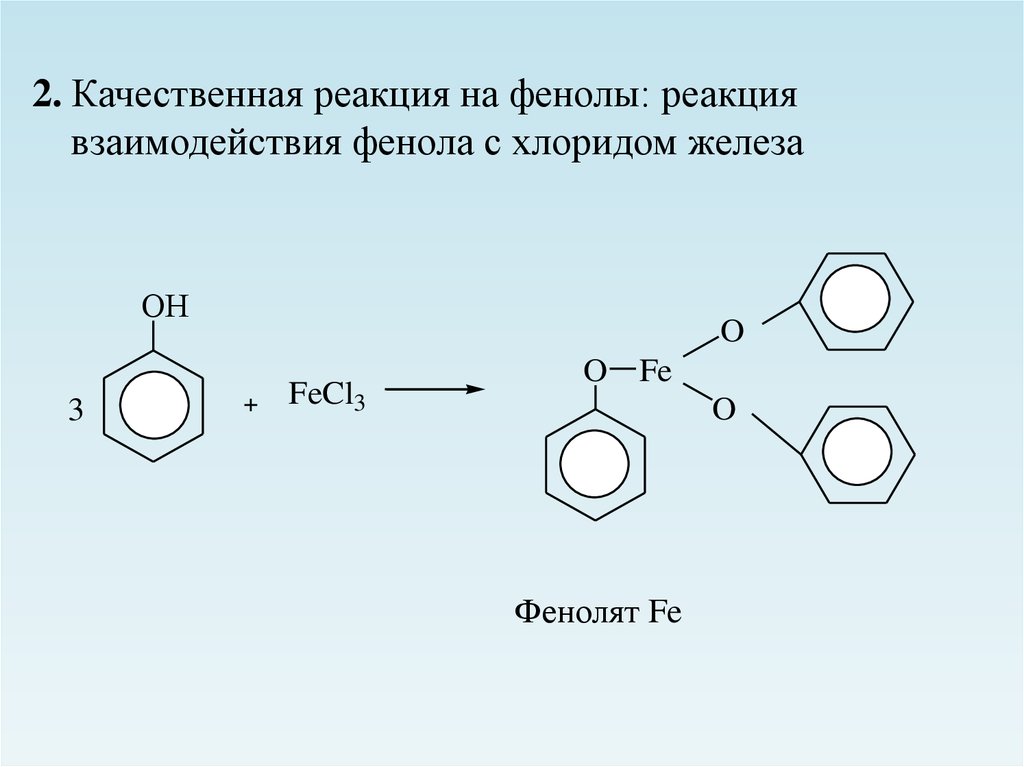
16.
2. Качественная реакция на фенолы: реакциявзаимодействия фенола с хлоридом железа
ОН
3
O
FeCl3
O Fe
O
Фенолят Fe
17.
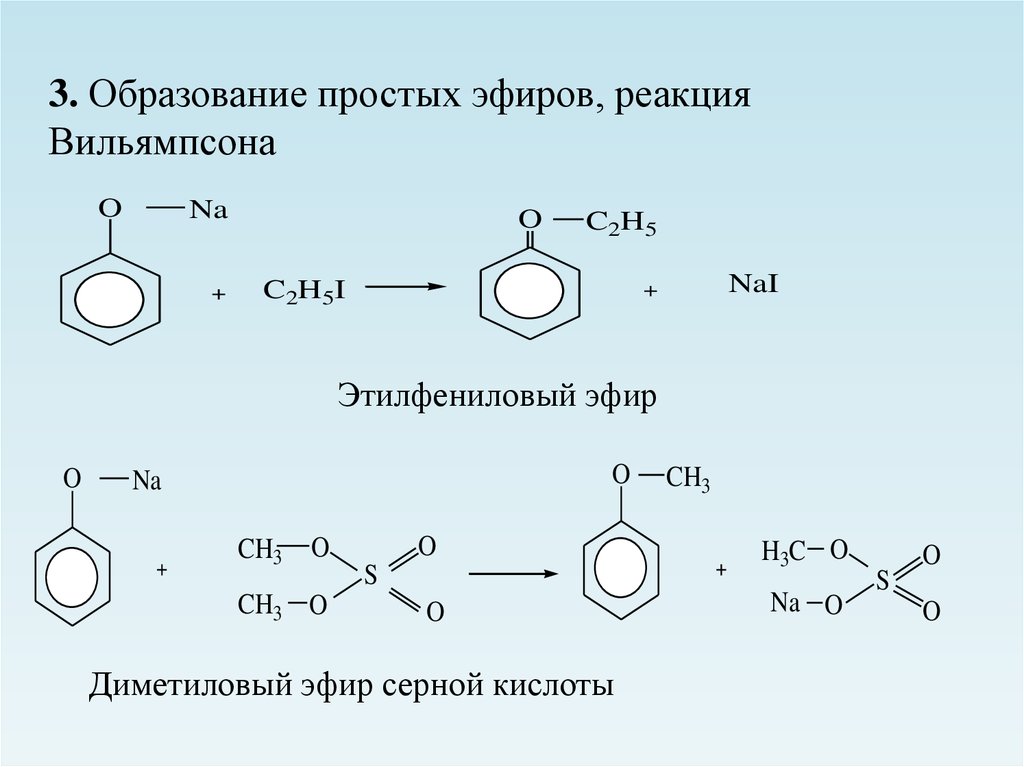
3. Образование простых эфиров, реакцияВильямпсона
O
Na
O
C2H5
NaI
C2H5I
Этилфениловый эфир
O
O
Na
CH3
O
O
CH3 O
S
O
Диметиловый эфир серной кислоты
CH3
H3C O
Na O
S
O
O
18.
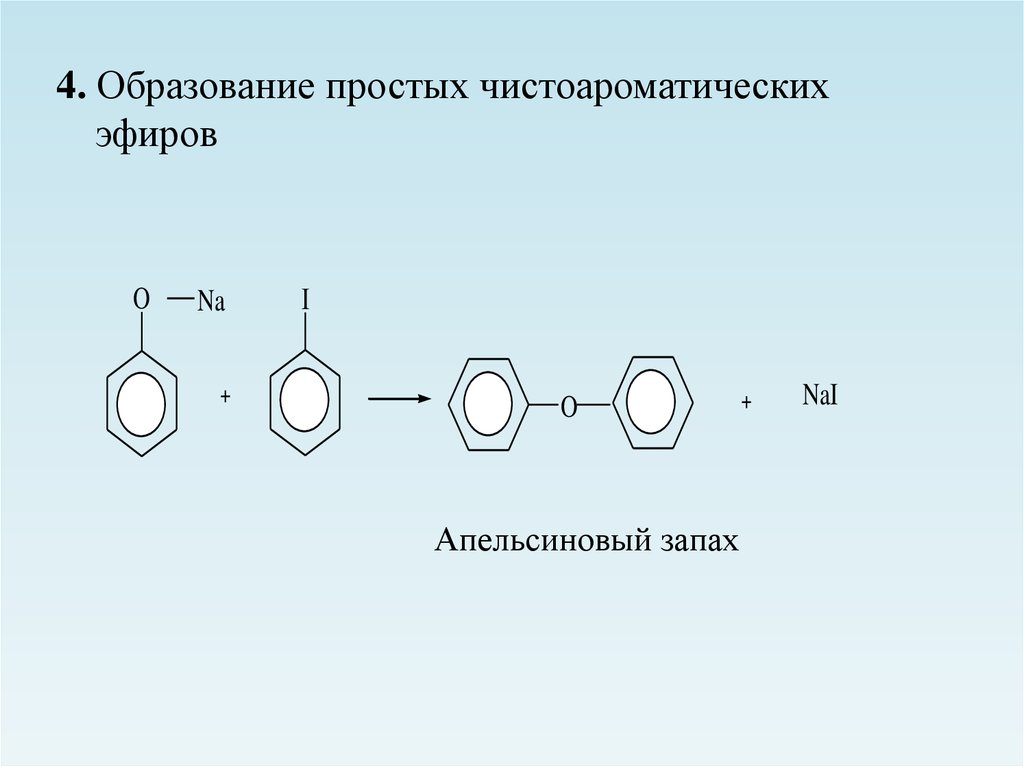
4. Образование простых чистоароматическихэфиров
O
Na
I
O
Апельсиновый запах
NaI
19.
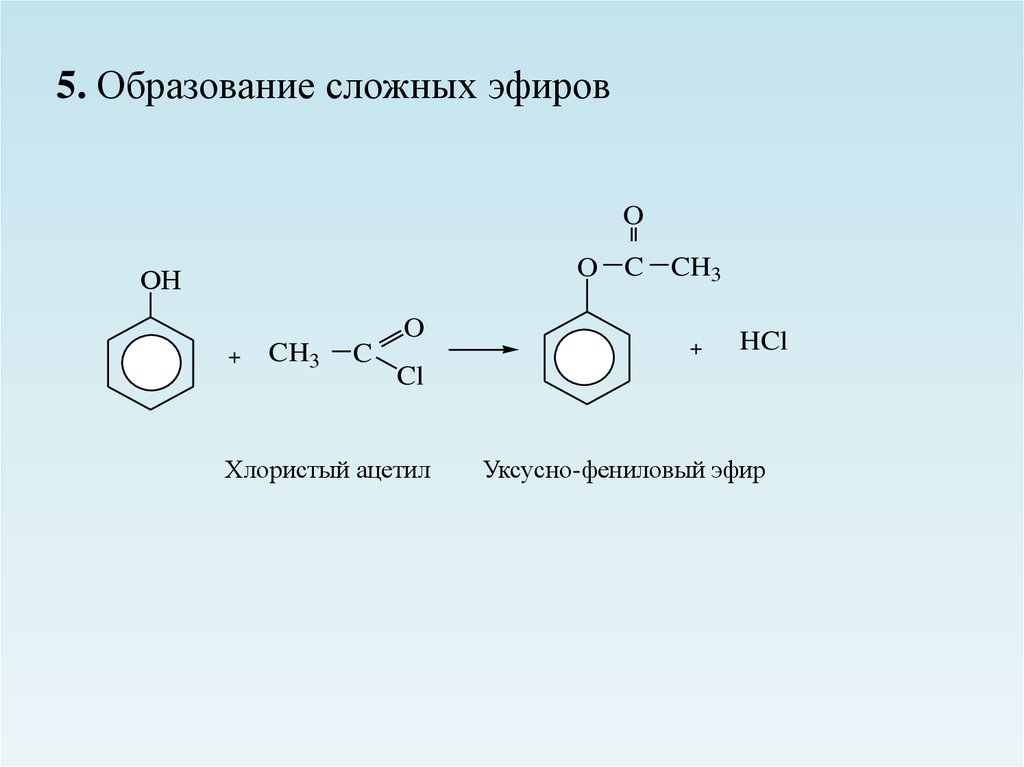
5. Образование сложных эфировO
O C
ОН
O
CH3
C
CH3
HCl
Cl
Хлористый ацетил
Уксусно-фениловый эфир
20.
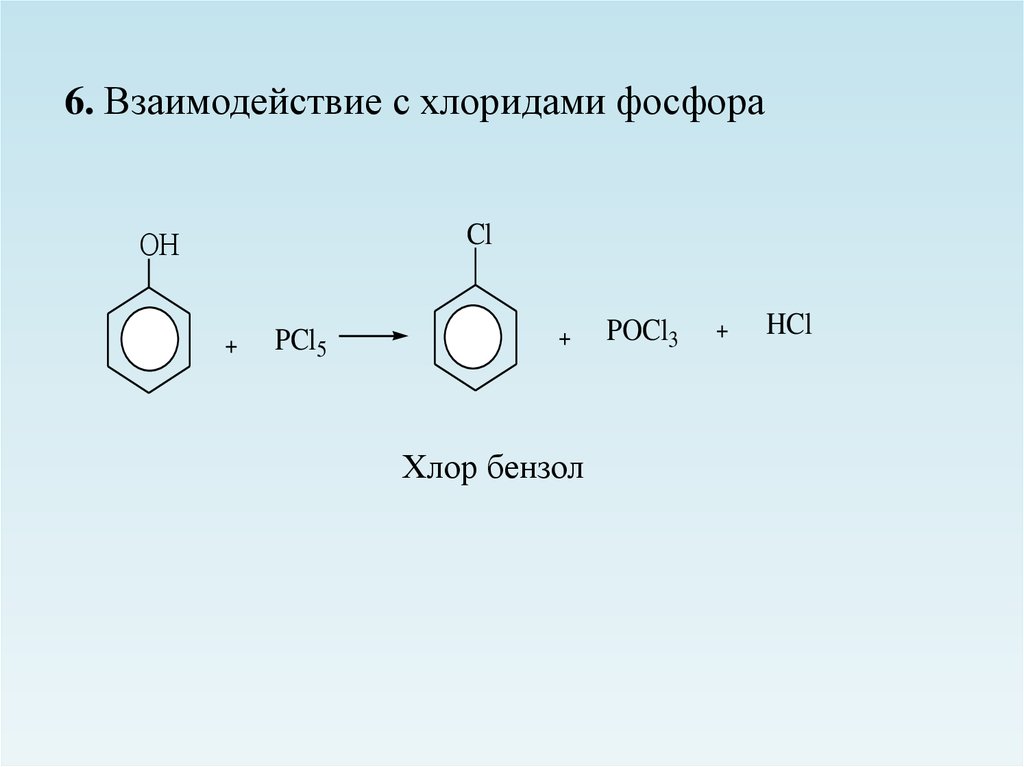
6. Взаимодействие с хлоридами фосфораCl
ОН
POCl3
PCl5
Хлор бензол
HCl
21.
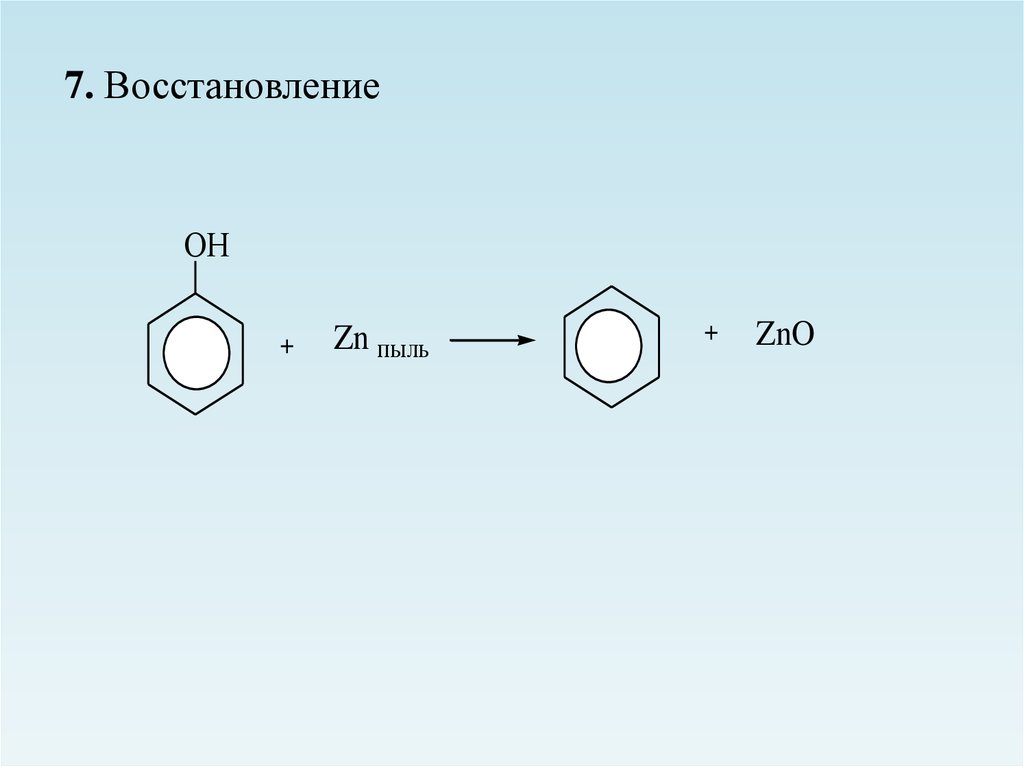
7. ВосстановлениеОН
Zn пыль
ZnO
22.
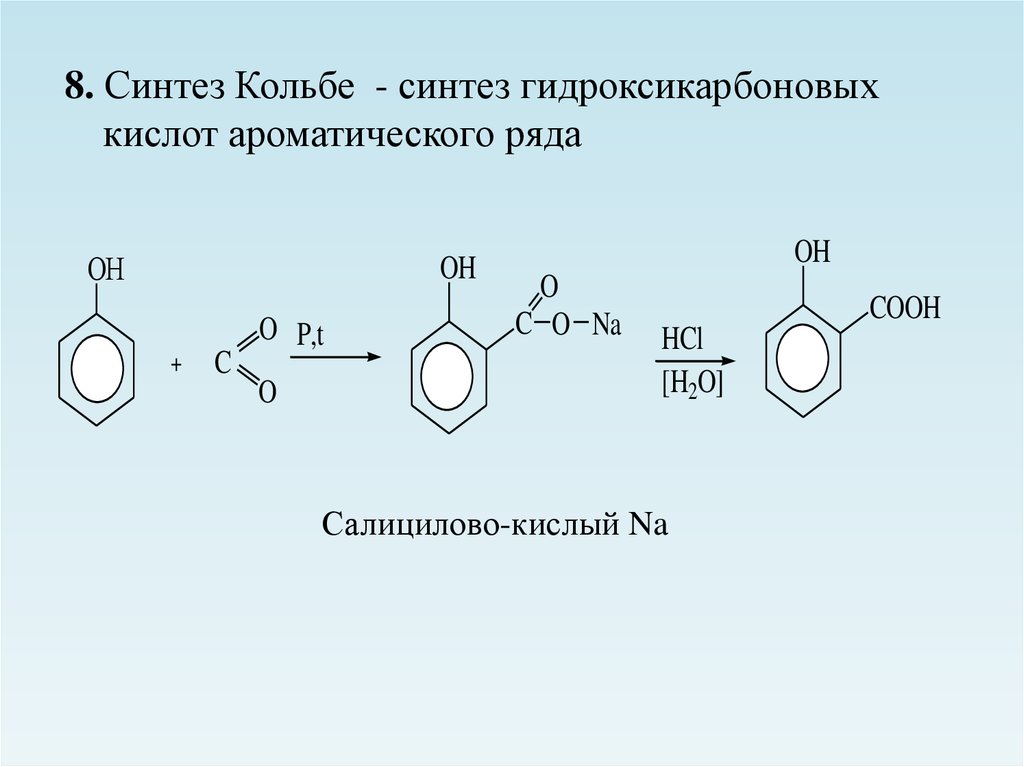
8. Синтез Кольбе - синтез гидроксикарбоновыхкислот ароматического ряда
ОН
OH
C
O P,t
O
OH
O
C O Na
COOH
HCl
[H2O]
Салицилово-кислый Na
23.
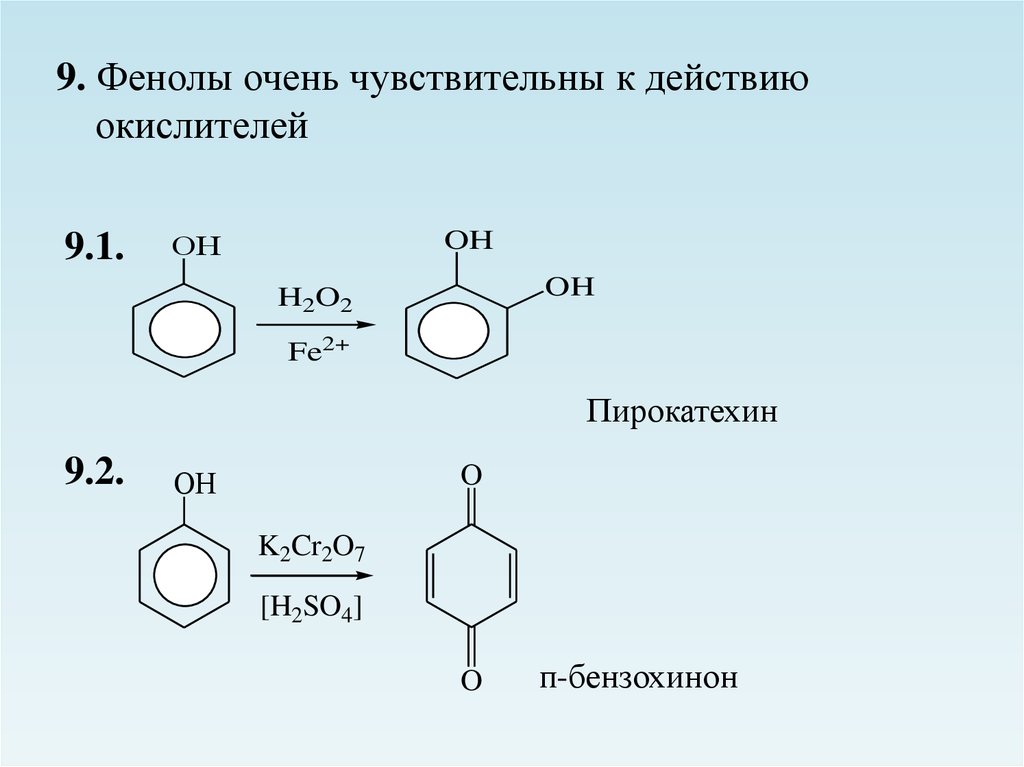
9. Фенолы очень чувствительны к действиюокислителей
9.1.
OH
ОН
OH
H2O2
Fe2+
Пирокатехин
9.2.
O
ОН
K2Cr2O7
[H2SO4]
O
п-бензохинон
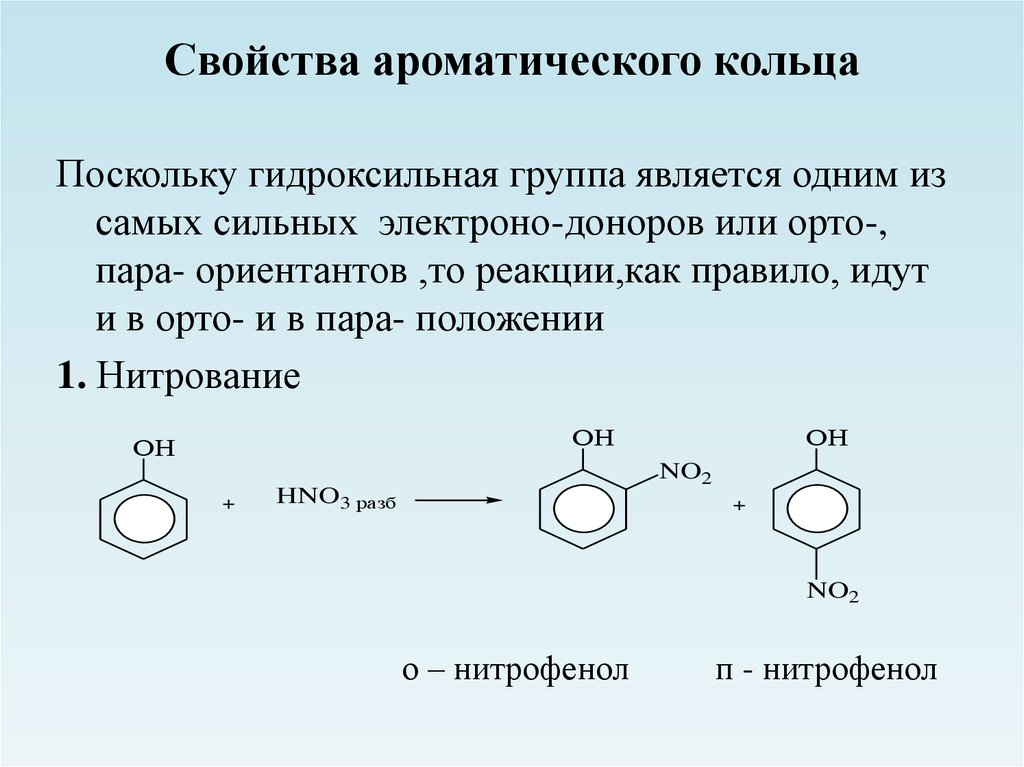
24. Свойства ароматического кольца
Поскольку гидроксильная группа является одним изсамых сильных электроно-доноров или орто-,
пара- ориентантов ,то реакции,как правило, идут
и в орто- и в пара- положении
1. Нитрование
ОН
ОН
ОН
NO2
HNO3 разб
NO2
о – нитрофенол
п - нитрофенол
25.
2. СульфированиеОН
ОН
SO3H
250C
H2SO4 конц
ОН
ОН
1700C
H2SO4 конц
SO3H
26.
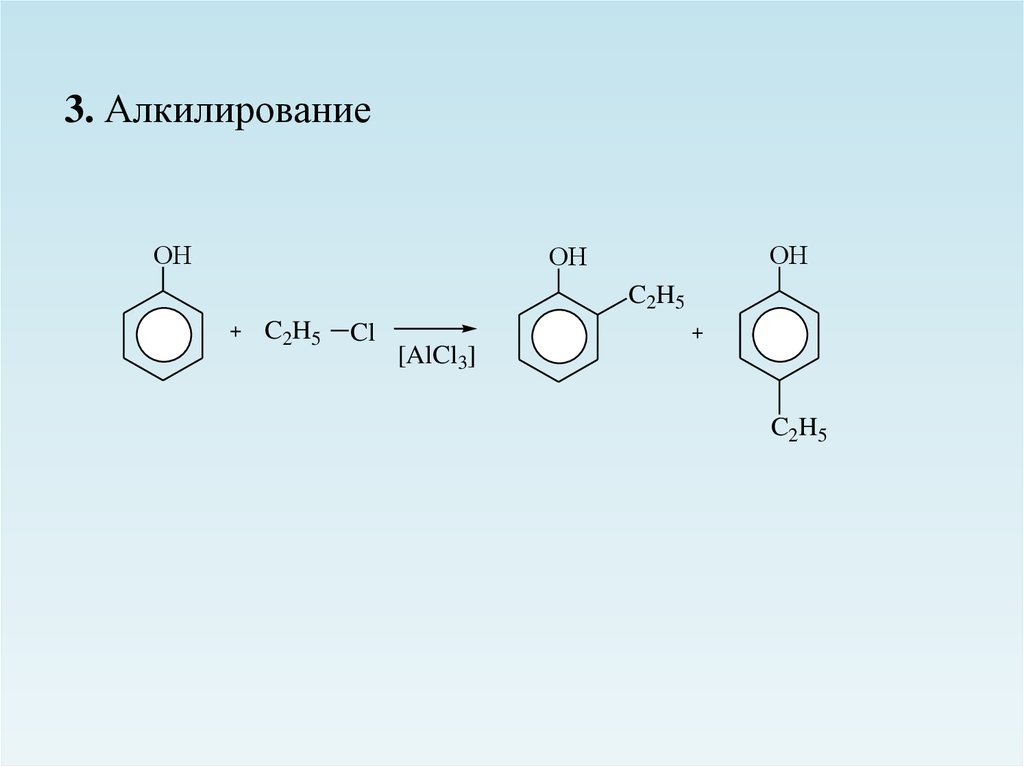
3. АлкилированиеОН
ОН
ОН
C2H5
C2H5
Cl
[AlCl3]
C2H5
27.
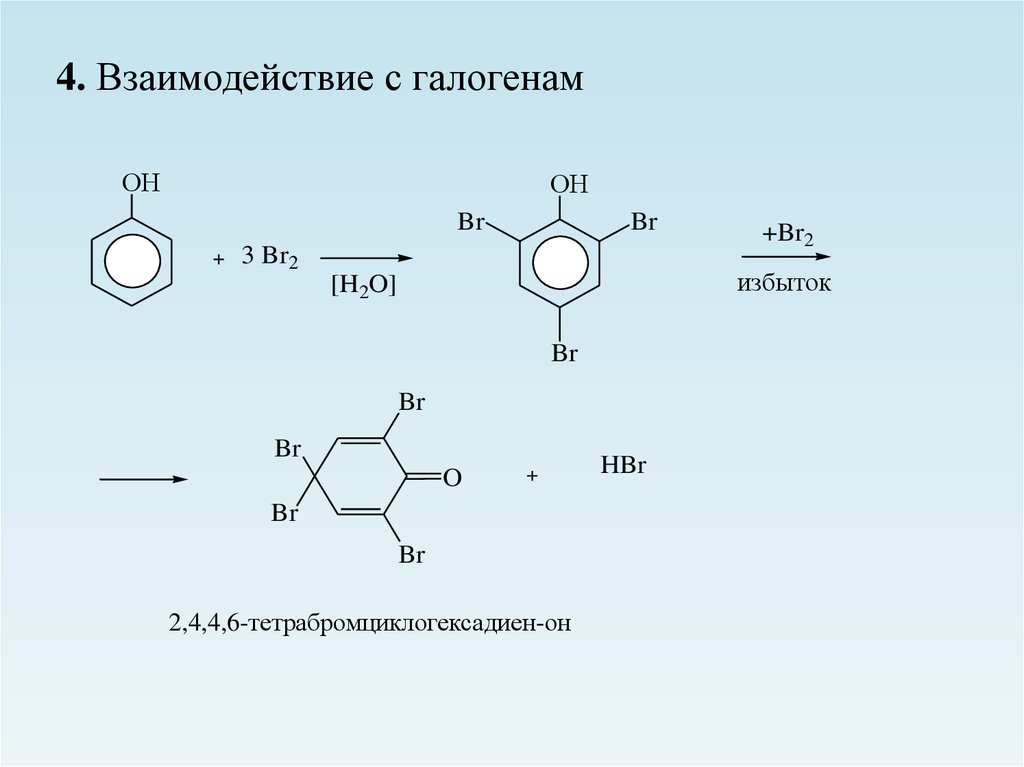
4. Взаимодействие с галогенамОН
ОН
Br
Br
3 Br2
+Br2
избыток
[H2O]
Br
Br
Br
O
Br
Br
2,4,4,6-тетрабромциклогексадиен-он
HBr
28.
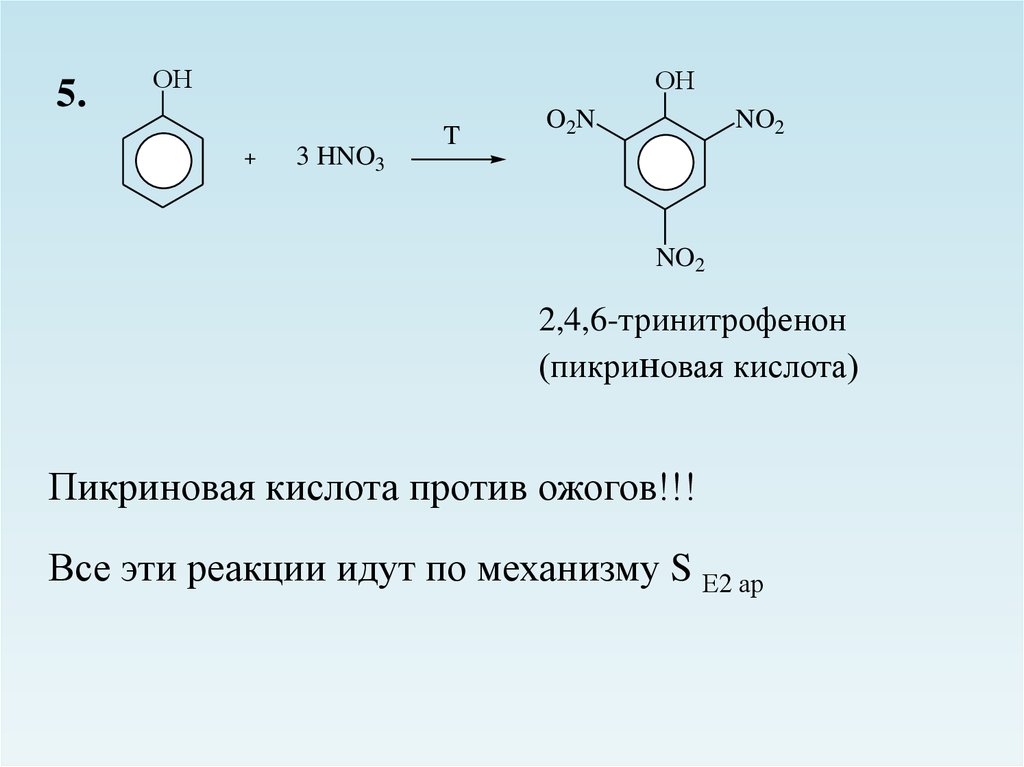
5.ОН
ОН
3 HNO3
T
O2N
NO2
NO2
2,4,6-тринитрофенон
(пикриновая кислота)
Пикриновая кислота против ожогов!!!
Все эти реакции идут по механизму S Е2 ар
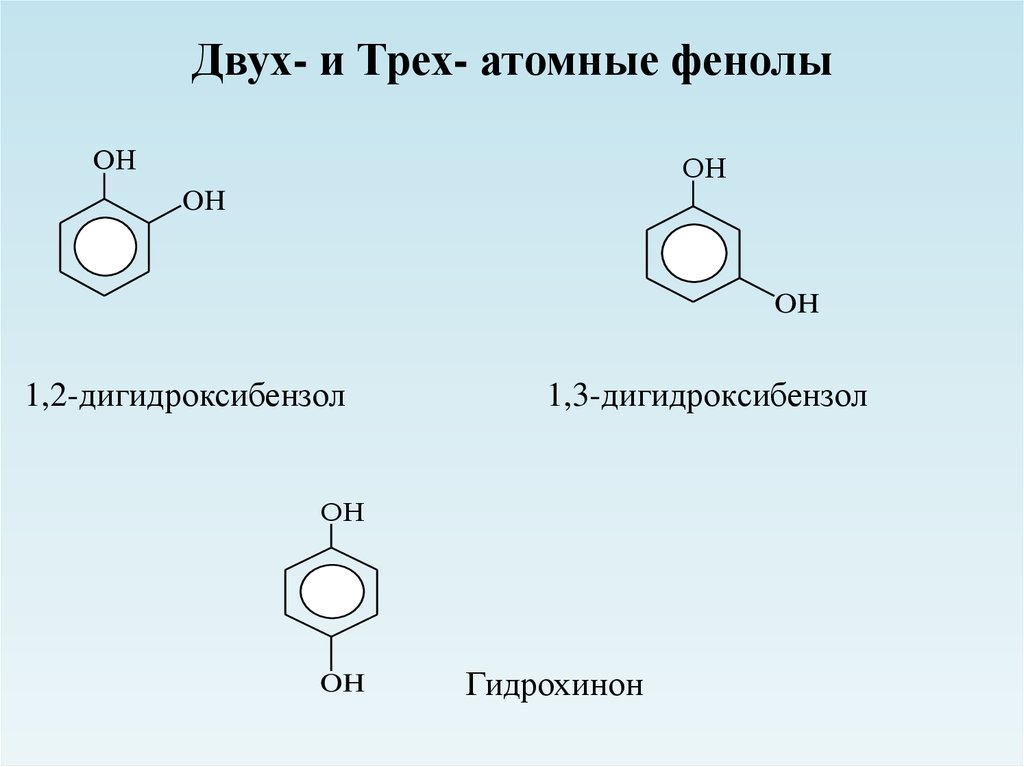
29. Двух- и Трех- атомные фенолы
ОНОН
OH
OH
1,2-дигидроксибензол
1,3-дигидроксибензол
ОН
OH
Гидрохинон
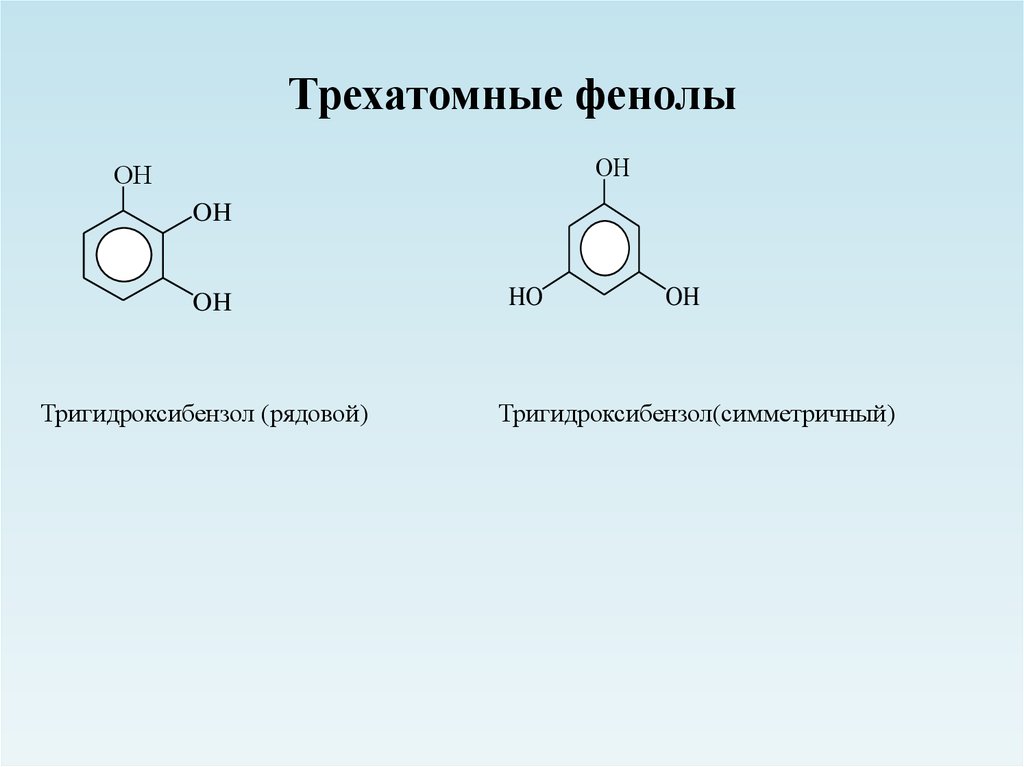
30. Трехатомные фенолы
ОНОН
OH
OH
Тригидроксибензол (рядовой)
HO
OH
Тригидроксибензол(симметричный)
31.
Двух- и трех- атомные фенолы – кристаллическиевещества, которые легко растворяются в воде.
Проявляют все свойства одноатомных фенолов.
Однако есть некоторые особенности в их свойствах:
1.Поскольку они содержат большее количество
гидроксильных групп, то они проявляют большие
кислотные свойства.
32.
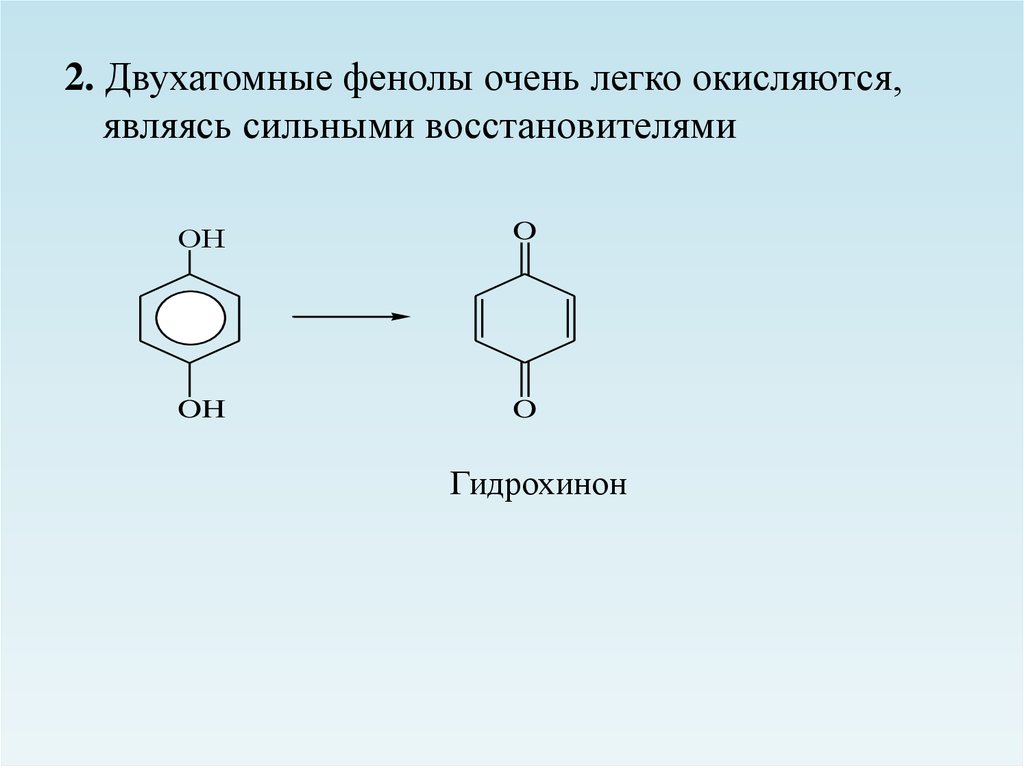
2. Двухатомные фенолы очень легко окисляются,являясь сильными восстановителями
ОН
O
OH
O
Гидрохинон
33.
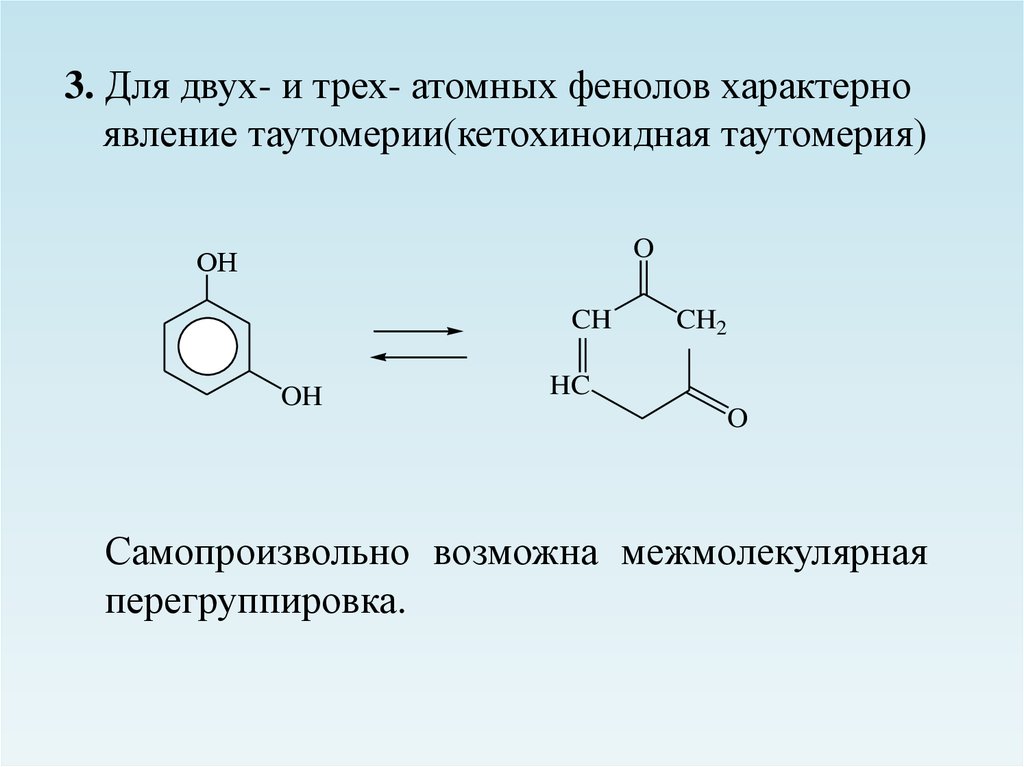
3. Для двух- и трех- атомных фенолов характерноявление таутомерии(кетохиноидная таутомерия)
O
ОН
CH
OH
CH2
HC
O
Самопроизвольно возможна межмолекулярная
перегруппировка.







 Химия
Химия