Похожие презентации:
Кислоты. Классификация кислот
1.
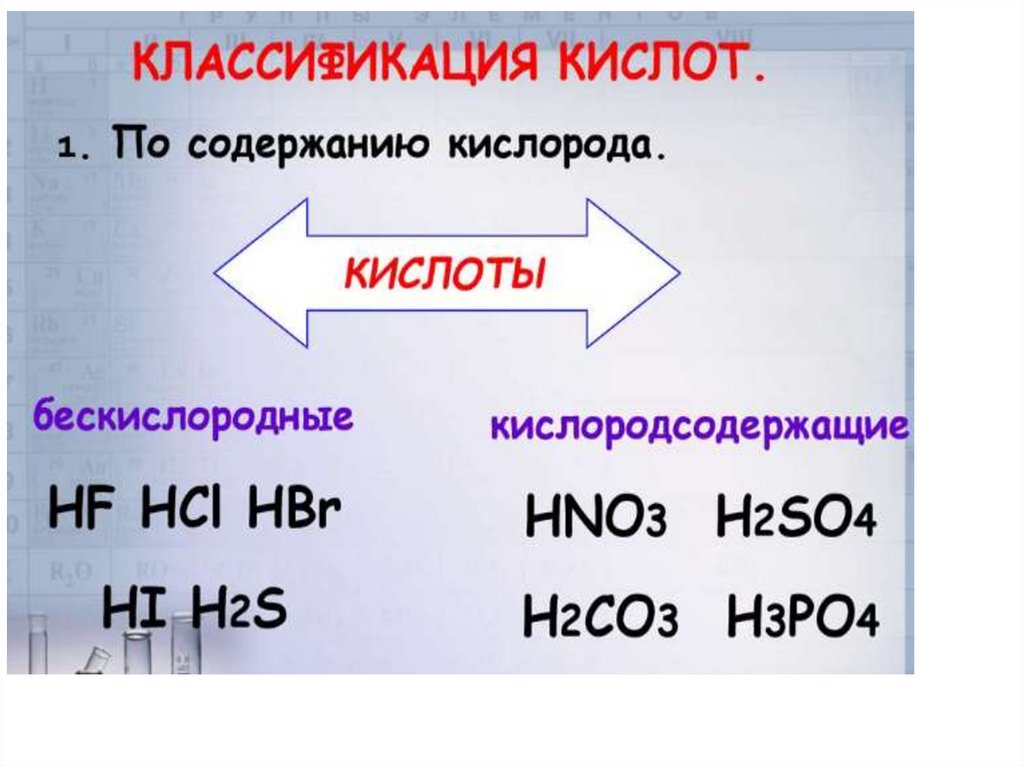
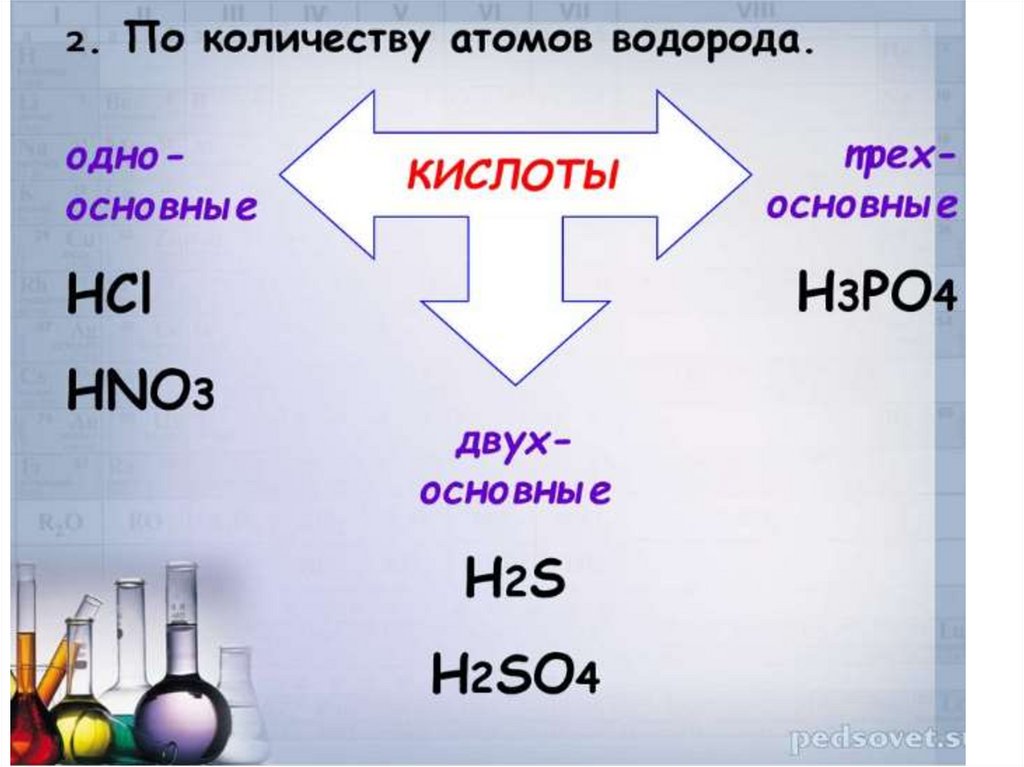
КИСЛОТЫ2.
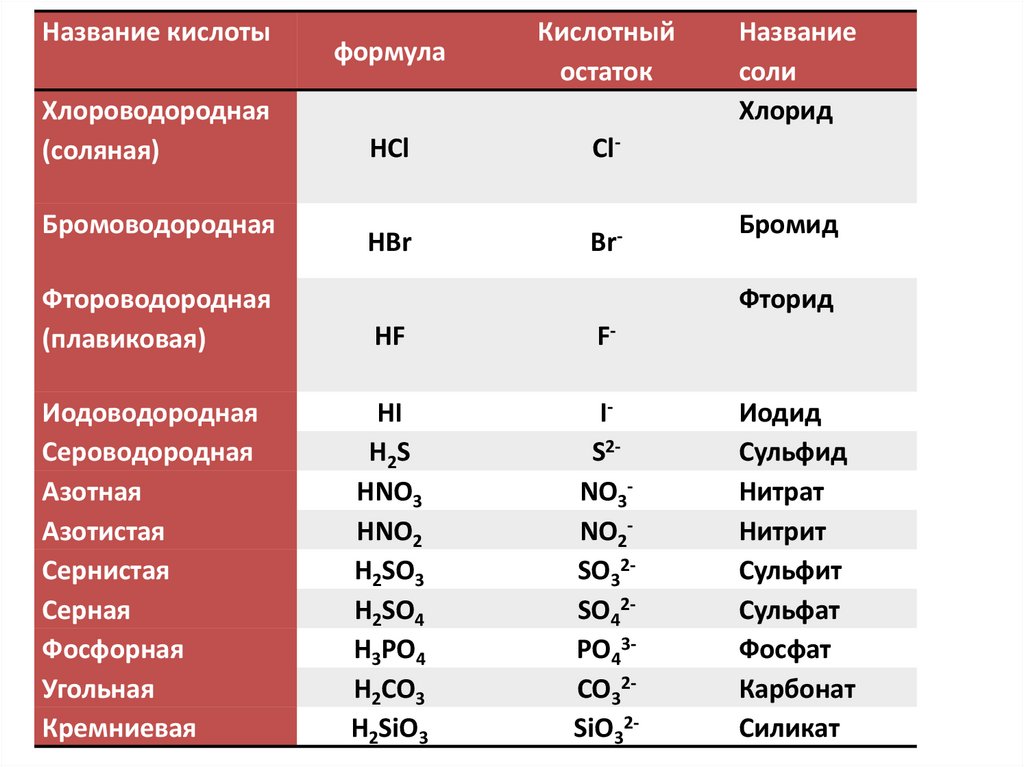
Название кислотыХлороводородная
(соляная)
Бромоводородная
формула
Кислотный
остаток
HCl
Cl-
HBr
Br-
Фтороводородная
(плавиковая)
HF
F-
Иодоводородная
Сероводородная
Азотная
Азотистая
Сернистая
Серная
Фосфорная
Угольная
Кремниевая
HI
H2S
HNO3
HNO2
H2SO3
H2SO4
H3PO4
H2CO3
H2SiO3
IS2NO3NO2SO32SO42PO43CO32SiO32-
Название
соли
Хлорид
Бромид
Фторид
Иодид
Сульфид
Нитрат
Нитрит
Сульфит
Сульфат
Фосфат
Карбонат
Cиликат
3.
4.
5.
6.
7.
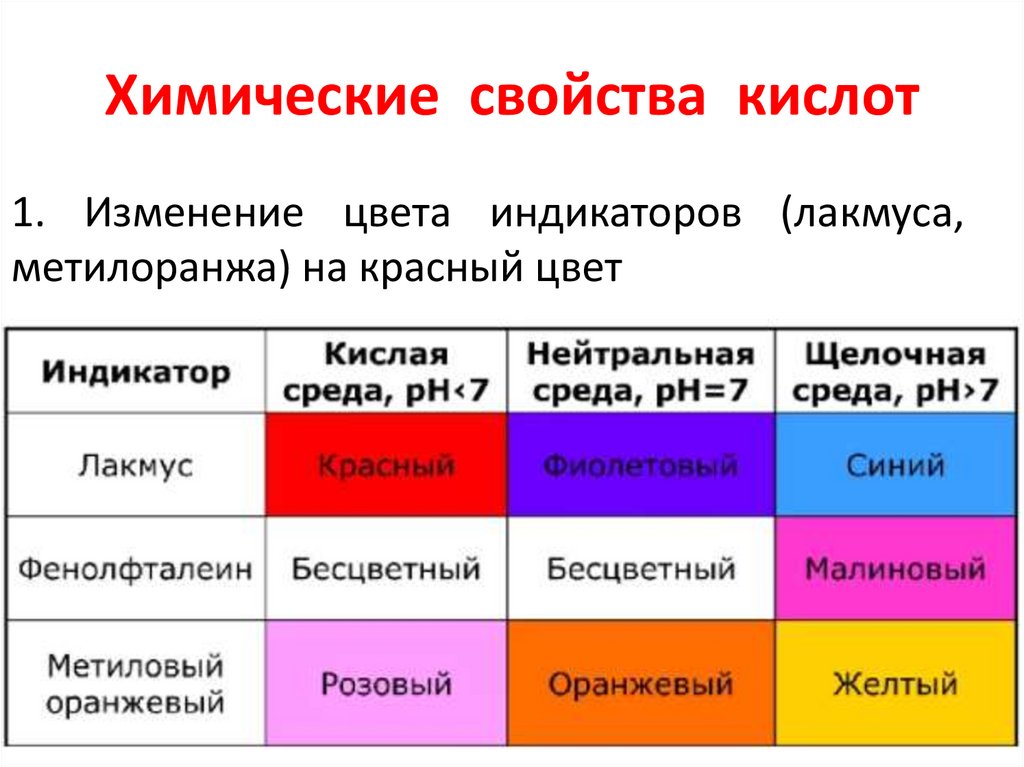
Химические свойства кислот1. Изменение цвета индикаторов (лакмуса,
метилоранжа) на красный цвет
8.
2. Кислота + металл (до Н) = соль + Н29.
3.Кислота + основный оксид = соль + Н2О(оксид металла со ст.ок.≤3)
• 2HCl + CuO = CuCl2 + H2O
• HCl + P2O5 /
• H2SO4 + CrO3 /
10.
4.Кислота + Основание = соль + Н2О• Реакция между кислотой и основанием с
получением соли и воды называется
реакцией НЕЙТРАЛИЗАЦИИ
• HNO3 + NaOH (ф-ф) = NaNO3 + H2O
• 3HCl + Al(OH)3↓ = AlCl3 + 3H2O
11.
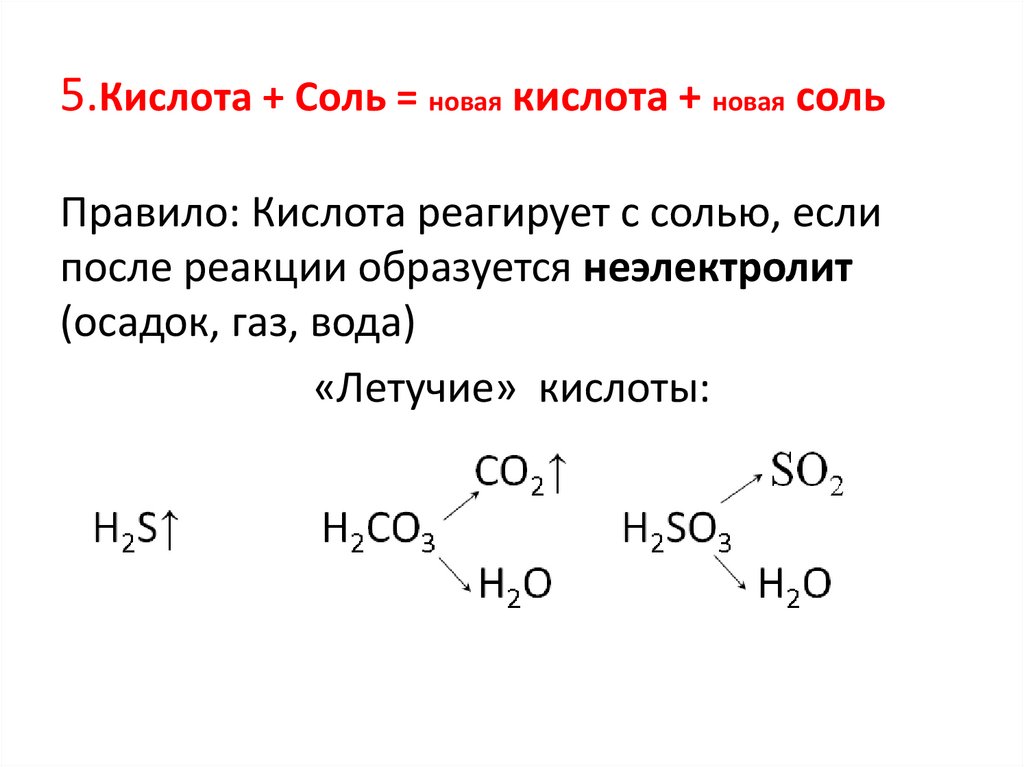
5.Кислота + Соль = новая кислота + новая сольПравило: Кислота реагирует с солью, если
после реакции образуется неэлектролит
(осадок, газ, вода)
«Летучие» кислоты:
12.
13.
Способы получения кислот1. Кислотный оксид (кроме SiO2) + Н2О = Кислота
SO2 + H2O = H2SO3
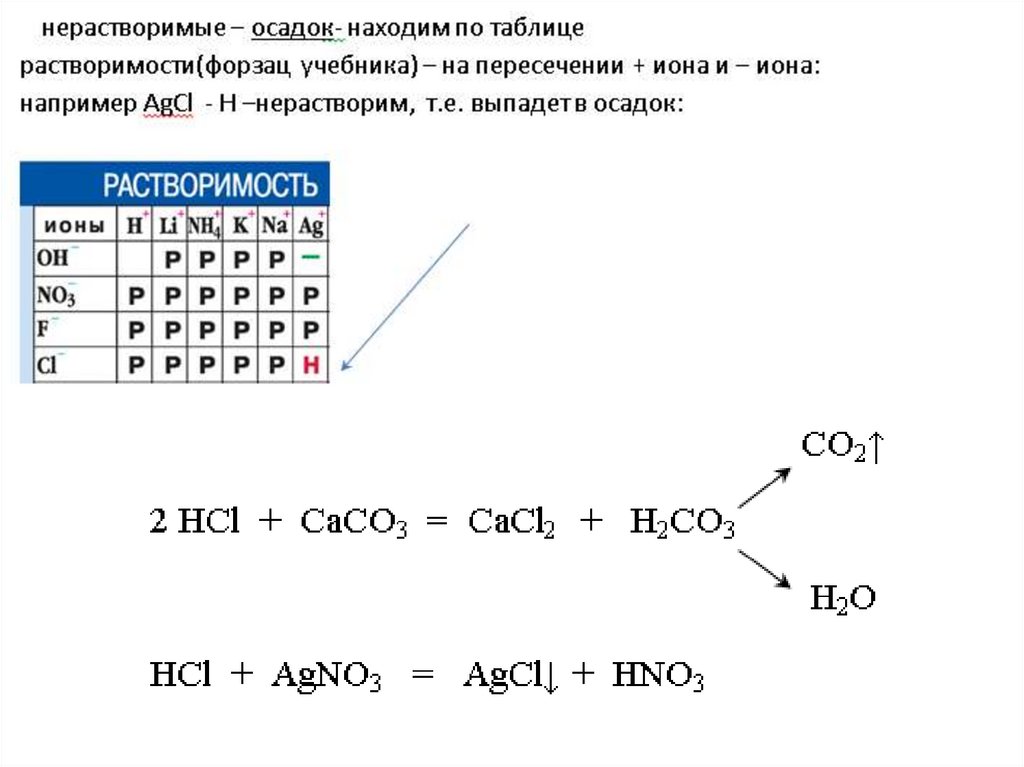
2. Кислота + Соль = новая соль + новая кислота
H2SO4 + BaCl2 = BaSO4↓ + 2 HCl
3. Водород + неметалл = кислота
H2 + S = H2S
14.
Завершите запись тех уравненийреакций, которые будут происходить
H2SO4 + NaOH →
HCl + Cu →
HNO3 + SiO2 →
H3PO4 + CaCl2 →
HBr + Al →
15.
• HI + MgO →• HNO3 + Fe2(SO4)3 →
• H2S + Pb(NO3)2 →
• H2SiO3 + KCl →
• H2SO4 + Fe(OH)3 →
16.
Осуществить превращения• P → P2O5 → H3PO4 → Na3PO4 → Ba3(PO4)2
• H2SO4 → HCl → HNO3 → AgNO3 → Ag2S
• Na → NaOH → Na3PO4 →NaCl → NaNO3










 Химия
Химия








