Похожие презентации:
Типы химических реакций
1.
Урок рефлексии в 8 классеучитель МБОУ «СОШ с. Б. Чечуйка»
Клевцова Г.В.
Достичь вершины- не свалиться в пропасть
2.
1. «Угадай слово»2. «Письмо»
3. «Найди свою пару»
4. «Химический
снегопад»
5. «Путь домой»
3.
Запишите формулы веществ всоответствующие столбцы таблицы:
• H2, Na2S, Al, CuCl2, Mg, KI, S, Ca(OH) 2, O3, FeBr3
Простые
вещества
Сложные
вещества
…………………..
…………………..
…………………..
…………………..
…………………..
…………………..
…………………..
…………………..
…………………..
…………………..
4.
«Соответствие движению»• «Кислота»-поднимаете правую руку
• «Оксид»- поднимаете левую руку
• «Основание»- тихонько топаете
• «Соль»- приседаете
5.
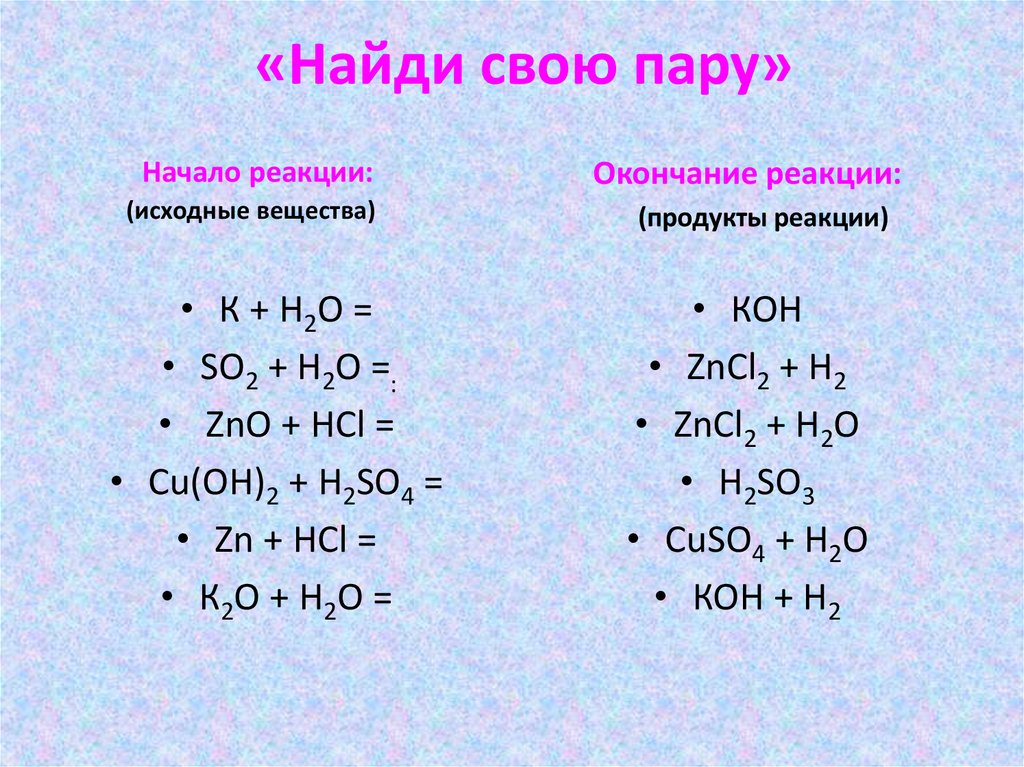
«Найди свою пару»Начало реакции:
(исходные вещества)
• К + Н2О =
• SО2 + Н2О =:
• ZnО + НСl =
• Сu(ОН)2 + Н2SО4 =
• Zn + НСl =
• К2О + Н2О =
Окончание реакции:
(продукты реакции)
• КОН
• ZnСl2 + Н2
• ZnСl2 + Н2О
• Н2SО3
• CuSО4 + Н2О
• КОН + Н2
6.
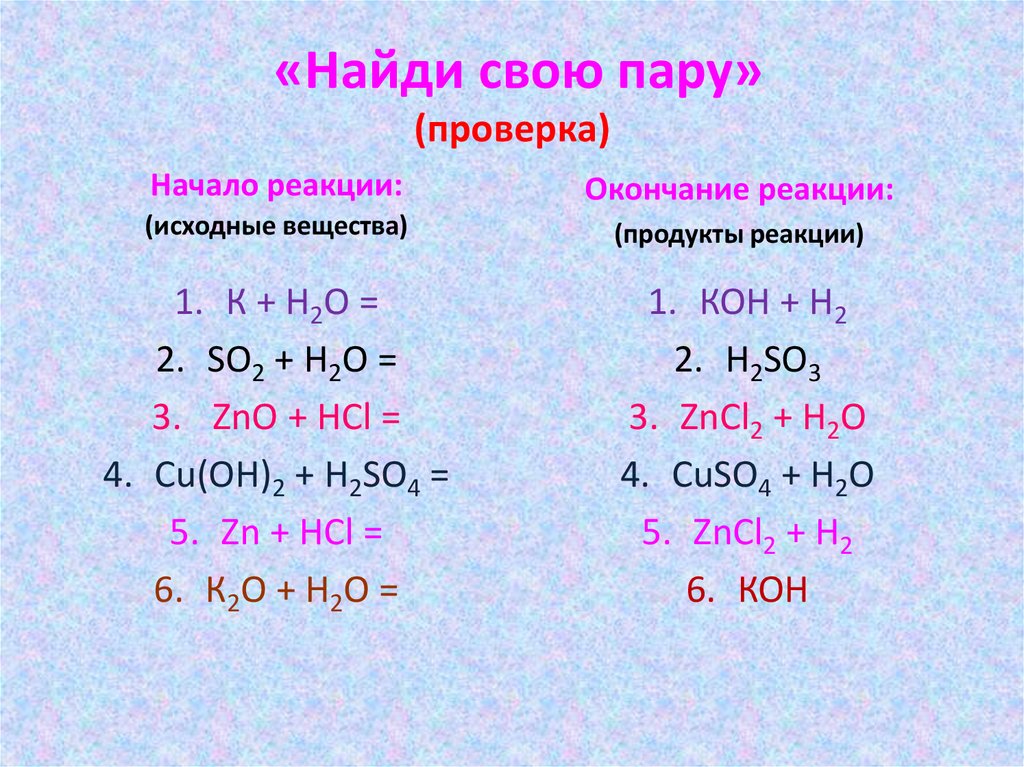
«Найди свою пару»(проверка)
Начало реакции:
Окончание реакции:
(исходные вещества)
(продукты реакции)
1. К + Н2О =
2. SО2 + Н2О =
3. ZnО + НСl =
4. Сu(ОН)2 + Н2SО4 =
5. Zn + НСl =
6. К2О + Н2О =
1. КОН + Н2
2. Н2SО3
3. ZnСl2 + Н2О
4. CuSО4 + Н2О
5. ZnСl2 + Н2
6. КОН
7.
Ключ к тесту«Атом»
1г
2б
3а
4.
а)4Li + O₂= 2Li₂O
б) Fe₂O₃ + 2Al = Al₂O₃ + 2Fe
в) 2Al +3Cl₂ = 2AlCl₃
«Молекула»
1в
2а
3б
4.
а) CuO + 2HCl = CuCl₂+ H₂O
б) 2NH₃= N₂ + 3H₂
в) Fe₂O₃+ 3H₂ = 2Fe + 3H₂O




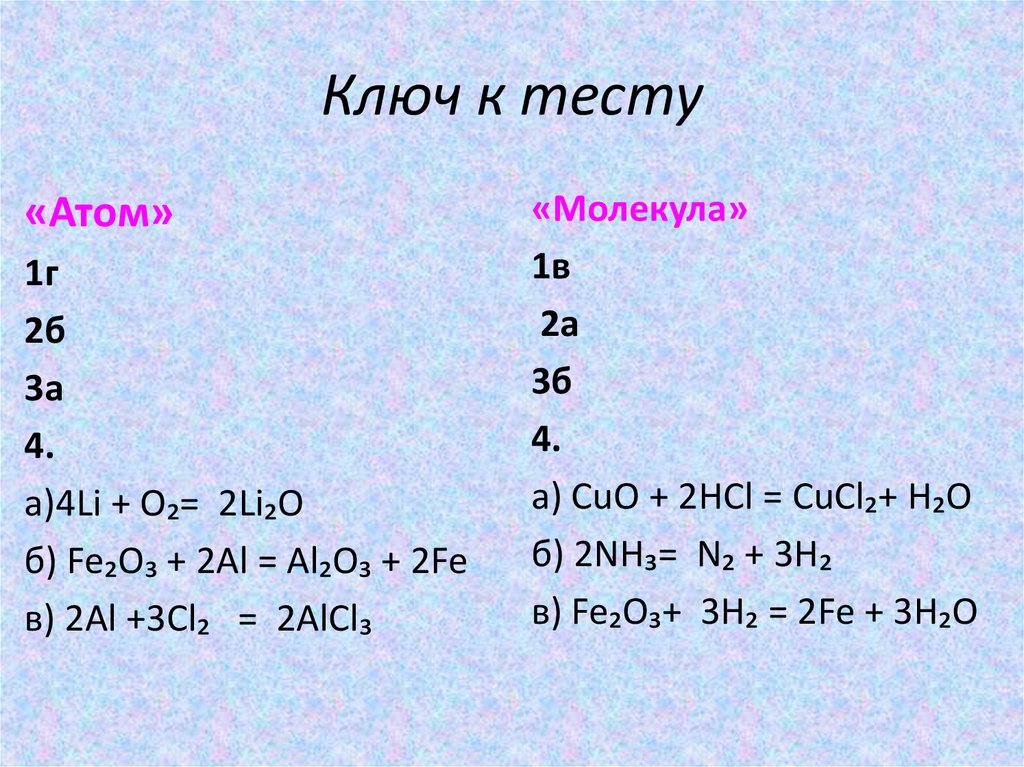
 Химия
Химия








