Похожие презентации:
Непредельные углеводороды. Алкены
1.
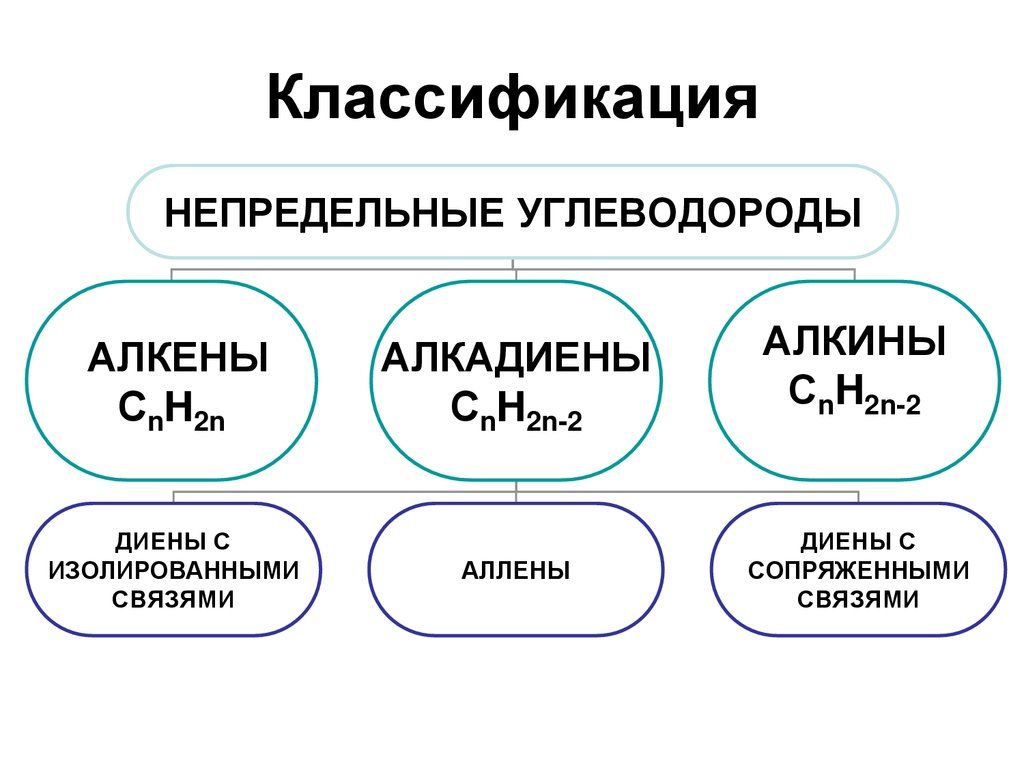
КлассификацияНЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ
АЛКЕНЫ
СnH2n
ДИЕНЫ С
ИЗОЛИРОВАННЫМИ
СВЯЗЯМИ
АЛКАДИЕНЫ
СnH2n-2
АЛЛЕНЫ
АЛКИНЫ
СnH2n-2
ДИЕНЫ С
СОПРЯЖЕННЫМИ
СВЯЗЯМИ
2.
АлкеныАлкены (олефины, непредельные или
ненасыщенные УВ) – углеводороды, которые
содержат в молекуле двойную C=C связь.
Общая формула СnН2n.
В природе распространены редко ввиду высокой
реакционной способности: низшие – входят в
состав нефтяного газа; высшие – в состав нефти.
Алкены входят в состав феромонов,
которые в малых количествах влияют на
поведение насекомых. Алкены с сопряженными
двойными связями содержатся в эфирных
маслах терпеновых УВ, в виде красящих веществ
– в помидорах, моркови, подсолнухе.
3.
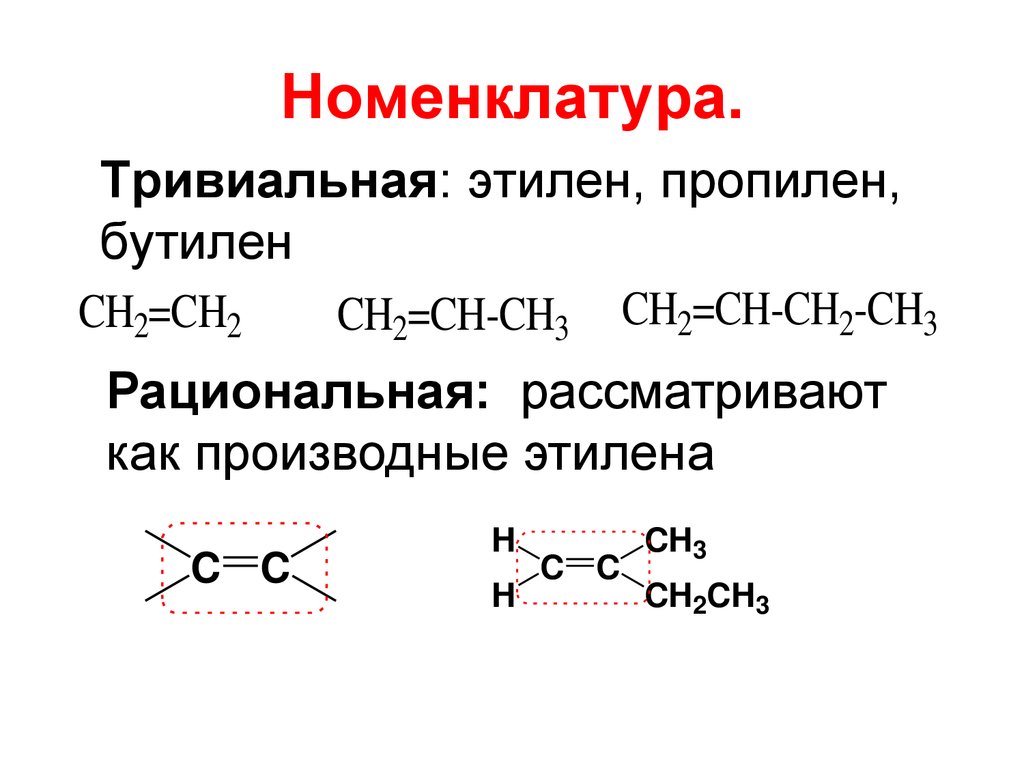
Номенклатура.Тривиальная: этилен, пропилен,
бутилен
CH2=CH2
CH2=CH-CH3
CH2=CH-CH2-CH3
Рациональная: рассматривают
как производные этилена
C C
H
H
C C
CH3
CH2CH3
4.
Систематическаяноменклатура ИЮПАК
• выбирают главную цепь, включающую
двойную связь (даже если цепь не самая
длинная);
• нумеруют так, чтобы атом углерода при
кратной связи получил наименьший
номер;
• указывают цифрой положение кратной
связи и в названии основы суффикс -ан
H3C CH
меняют на -ен.
3
H
H
C
C
C
CH3
CH2CH3
5.
Углеводородные радикалы, которыеобразуются от алкенов,
называются: алкенилы
H2C
CH
винил
CH3
CH CH
H2C
CH CH2
пропенил
аллил
6.
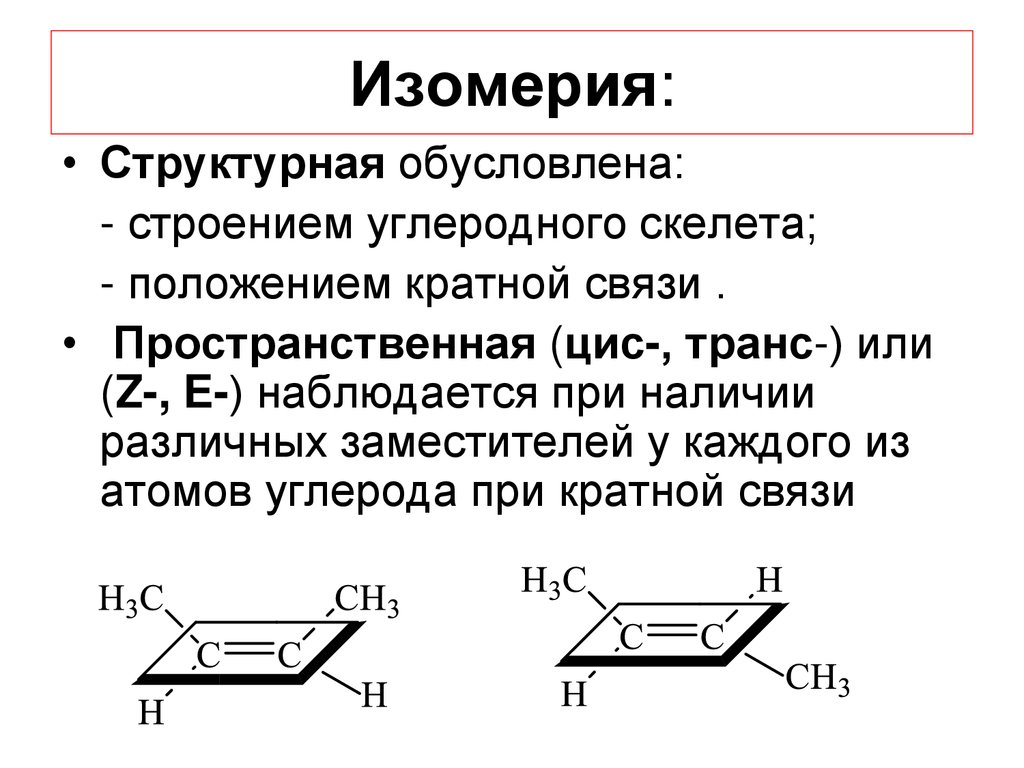
Изомерия:• Структурная обусловлена:
- строением углеродного скелета;
- положением кратной связи .
• Пространственная (цис-, транс-) или
(Z-, E-) наблюдается при наличии
различных заместителей у каждого из
атомов углерода при кратной связи
7.
Способы полученияОбщая схема получения алкенов
R CH2 CH2 R
-H2
+H2
R C
C
R
R CH CH R
R CH CH2 R
X
-HX
-OYZ R C
O Y
H Z
CH R
8.
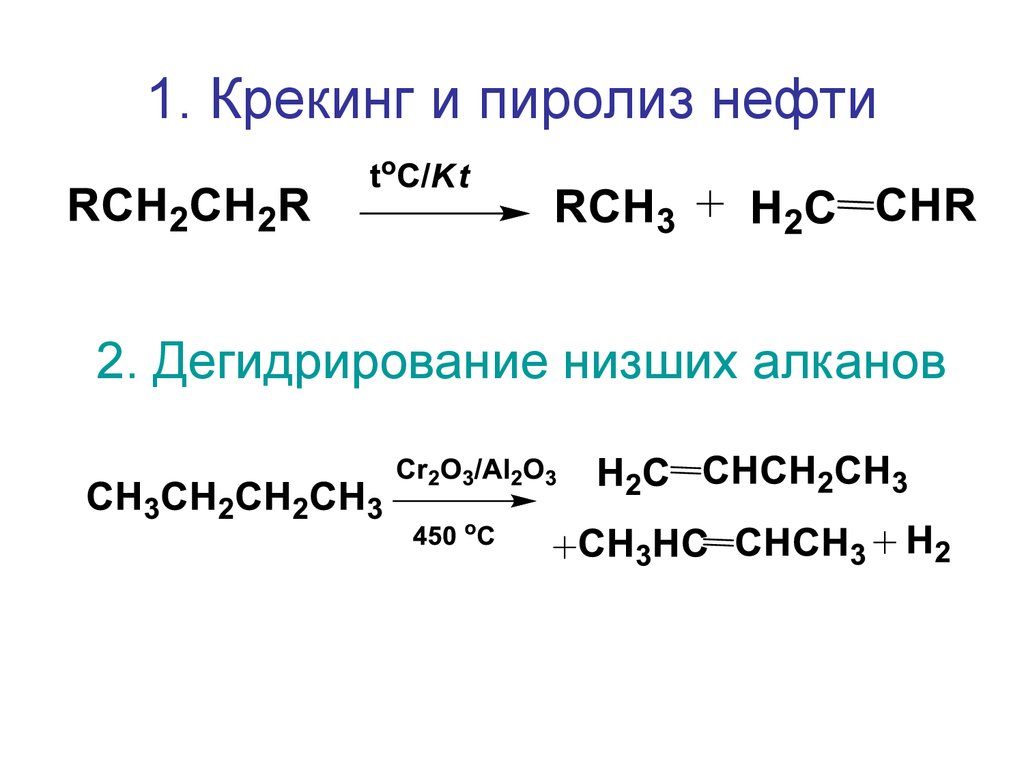
1. Крекинг и пиролиз нефти2. Дегидрирование низших алканов
9.
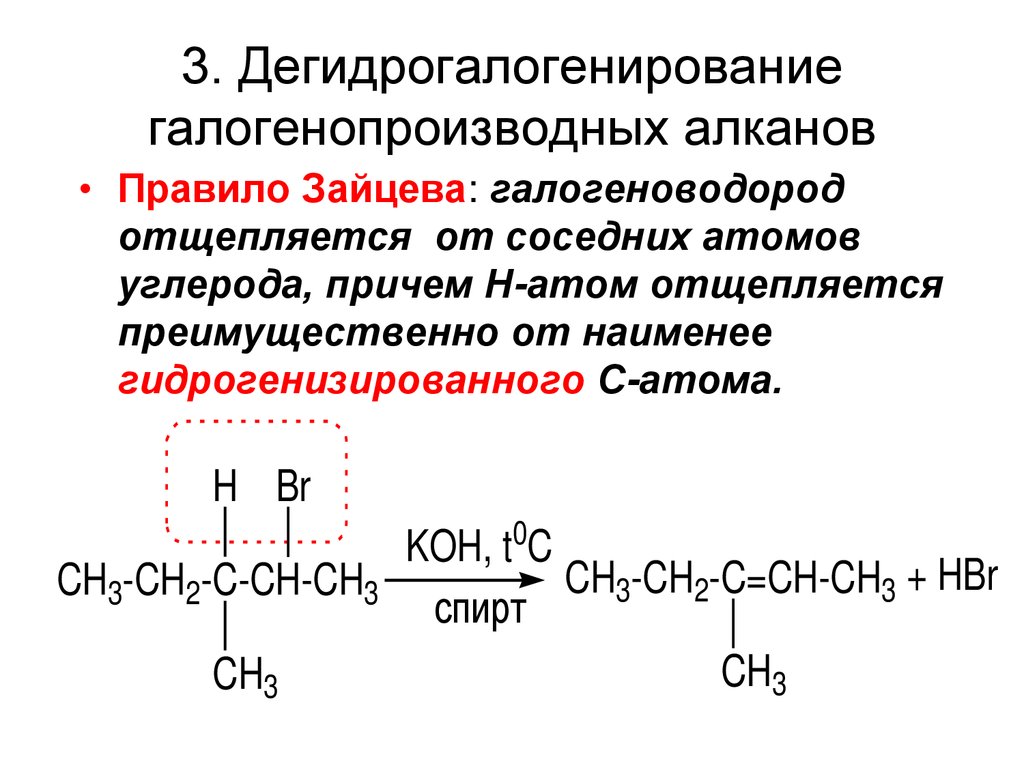
3. Дегидрогалогенированиегалогенопроизводных алканов
• Правило Зайцева: галогеноводород
отщепляется от соседних атомов
углерода, причем Н-атом отщепляется
преимущественно от наименее
гидрогенизированного С-атома.
H Br
KOH, t0C
CH3-CH2-C=CH-CH3 + HBr
CH3-CH2-C-CH-CH3
спирт
CH3
CH3
10.
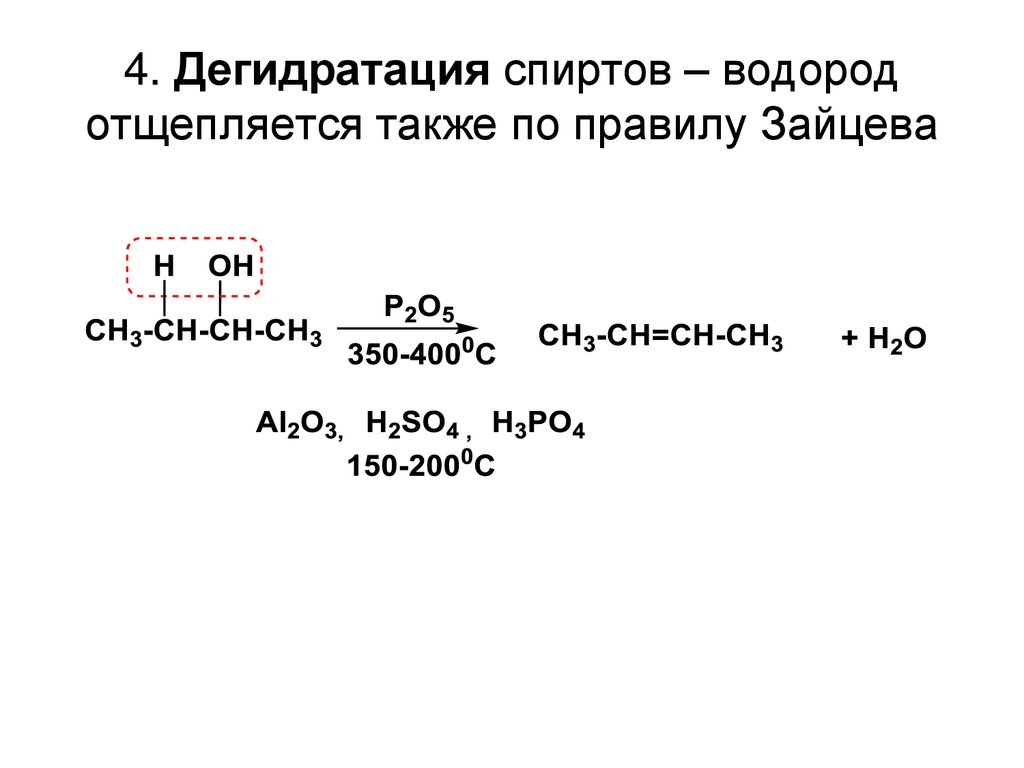
4. Дегидратация спиртов – водородотщепляется также по правилу Зайцева
11.
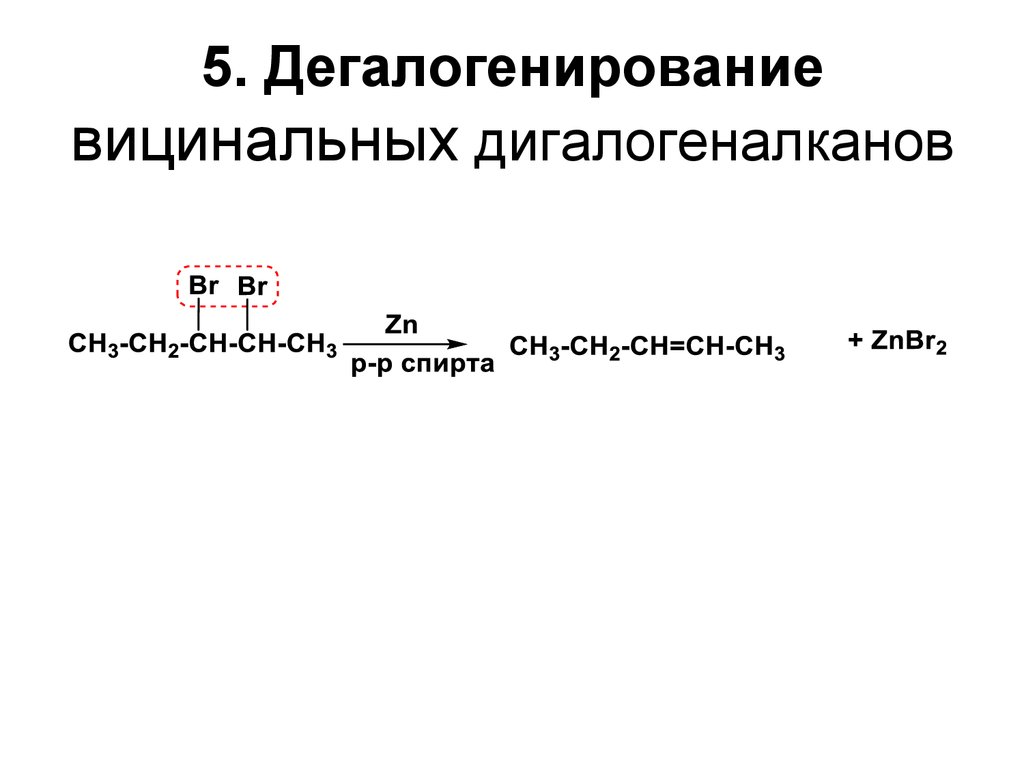
5. Дегалогенированиевицинальных дигалогеналканов
12.
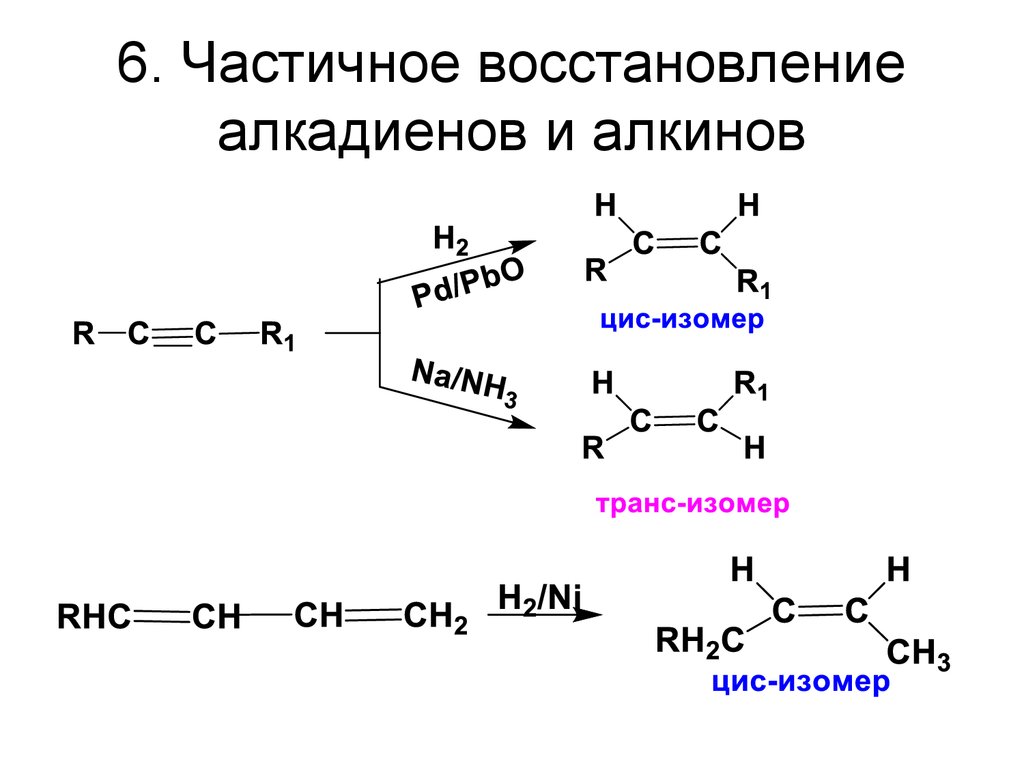
6. Частичное восстановлениеалкадиенов и алкинов
13.
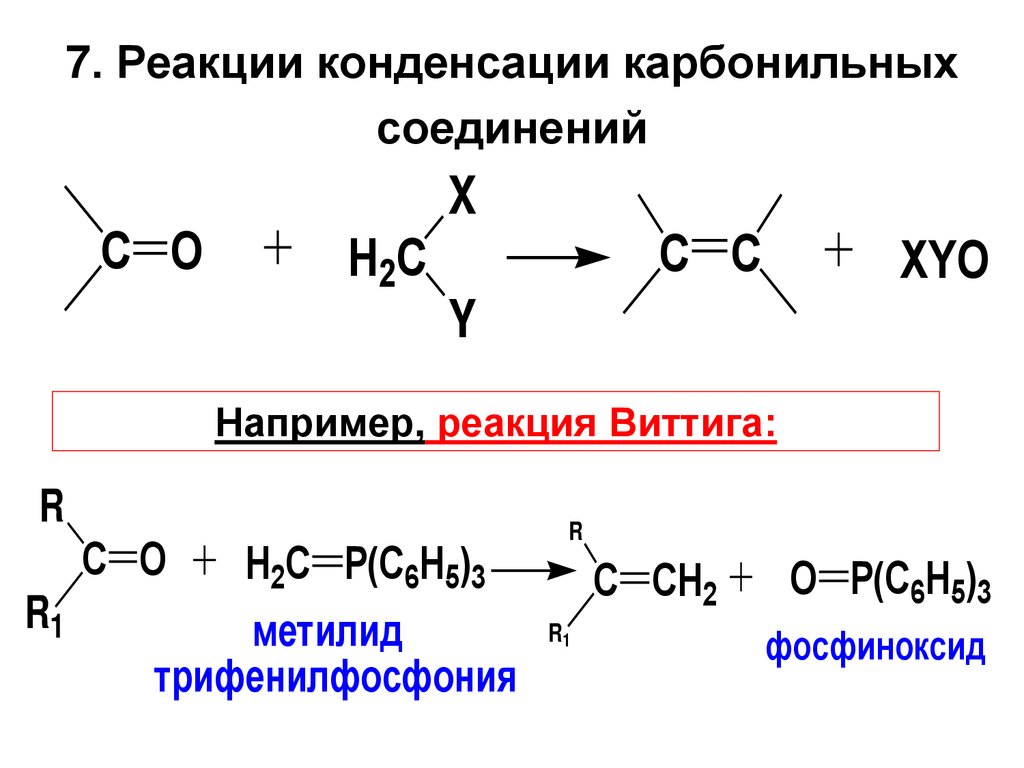
7. Реакции конденсации карбонильныхсоединений
C O
X
C C
H2C
XYO
Y
Например, реакция Виттига:
R
C O
R1
H2C P(C6H5)3
метилид
трифенилфосфония
R
C CH2
R1
O P(C6H5)3
фосфиноксид
14.
Физические свойства алкенов.С1 - С4 – газы
С5 - С17 – жидкости
С18 и выше – твердые вещества.
По физическим свойствам близки к
соответствующим алканам.
Ткип их несколько ниже, а плотности
выше, чем у алканов, но d420 меньше, чем
у воды . Обладают сильным характерным
запахом. Плохо растворимы в воде.
15.
Химические свойстваТак как -электроны более удалены от
ядра, чем -электроны, то -связь менее
прочная, легче поляризуется и легко
вступает в реакцию с электрофилами,
которые вызывают гетеролитический
разрыв этой связи. Энергия разрыва
-связи = 348 кДж / моль,
а -связи = 270 кДж/моль).
p
p
16.
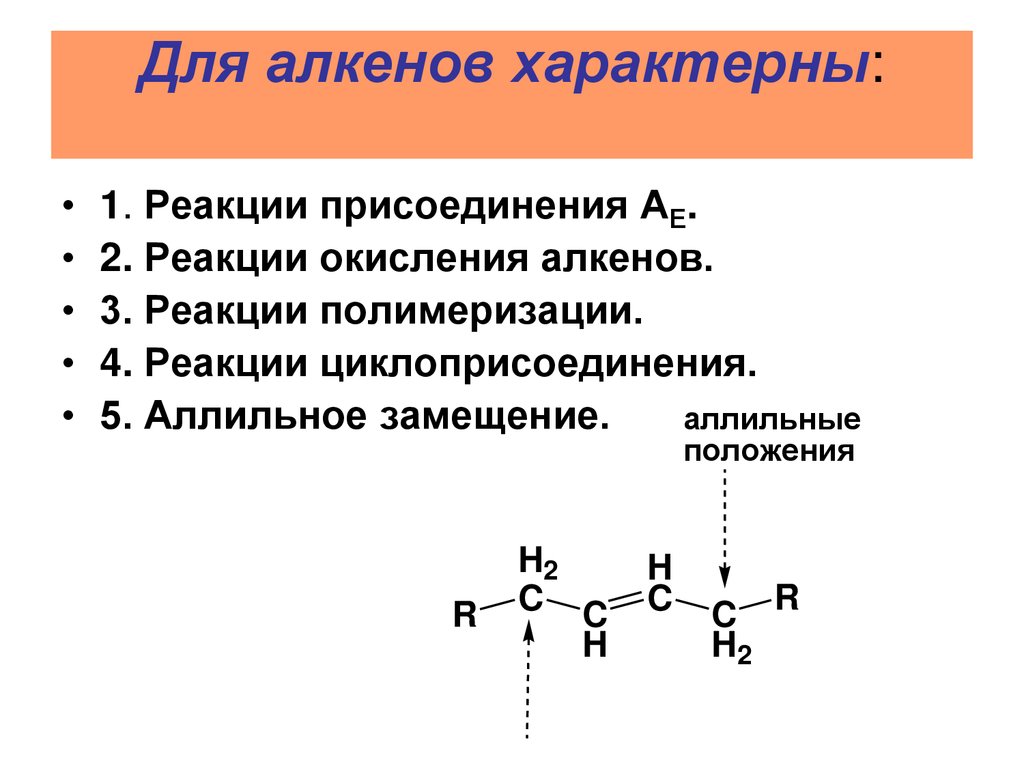
Для алкенов характерны:1. Реакции присоединения АЕ.
2. Реакции окисления алкенов.
3. Реакции полимеризации.
4. Реакции циклоприсоединения.
5. Аллильное замещение.
аллильные
положения
R
H2
C C
H
H
C
C R
H2
17.
Реакции электрофильногоприсоединения AE
• Электроны π-связи алкенов могут
выступать в роли доноров
электронов по отношению к
электрофильным реагентам (т.е. они
могут быть нуклеофилами)
В качестве Е :
• Н (протон) кислот: HBr, HCl, HI,
H2SO4;
• Hal : Br , Cl , молекулярные Br2, Cl2.
18.
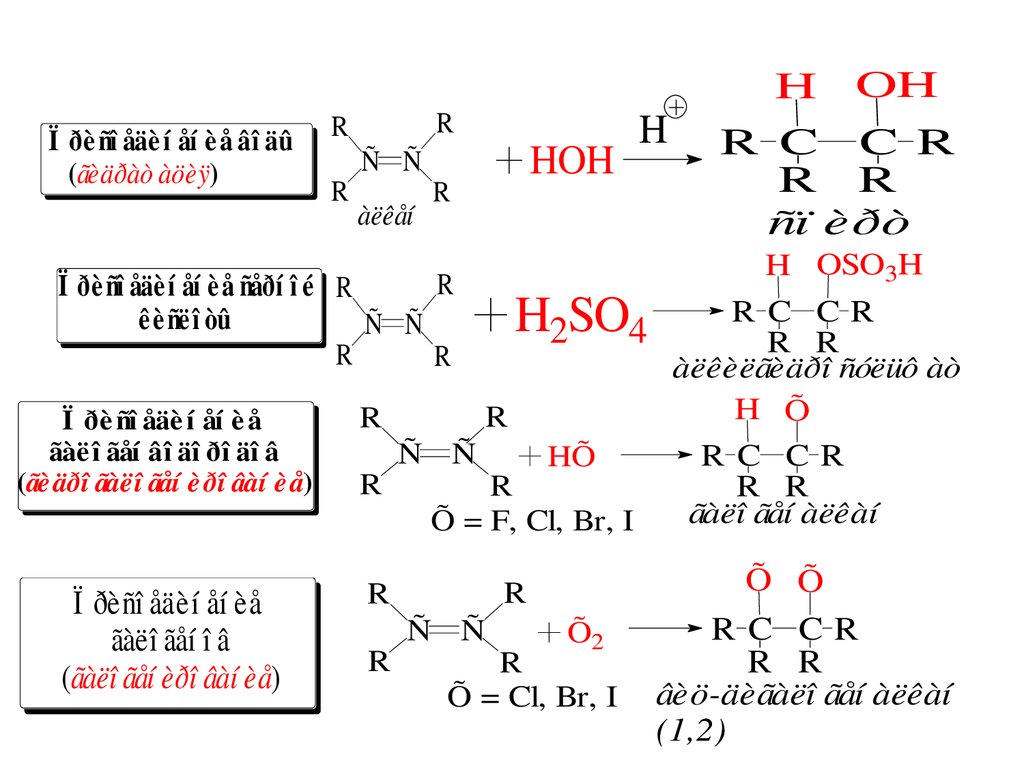
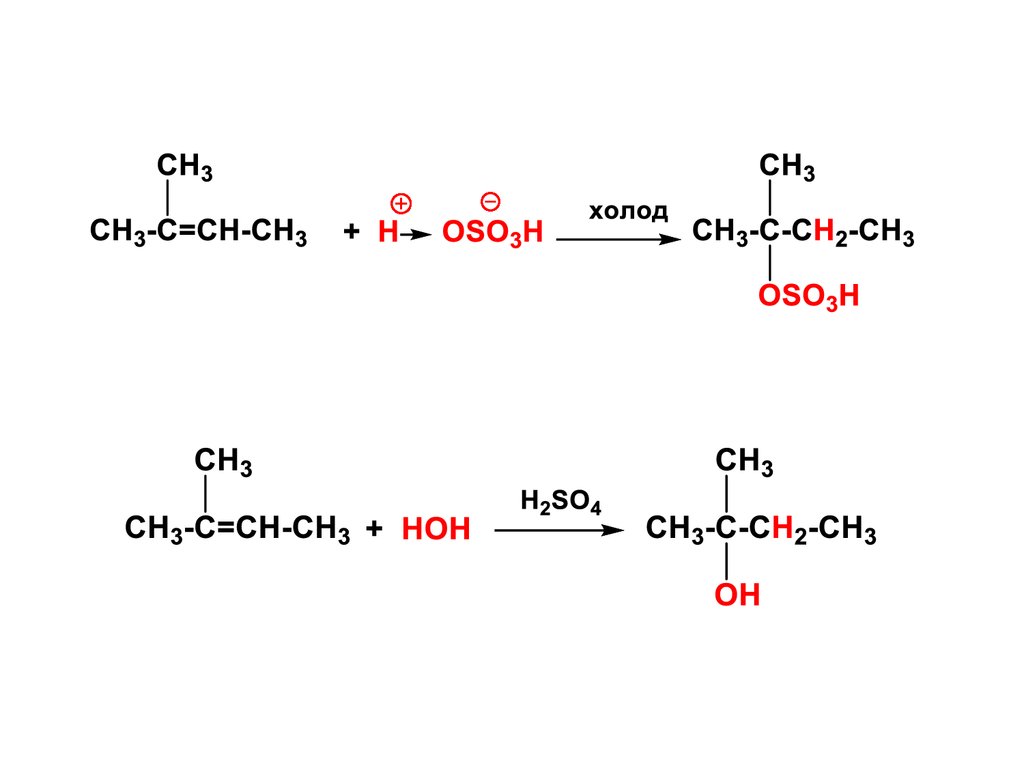
Ï ðè ñî åäè í åí è å âî äû(ãèäðàò àöèÿ)
R
R
HOH
Ñ Ñ
R
àëêåí
R
R
Ï ðè ñî åäè í åí è å ñåðí î é R
ê è ñëî òû
Ñ Ñ
R
R
Ï ðè ñî åäè í åí è å
ãàë î ãåí âî äî ðî äî â
(ãè äðî ãàëî ãåí è ðî âàí è å)
R
Ï ðèñî åäèí åí èå
ãàëî ãåí î â
(ãàëî ãåí èðî âàí èå)
R
H2SO4
R
Ñ Ñ
R
HÕ
R
Õ = F, Cl, Br, I
R
Ñ Ñ
R
H
Õ2
R
Õ = Cl, Br, I
H OH
R C C R
R R
ñï èðò
H OSO3H
R C CR
R R
àëêèëãèäðî ñóëüô àò
H Õ
R C CR
R R
ãàëî ãåí àëêàí
Õ Õ
RC CR
R R
âèö-äèãàëî ãåí àëêàí
(1,2)
19.
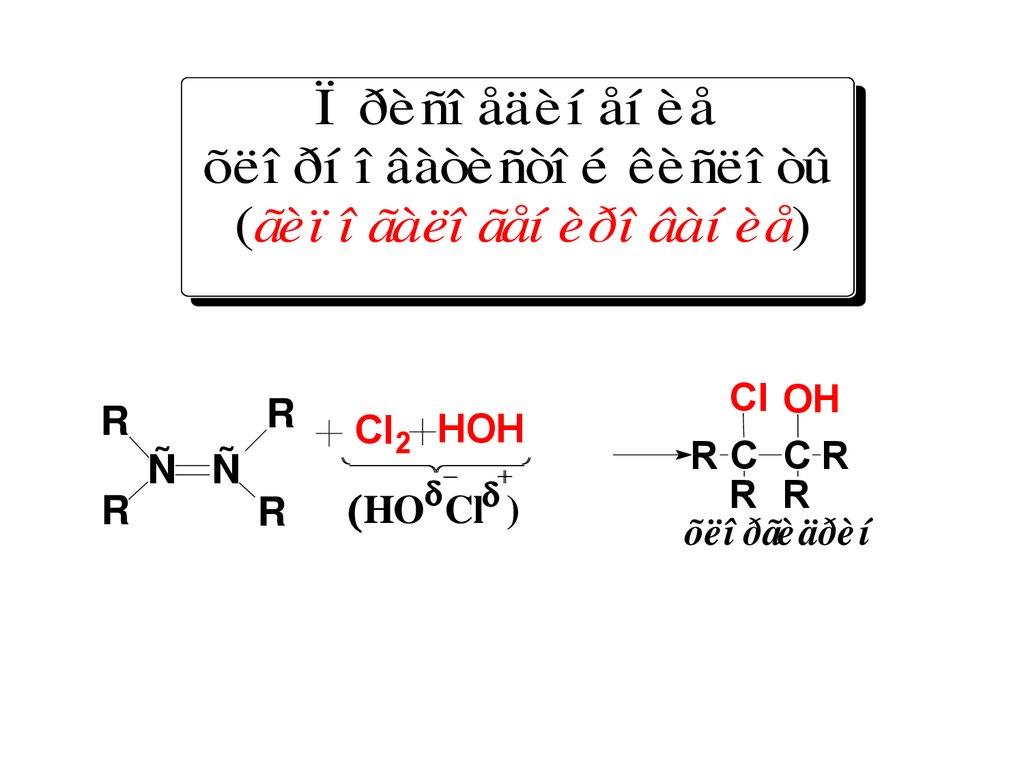
Ï ðè ñî åäè í åí è åõëî ðí î âàòè ñòî é êè ñëî òû
(ãèï î ãàëî ãåí èðî âàí èå)
R
R
Cl2 HOH
R
HO Cl )
Ñ Ñ
R
Cl OH
R C CR
R R
õëî ðãè äðè í
20.
1.1. Присоединение Br2 (хлора, йода).• Качественная реакция на кратную
связь – обесцвечивание бромной
воды:
Br
CH3-CH2-CH=CH2 + Br2
HOH
CH3-CH2-CH-CH2
Br
21.
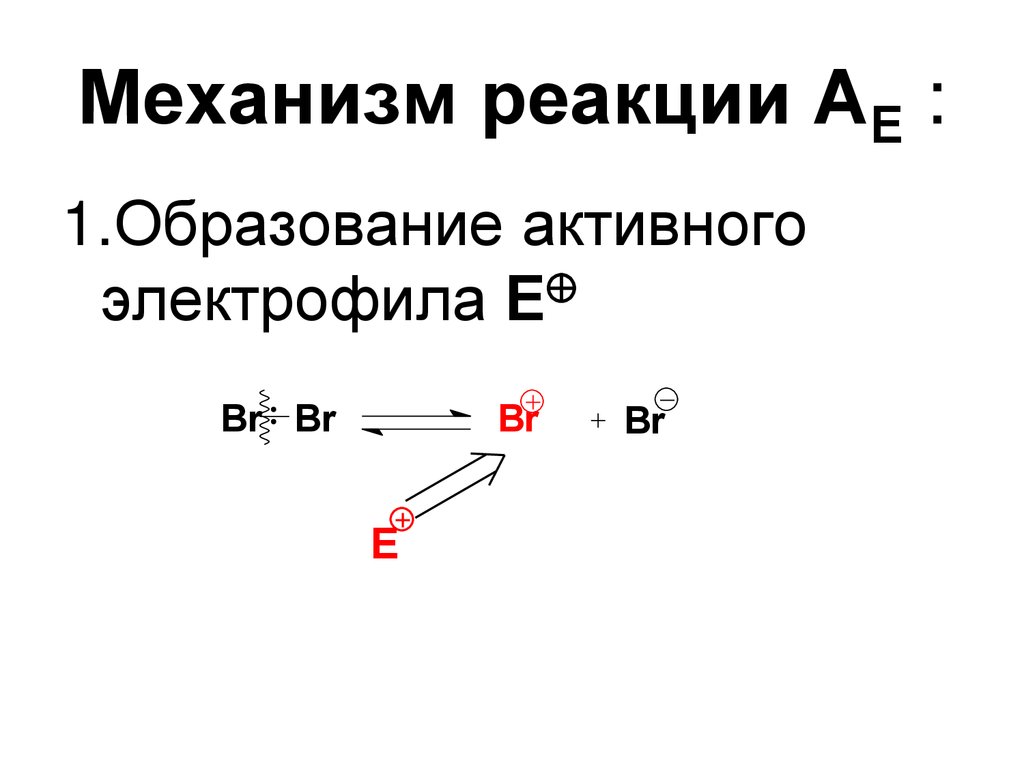
Механизм реакции АЕ :1.Образование активного
электрофила Е
Br Br
Br
E
Br
22.
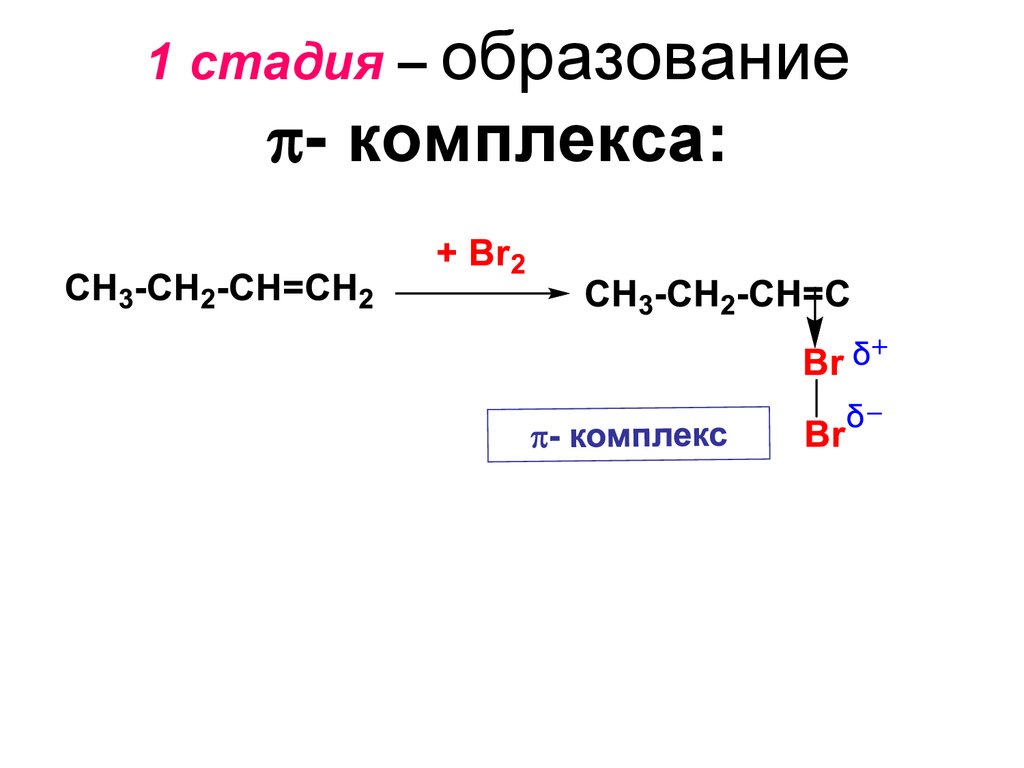
1 стадия – образование- комплекса:
23.
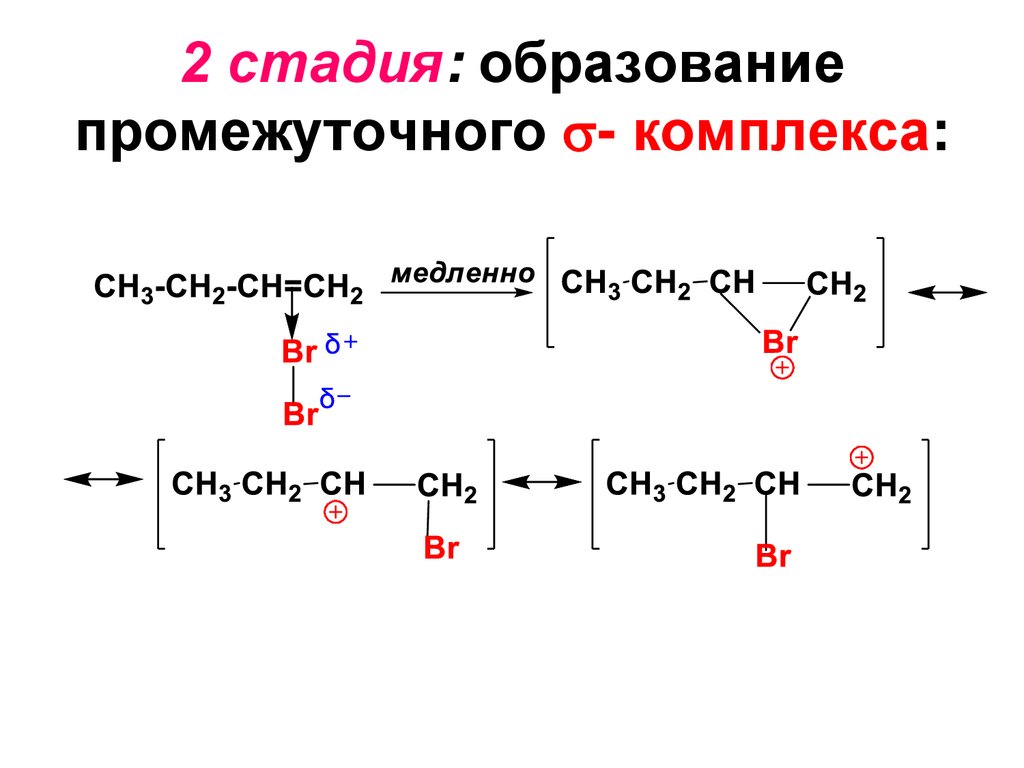
2 стадия: образованиепромежуточного - комплекса:
24.
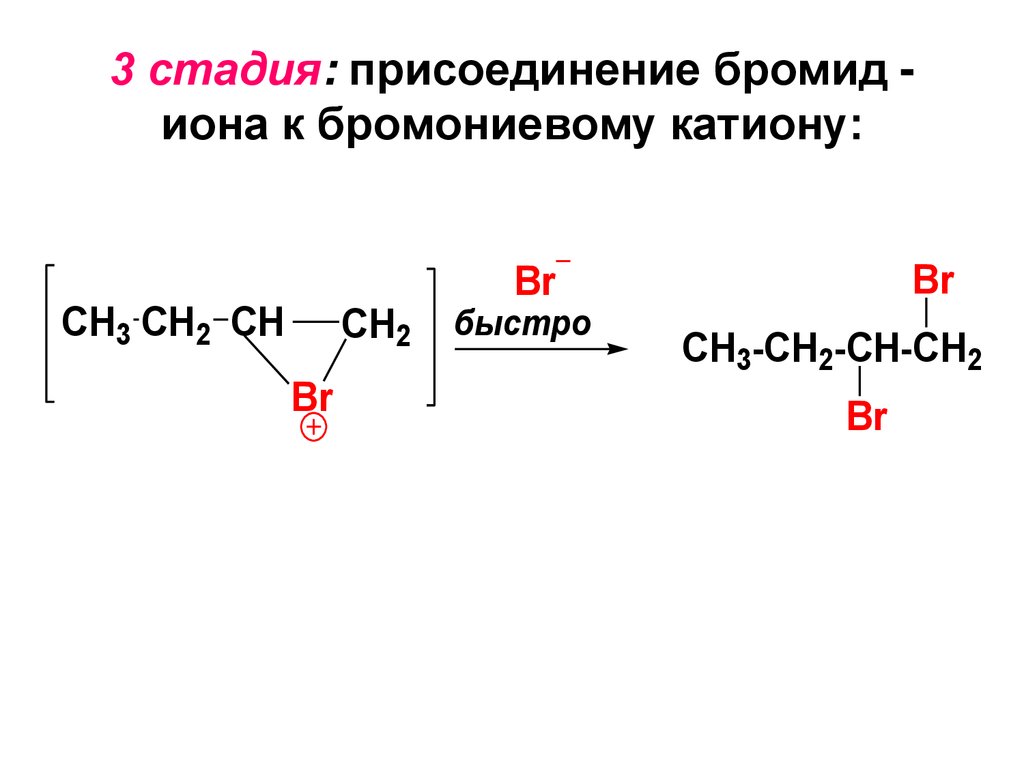
3 стадия: присоединение бромид иона к бромониевому катиону:CH3 CH2 CH
CH2
Br
Br
Br
быстро
CH3-CH2-CH-CH2
Br
25.
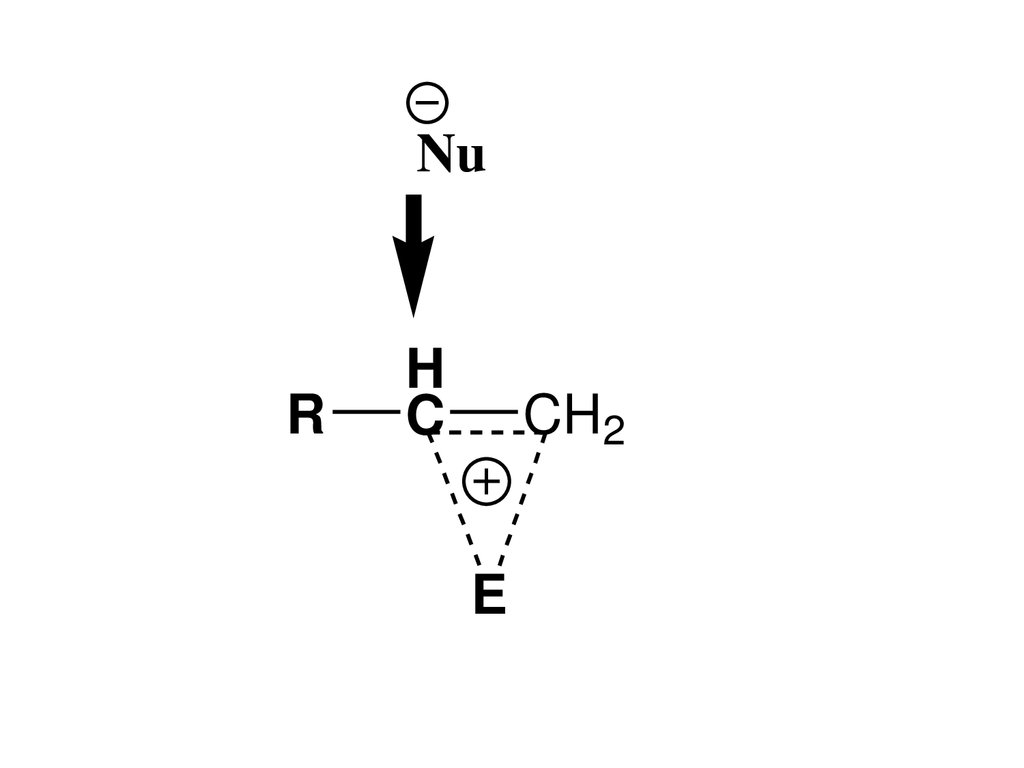
Стереохимия АЕ-реакцийВ полярных средах АЕ-реакции протекают
как транс-присоединение – подход
нуклеофильной частицы осуществляется
со стороны противоположной
присоединению электрофила.
Оказывается, что при взаимодействии
электрофила с электронами π-связи алкена
образуется циклический аддукт (так
называемый «ониевый катион» - протониевый, бромониевый, хлорониевый и т.д.
Атака такого π-аддукта возможна только со
стороны, противоположной присоединению
электрофильной частицы из-за
пространственных и причин
26.
NuR
H
C
CH2
E
27.
Применительно к реакциям, которыесопровождаются образованием
асимметрического атома углерода в
продукте, следует отметить, что
стереохимическим результатом в
таком случае также является
оптически неактивная рацемическая
смесь (смесь обоих возможных
энантиомеров в отношении 1:1).
28.
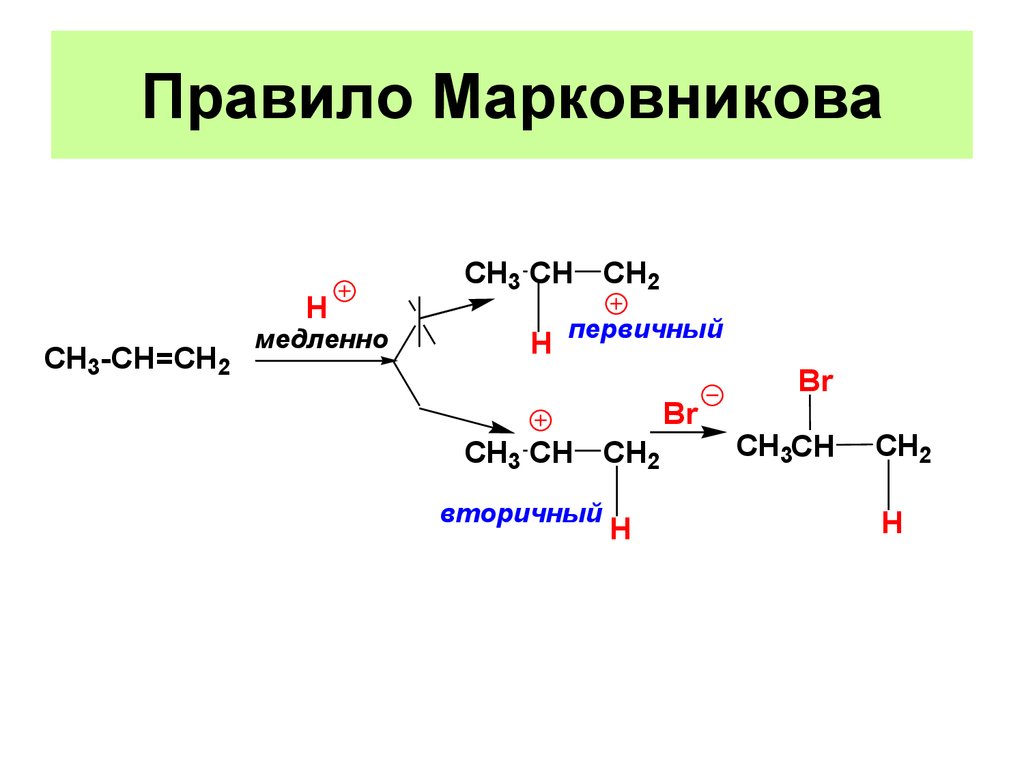
1.2. ГидрогалогенированиеПравило Марковникова: при
присоединении галогеноводорода к
несимметричным алкенам водород
присоединяется
к более гидрогенизированному C-атому
при двойной связи.
Это объясняют тем, что в условиях
равновесия реакция протекает в
направлении образования в
лимитирующей стадии более
стабильного карбокатиона.
29.
Правило МарковниковаH
CH3-CH=CH2
медленно
CH3 CH CH2
H
первичный
Br
CH3 CH CH2
вторичный
H
Br
CH3CH
CH2
H
30.
• ВЫВОД: направлениеприсоединения к несимметрично
замещенным алкенам
определяется стабильностью
промежуточно-образующегося σаддукта (именно эта частица
образуется на лимитирующей
стадии реакции)
31.
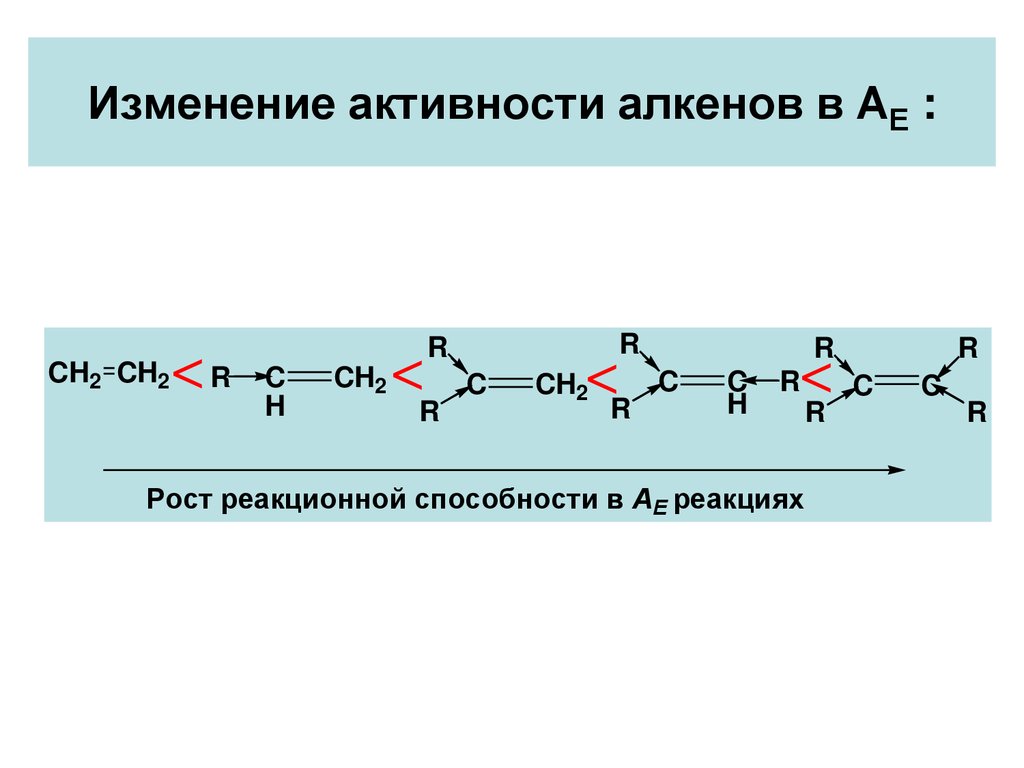
Изменение активности алкенов в АЕ :CH2
>
C
H
R
C
>
R
CH2
R
R
R
C
C
H
R
>
>
CH2 CH2
R
Рост реакционной способности в АЕ реакциях
R
R
C
C
R
32.
В соответствии с механизмом АЕреакции результат превращенияизменяется в том случае, если двойная
С=С связь соединена c ЭА группой
33.
1.3. Присоединение ICl, HOClхлорноватистой кислоты, H2SO4,
H2O (гидратация) :
CH3
CH3-C=CH-CH3
CH3 Cl
+ HO Cl
CH3-C-CH-CH3
OH
34.
35.
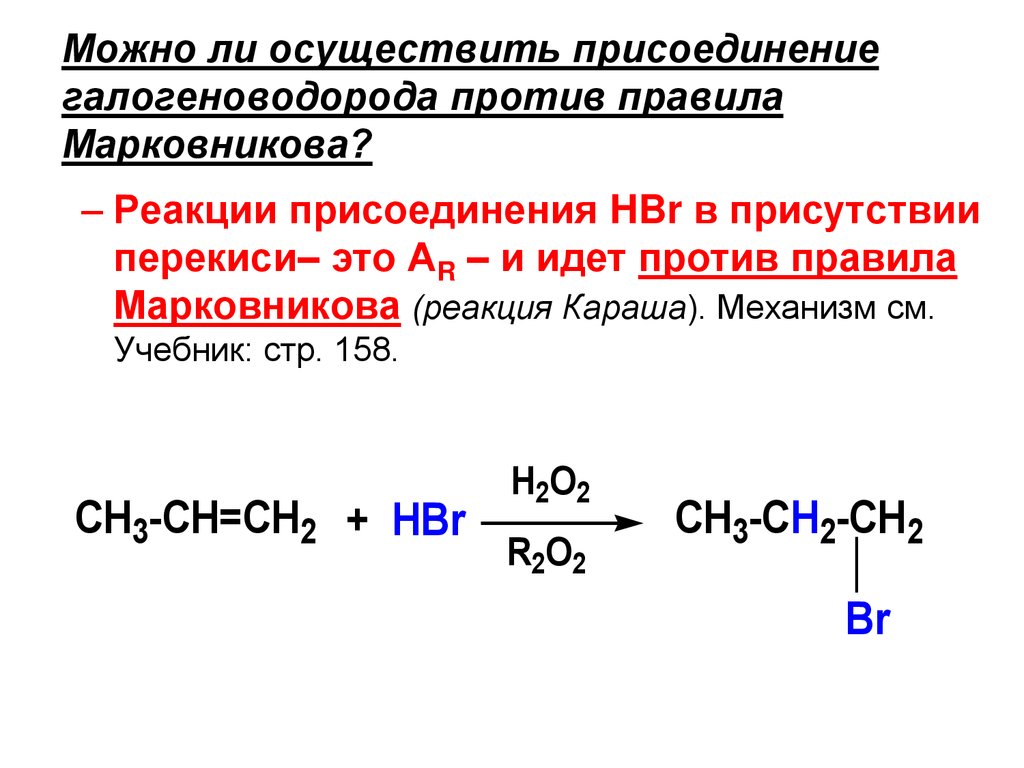
Можно ли осуществить присоединениегалогеноводорода против правила
Марковникова?
– Реакции присоединения HBr в присутствии
перекиси– это АR – и идет против правила
Марковникова (реакция Караша). Механизм см.
Учебник: стр. 158.
CH3-CH=CH2 + HBr
H2O2
R2O2
CH3-CH2-CH2
Br
36.
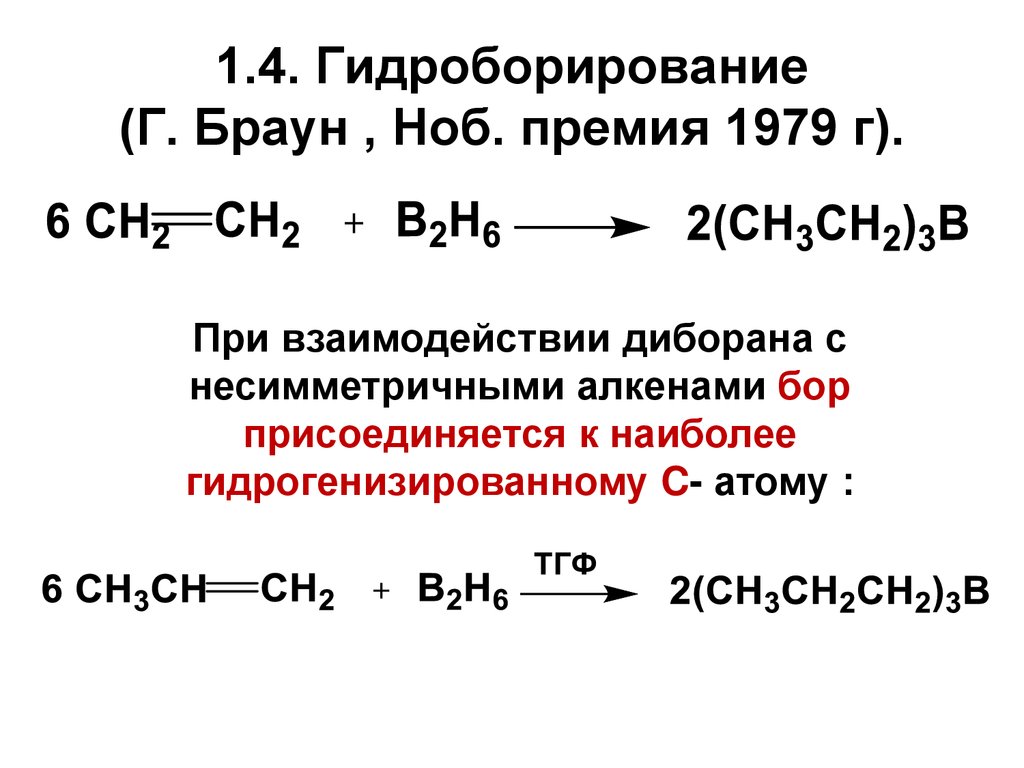
1.4. Гидроборирование(Г. Браун , Ноб. премия 1979 г).
При взаимодействии диборана с
несимметричными алкенами бор
присоединяется к наиболее
гидрогенизированному C- атому :
37.
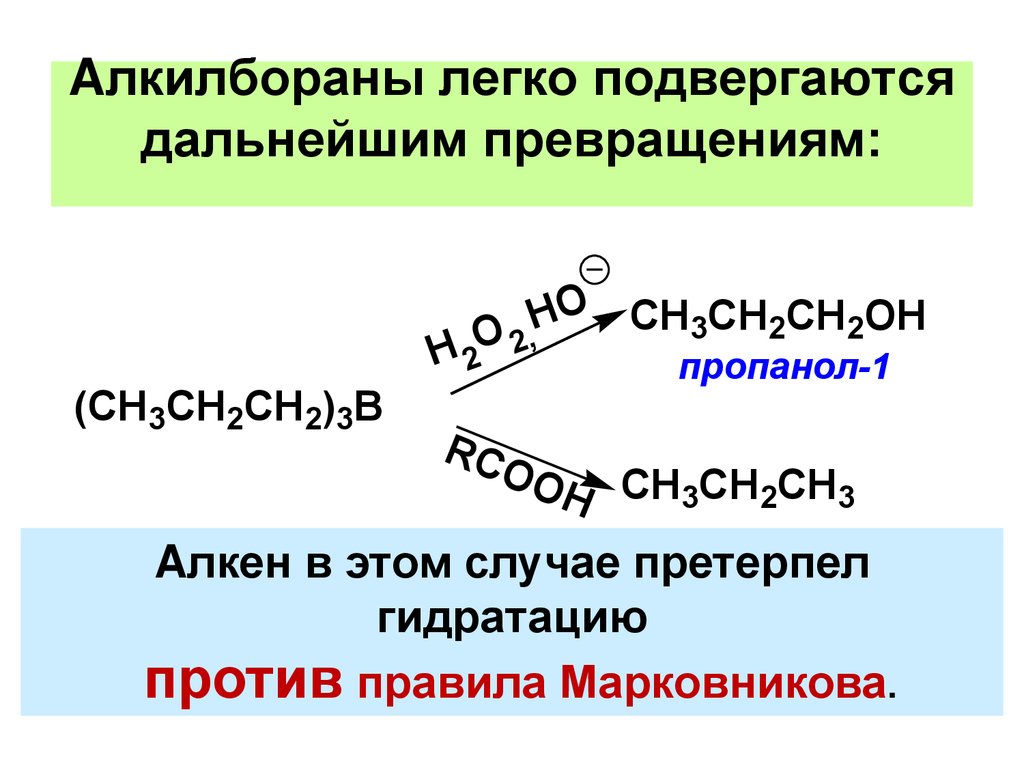
Aлкилбораны легко подвергаютсядальнейшим превращениям:
(CH3CH2CH2)3B
O CH3CH2CH2OH
H
H 2O 2,
пропанол-1
RC
OO CH CH CH
H
3
2
3
пропан
Aлкен в этом случае претерпел
гидратацию
против правила Марковникова.
38.
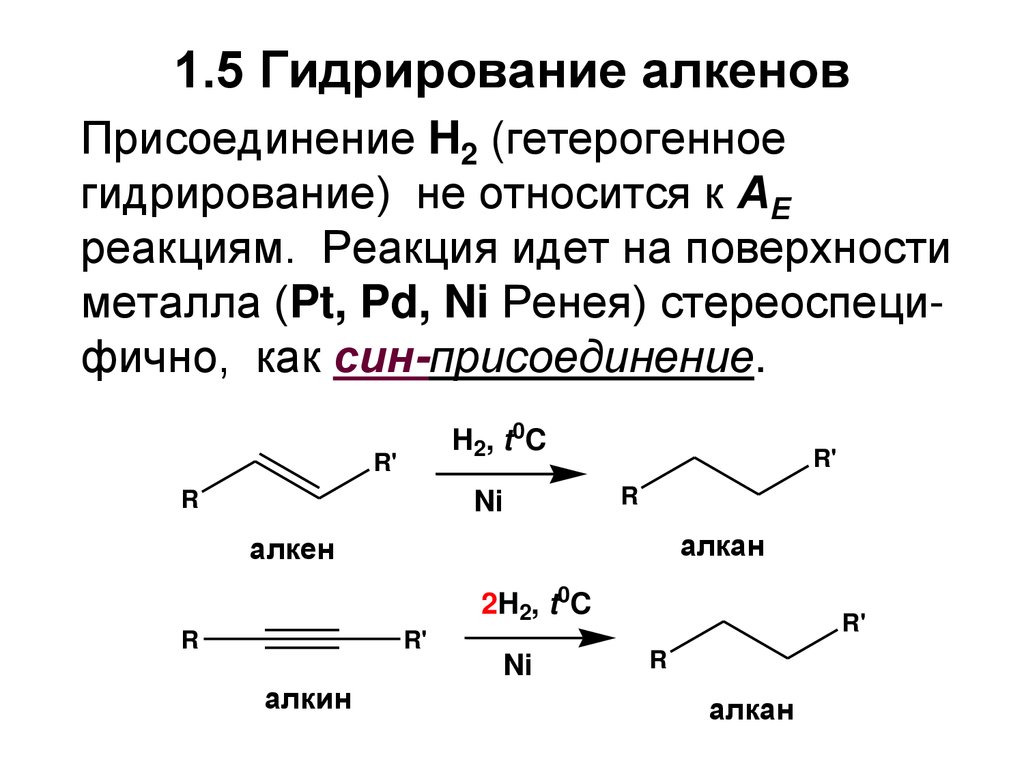
1.5 Гидрирование алкеновПрисоединение H2 (гетерогенное
гидрирование) не относится к АЕ
реакциям. Реакция идет на поверхности
металла (Pt, Pd, Ni Ренея) стереоспецифично, как син-присоединение.
H2, t0C
R'
R
Ni
R'
R
алкан
алкен
2H2, t0C
R
R'
Ni
алкин
R'
R
алкан
39.
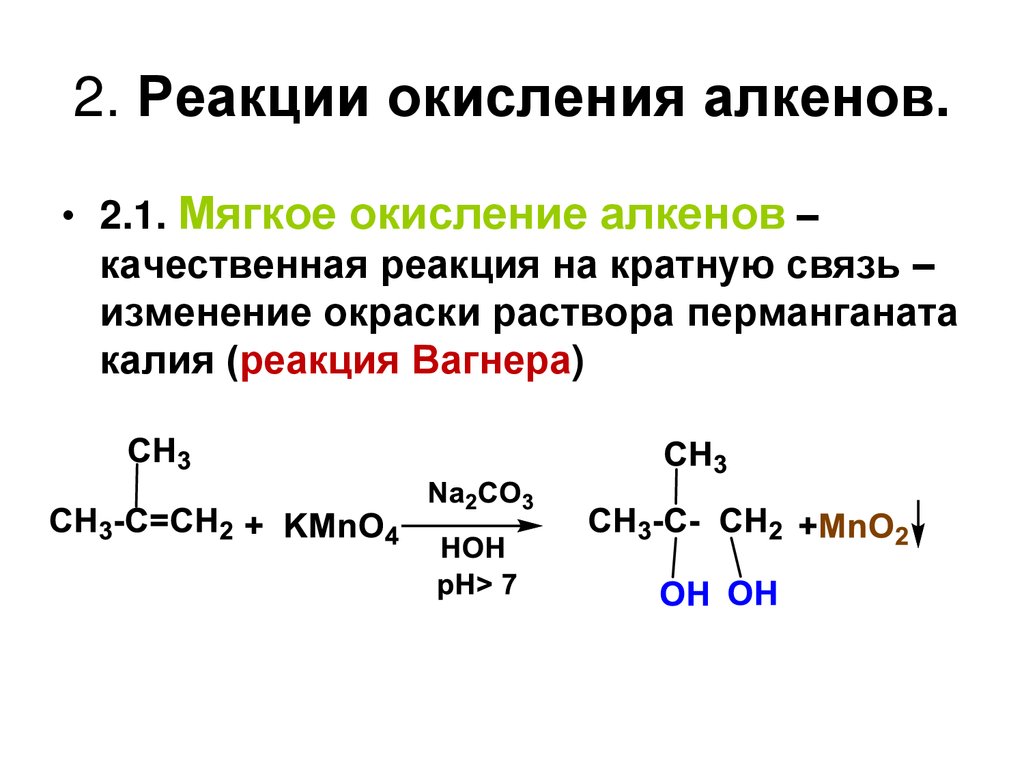
2. Реакции окисления алкенов.• 2.1. Мягкое окисление алкенов –
качественная реакция на кратную связь –
изменение окраски раствора перманганата
калия (реакция Вагнера)
40.
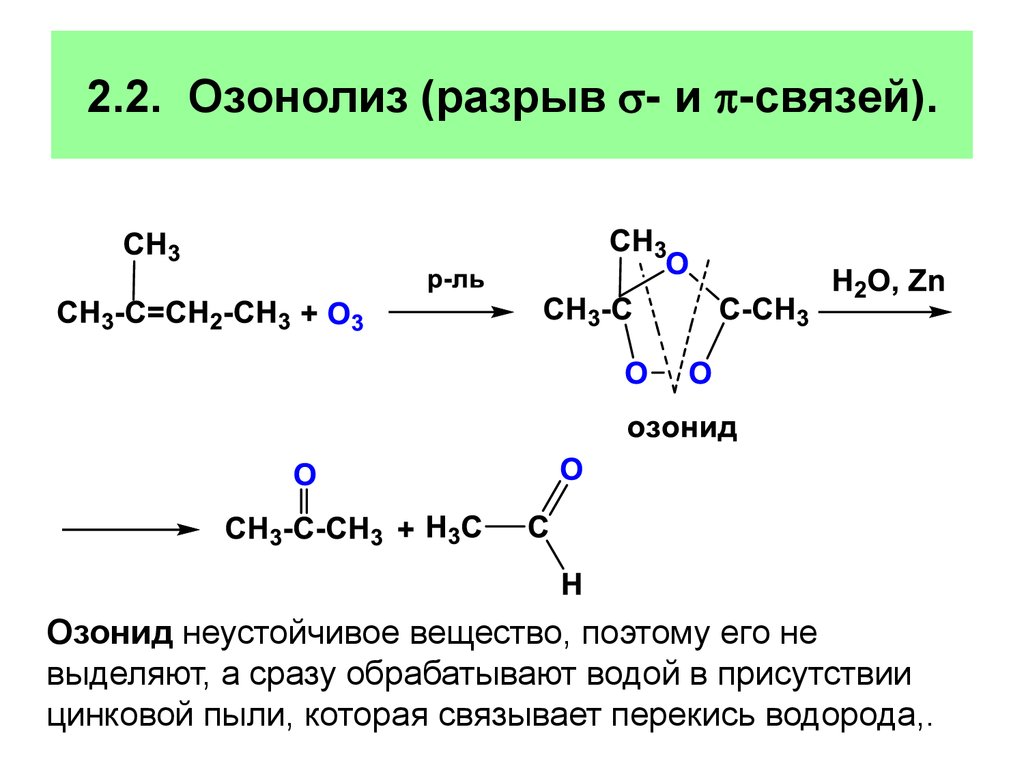
2.2. Озонолиз (разрыв - и -связей).Озонид неустойчивое вещество, поэтому его не
выделяют, а сразу обрабатывают водой в присутствии
цинковой пыли, которая связывает перекись водорода,.
41.
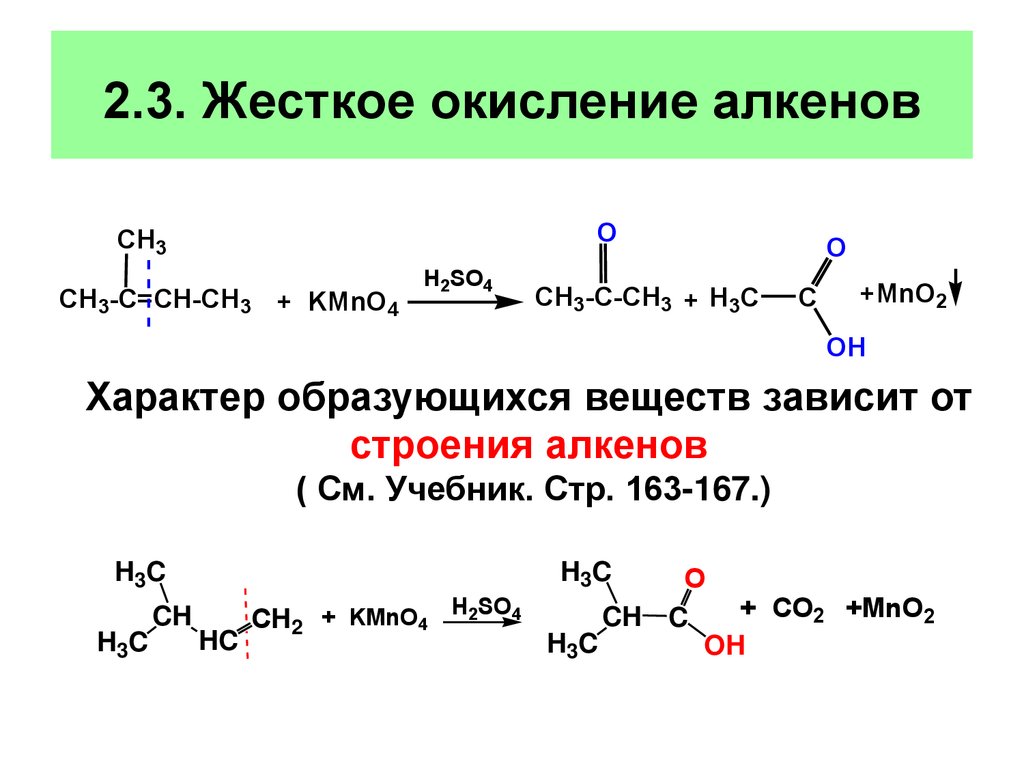
2.3. Жесткое окисление алкеновO
CH3
CH3-C=CH-CH3 + KMnO4
H2SO4
CH3-C-CH3 + H3C
O
C
+MnO2
OН
Характер образующихся веществ зависит от
строения алкенов
( См. Учебник. Стр. 163-167.)
H3C
H3C
CH
H3C
HC
СH2 + KMnO4 H2SO4
O
+ CO2 +MnO2
CH C
H3C
OH
42.
CH2CH3
СH
H3C
HC
CH2
+ KMnO4 H2SO4
O
2 CH2
H3C
C
+MnO2
OH
O
CH3
HC
СH
CH2
CH3
+ KMnO4 H2SO4
C
С
OH
CH2
CH3
+ KMnO4 H2SO4
C
СH3
CH2
C
OH
O
2 CH2
H3C
C
+MnO2
CH3
O
CH3
СН2
С
+MnO2
O
СH3
CH2
H3C
C
CH2
H3C
СН3
CH2
H3C
CH3
CH2
H3C
CH3
+ KMnO4 H2SO4
C
CH3
O
H3C CH2
+MnO2
C
CH2 CH3
43.
2.4. Окисление алкенов в присутствиисолей палладия (вакер-процесс)
Промышленное получение ацетальдегида :
CH2 CH2
PdCl2/H2O
1/2O2
(CuCl2)
CH3C
O
H
Окисление гомологов этилена идет по
менее гидрогенизированному атому
углерода ( из пропилена, например,
получается ацетон).
44.
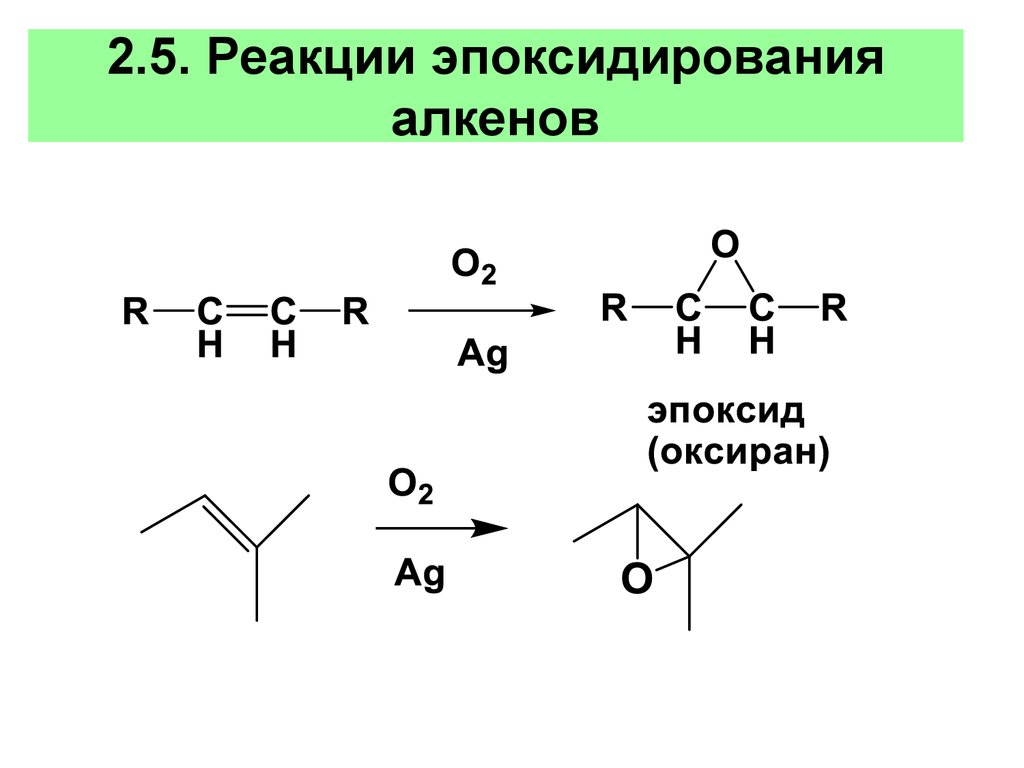
2.5. Реакции эпоксидированияалкенов
45.
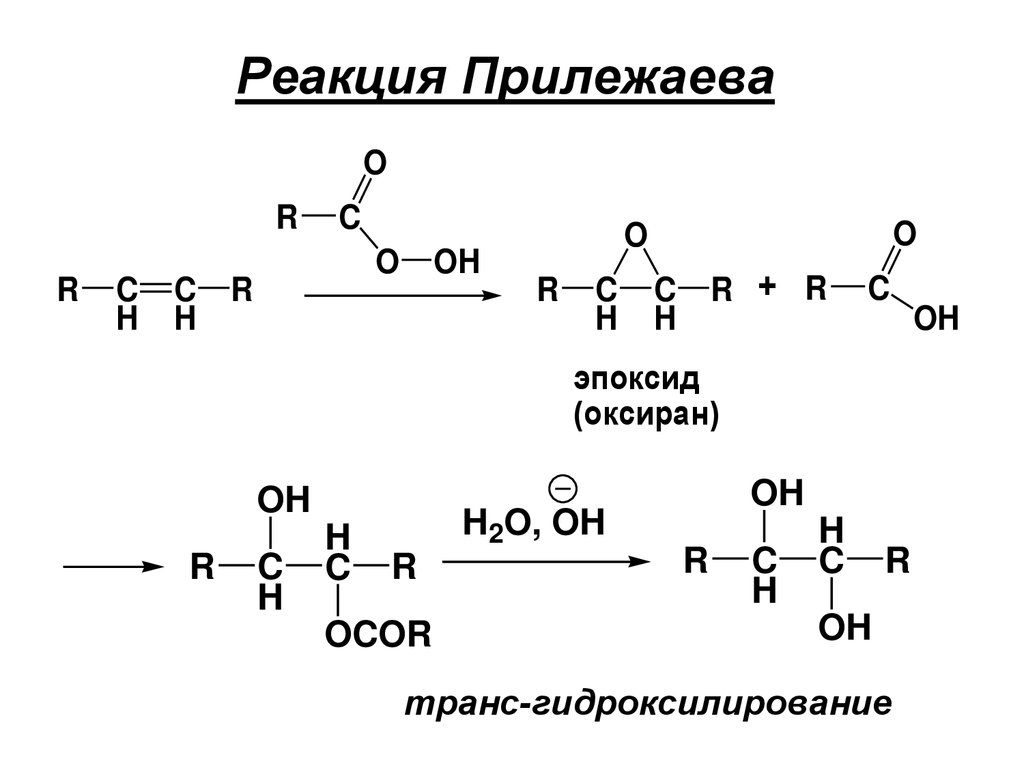
Реакция ПрилежаеваO
R
R
C
H
C
H
C
O
R
OH
O
O
R
C
H
R + R
C
H
C
эпоксид
(оксиран)
OH
R
C
H
H
C
H2O, OH
R
OCOR
OH
R
C
H
H
C
R
OH
транс-гидроксилирование
OH
46.
3. Реакции полимеризацииПолимеризация – химический процесс, в
котором молекулы ненасыщенного
углеводорода присоединяются одна к
другой за счет разрыва π-связей и
образования новых σ-связей.
n CH2 CH2
Kt
CH2 CH2
n
Полимер, получаемый из одинаковых молекул
называют гомополимером, из различных
молекул – гетерополимером или
сополимером.
47.
Олигомеризация приводит книзкомолекулярным полимерам –
олигомерам.
• Пример олигомеризации - образование
димера изобутилена под действием
60% H2SO4:
CH3
H2SO4
ÑH3 C CH2
CH3
ÑH3 C CH C CH3
CH3
CH3
2,4,4-òðèì åòèëï åí ò-2-åí
CH3
ÑH3 C CH C CH2
CH3
CH
3
2,4,4-òðèì åòèëï åí ò-1-åí
48.
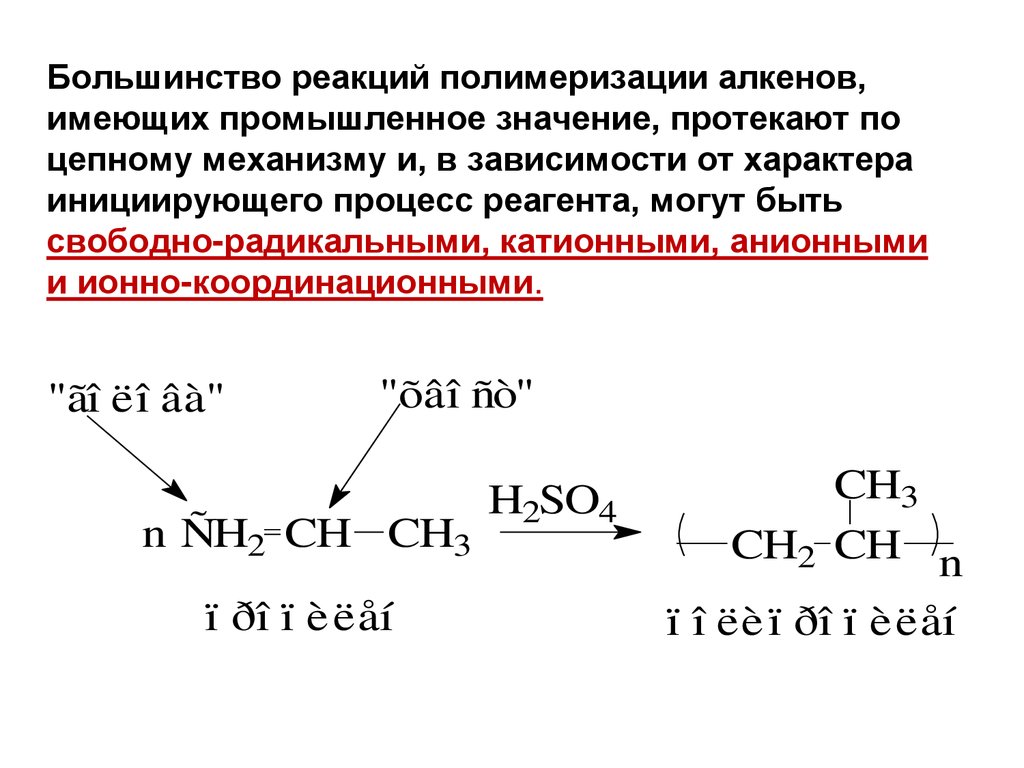
Большинство реакций полимеризации алкенов,имеющих промышленное значение, протекают по
цепному механизму и, в зависимости от характера
инициирующего процесс реагента, могут быть
свободно-радикальными, катионными, анионными
и ионно-координационными.
"ãî ëî âà"
"õâî ñò"
n ÑH2 CH CH3
ï ðî ï è ëåí
H2SO4
CH3
CH2 CH n
ï î ëè ï ðî ï è ëåí
49.
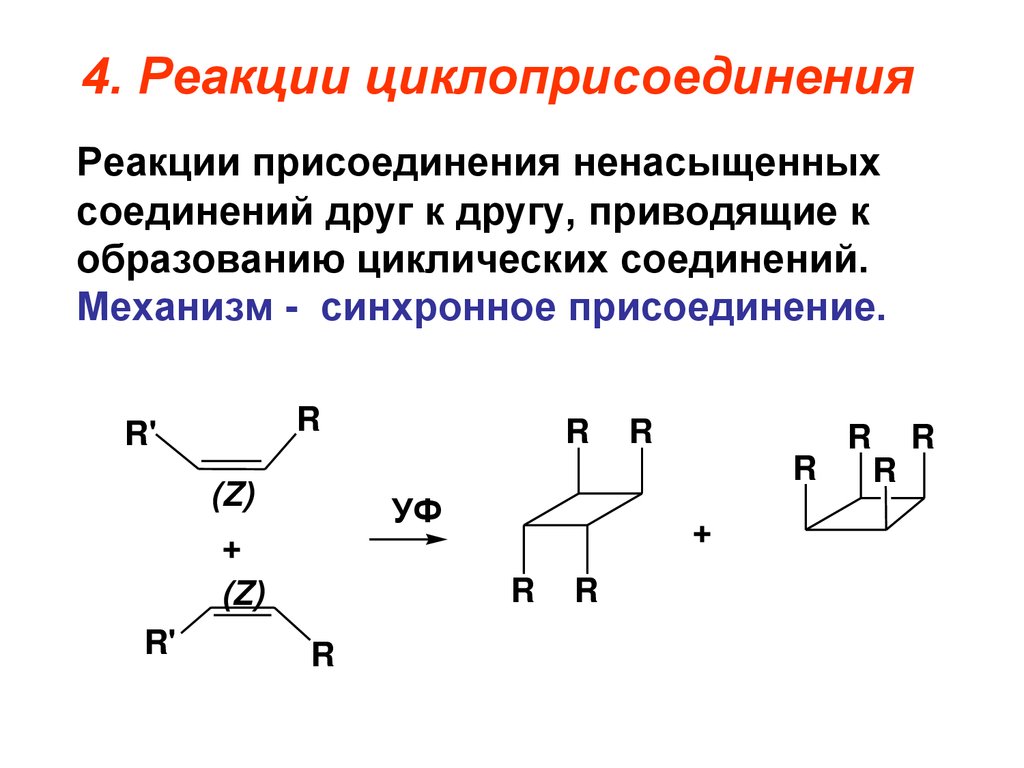
4. Реакции циклоприсоединенияРеакции присоединения ненасыщенных
соединений друг к другу, приводящие к
образованию циклических соединений.
Механизм - синхронное присоединение.
R
R'
R
R
R
(Z)
+
+
УФ
R
(Z)
R'
R
R
R
R
R
50.
5. Аллильное замещениеВзаимодействие гомологов этилена с галогенами
(Cl2, Br2) при высоких температурах ( выше 400о С)
ведет к замещению атома водорода в аллильном
положении на галоген и называется
аллильным замещением.
аллильное
положение
CH3CH
CH2
Cl2
>400oC
Cl
CH2CH
CH2
аллилхлорид
Реакция идет как радикальный цепной процесс
(см. Учебник стр. 159).
HCl
51.
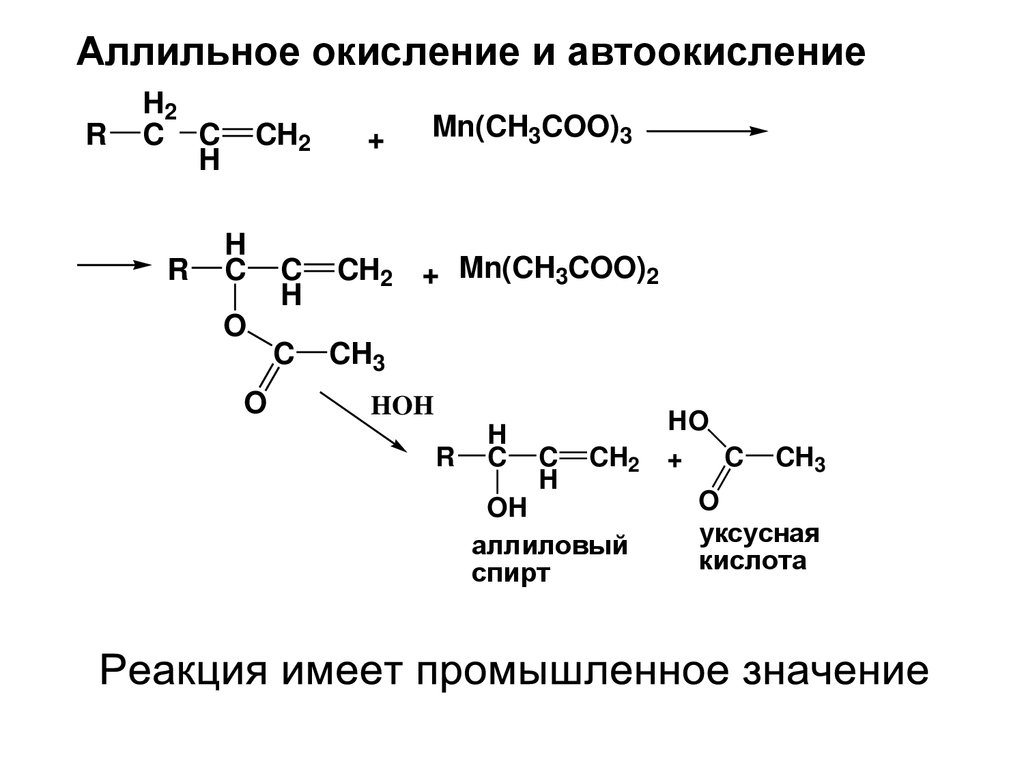
Аллильное окисление и автоокислениеR
H2
C C
H
R
CH2
H
C
+
Mn(CH3COO)3
C
H
CH2 + Mn(CH3COO)2
C
CH3
O
O
HOH
R
H
C
C
H
CH2
OH
аллиловый
спирт
HO
C
+
CH3
O
уксусная
кислота
52.
Применение алкенов1. Этилен, пропилен и изобутилен →
производство полиэтилена и пластмасс
2. Этилен → получение винилхлорида в
производстве ПВХ
3. Этилен → сварка и резка металлов
4. Пропилен → синтез акрилонитрила и
далее получение ПАН
5. Бутилен и изобутилен → исходное
сырье для синтеза каучуков




















 Химия
Химия








