Похожие презентации:
Классификация неорганических веществ. Степень окисления
1. Классификация неорганических веществ. Степень окисления
Только при посредстве теориизнание, слагаясь в связанное целое,
становится научным знанием
А.М. Бутлеров
Классификация
неорганических веществ.
Степень окисления
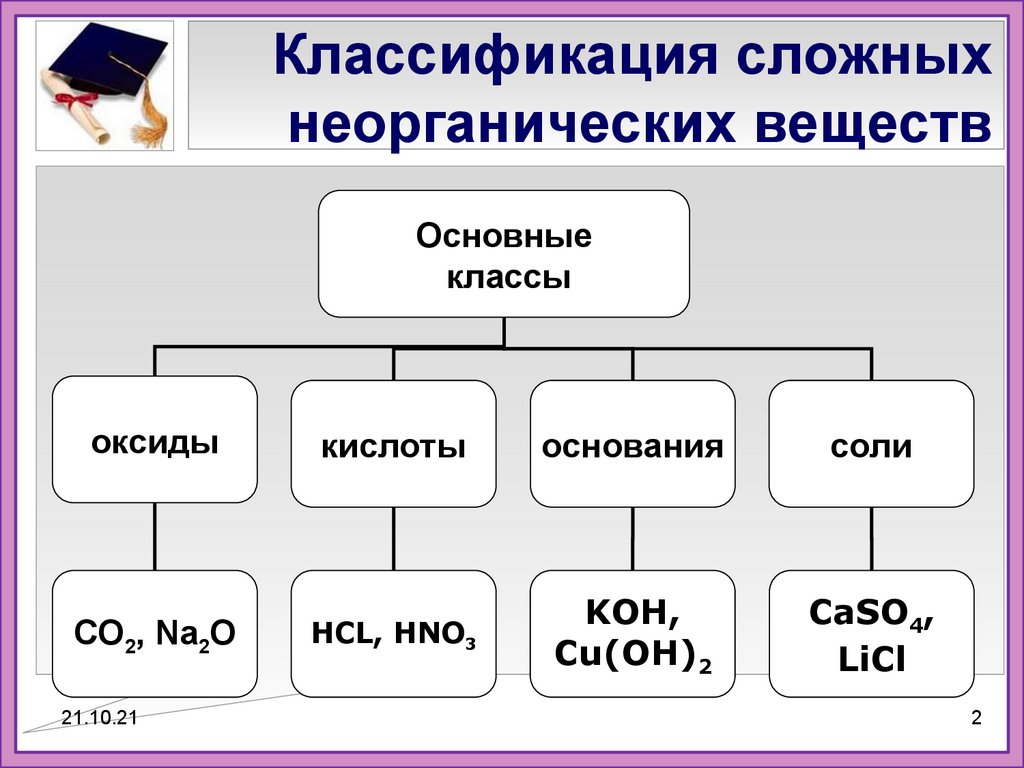
2. Классификация сложных неорганических веществ
Основныеклассы
оксиды
СО2, Na2O
21.10.21
кислоты
основания
соли
HCL, HNO3
KOH,
Cu(OH)2
CaSO4,
LiCl
2
3. Степень окисления
Степень окисления – это условныйзаряд атома химического элемента в
соединении, вычисленный на основе
предположения, что все соединения (и
ионные, и ковалентные полярные)
состоят только из ионов .
• Значение степени окисления определяется числом
электронов, смещённых от атома одного элемента к
атому другого элемента
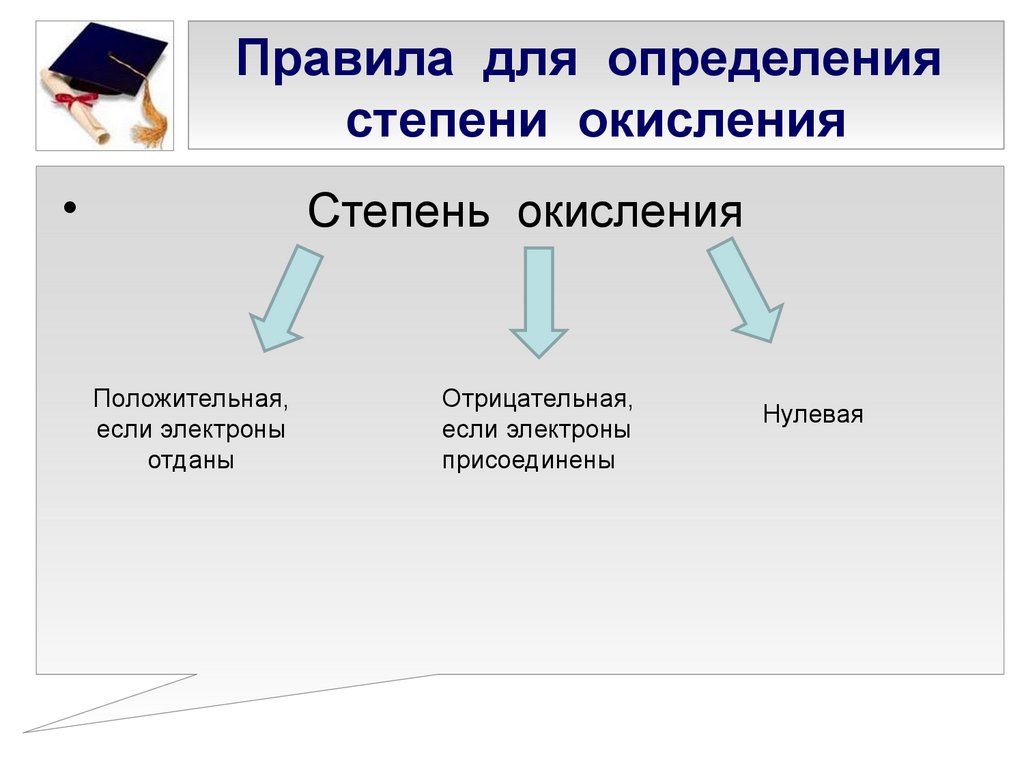
4. Правила для определения степени окисления
Степень окисления
Положительная,
если электроны
отданы
Отрицательная,
если электроны
присоединены
Нулевая
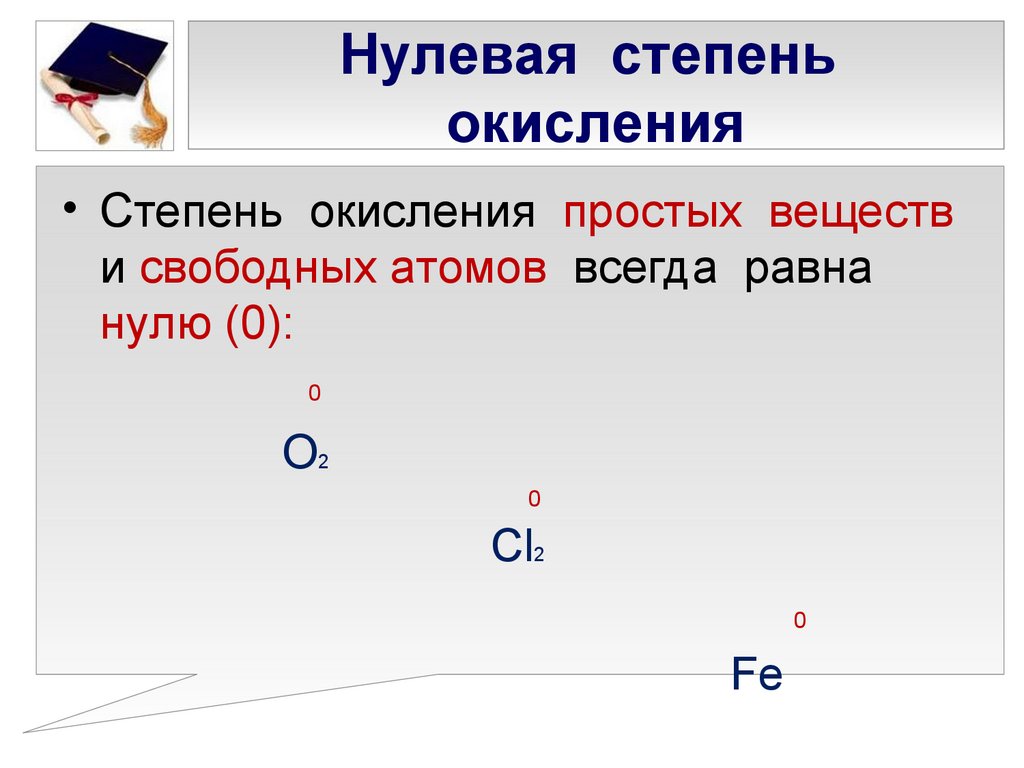
5. Нулевая степень окисления
• Степень окисления простых веществи свободных атомов всегда равна
нулю (0):
0
О2
0
Cl2
0
Fe
6. Отрицательная степень окисления
• Степень окисления фтора (F) всегдаравна -1;
• В бинарных соединениях у правого
элемента определяется по формуле
№ - 8, где № - номер группы
периодической системы
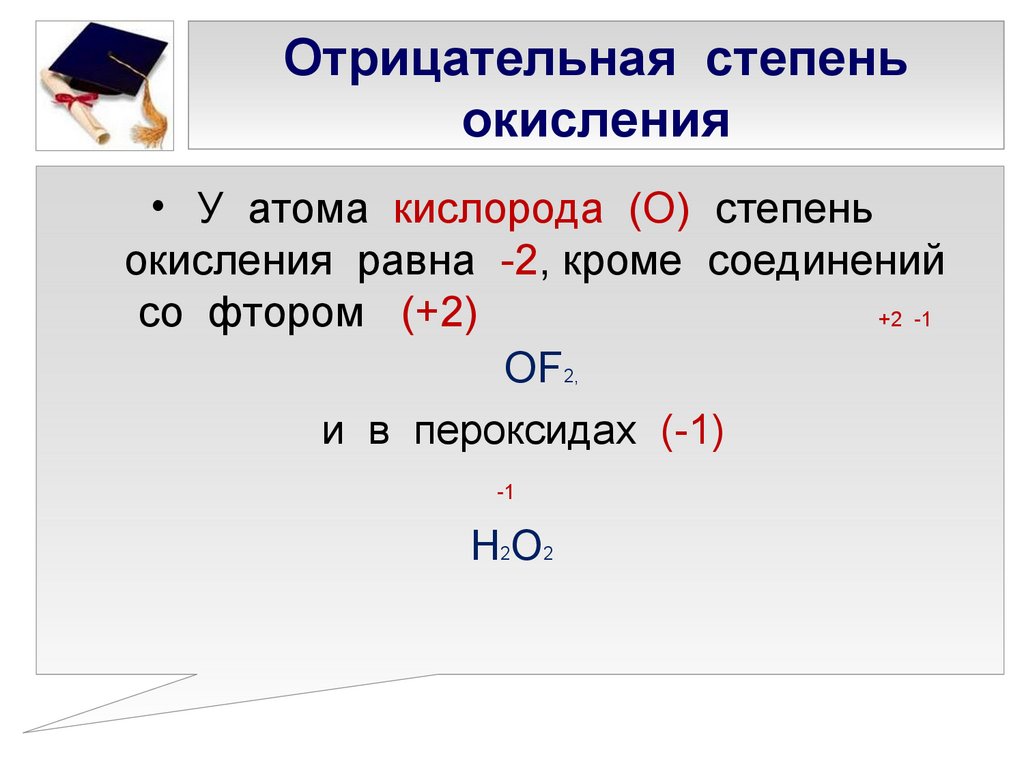
7. Отрицательная степень окисления
• У атома кислорода (О) степеньокисления равна -2, кроме соединений
со фтором (+2)
+2 -1
ОF2,
и в пероксидах (-1)
-1
Н2О2
8. Положительная степень окисления
• Уметаллов
степень окисления
всегда положительна и равна номеру
группы
(для
металлов
главных
подгрупп).
1)У металлов I группы С.О.= +1
2)У металлов II группы С.О.= +2
3)У металлов III группы С.О.= +3
9. Положительная степень окисления
• У атома водорода степень окисления равна +1+1
-2
Н2О,
Кроме соединений с металлами (-1):
+1
-1
NaH
10. Значения степени окисления
• Некоторые элементы имеют постоянную степеньокисления, а некоторые переменную
• У элементов с переменной с.о. различают
максимальную, минимальную и промежуточную с.о.
• Положительная "+" равна числу отданных
электронов. Максимальная с.о. равна номеру группы
• Отрицательная "-" равна числу принятых
электронов. Минимальная с.о. равна номер группы - 8
• Нулевое значение с.о. имеют атомы в молекулах с
неполярной связью
11. Правила определения степени окисления
• Степень окисления металлов всегда (+)• у металлов групп А = № группы
Например:
+1
+2
+3
KCl Ca3N2 AlBr3
12. Правила определения степени окисления
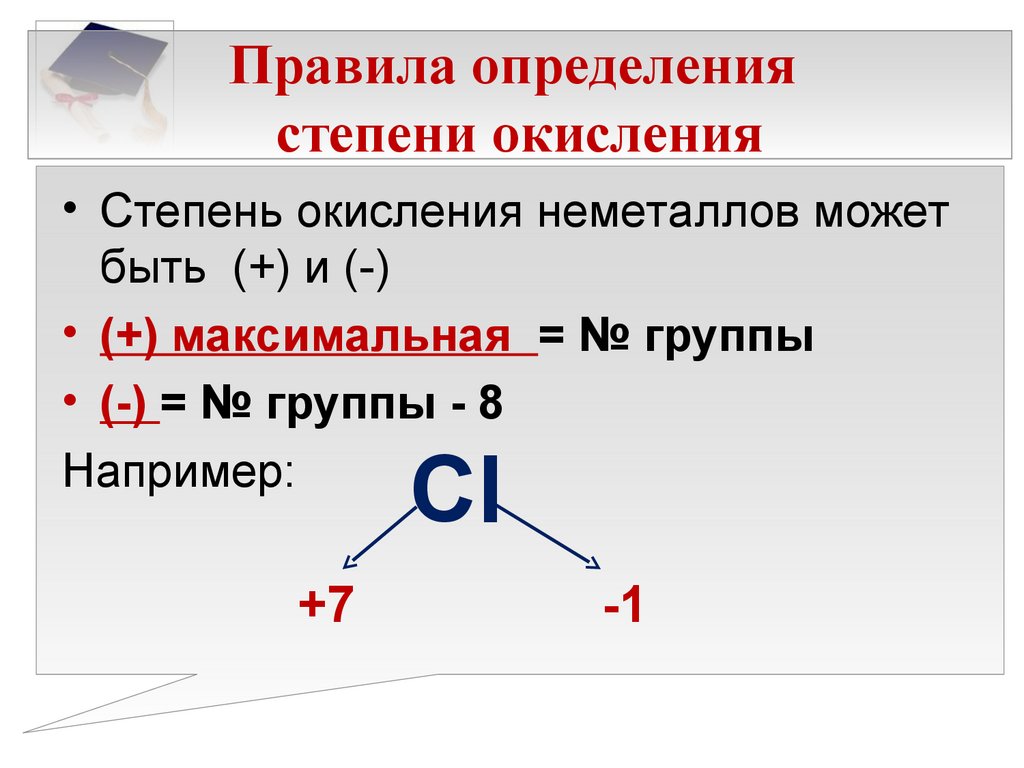
• Степень окисления неметаллов можетбыть (+) и (-)
• (+) максимальная = № группы
• (-) = № группы - 8
Например:
Cl
+7
-1
13.
Cl2
+14
+7
O
-2
7
-14 =0
В соединениях суммарная степень окисления
всегда равна нулю. Зная это и степень одного из
элементов, всегда можно найти степень окисления другого
элемента по формуле бинарного соединения. Например, найдём
степень окисления хлора в соединении Cl2O7. Обозначим
степень окисления кислорода: Cl2O7-2.Следовательно, семь
атомов кислорода будут иметь общий отрицательный заряд(2).7=-14. Тогда общий заряд двух атомов хлора будет равен+14, а
степень окисления одного атома:
(+14):2=+7
14.
Правило: алгебраическая сумма степеней окисления всложном ионе равна суммарному заряду этого иона.
(S2 O3-2)2Рассмотрим пример:
+4
-6
=-2
Обозначим степень окисления кислорода-2 .Три иона
кислорода будут иметь общий отрицательный заряд
(-2).3=-6. Тогда общий заряд двух ионов серы будет
равен+4, а одного иона (+4):2=+2
(S22+O3-2)2-
15. Бинарные соединения
• Бинарные соединения – этосоединения, состоящие из двух
химических элементов.
• При составлении формул бинарных
соединений на первом месте всегда
записывают элемент с положительной
степенью окисления, а на втором – с
отрицательной
16. Названия бинарных соединений
• На первом месте в названиибинарного соединения записывается
латинское название элемента с
отрицательной степенью окисления с
суффиксом -ид, а затем название
элемента с положительной степенью
окисления в родительном падеже.
17. Названия бинарных соединений.
Названия элементов с отрицательной степеньюокисления:
Cl ОНSNPСBr -
хлорид
оксид
гидрид
сульфид
нитрид
фосфид
карбид
бромид
18. Составление формул бинарных соединений по названию
оксид углерода (IV).1) Записать
символы
химических
элементов образующих соединение:
СО
19. Составление формул бинарных соединений по названию
оксид углерода (IV)2) Над атомами химических элементов
в соединении проставить их степени
окисления (в скобках указана
переменная степень окисления
элемента – она положительна):
+4
-2
СО
20. Составление формул бинарных соединений по названию
3) Найти наименьшее общее кратноемежду значениями степеней
окисления:
4
+4 -2
СО
21. Составление формул бинарных соединений по названию
4) Определить индексы, разделив НОКна значения степеней окисления
каждого элемента.
4
+4 -2
СО 2
Индекс «1» не пишут
СО2
- оксид углерода (IV)
22. Правило креста
Правило креста: для составления химическихформул по названию вещества надо записать
соответствующие знаки химических элементов
и указать степени окисления каждого из них.
Например, оксид алюминия - Al+3O-2. Затем по
«правилу креста» степень окисления кислорода
равна индексу у атома Al, а степень окисления
алюминия-индексу у атома O.
Al+3 O-2
2
Al2O3
3
23.
1)2)
3)
4)
a)
b)
c)
d)
e)
f)
Степень окисления простых веществ равна нулю
Например: S0, H02, Cl02, O02, Na0.
Максимальная (высшая) степень окисления равна + номер группы
(элемент на первом месте)
Например: P2+5O5 , S+6F6.
Если степень окисления переменная – будет указано в скобках.
Минимальная степень окисления равна – ( 8 – номер группы) (элемент на
втором месте)
Например: SCl2-1 , Li3P-3.
Постоянные степени окисления:
H +1 (кроме гидридов активных металлов, например:Na+1H-1)
O-2 (кроме O+2F2, H2O2-1,пероксидов металлов)
F-1
+1
металлы первой группы (кроме Cu, Au) –степень окисления
+2
металлы второй группы (кроме Hg) – степень окисления
+3
B и металлы третьей группы – степень окисления
24.
1)Расставьте
степени
окисления в
соединениях и в
ионах:
MgO
Zn
KNO3
HMnO4
CaSo3
Na3PO4
(CrO4)-2
(IO4)-
2) Составьте формулы
следующих соединений:
Хлорид железа(III)
Оксид серы(VI)
Гидрид калия
Нитрид бария
3) Назовите вещества,
представленные формулами:
P2O5
AgBr
CuS
NaH



















 Химия
Химия








