Похожие презентации:
Типы химических реакций в органической и неорганической химии
1.
Ермолаева Светлана АнатольевнаМБОУ СОШ №17
Г.Узловая Тульская обл.
2012
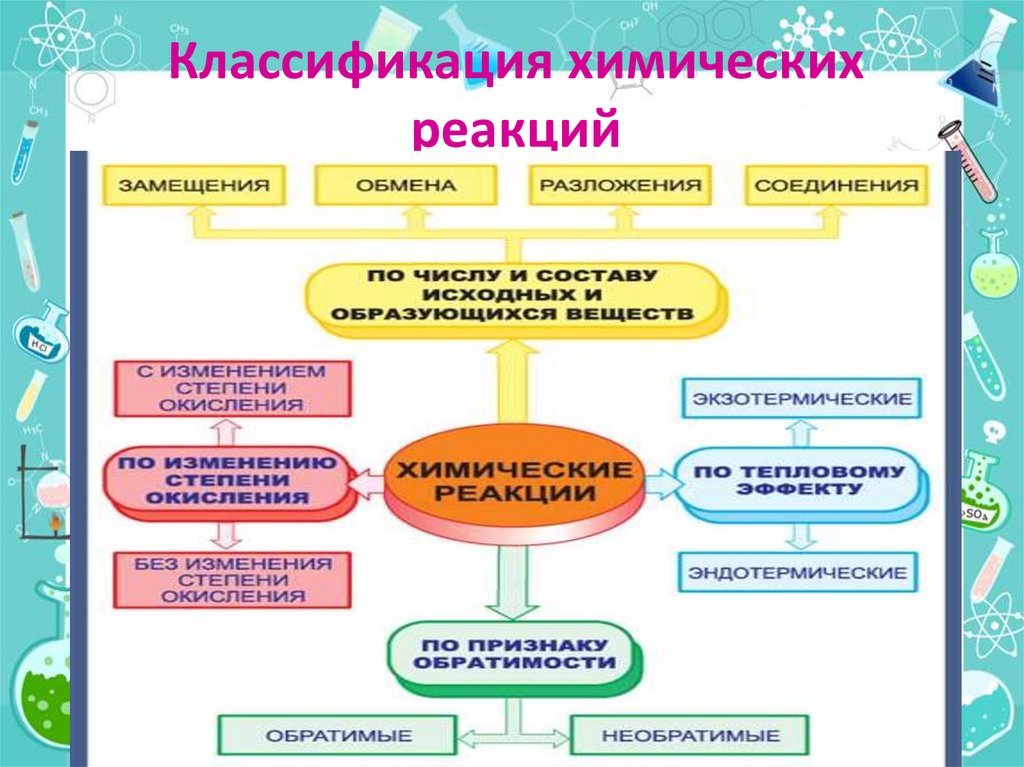
2. Классификация химических реакций
3.
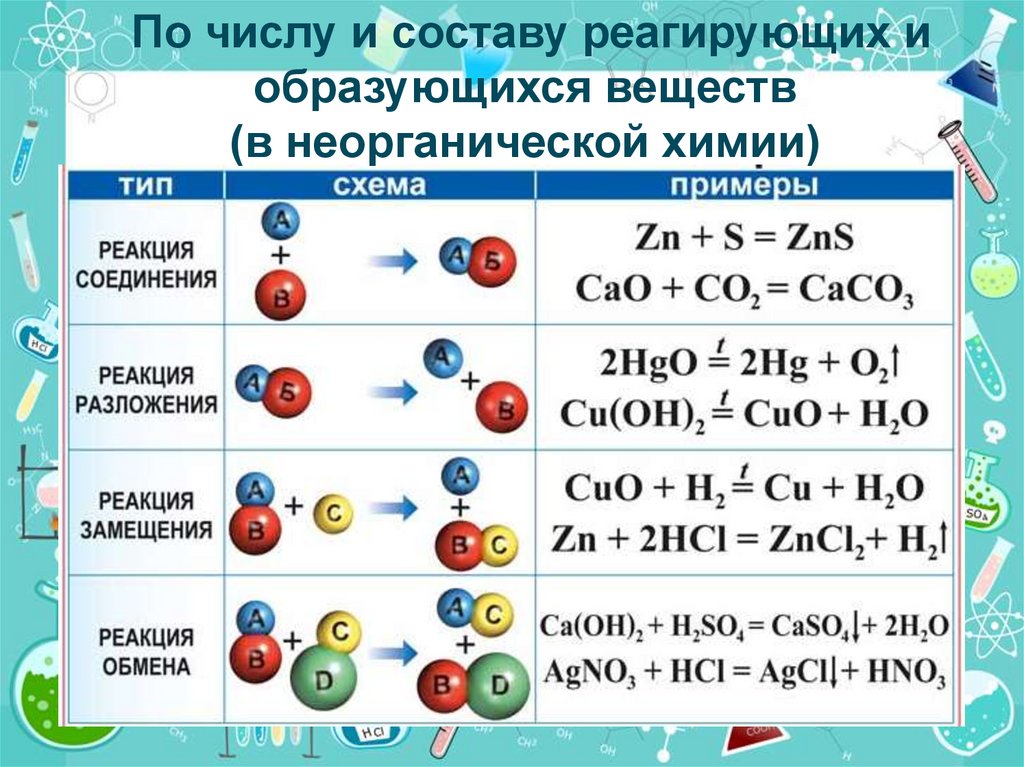
По числу и составу реагирующих иобразующихся веществ
(в неорганической химии)
4.
По числу и составу реагирующих иобразующихся веществ
(в органической химии)
ТИП
РЕАКЦИЯ
ЗАМЕЩЕНИ Я
РЕАКЦИЯ
ПРИСОЕДИНЕНИЯ
РЕАКЦИЯ
ОТЩЕПЛЕНИЯ
РЕАКЦИЯ
ПЕРЕГРУППИРОВКИ
ПРИМЕРЫ
СН4 + Сl2
CH2=CH2 + Br2
CH3 – CH3
CH3Cl + HCl
CH2Br-CH2Br
CH2=CH2 + H2
CH3 – CH2– CH2 – CH3
CH3 – CH2( CH3) – CH3
5. По изменению степени окисления
ТИППРИМЕРЫ
Окислительно-
0 0
+2-2
2Cu + O2 = 2CuO
-2+1 -2+1 0
-1+1-1 -1+1-1
CH2=CH2 + Br2
CH2Br-CH2Br
+2 -2+1
+2-2 +1-2
Сu(OH)2 = CuO + H2O
-3+1 -1+1 -1 +1-2+1
CH3 – CH2– Cl + NaOH
-3+1 -1+1 -2+1 +1-1
CH3 – CH2 – OH + NaCl
восстановительные
реакции
Не окислительновосстановительные
реакции
6. По тепловому эффекту
ТИППРИМЕРЫ
Экзотермические
CaO + H2O = Ca(OH)2 +Q
CH2=CH2 + O2
Эндотермические
CO2 + H2O + Q
HgO = Hg + O2 - Q
СН4 + Сl2
CH3Cl + HCl - Q
7. По обратимости
ТИПОбратимые
ПРИМЕРЫ
NH3
CH2=CH2 + Н2
Необратимые
N2 + H2
CH3-CH3
Cu + 2AgNO3 = Ag + Cu(NO3)2
CH3 – COOH + NaOH
CH3 – COONa + H2O





 Химия
Химия








