Похожие презентации:
Нитрофенилалкиламины
1.
Нитрофенилалкиламины1
2.
Впервые в 1947 г. из почвы Венесуэлы былвыделен хлорамфеникол – антибиотик широкого
спектра действия
В 1949 г была установлена его структура и
осуществлен синтез в США
В 1950 г в нашей стране под руководством
Шемякина был получен рацемат – синтомицин,
из которого был выделен левовращающий
изомер D( )-трео-изомер – левомицетин,
полностью соответствуетствующий природному
антибиотику хлорамфениколу
2
3.
Хлорамфеникол (Chloramphenicolum)Левомицетин
OH
O2N
*CH *CH
NH
CH2OH
C
CHCl2
O
D( )-трео-1-n-нитрофенил-2-дихлорацетиламинопропандиол-1,3
3
4.
Хлорамфеникола стеарат(Chloramphenicolum Stearatum)
OH
O2N
O
*CH *CH
NH
CH2
C
O
CHCl2
C
CH2
CH3
16
O
D( )-трео-1-n-нитрофенил-2-дихлорацетиламинопропандиола-1,3-3-стеарат
4
5.
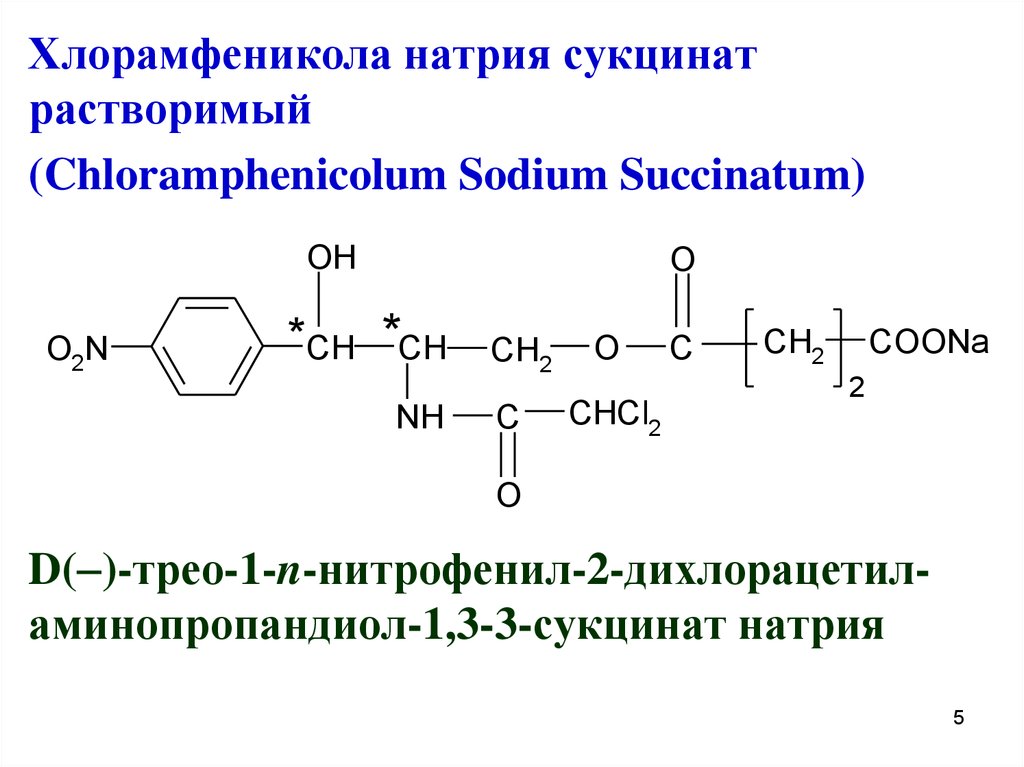
Хлорамфеникола натрия сукцинатрастворимый
(Chloramphenicolum Sodium Succinatum)
OH
O2N
O
*CH *CH
NH
CH2
C
O
CHCl2
C
CH2
COONa
2
O
D( )-трео-1-n-нитрофенил-2-дихлорацетиламинопропандиол-1,3-3-сукцинат натрия
5
6.
Физические свойстваХлоамфеникол и хлорамфеникола стеарат –
белые или белые с желтовато-зеленоватым
оттенком
Хлорамфеникол – крист. порошок горького
вкуса, без запаха. м.р. воде, л.р. спирте
Хлорамфеникола стеарат – порошок без вкуса и
запаха, п.н.р. воде, р. спирте, хлф, эфире с
образованием мутных растворов
6
7.
Хлорамфеникола натрия сукцинат - пористаямасса белого или со слегка желтоватым цветом
горького вкуса со слабым специфическим
запахом, л.р. воде, м.р. спирте
В структуре хлорамфеникола имеется два
ассиметрических атома углерода, п/э возможно
существование 4-х пространственных изомеров
По характеру конфигурации асс. атома С в
положении 1 оптически активные соединения
относят к D- или L-ряду
7
8.
NO2R
NO2
H
C
OH
HN
C
H
CH2OH
NO2
HO
C
H
H
C
H
CH2OH
D( )L(+)
-трео- изомеры
R
NO2
H
C
OH
H
C
H
CH2OH
R R
HO
C
H
HN
C
H
CH2OH
D( )L(+)эритро-изомеры
8
9.
Т.е., если соединение имеет конфигурацию,подобную d-глицериновому альдегиду, то его
относят к D-ряду, если – l-глиц. альдегиду, то к
L-ряду
H
O
H
C
H
C
O
C
OH
CH2OH
HO
C
H
CH2OH
Однако оптическая активность зависит от всех
асс. ат. С, п/э как в L-, так и в D-ряду м.б.
правовращающие (+) и левовращающие ( )
9
изомеры
10.
Изомеры хлорамфениколаD( )-трео-изомер – природный
L(+)-трео-изомер - фармакологически
неактивное в-во
Смесь D( )- и L(+)-трео-изомеры – синтомицин,
обладающий 50% биологической активностью
хлорамфеникола
D( )- и L(+)-эритро-изомеры – токсичные в-ва
10
11.
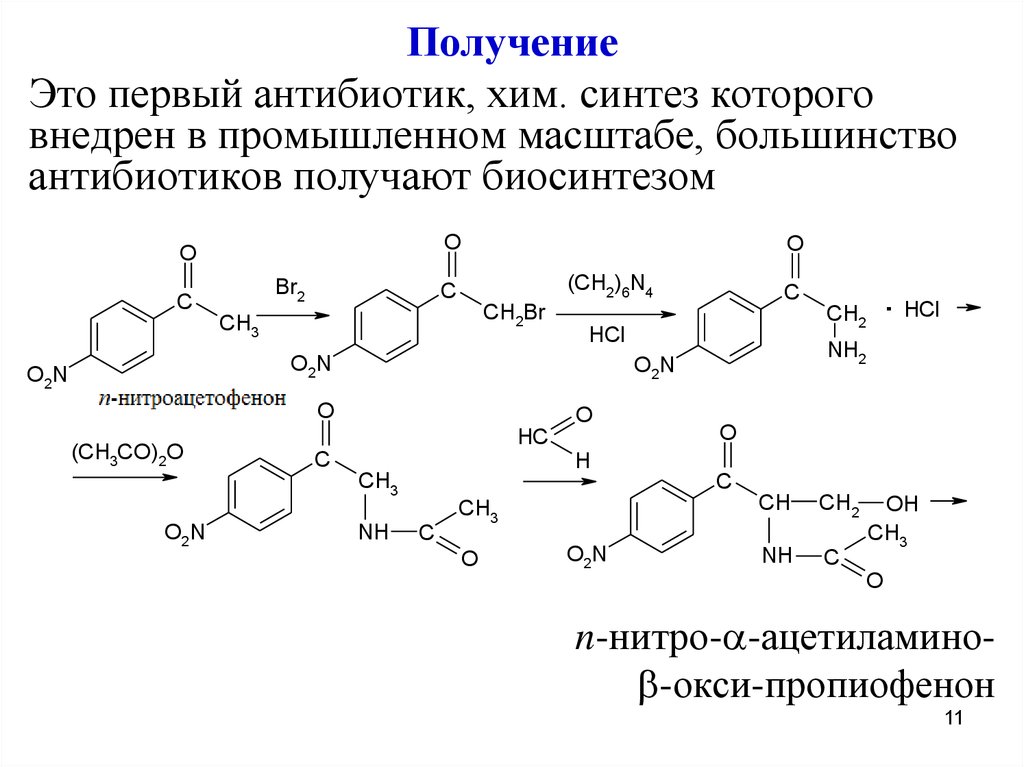
ПолучениеЭто первый антибиотик, хим. синтез которого
внедрен в промышленном масштабе, большинство
антибиотиков получают биосинтезом
O
O
Br2
C
O
(CH2)6N4
C
CH2Br
CH3
O
HC
C
NH
O
H
CH3
O2N
. HCl
NH2
O2N
O
(CH3CO)2O
CH2
HCl
O2N
O2N
C
C
C
CH3
O
O2N
CH
CH2
NH
C
OH
CH3
O
n-нитро- -ацетиламино -окси-пропиофенон
11
12.
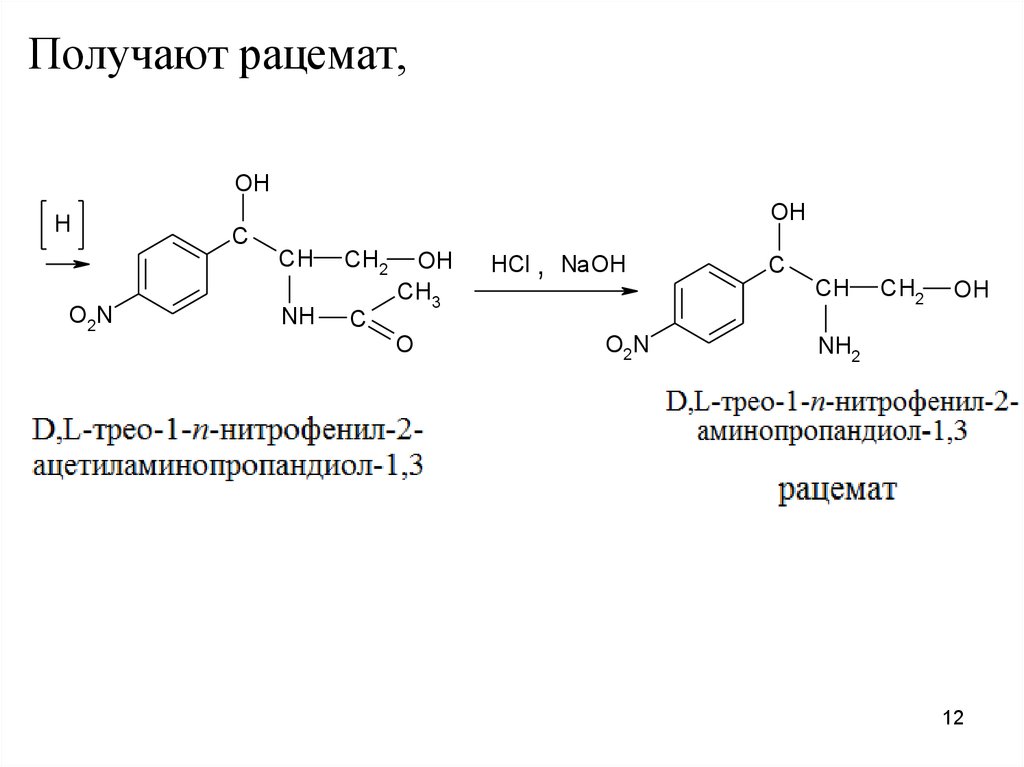
Получают рацемат,OH
H
OH
C
CH
O2N
NH
CH2
C
OH
CH3
O
HCl , NaOH
O2N
C
CH
CH2
OH
NH2
12
13.
который разделяют на оптические антиподыпоследовательной перекристаллизацией водных
растворов и на D-изомер действуют метиловым
эфиром дихлоруксусной кислоты
OH
OH
C
O2N
CH
CH2
OH
NH2
H3C
O
C
C
O
_ CH OH
3
CHCl2
O2N
CH
CH2
NH
C
OH
CHCl2
O
13
14.
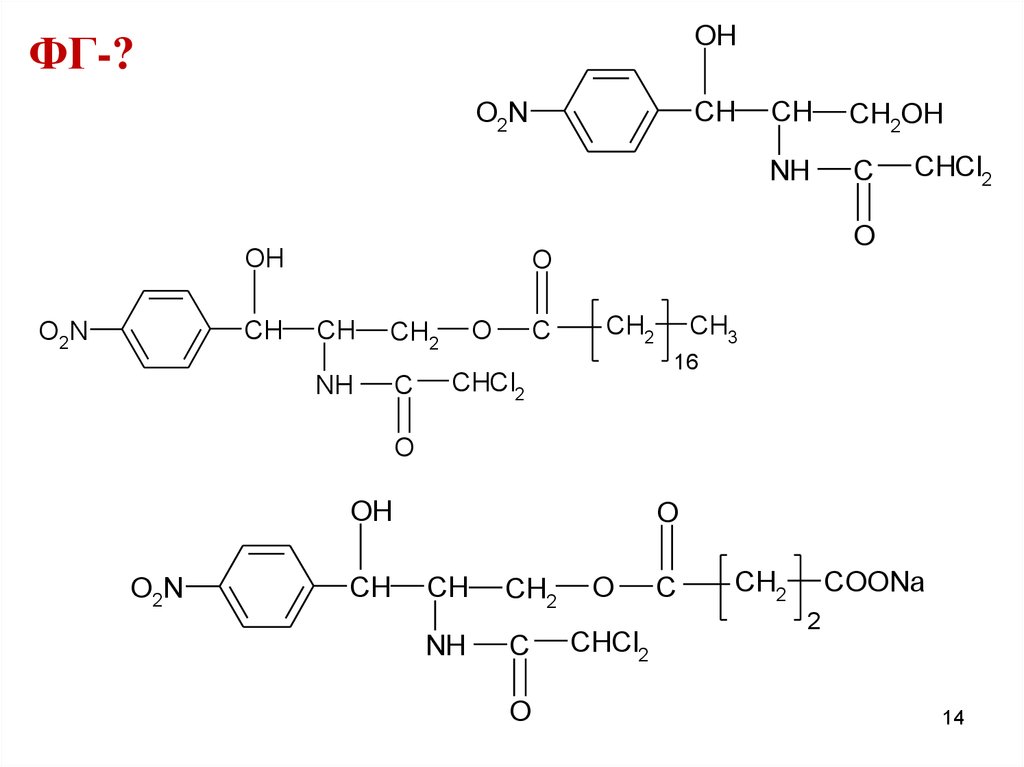
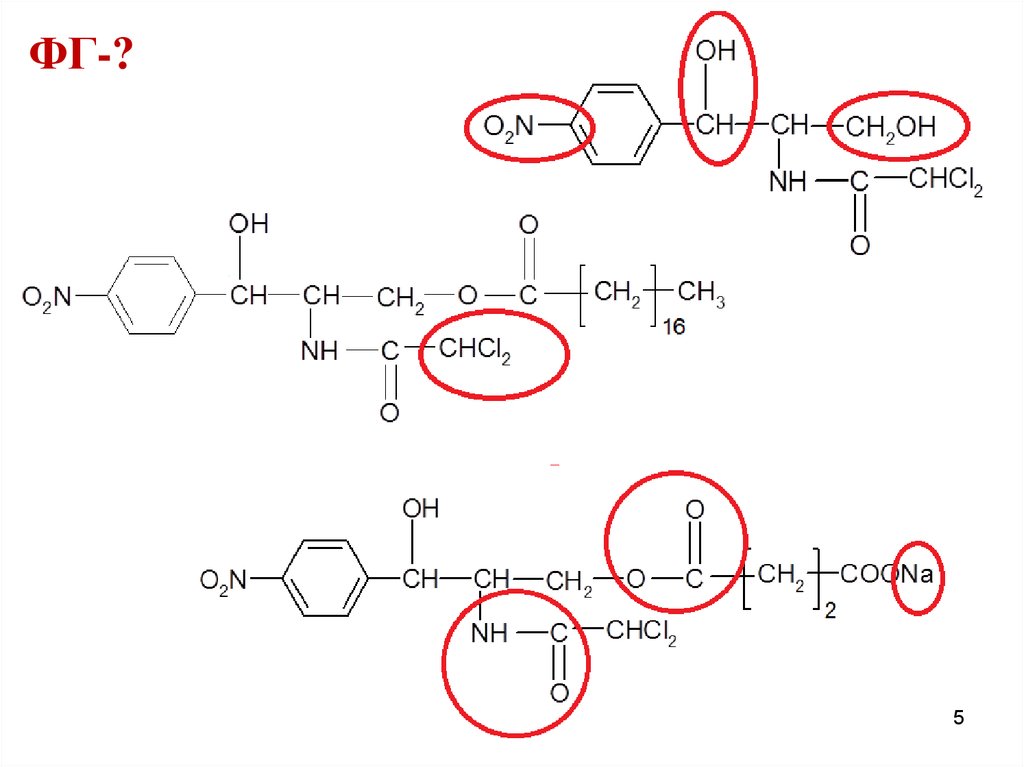
OHФГ-?
CH
O2N
OH
CH
O2N
CH
CH2OH
NH
C
O
O
CH
O
CH2
NH
C
C
CHCl2
CH2
CH3
16
CHCl2
O
OH
O2N
CH
O
CH
NH
CH2
C
O
O
CHCl2
C
CH2
COONa
2
14
15.
ФГ-?15
16.
ФГ ароматическая аминогруппаамидная группа
ковалентно связанный хлор
втор. и перв. спиртовые гидроксилы
сложноэфирная группа
ион натрия
16
17.
Физико-химические свойства1. Определяют Т плавления (хлорамфеникол и
хлорамфеникола стеарат)
2. Определяют величину удельного вращения
(поляриметрия) – левовращающие изомеры
3. СПФ в УФ-области спектра (кето-группа,
бензольное кольцо)
4. ИК, ВЭЖХ
17
18.
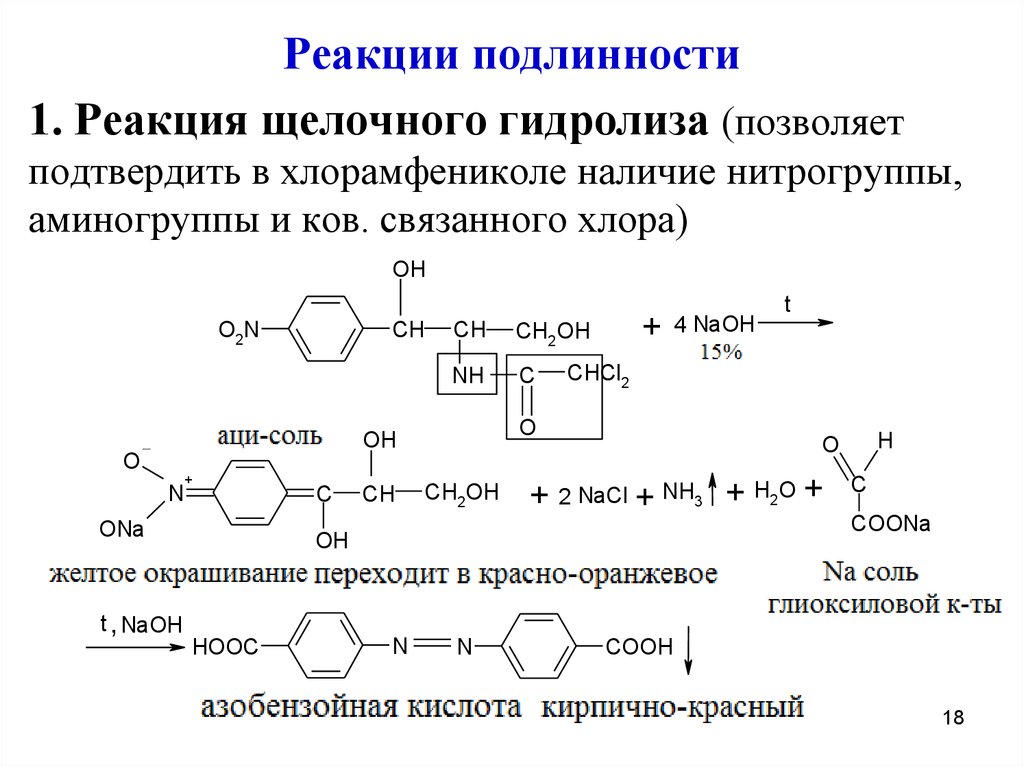
Реакции подлинности1. Реакция щелочного гидролиза (позволяет
подтвердить в хлорамфениколе наличие нитрогруппы,
аминогруппы и ков. связанного хлора)
OH
CH
O2N
CH
CH2OH
NH
C
+
CHCl2
O
OH
+
ONa
C
CH
CH2OH
+ 2 NaCl + NH3 + H2O +
OH
t , NaOH
HOOC
N
N
H
O
O
N
4 NaOH
t
C
COONa
COOH
18
19.
Образование азосоединения можно объяснитьдиспропорционированием хлорамфеникола. При
этом спиртовые группы окисляются, а нитрогруппа восстанавливается
Запах аммиака доказывает наличие аминогруппы
В фильтрате после подкисления азотной
кислотой определяют хлорид-ионы
Хлорамфеникола стеарат при нагревании с
15% р-ром NaOH приобретает желтое
окрашивание переходящее в красно-оранжевое
19
20.
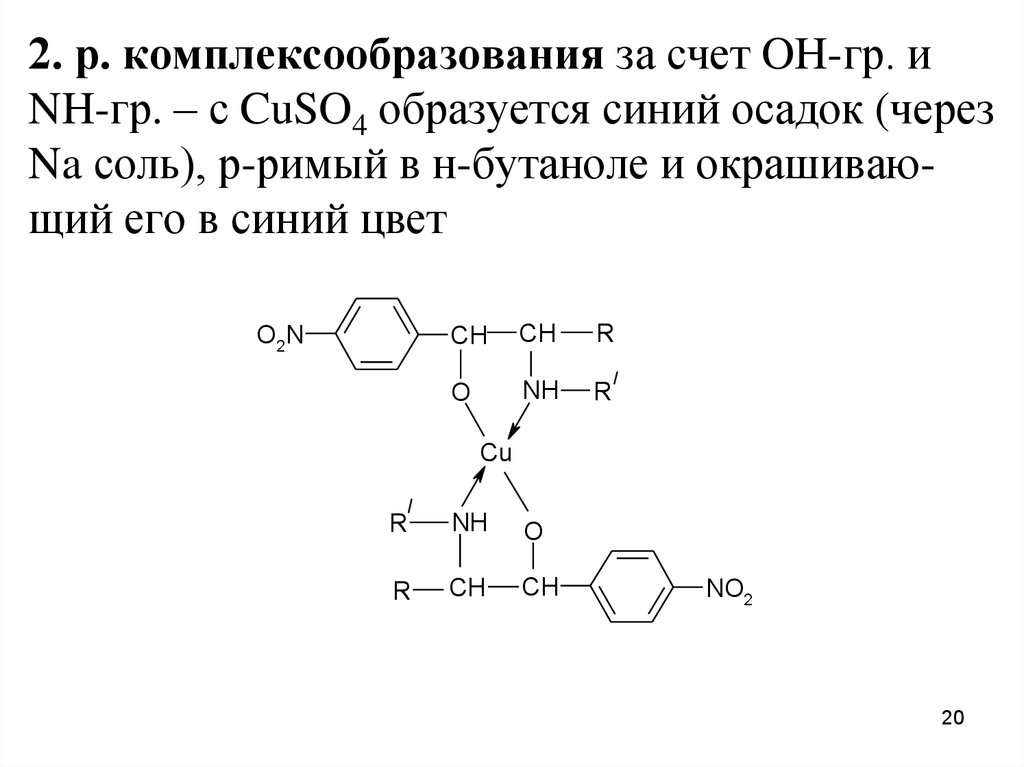
2. р. комплексообразования за счет OH-гр. иNH-гр. – с CuSO4 образуется синий осадок (через
Na соль), р-римый в н-бутаноле и окрашивающий его в синий цвет
O2N
CH
CH
R
O
NH
R
Cu
R
NH
O
R
CH
CH
NO2
20
21.
3. р. гидрирования нитрогруппы до аминогруппы (Zn пылью в кислой среде), одновременно идет минерализация по атому хлораOH
O2N
CH
CH
CH2OH
NH
C
Zn , HCl
CHCl2
O
OH
H2N
CH
CH
CH2OH +
NH
C
ZnCl2
CH3
O
21
22.
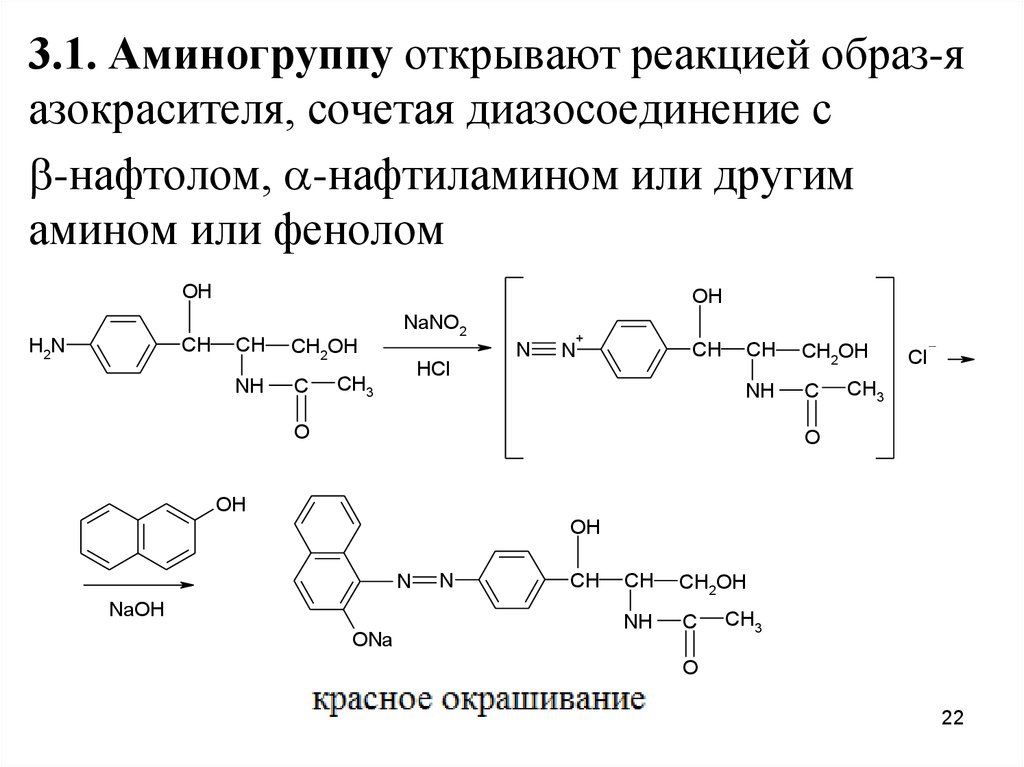
3.1. Аминогруппу открывают реакцией образ-яазокрасителя, сочетая диазосоединение с
-нафтолом, -нафтиламином или другим
амином или фенолом
OH
CH
H2N
OH
CH
NH
NaNO2
CH2OH
C
N
+
CH
N
CH
CH2OH
NH
C
HCl
CH3
O
Cl
CH3
O
OH
OH
N
NaOH
ONa
N
CH
CH
CH2OH
NH
C
CH3
O
22
23.
3.2. также образовавшееся аминосоединениеоткрывают n-диметилбензальдегидом
ярко-оранжевая соль основания Шиффа
23
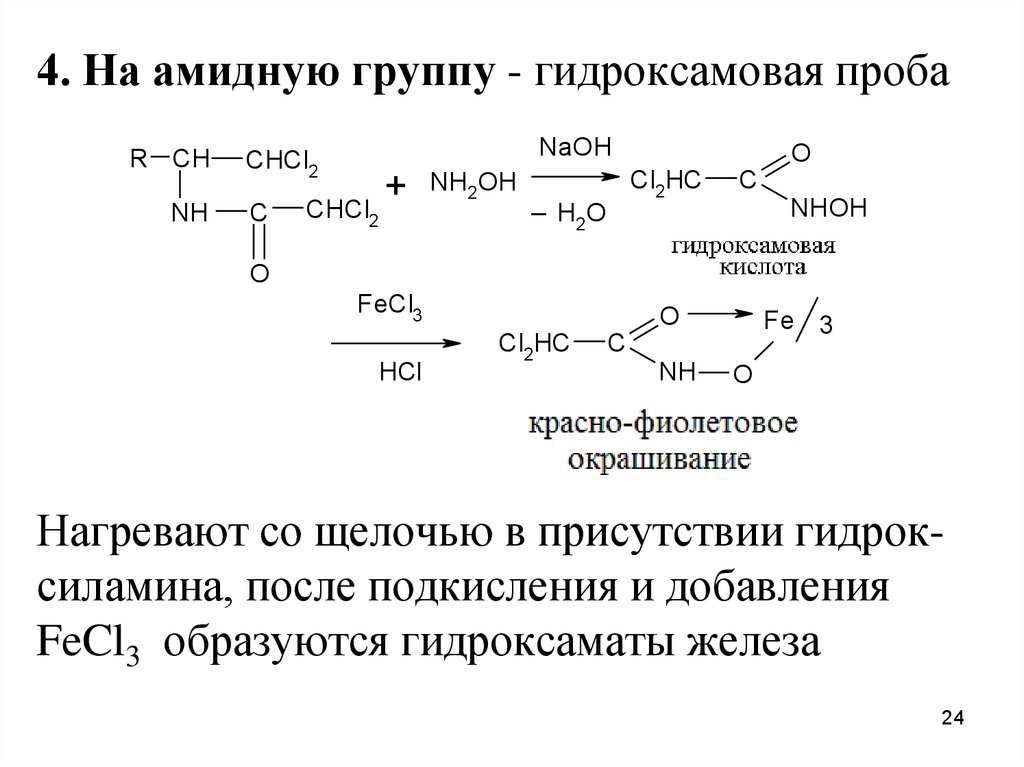
24.
4. На амидную группу - гидроксамовая пробаR CH
NH
NaOH
CHCl2
C
CHCl2
+
NH2OH
O
Cl2HC
_ HO
2
C
NHOH
O
FeCl3
HCl
O
Cl2HC
Fe 3
C
NH
O
Нагревают со щелочью в присутствии гидроксиламина, после подкисления и добавления
FeCl3 образуются гидроксаматы железа
24
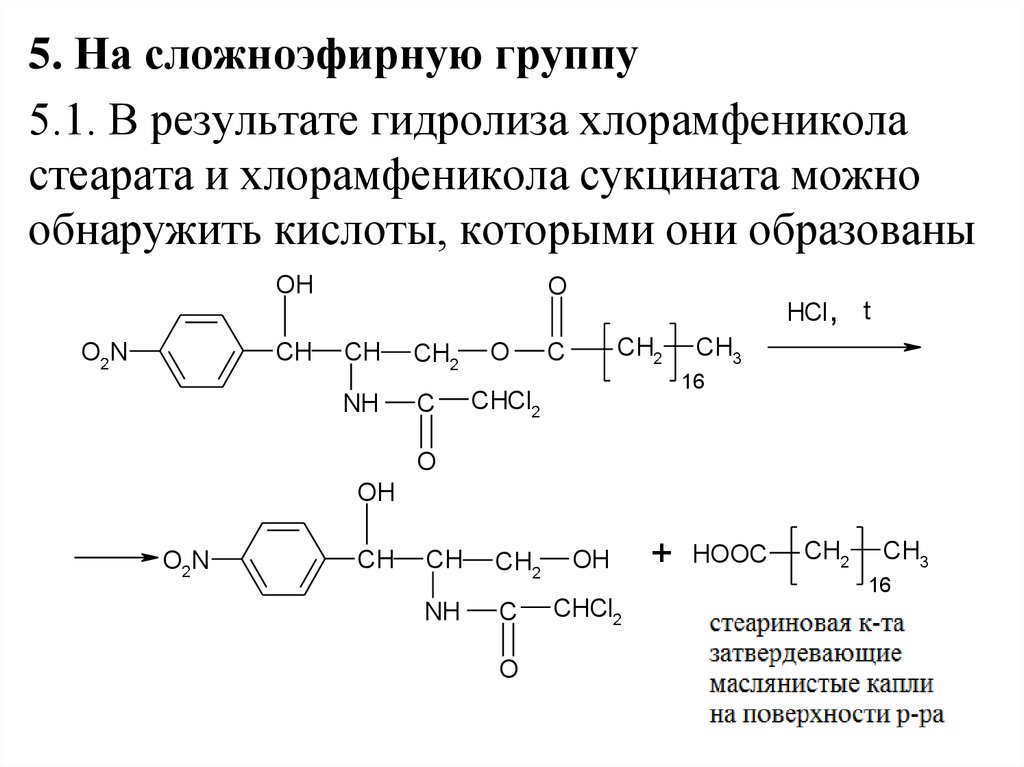
25.
5. На сложноэфирную группу5.1. В результате гидролиза хлорамфеникола
стеарата и хлорамфеникола сукцината можно
обнаружить кислоты, которыми они образованы
OH
CH
O2N
O
CH
NH
CH2
C
O
HCl , t
CH2
C
CH3
16
CHCl2
O
OH
O2N
CH
CH
NH
CH2
C
OH
+
HOOC
CH2
CH3
16
CHCl2
O
25
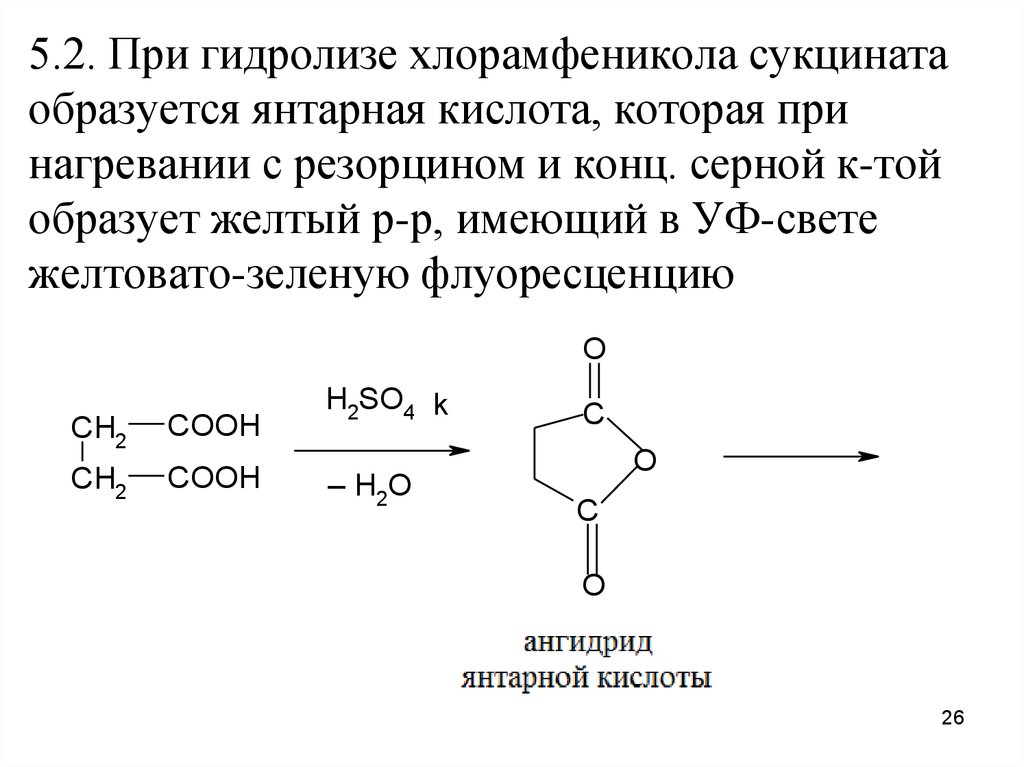
26.
5.2. При гидролизе хлорамфеникола сукцинатаобразуется янтарная кислота, которая при
нагревании с резорцином и конц. серной к-той
образует желтый р-р, имеющий в УФ-свете
желтовато-зеленую флуоресценцию
O
CH2
COOH
CH2
COOH
H2SO4 k
_HO
2
C
O
C
O
26
27.
Образование флуоресцеинаO
C
O
C
+
2
HO
OH
_ 2 HO
2
O
O
O
C
C ONa
NaOH
O
_
C
HO
O
OH
C
2H
HO
O
O
27
28.
6. Na+ – желтое окрашивание пламени– р-ция с цинкуранилацетатом
7. Проба Бейльштейна
28
29.
ПримесиВ хлорамфениколе определяют избыточную
кислотноть (ЛВ р-рют в нейтрализованном по
ф/ф спирту, перемешивают, фильтруют – к
фильтрату + ф/ф и NaOH р-р д. окраситься в
розовый цвет, не исчезающий 3 минуты)
В хлорамфеникола стеарате определяют
свободную стеариновую к-ту (доп) титрованием
NaOH по ф/ф
В хлорамфеникола сукцинате – свободный
хлорамфеникол (доп) методом диффузии в агар,
устанавливая антимикробную активность
29
30.
Количественное определение1. после восстановления цинком в кислой среде
OH
CH
O2N
CH
CH2OH
NH
C
+ 5 Zn + 8 HCl
CHCl2
O
OH
H2N
CH
CH
CH2OH
NH
C
+ 5 ZnCl2 + 2 H2O
CH3
O
30
31.
о1.1. нитритометрия (при Т 20 во избежание
разложения соли диазония и потерь азотистой к-ты)
+
NH2
N
+
R
NaNO2
+
N
KBr
+
2 HCl
NaCl
+
2 H2O
R
2HNO2 + 2KI + 2HCl I2 + 2KCl + 2NO + 2H2O
Ind – иодкрахмальная бумага, титруют до появления
синего окрашивания, KBr - катализатор
fэкв(хламф) = 1
31
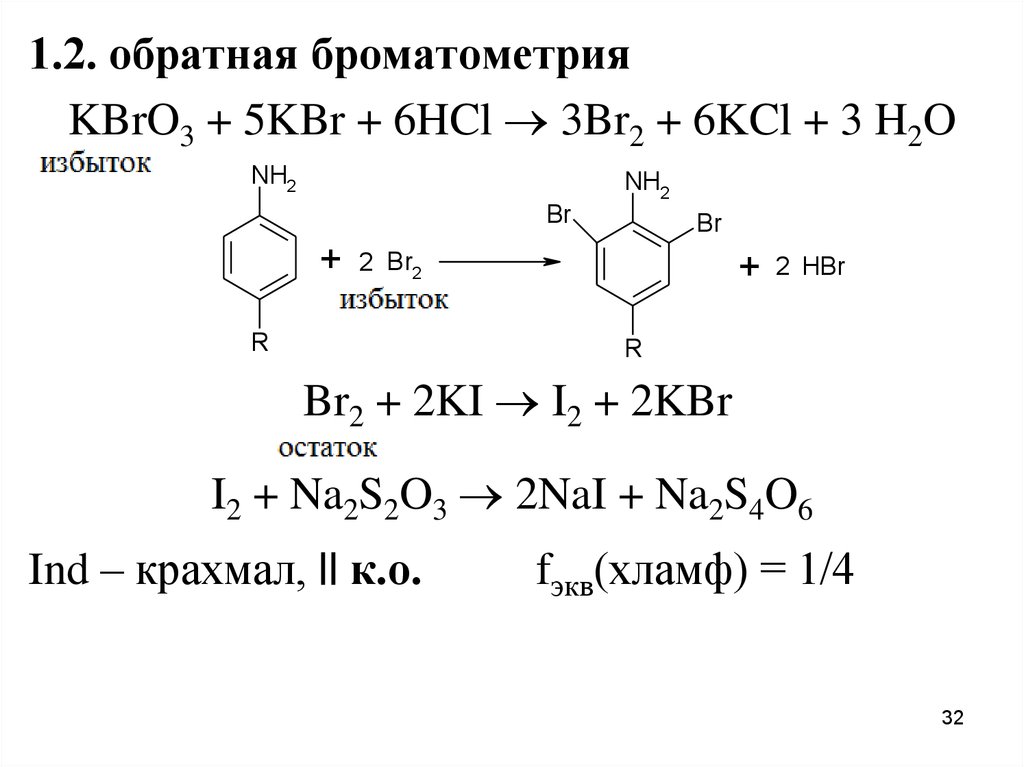
32.
1.2. обратная броматометрияKBrO3 + 5KBr + 6HCl 3Br2 + 6KCl + 3 H2O
NH2
NH2
Br
+
Br
+
2 Br2
R
2 HBr
R
Br2 + 2KI I2 + 2KBr
I2 + Na2S2O3 2NaI + Na2S4O6
Ind – крахмал, || к.о.
fэкв(хламф) = 1/4
32
33.
2. Прямое куприметрическое титрованиеНавеску р-ют в воде, добавляют NaOH и
титруют сульфатом меди по мурексиду до
фиолетовой окраски, || к.о., fэкв(хламф) = 2
3. После минерализации в щелочной среде
R-NH-CO-CHCl2 + H2O2 + 4NaOH
R-NH2 + 2NaCl + Na2C2O4 + 3H2 O
33
34.
3. После минерализации в щелочной средеR-NH-CO-CHCl2 + H2O2 + 4NaOH
R-NH2 + 2NaCl + Na2C2O4 + 3H2 O
3.1. Аргентометрия (подкисл-е, м-д Фольгарда)
3.2. Меркуриметрия
fэкв(хламф)=1/2, (на 1 моль хламф – 2 моль т-нта)
ДЗ: написать химизм 2 и 3 методов см
34
35.
4. СПФ (сукцинат и стеарат)5. ФЭК (р-ция с сульфатом меди)
Хранение
Список Б, в ХУТ, защищенном от света месте
Хл. сукцинат – гигроск. в-во, защищают от
влаги (гидролиз по сложноэфирной и амидной
группам)
Применение
Для лечения инфекционных заболеваний
35
36.
Хлорамфеникол хорошо всасывается из ЖКТФВ: 0,25 и 0,5 г – таблетки
0,25% р-р – глазные капли
0,25-1-3-5% спирт. р-ры для наруж. применения
Хл. стеарат применяется в детсткой практике,
когда введение хлорамфеникола затруднено
из-за горького вкуса
ФВ: порошок, таблетки 0,25 г, суспензия 5%
Хл. сукцинат – внутрь (тб, капсулы) или в/в, в/м
36
37.
Аминодибромфенилалкиламины37
38.
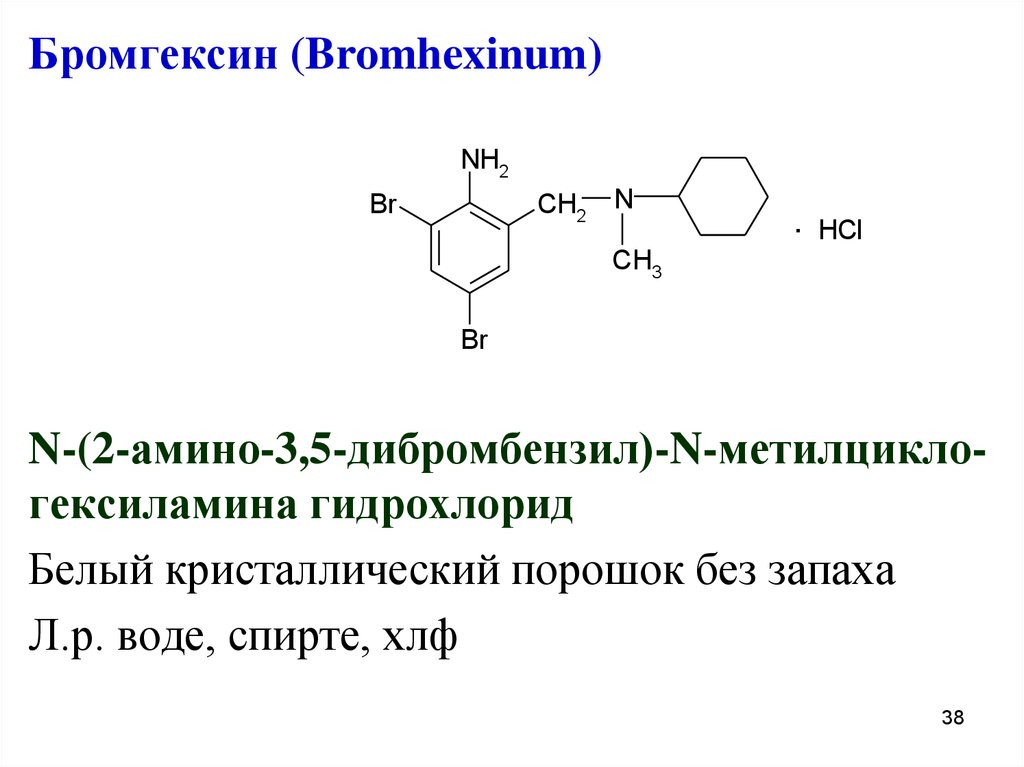
Бромгексин (Bromhexinum)NH2
CH2
Br
N
.
HCl
CH3
Br
N-(2-амино-3,5-дибромбензил)-N-метилциклогексиламина гидрохлорид
Белый кристаллический порошок без запаха
Л.р. воде, спирте, хлф
38
39.
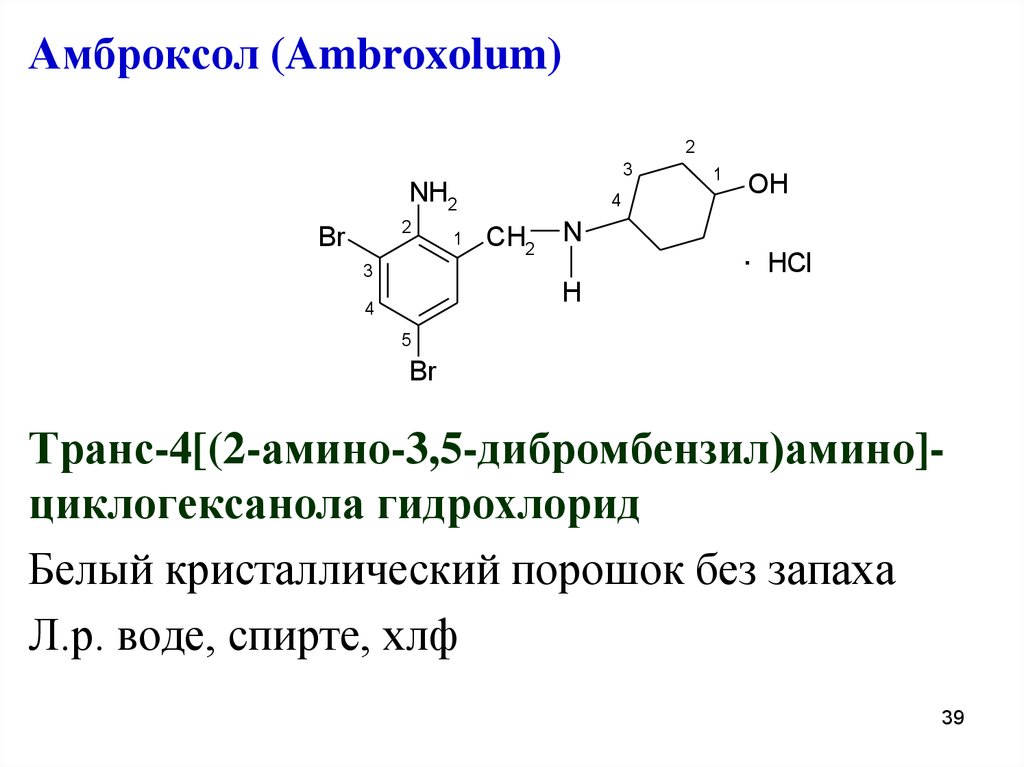
Амброксол (Ambroxolum)2
3
NH2
2
Br
1
4
CH2
N
3
1
OH
.
HCl
H
4
5
Br
Транс-4[(2-амино-3,5-дибромбензил)амино]циклогексанола гидрохлорид
Белый кристаллический порошок без запаха
Л.р. воде, спирте, хлф
39
40.
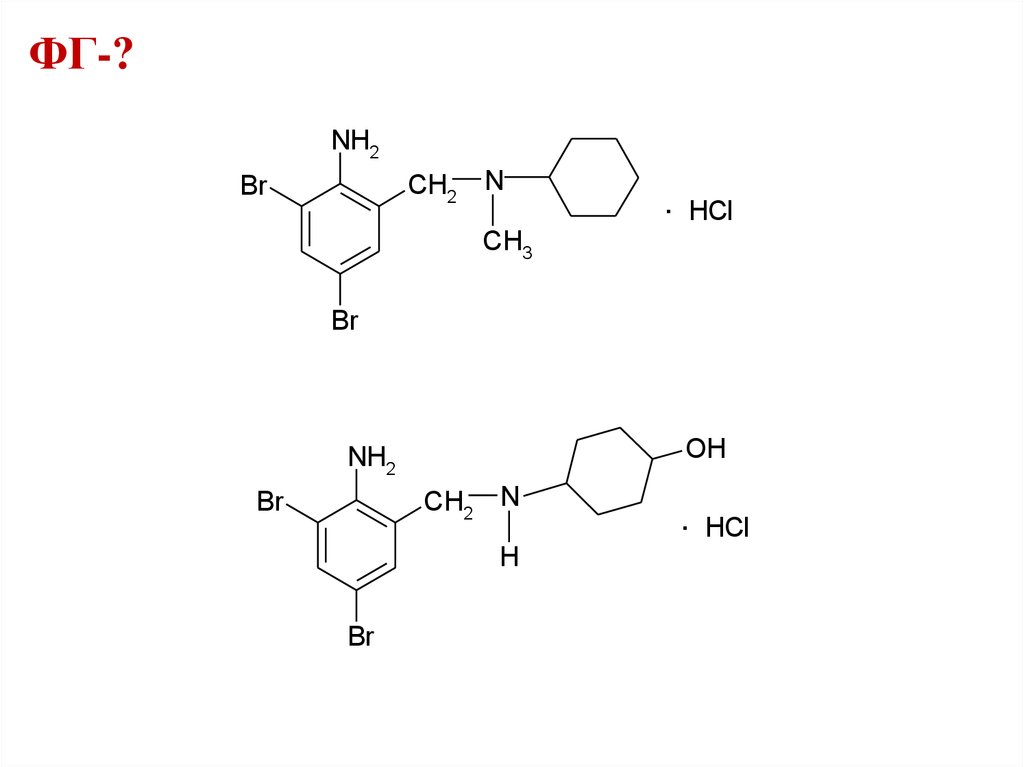
ФГ-?NH2
CH2
Br
N
.
HCl
CH3
Br
OH
NH2
CH2
Br
N
H
Br
.
HCl
41.
ФГ-?42.
ФГ-?ковалентно связанный бром
ароматическая аминогруппа
вторичный и третичный атомы азота
хлорид-ион
43.
Качественный анализ1. Определяют Т плавления
2. СПФ в УФ-области спектра ( бензольное
кольцо)
3. ТСХ
44.
Реакции подлинности1. На ароматическую аминогруппу
1.1. образование азокрасителя (после р. диазотирования с -нафтолом) красное окрашивание
1.2. реакция с n-диметилбензальдегидом яркооранжевая соль основания Шиффа
2. На вторичный и третичный атом азота –
реакция с общеалкалоидными реактивами,
например, реактивом Драгендорфа K[BiI4]
оранжевый осадок
Наличие третичного атома N можно установить
нагреванием с лимонной кислотой в уксусном
ангидриде красно-фиолетовое окрашивание
45.
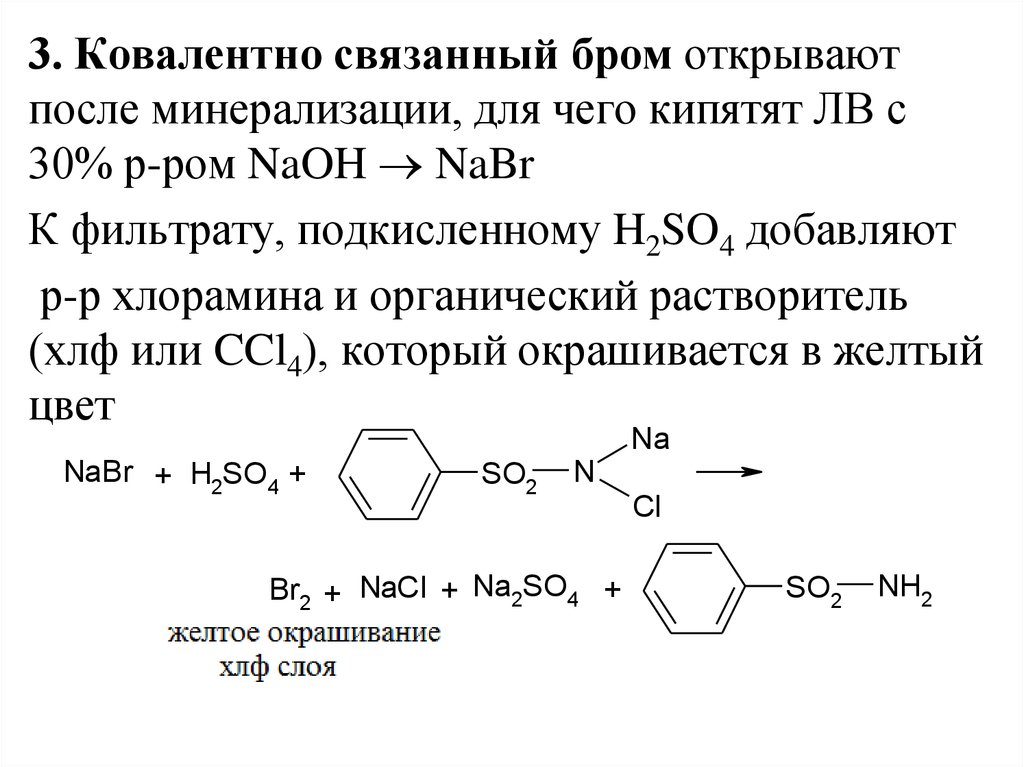
3. Ковалентно связанный бром открываютпосле минерализации, для чего кипятят ЛВ с
30% р-ром NaOH NaBr
К фильтрату, подкисленному H2SO4 добавляют
р-р хлорамина и органический растворитель
(хлф или CCl4), который окрашивается в желтый
цвет
Na
NaBr + H2SO4 +
SO2
N
Br2 + NaCl + Na2SO4 +
Cl
SO2
NH2
46.
ПримесиОпределение посторонних примесей проводят
методом ТСХ, сравнивая полученные на
плстинке хроматограммы испытуемого и
стандартного образцов
47.
Количественное определение1. Неводное титрование
Титрант – 0,1 н. хлорная к-та
Среда – уксусный ангидрид
Ind – крист.фиолет. или потенциометрически
2. По HCl
2.1. Алкалиметрия
Ind – ф/ф, в присутствии органического
растворителя
48.
2.2. Аргентометрия2.3. Меркуриметрия
3. По аминогруппе – нитритометрия
4. Метод сжигания в колбе с кислородом
Т.к. в растворе будут присутствовать хлоридионы, то перед сжиганием основание осаждают
щелочью и фильтруют. Фильтрат промывают до
отрицательной р-ции на Cl ,
После сжигания в поглощающей жидкости
определяют Br
5. СПФ, ФЭК , ГЖХ, ВЭЖХ
ДЗ: Написать химизм титримет-ких методов
49.
ХранениеСписок Б, в сухом, защищенном от света месте
Применение
Муколитические средства
ФВ: Тб, драже по 8 мг - бромгекседина г/хл
по 30 мг - амброксола г/хл
Сироп, микстуры
Р-р для ингаляций (амброксола г/хл)

































 Химия
Химия








