Похожие презентации:
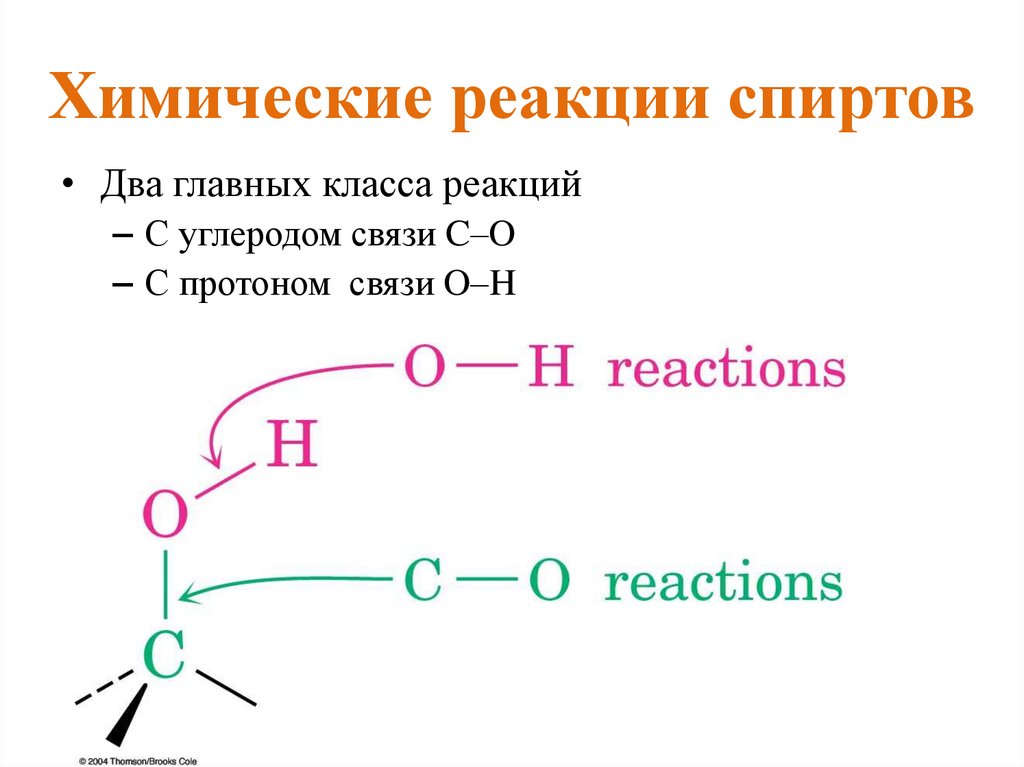
Химические реакции спиртов
1.
Химические реакции спиртов• Два главных класса реакций
– С углеродом связи C–O
– С протоном связи O–H
2.
3.
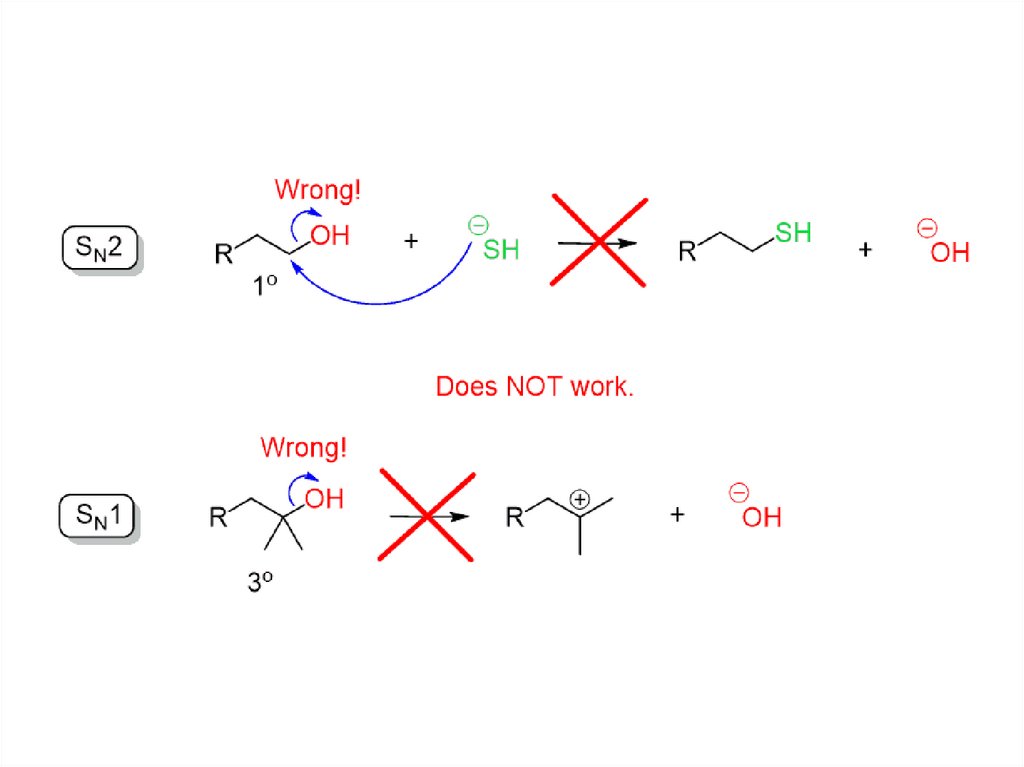
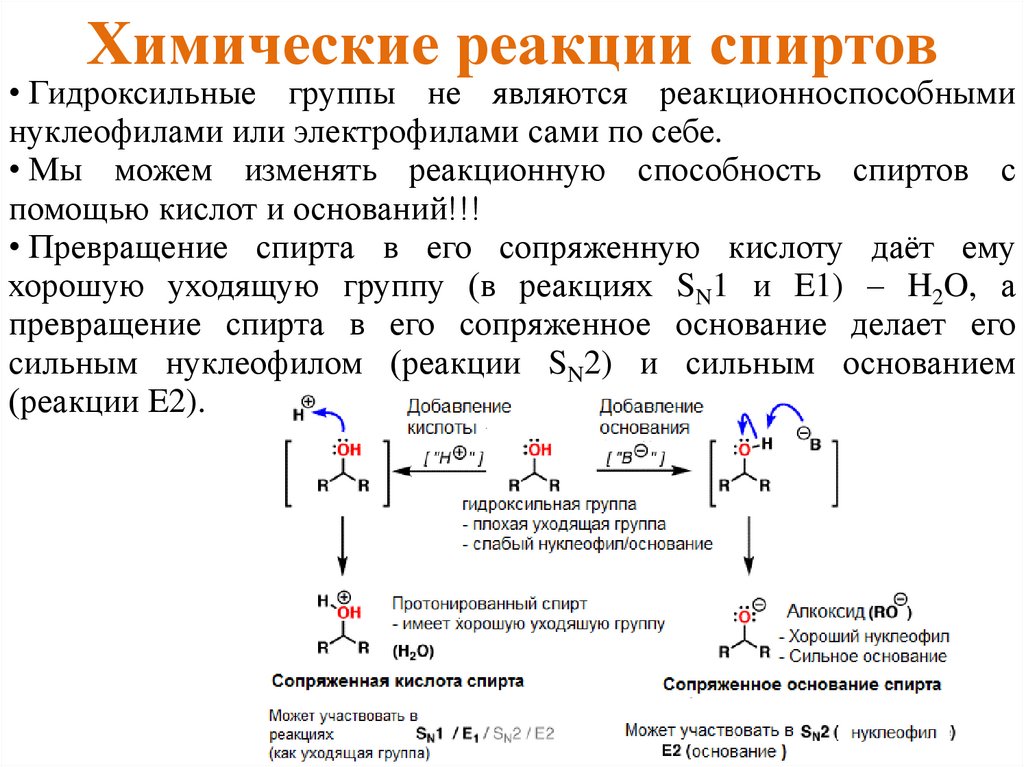
Химические реакции спиртов• Гидроксильные группы не являются реакционноспособными
нуклеофилами или электрофилами сами по себе.
• Мы можем изменять реакционную способность спиртов с
помощью кислот и оснований!!!
• Превращение спирта в его сопряженную кислоту даёт ему
хорошую уходящую группу (в реакциях SN1 и E1) – H2O, а
превращение спирта в его сопряженное основание делает его
сильным нуклеофилом (реакции SN2) и сильным основанием
(реакции E2).
4.
Кислотные свойства спиртов• Спирты реагируют с щелочными металлами (также с NaH,
NaNH2, и реактивами Гриньяра (RMgX) с образованием анионов
алкоксидов – сильных оснований, часто используемых для
реакций элиминирования (отщепления).
С щелочами:
ROH + NaOH нет реакции
5.
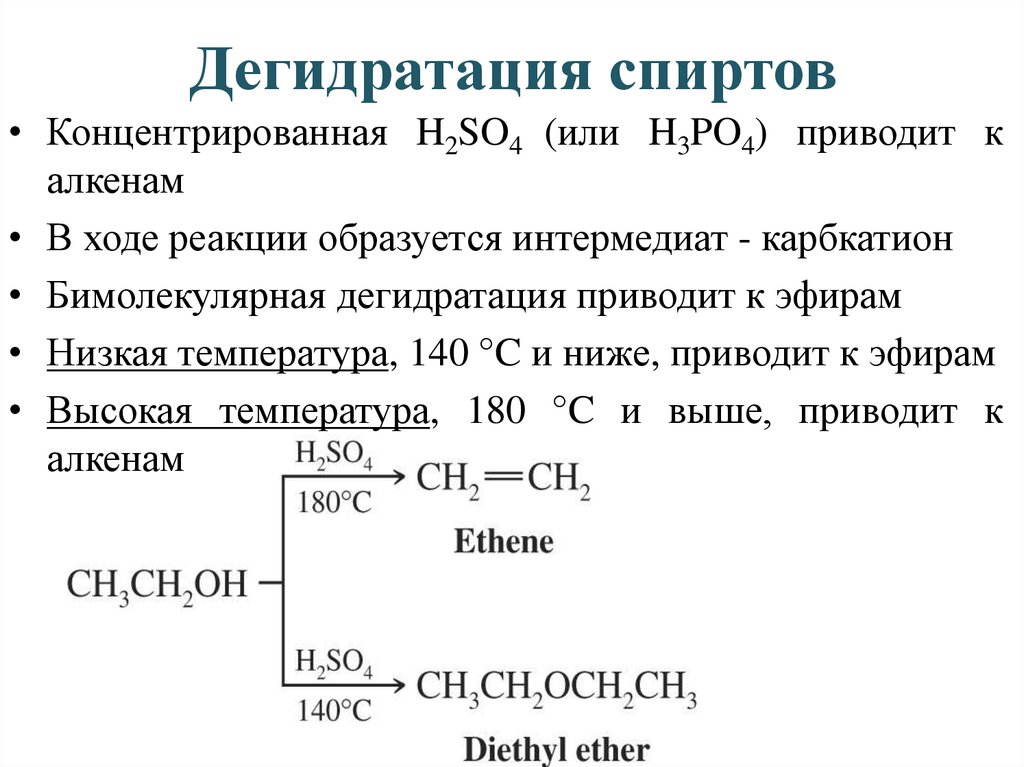
Дегидратация спиртов• Концентрированная H2SO4 (или H3PO4) приводит к
алкенам
• В ходе реакции образуется интермедиат - карбкатион
• Бимолекулярная дегидратация приводит к эфирам
• Низкая температура, 140 °C и ниже, приводит к эфирам
• Высокая температура, 180 °C и выше, приводит к
алкенам
6. Химические реакции спиртов
Дегидратация спиртов• Третичные спирты легко дегидратируются
кислотой.
• Вторичные спирты требуют более жестких
условий (75% H2SO4, 100 °C).
• Первичные спирты требуют очень жёстких
условий – непрактичный способ.
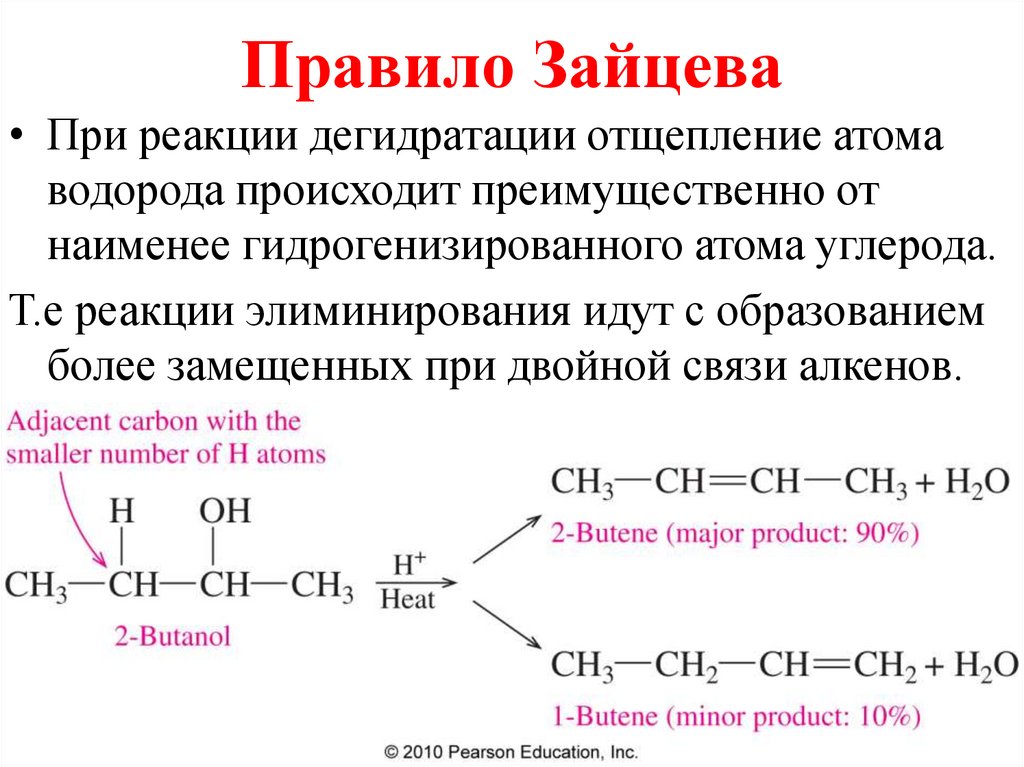
7.
Правило Зайцева• При реакции дегидратации отщепление атома
водорода происходит преимущественно от
наименее гидрогенизированного атома углерода.
Т.е реакции элиминирования идут с образованием
более замещенных при двойной связи алкенов.
8.
• В ходе дегидратации часто происходят нежелательныепроцессы – перегруппировки в более стабильный
карбкатион.
9. Кислотные свойства спиртов
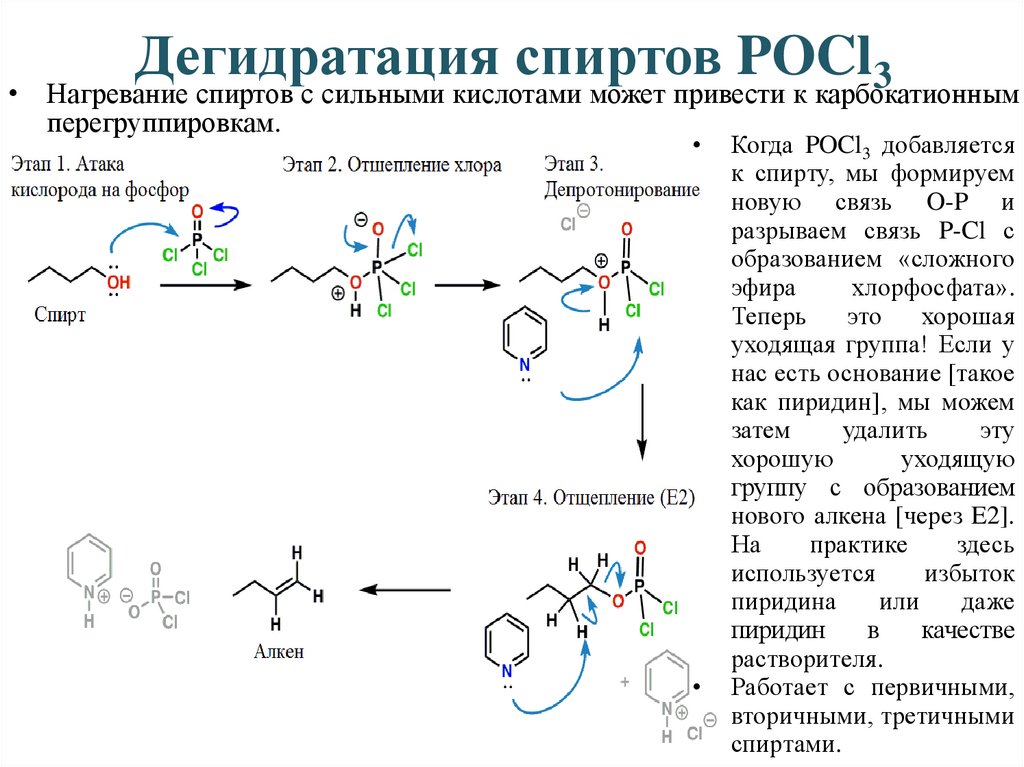
Дегидратация спиртов POCl3• Нагревание спиртов с сильными кислотами может привести к карбокатионным
перегруппировкам.
Когда POCl3 добавляется
к спирту, мы формируем
новую связь O-P и
разрываем связь P-Cl с
образованием «сложного
эфира
хлорфосфата».
Теперь
это
хорошая
уходящая группа! Если у
нас есть основание [такое
как пиридин], мы можем
затем
удалить
эту
хорошую
уходящую
группу с образованием
нового алкена [через E2].
На
практике
здесь
используется
избыток
пиридина
или
даже
пиридин
в
качестве
растворителя.
Работает с первичными,
вторичными, третичными
спиртами.
10.
Образование простых эфиров• Простые эфиры образуются при дегидратации
при низких температурах и кислотном катализе.
Две молекулы метанола
диметиловый эфир
Ограничения: - Эфир должен быть симметричным
- Хорошо работает только для первичных спиртов
11. Химические превращения спиртов
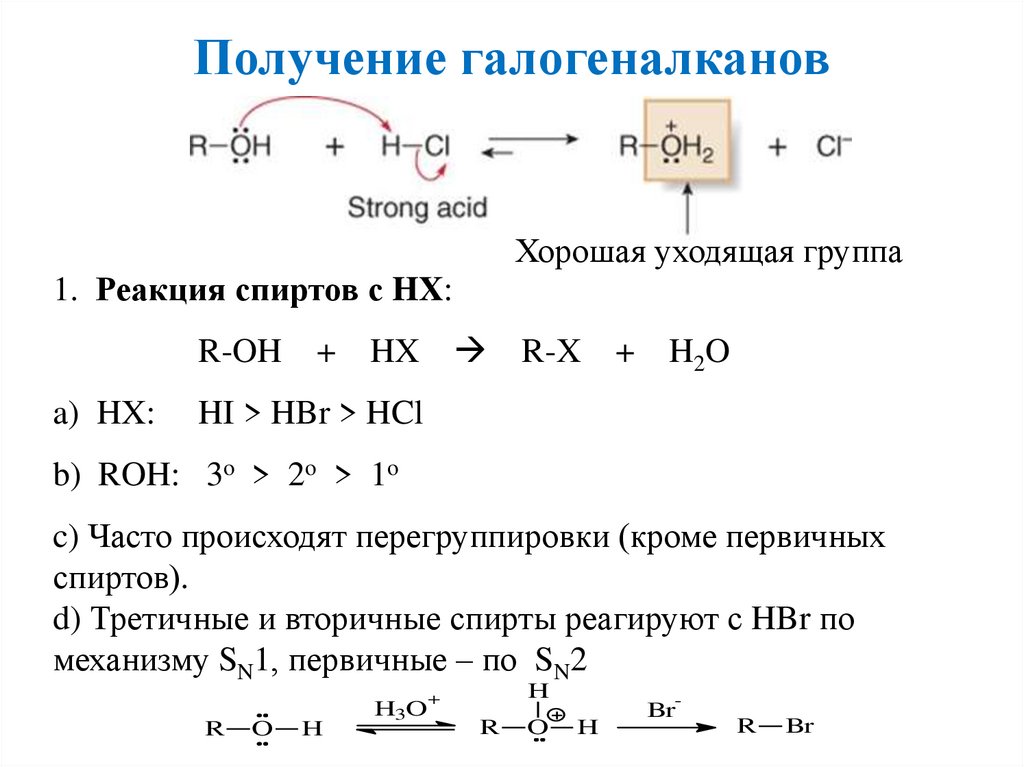
Получение галогеналкановХорошая уходящая группа
1. Реакция спиртов с HX:
R-OH
a) HX:
+ HX
R-X
+
H2O
HI > HBr > HCl
b) ROH: 3o > 2o > 1o
c) Часто происходят перегруппировки (кроме первичных
спиртов).
d) Третичные и вторичные спирты реагируют с HBr по
механизму SN1, первичные – по SN2
R
O
H
H3O
H
+
R
O
-
H
Br
R
Br
12.
Реагент ЛукасаZnCl2
ROH + HCl
RCl
Положительный
результат: раствор
становится мутным
Результаты теста с разными спиртами при комнатной
температуре:
SN2
• Первичные: Нет реакции
SN2 и SN1
• Вторичные: Реакция в течение ~5 минут
• Третичные, аллильные, бензильные: Реакция в течение <1 минуты
SN1
13. Дегидратация спиртов
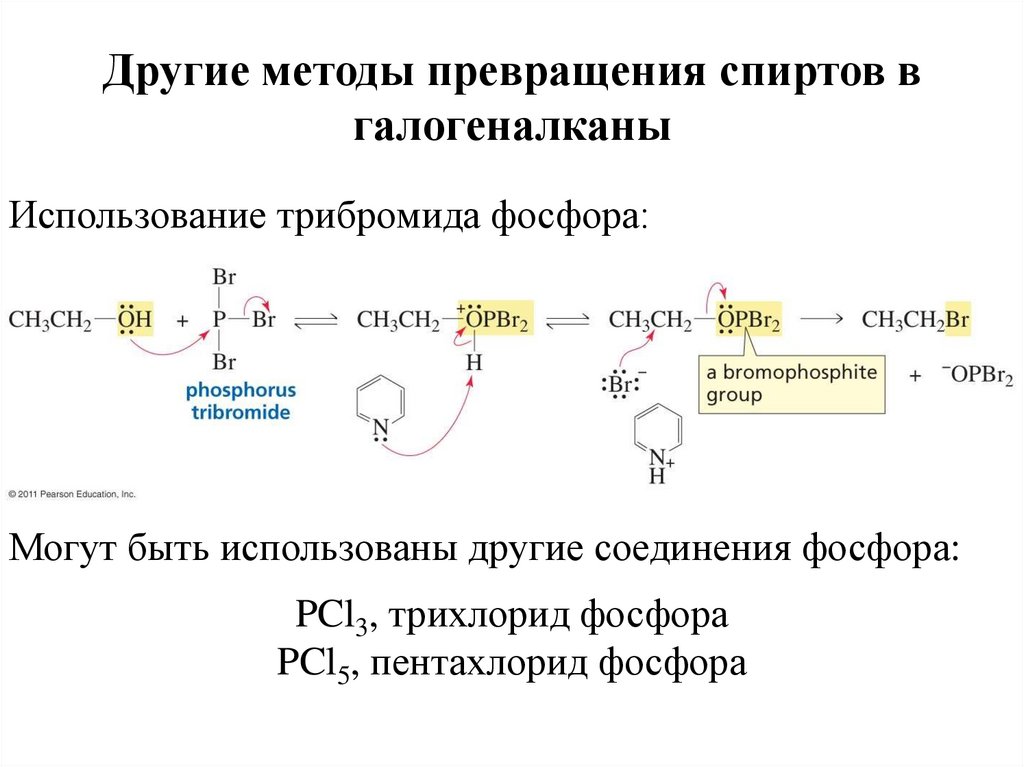
Другие методы превращения спиртов вгалогеналканы
Использование трибромида фосфора:
Могут быть использованы другие соединения фосфора:
PCl3, трихлорид фосфора
PCl5, пентахлорид фосфора
14. Дегидратация спиртов
Реакция спиртов с PX3ROH
+ PX3
a) PX3 = PCl3, PBr3, P + I2
b) Меньше перегруппировок
RX
c) ROH: CH3 > 1o > 2o (хорошие выходы для первичных и
вторичных спиртов)
CH3
CH3
CH3CCH2-OH
+
PBr3
CH3CCH2-Br
CH3
CH3
neopentyl alcohol
2,2-dimethyl-1-bromopropane
Реакция спиртов с тионилхлоридом
15.
Этерификация по Фишеру• Карбоновая кислота + Спирт = Сложный эфир + вода
• Неорганические сильные кислоты (серная или соляная)
служат катализаторами.
• Каждая стадия обратима.
O
CH3
C OH
CH3
+ H O CH2CH2CHCH3
+
H
O
CH3
CH3C OCH2CH2CHCH3
+ HOH
16. Относительная стабильность алкенов
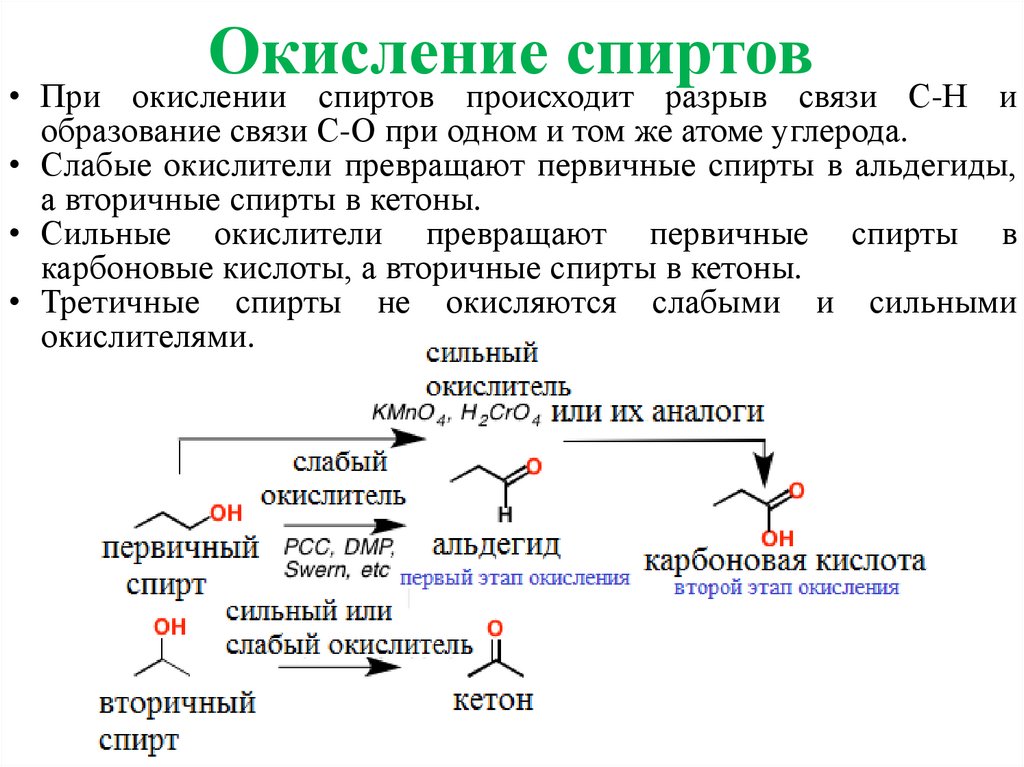
Окислениеспиртов
окислении спиртов происходит разрыв связи
• При
С-Н и
образование связи С-О при одном и том же атоме углерода.
• Слабые окислители превращают первичные спирты в альдегиды,
а вторичные спирты в кетоны.
• Сильные окислители превращают первичные спирты в
карбоновые кислоты, а вторичные спирты в кетоны.
• Третичные спирты не окисляются слабыми и сильными
окислителями.
17.
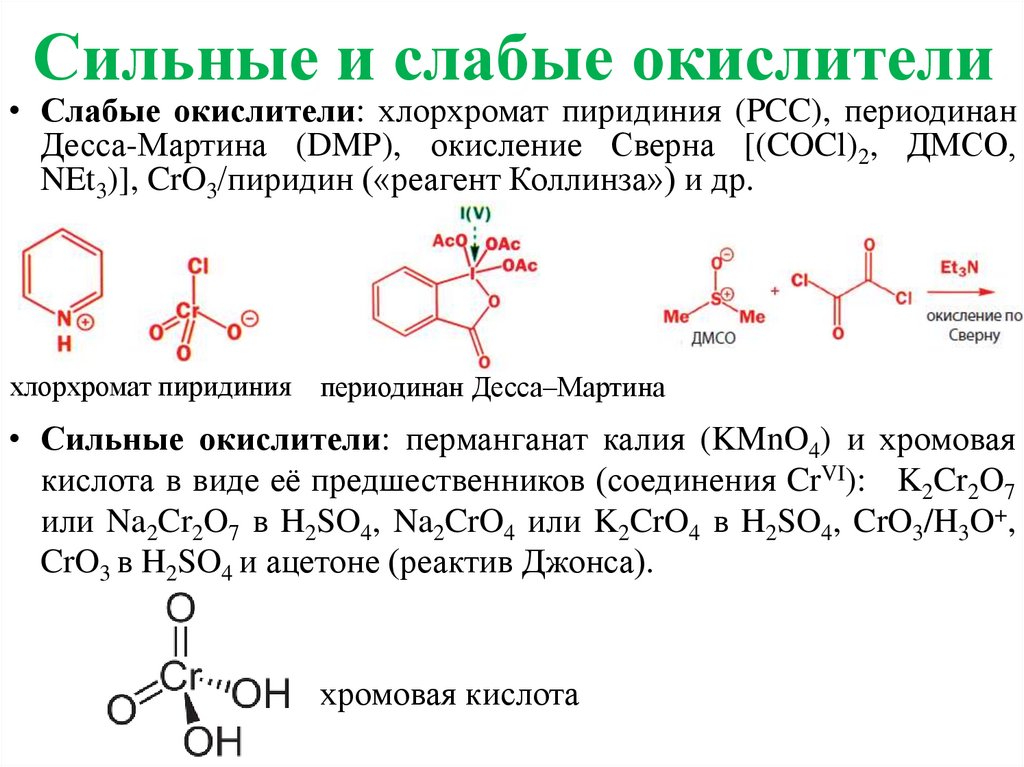
Сильные и слабые окислители• Слабые окислители: хлорхромат пиридиния (PCC), периодинан
Десса-Мартина (DMP), окисление Сверна [(COCl)2, ДМСО,
NEt3)], CrO3/пиридин («реагент Коллинза») и др.
хлорхромат пиридиния периодинан Десса–Мартина
• Сильные окислители: перманганат калия (KMnO4) и хромовая
кислота в виде её предшественников (соединения CrVI): K2Cr2O7
или Na2Cr2O7 в H2SO4, Na2CrO4 или K2CrO4 в H2SO4, CrO3/H3O+,
CrO3 в H2SO4 и ацетоне (реактив Джонса).
хромовая кислота
18.
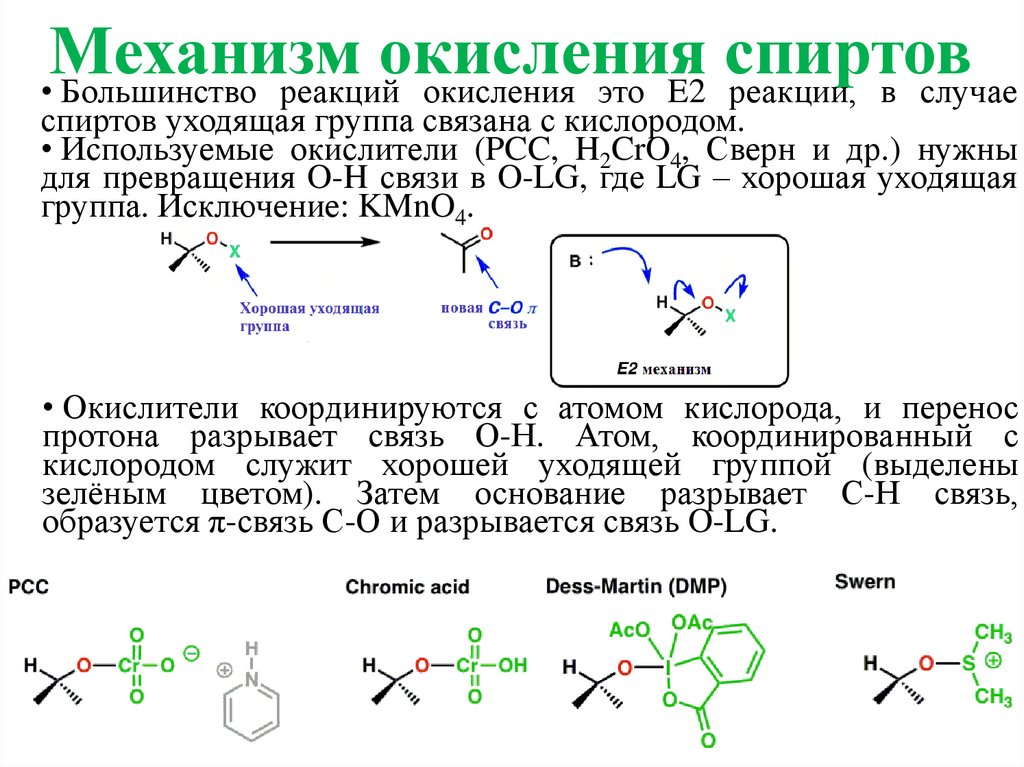
Механизмокисления
спиртов
• Большинство реакций окисления это E2 реакции, в случае
спиртов уходящая группа связана с кислородом.
• Используемые окислители (PCC, H2CrO4, Сверн и др.) нужны
для превращения O-H связи в O-LG, где LG – хорошая уходящая
группа. Исключение: KMnO4.
• Окислители координируются с атомом кислорода, и перенос
протона разрывает связь О-Н. Атом, координированный с
кислородом служит хорошей уходящей группой (выделены
зелёным цветом). Затем основание разрывает С-Н связь,
образуется π-связь С-О и разрывается связь O-LG.
19.
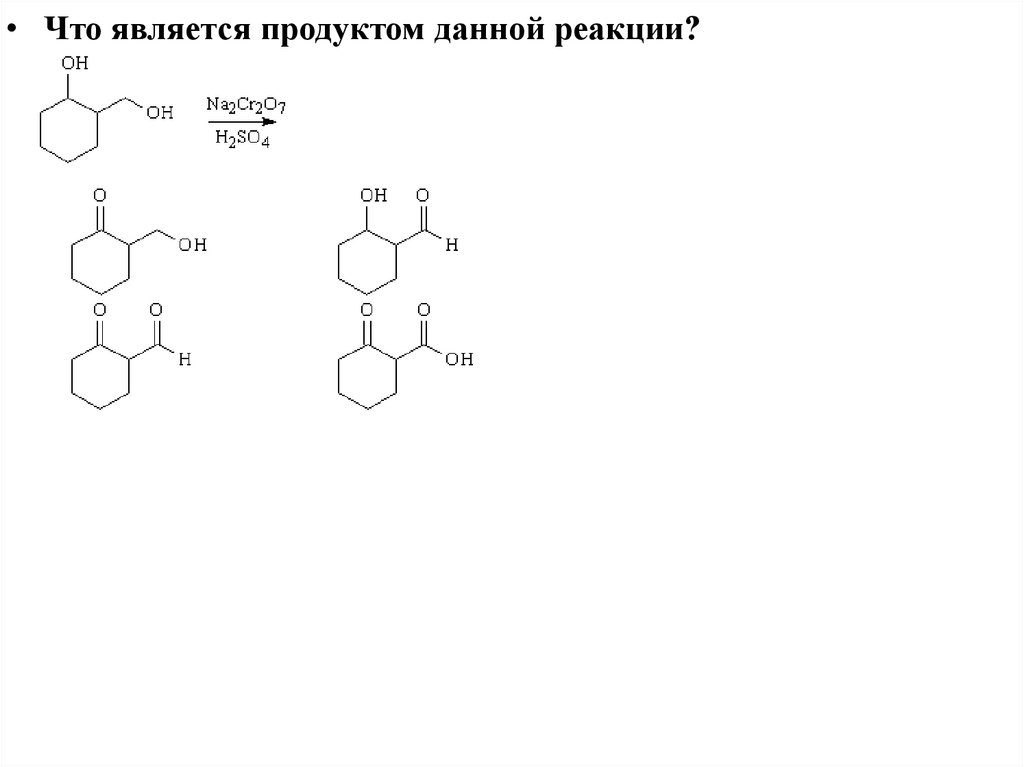
• Что является продуктом данной реакции?20. Образование простых эфиров
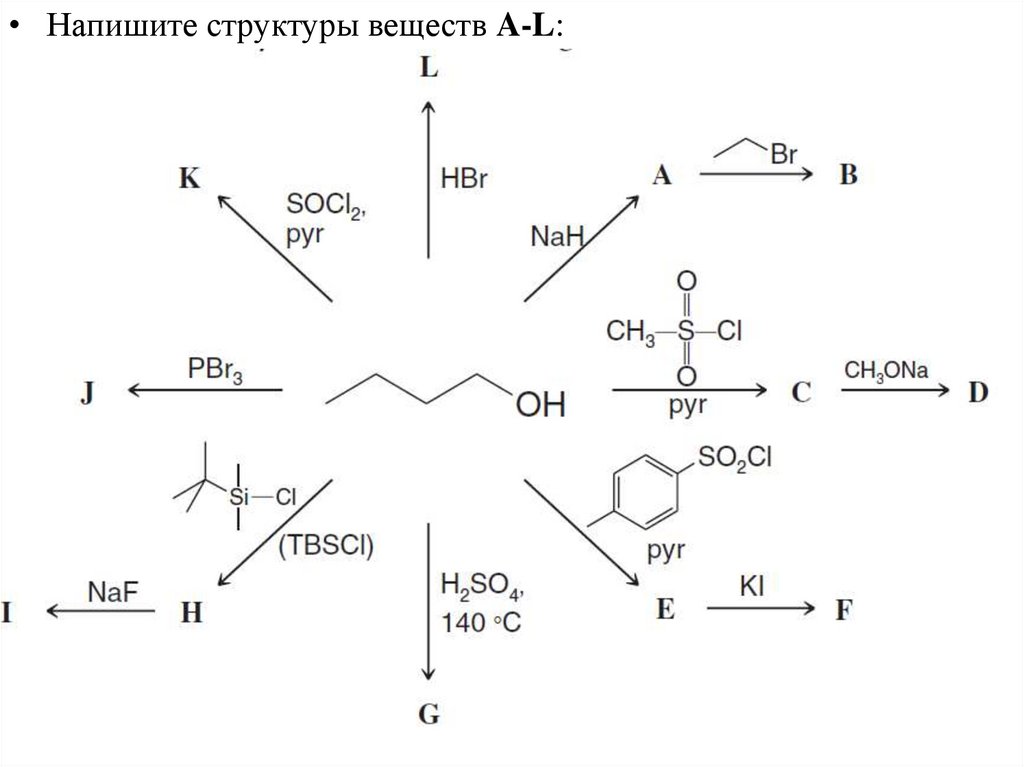
• Напишите структуры веществ A-L:21.
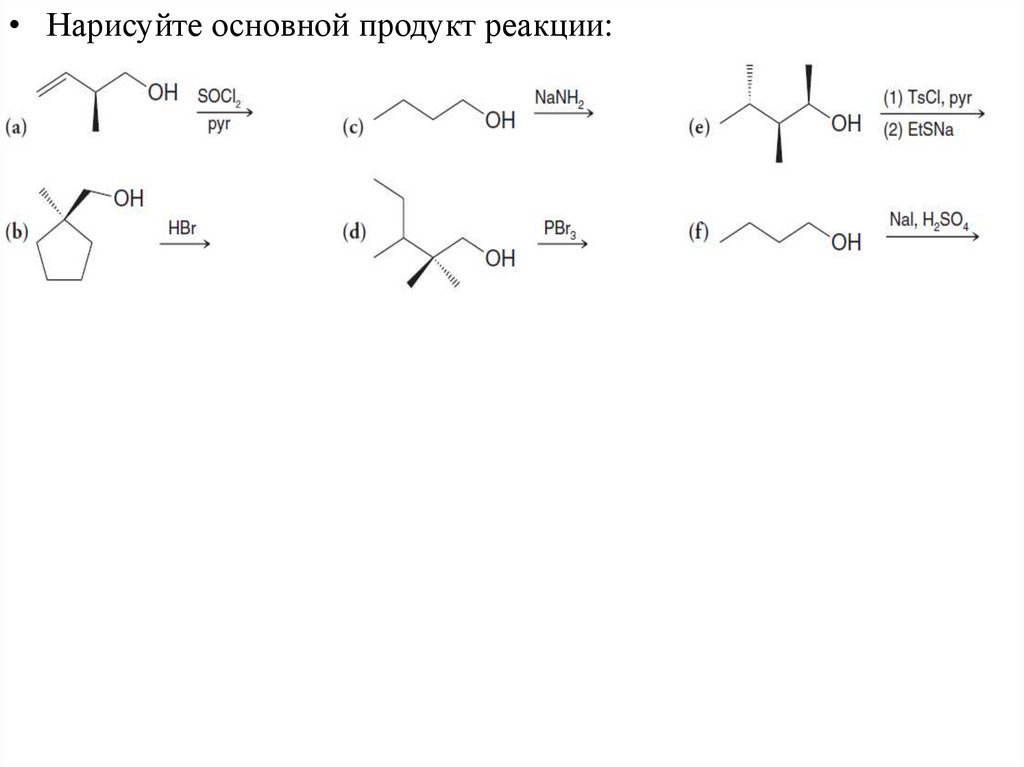
• Нарисуйте основной продукт реакции:22. Механизм нуклеофильного замещения
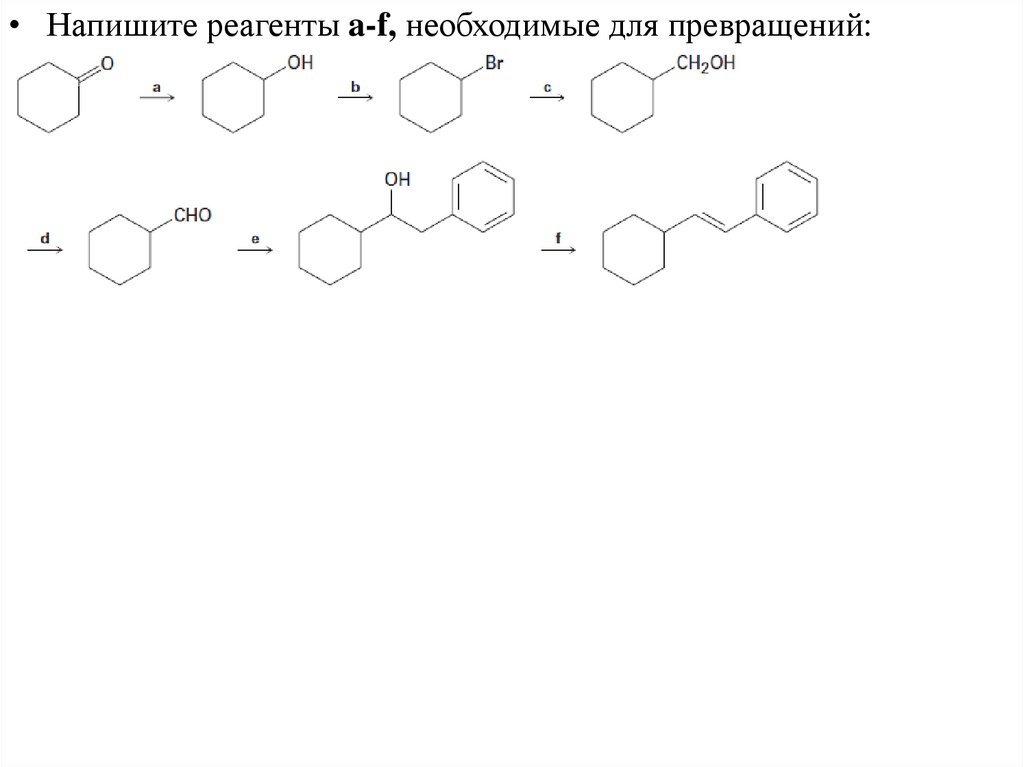
• Напишите реагенты a-f, необходимые для превращений:23. Реакция спиртов с HCl
Осуществить превращение:1) пропилен в глицерин
2) хлористый бутил в 2-бутанол
3) изобутиловый спирт в трет-бутанол
4) 3-метил-бутанол-1 в 2-метил-бутанол-2
5) из этилена и пропилена получить 2-метил-бутанол-2
24. Реагент Лукаса
Задачи на установление строения:25.
26.
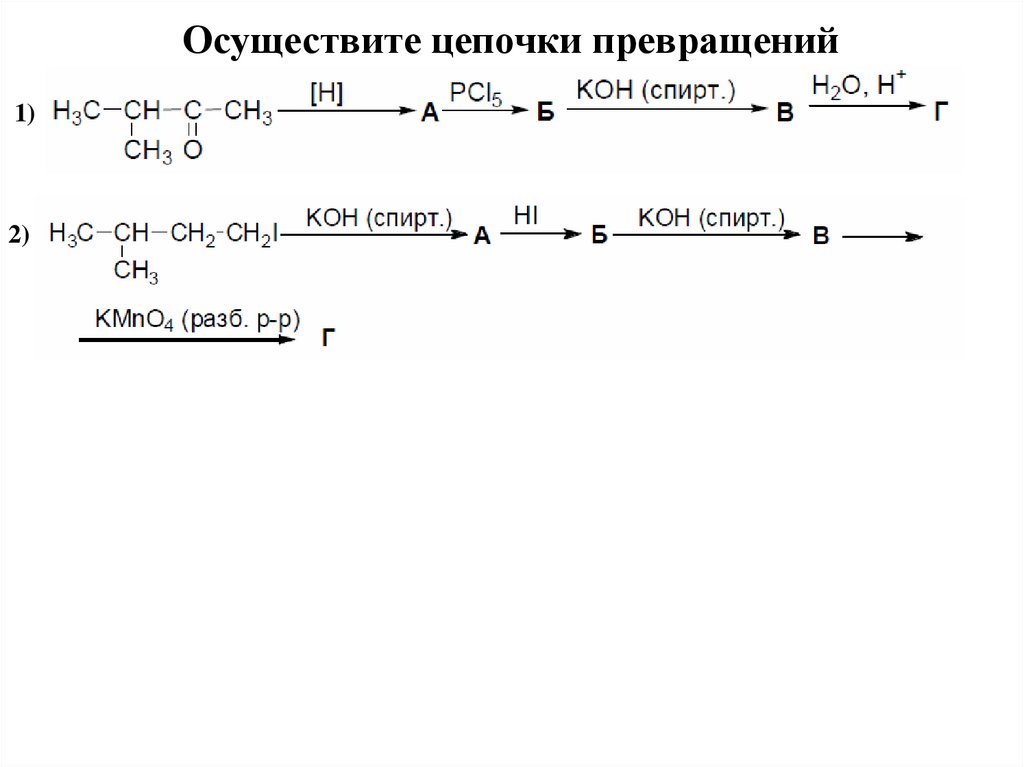
Осуществите цепочки превращений1)
2)
27. Этерификация по Фишеру
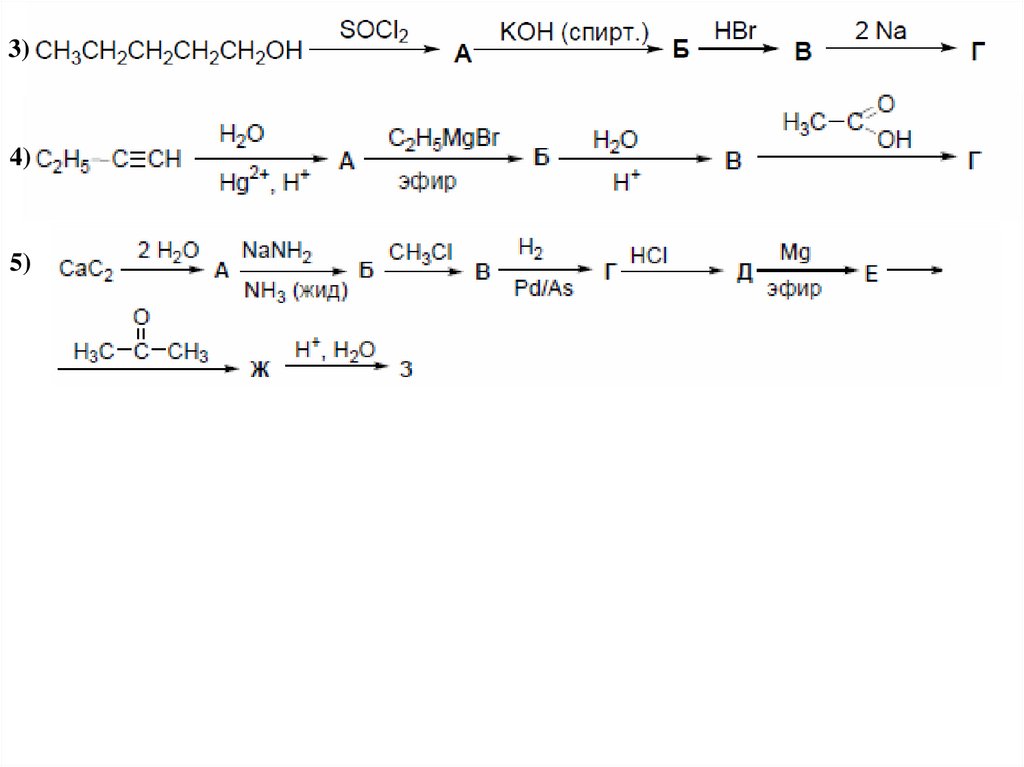
3)4)
5)
28.
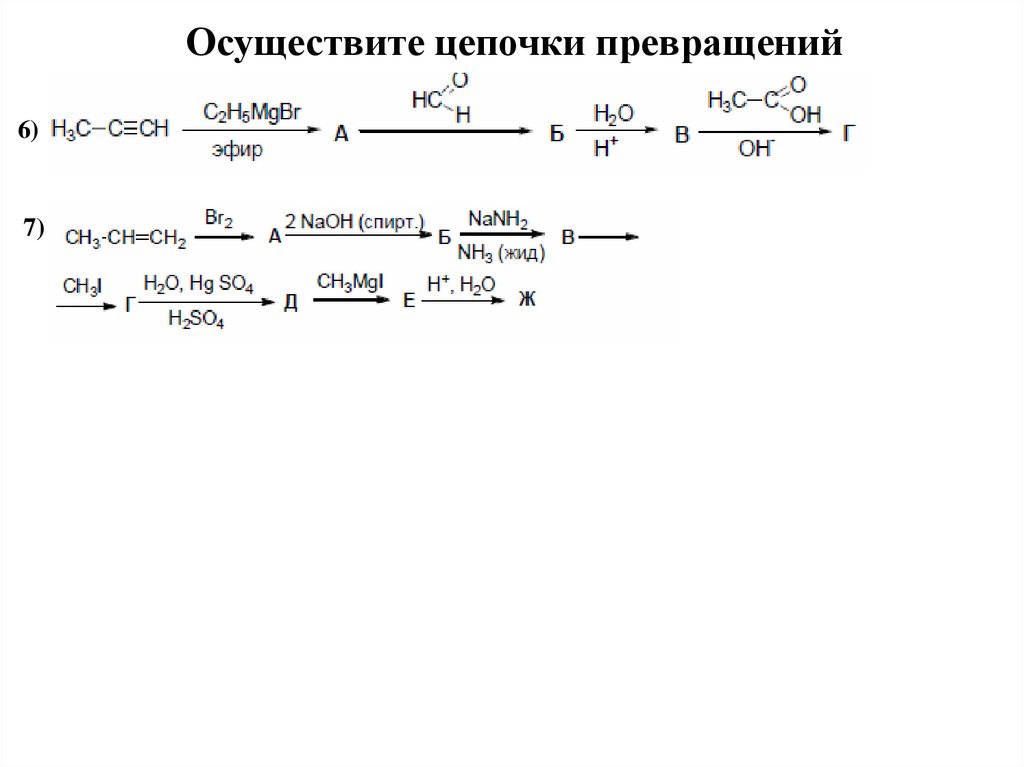
Осуществите цепочки превращений6)
7)
29.
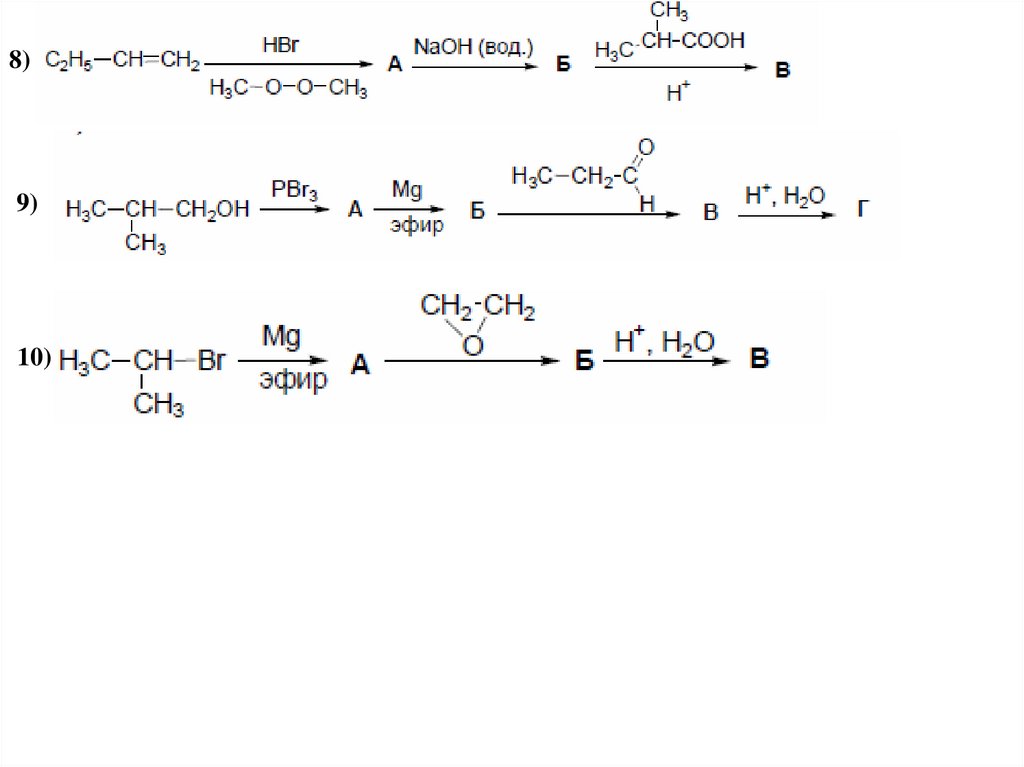
8)9)
10)
30.
• Вещество Х состава С4Н6О взаимодействует с аммиачнымраствором оксида серебра, а также бромоводородом (образуется
С4Н7Br3) и гидридом натрия (образуется С4Н4ОNa2). Установите
строение Х.
31.
1) Напишите схемы превращений (с использованием тольконеорганических реактивов) пропилена в 2,3-диметил-2-бутанол
2) Используйте этиловый спирт для получения 3-метил-3-пентанола
3) Используя в качестве исходного вещества ацетилен, напишите
схемы получения: а) 1-бутанола. 2) 1-пропанола















 Химия
Химия