Похожие презентации:
Классификация кислот
1. Приложения: 179980 – индивидуальное 106308 (основность) –для всех
2.
КЛАССИФИКАЦИЯ КИСЛОТ.1. По содержанию кислорода
КИСЛОТЫ
бескислородные
кислородсодержащие
2
3.
2. По количеству атомов водородаКИСЛОТЫ
одно-
трехосновные
основные
двухосновные
24.04.2022
3
4.
КЛАССИФИКАЦИЯ КИСЛОТ.3. По растворимости в воде
КИСЛОТЫ
нерастворимые
растворимые
4
5.
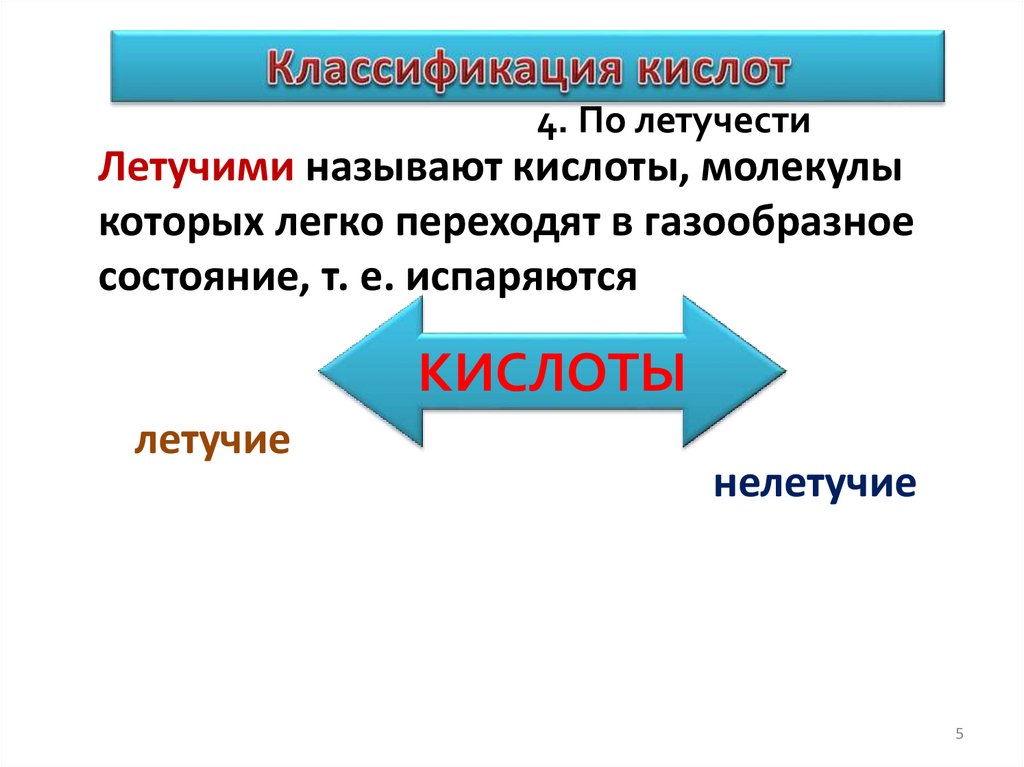
КЛАССИФИКАЦИЯ КИСЛОТ.4. По летучести
Летучими называют кислоты, молекулы
которых легко переходят в газообразное
состояние, т. е. испаряются
КИСЛОТЫ
летучие
нелетучие
5
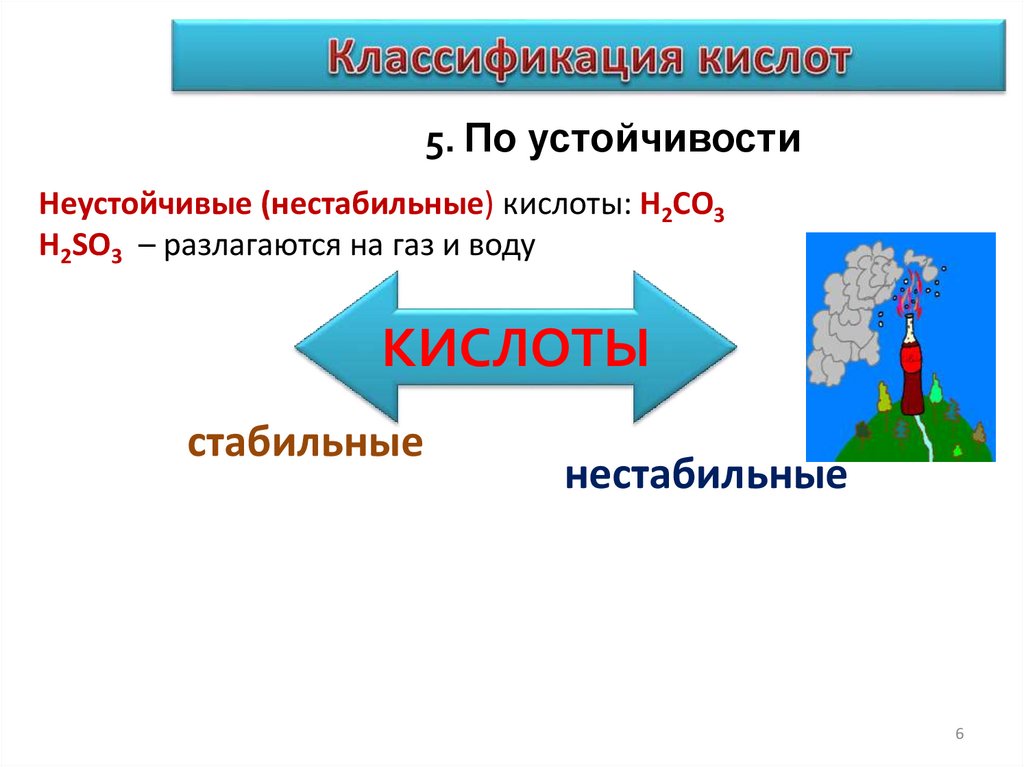
6.
5. По устойчивостиНеустойчивые (нестабильные) кислоты: H2CO3
H2SO3 – разлагаются на газ и воду
КИСЛОТЫ
стабильные
нестабильные
6
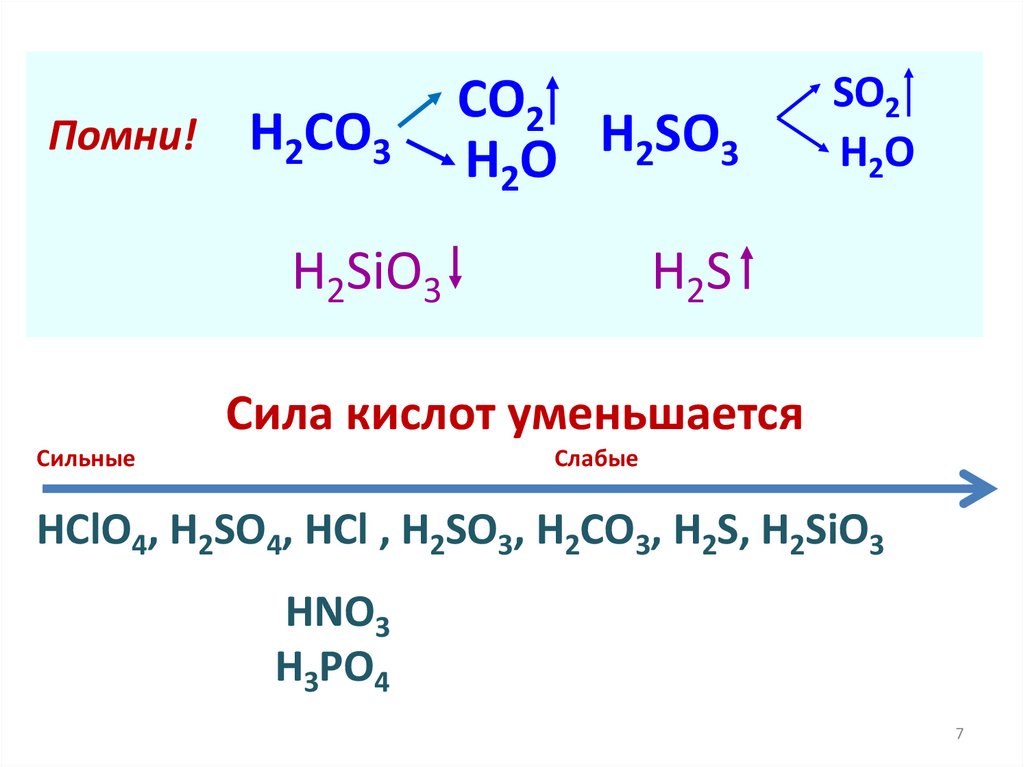
7.
Помни!H2CO3
CO2
H
SO
2
3
H2O
H2SiO3
SO2
H2O
H2S
Сила кислот уменьшается
Cильные
Слабые
HClO4, H2SO4, HCl , H2SO3, H2СO3, H2S, H2SiO3
HNO3
H3PO4
7
8.
ПРАВИЛА ТЕХНИКИБЕЗОПАСНОСТИ
Едкое вещество—
кислота! Разрушает
и раздражает кожу,
слизистые
оболочки.
Попавшие на кожу капли
раствора кислоты
немедленно смойте
сильной струей холодной
воды, а затем
обработайте
поврежденную
поверхность 2%-м
раствором питьевой
соды.
8
9. Химические свойства кислот
10.
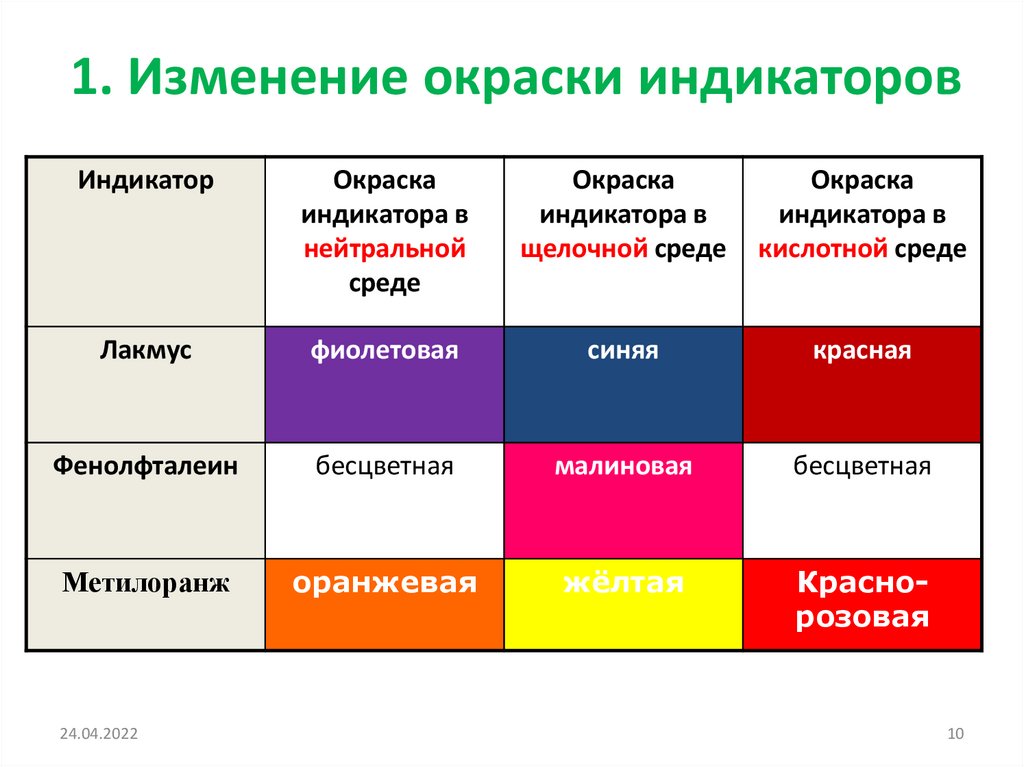
1. Изменение окраски индикаторовИндикатор
Окраска
индикатора в
нейтральной
среде
Окраска
индикатора в
щелочной среде
Окраска
индикатора в
кислотной среде
Лакмус
фиолетовая
синяя
красная
Фенолфталеин
бесцветная
малиновая
бесцветная
Метилоранж
оранжевая
жёлтая
Краснорозовая
24.04.2022
10
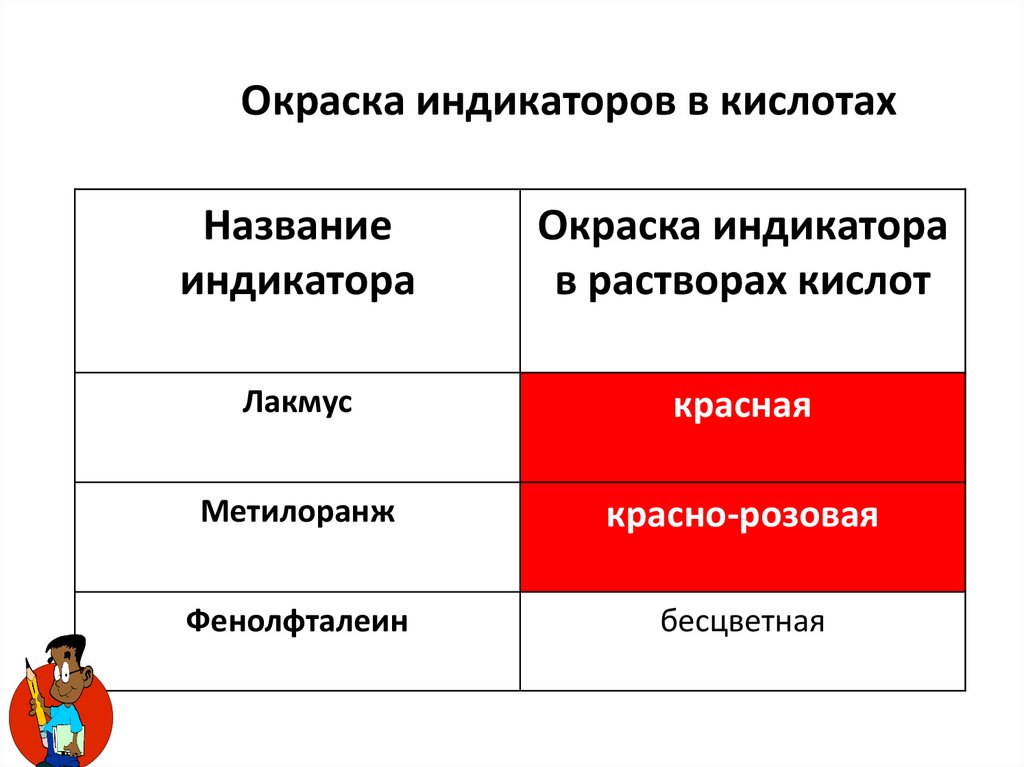
11.
Окраска индикаторов в кислотахНазвание
индикатора
Окраска индикатора
в растворах кислот
Лакмус
красная
Метилоранж
красно-розовая
Фенолфталеин
бесцветная
12.
Шкала рНУниверсальная
индикаторная бумага
Кислая среда
Нейтральная среда
рН = 7 – среда нейтральная
рН < 7 – среда кислая
рН > 7 – среда щелочная
Щелочная среда
13.
2. Взаимодействие с Металлами.Ряд активности металлов
Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Co Ni Sn Pb H2 Sb Cu Hg Ag Pt Au
вытесняют водород из кислот
водород из кислот
не вытесняют
Кислота + Ме → соль + Н2
1.
2.
3.
4.
Ме должен находиться в ряду напряжений до водорода;
Кислота должна быть растворимой;
Образующаяся соль должна быть растворимой;
Азотная кислота и серная концентрированная не подчиняются данным
правилам.
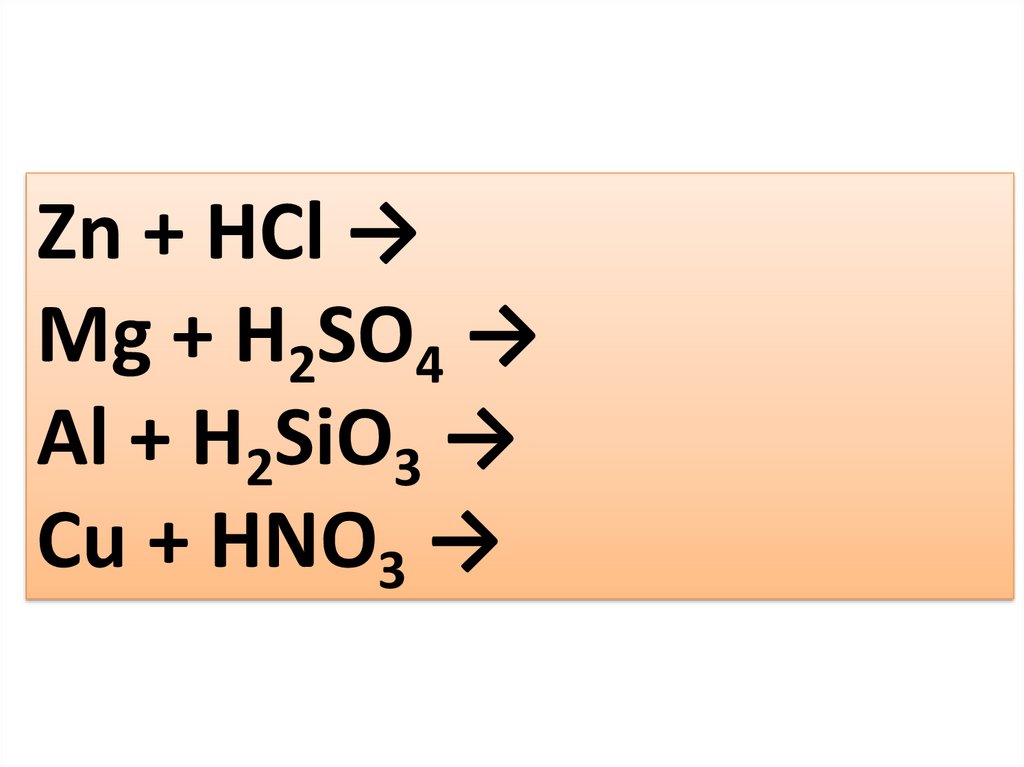
Zn + HCl →
Mg + H2SO4 (p-p) →
Al + H2SiO3 →
Cu + HNO3 →
14.
Zn + HCl →Mg + H2SO4 →
Al + H2SiO3 →
Cu + HNO3 →
15.
3. Взаимодействие с оксидами металловМеО (основными и амфотерными):
Кислота + основный оксид → соль + вода
HCl + K2O →
H2SO4 + CaO →
HNO3 + CuO →
Кислота + амфотерный оксид → соль + вода
HCl + ZnO →
HNO3 + Al2O3 →
16.
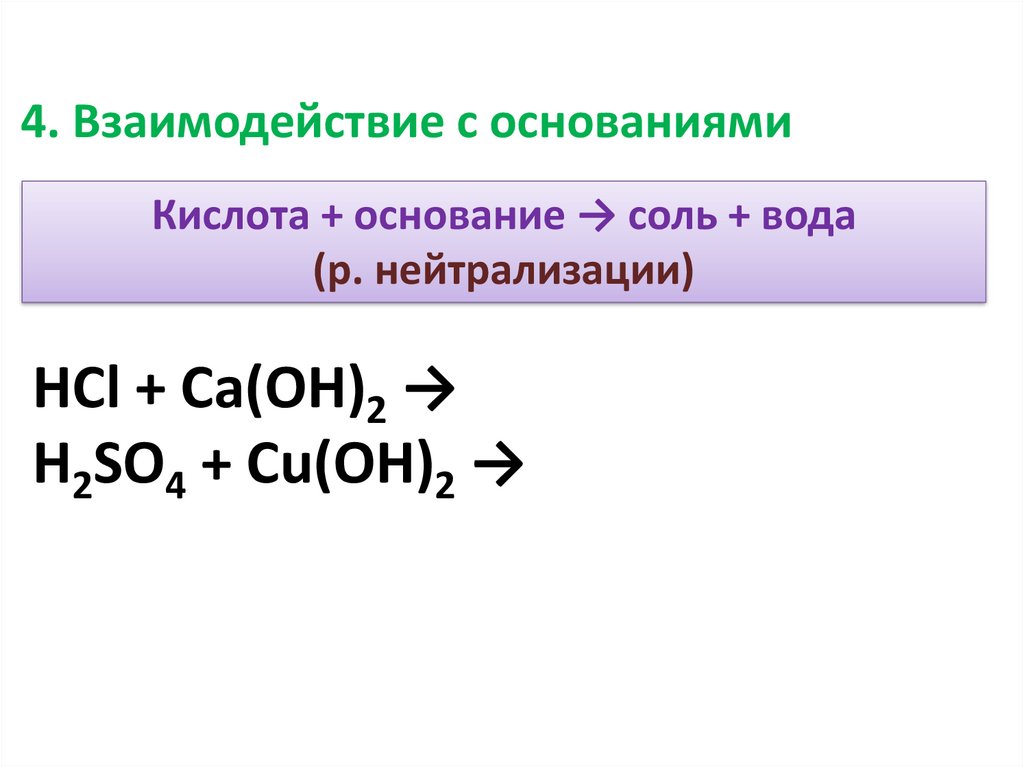
4. Взаимодействие с основаниямиКислота + основание → соль + вода
(р. нейтрализации)
HCl + Ca(OH)2 →
H2SO4 + Cu(OH)2 →
17.
5. Взаимодействие с cолямиКислота + соль → новая кислота + новая соль
(р. обмена)
Условия протекания реакции: выпадение осадка
выделение газа
HCl + Na2CO3 →
H2SO4 + BaCl2 →
HNO3 + KCl →
18. Домашнее задание
1) Химические свойства кислот выучить2)








 Химия
Химия








