Похожие презентации:
Галогены
1.
Галогены2.
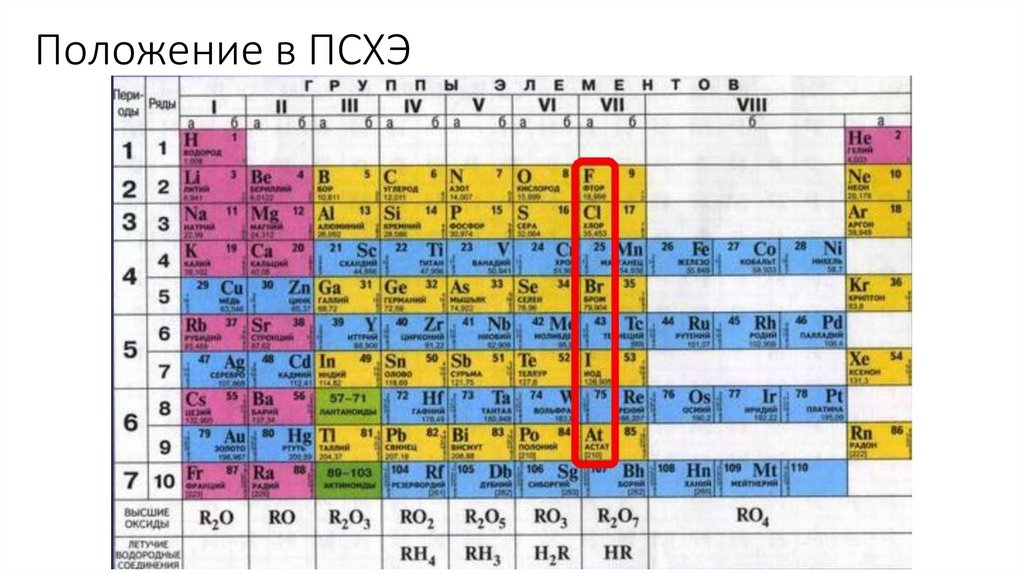
Положение в ПСХЭ3.
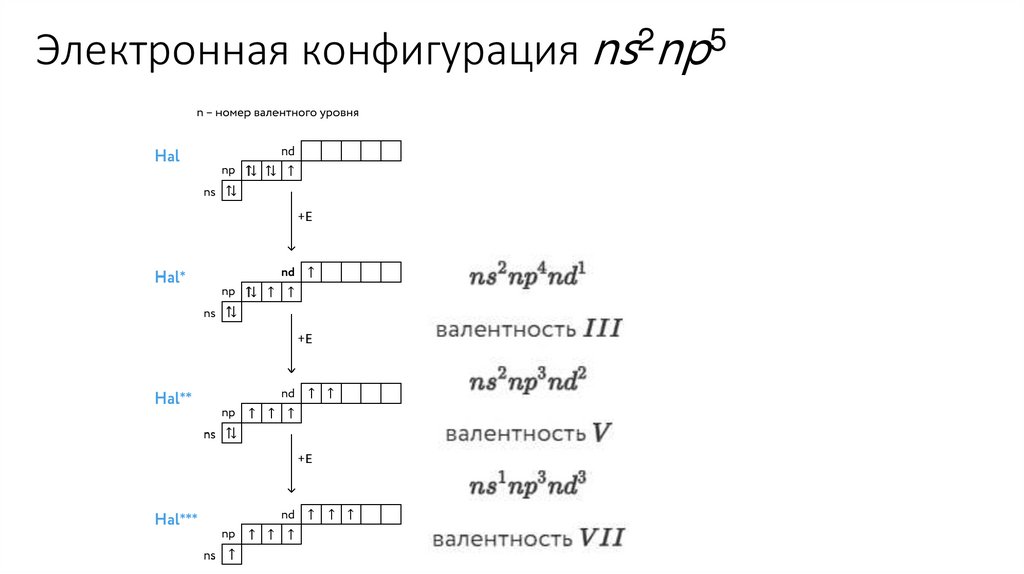
Электронная конфигурация ns2np54.
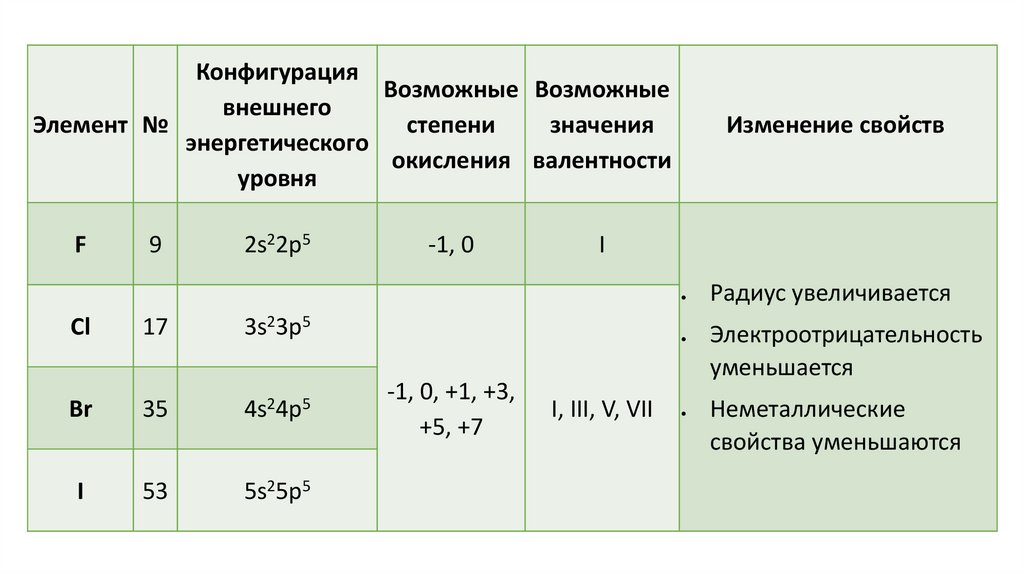
КонфигурацияВозможные Возможные
внешнего
Элемент №
степени
значения
энергетического
окисления валентности
уровня
F
9
2s22p5
-1, 0
Изменение свойств
I
17
3s23p5
Br
35
4s24p5
I
53
5s25p5
Cl
-1, 0, +1, +3,
+5, +7
I, III, V, VII
Радиус увеличивается
Электроотрицательность
уменьшается
Неметаллические
свойства уменьшаются
5.
Распространённость галогенов в природе• CaF2 — плавиковый шпат
• Na3AlF6 — криолит
• NaCl — поваренная соль (каменная соль)
• KCl — сильвин
• KCl∙MgCl2∙6H2O — карналлит
6.
Простые веществаФтор
Хлор
Бром
Йод
7.
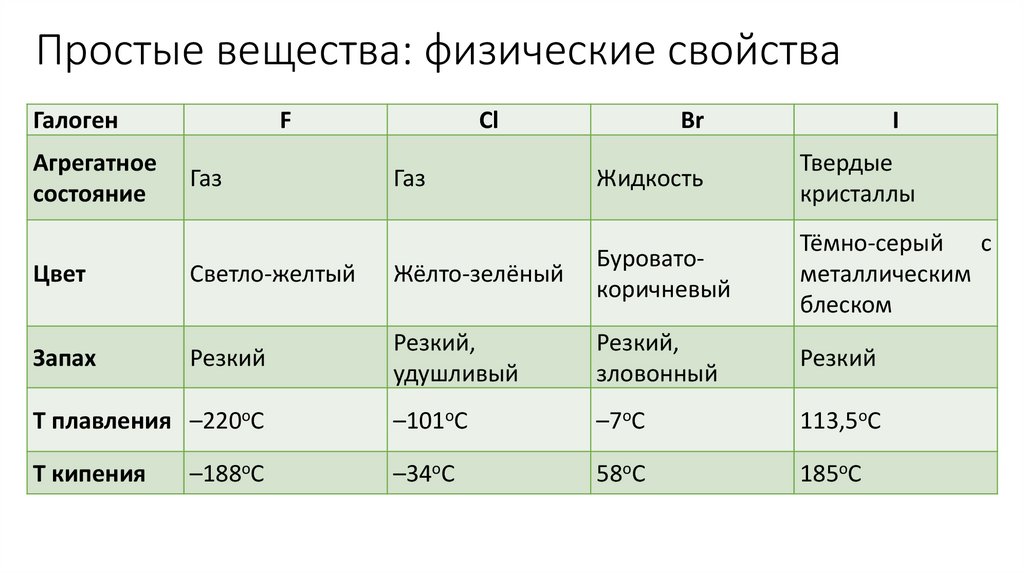
Простые вещества: физические свойстваГалоген
Агрегатное
состояние
F
Газ
Cl
Br
I
Газ
Жидкость
Твердые
кристаллы
Тёмно-серый с
металлическим
блеском
Цвет
Светло-желтый
Жёлто-зелёный
Буроватокоричневый
Запах
Резкий
Резкий,
удушливый
Резкий,
зловонный
Резкий
T плавления –220оС
–101оС
–7оС
113,5оС
–188оС
–34оС
58оС
185оС
Т кипения
8.
Способы получения галогенов1. Получение фтора.
2KHF2 → 2K + H2 + 2F2
3. Получение брома.
2HBr + Cl2 → Br2 + 2HCl
MnO2 + 4HBr → MnBr2 + Br2 + 2H2O
4. Получение йода.
2KI + Cl2 → I2 + 2KCl
2KI + MnO2 + 2H2SO4 → I2 + K2SO4 + MnSO4 + 2H2O
9.
Способы получения галогенов2. Получение хлора.
• Электролиз расплава хлорида натрия
NaCl → Na+ + Cl−
K(–): Na+ +1e → Na0
A(+): 2Cl− ̶ 2e → Cl20
2Na+ + 2Cl− → 2Na º + Cl2º
2NaCl → 2Na + Cl2
• Электролиз раствора хлорида натрия
NaCl → Na+ + Cl−
K(–): 2H2O + 2e → H2° + 2OH−
A(+): 2Cl− ̶ 2e → Cl20
2H2O + 2Cl− → H2°↑ + 2OH− + Cl2°↑
2NaCl + 2H2O → H2↑ + 2NaOH + Cl2↑
• В лаборатории
MnO2 + 4HCl
2KMnO4 + 16HCl
→ 2MnCl2 + 2KCl
KClO3 + 6HCl
K2Cr2O7 + 14HCl
→ MnCl2 + Cl2↑ + 2H2O
→
KCl
+
+
5Cl2↑ + 8H2O
3Cl2↑ + 3H2O
→ 2CrCl3 + 2KCl
+
3Cl2↑ + 7H2O
10.
Химические свойства галогенов1. Взаимодействие с металлами и неметаллами
1.1. Галогены не горят на воздухе:
2F2 + O2 → 2OF2
1.2. Взаимодействие с серой:
S + Cl2 → SCl2 (S2Cl2)
S + 3F2 → SF6
1.3. Взаимодействие с фосфором и
углеродом:
2P + 5Cl2 → 2PCl5
2P + 3Cl2 → 2PCl3
2F2 + C → CF4
1.4. Взаимодействие с металлами:
3Cl2 + 2Fe → 2FeCl3
I2 + Fe → FeI2
Cl2 + Cu → 2CuCl2
I2 + 2Cu → 2CuI
3Cl2 + 2Al → 2AlCl3
1.5. Взаимодействие с водородом:
F2 + H2 → 2HF
Cl2 + H2 → 2HCl
Br2 + H2 → 2HBr
I2 + H2 ↔ 2HI
1.6. Взаимодействие с галогенами:
Cl2 + F2 → 2ClF
Cl2 + I2 + H2O → HCl + HIO3
11.
Химические свойства галогенов2. Взаимодействие со сложными веществами
2.1. Растворение в воде:
2.3. Взаимодействие с солями и
галогеноводородами:
Cl2 + H2O ↔ HCl + HClO
Cl2 + 2NaI → 2NaCl + I2
Cl2 + 6H2O ↔ 5HCl + HClO3
Cl2 + 2NaBr → 2NaCl + Br2
2F2 + 2H2O → 4HF + O2
2.4. Взаимодействие с
2.2. Растворение в щелочах:
восстановителями:
Сl2 + 2NaOH(хол.) → NaCl + NaClO + H2O
Cl2 + H2S → S + 2HCl
3Cl2 + 6NaOH(гор.) → 5NaCl + NaClO3 +
Cl2 + H2O2 → 2HCl + O2
3H2O
2Сl2 + 2Са(OH)2(хол.) → СaCl2 + Сa(ClO)2
+ 2H2O
12.
Домашнее задание• Учебник Еремин, Кузьменко:
• Учить §2, выполнить №6
• Учить §3, выполнить №5-7








 Химия
Химия