Похожие презентации:
Галогены. Соединения галогенов. Урок №32, 33
1.
Урок №32, 33Галогены.
Соединения галогенов
2.
Галогены- химические элементы VII группы главной
подгруппы ПСХЭ Д.И. Менделеева.
Содержание в природе (по массе), %
F
0,06
Cl
0,02
Br
2·10-4
I
4·10-5
At
радиоактивный элемент, в
следовых количествах
В природе встречаются в виде соединений.
3.
Минералы галогеновCaF2 - флюорит (плавиковый шпат)
NaCl - галит
KCl - сильвин
KCl·NaCl - сильвинит
AgBr - бромаргирит
Ca(IO3)2 - лаутарит
Бром и иод относятся к рассеянным
элементам
4.
Электронная формулаns2np5
n- номер периода
До завершения электронного слоя не
хватает одного электрона.
5.
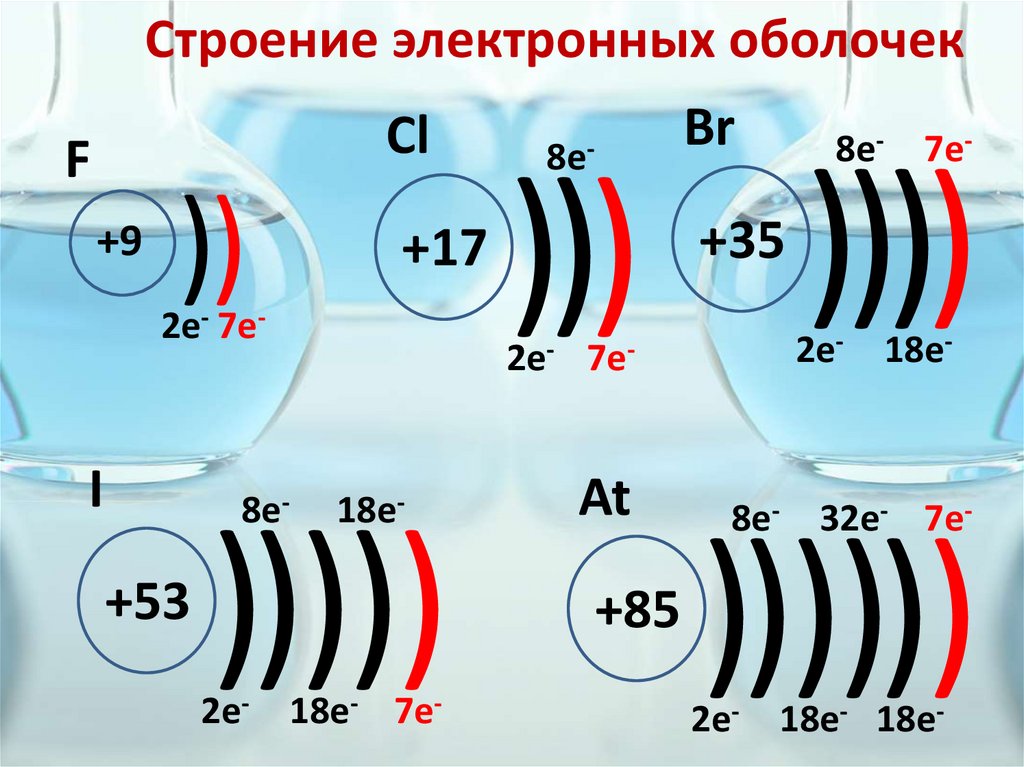
Строение электронных оболочекCl
F
+9
))
+17
2е- 7е-
I
8е-
+53
8е-
)))))
2е- 18е- 7е-
8е- 7е-
))) ))))
+35
2е-
18е-
Br
2е- 18е-
7е-
At
+85
8е- 32е- 7е-
))))))
2е-
18е- 18е-
6.
Физические свойстваСвойство
Цвет
tпл.
tкип.
F2
Cl2
Br2
I2
пар
-220
188
-100
-34
-7
59
Твёрдый
114
185
Для иода характерна сублимация (возгонка)
Молекулы галогенов состоят из двух атомов
7.
Химические свойстваХимически очень активны, сильные окислители.
F2 самый сильный окислитель из простых веществ.
Степень окисления
F2
Cl2
Br2
I2
-1; 0
-1; 0; +1; +3; +4; +5; +6; +7
-1; 0; +3; +1; +4; +5; +7
-1; 0; +1; +3; +5; +7
8.
1. Взаимодействие с простыми веществами9.
2. Взаимодействие с водой2F2 + 2H2O → 4HF + O2
Остальные галогены (Hal2)
Hal2 + H2O ⇄ HHal + HHalO
Cl2 + H2O ⇄ HCl + HClO
hν
2HClO → 2HCl + O2
Хлорная вода: раствор Cl2 в воде
Бромная вода: раствор Br2 в воде
Иодная вода: раствор I2 в воде
10.
3. Взаимодействие со щёлочью00C
2F2 + 2NaOH(2% р-р) → OF2 + 2NaF + H2O
Остальные галогены (Hal2)
tкомн.
Hal2 + 2NaOH → NaHal + NaHalO + H2O
tкомн.
Cl2 + 2NaOH → NaCl + NaClO + H2O
гипохлорит натрия
t 5NaHal + NaHalO + 3H O
3Hal2 + 6NaOH →
3
2
t
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O
хлорат натрия
11.
4. Более активный галоген вытесняет израствора соли менее активные галогены
Cl2 + 2KBr = 2KCl + Br2
Br2 + 2NaI = 2NaBr + I2
12.
Галогеноводороды (HHal)1. Бесцветные газы с резким запахом.
2. Отлично растворяются в воде.
3. Их растворы в воде являются кислотами.
HF
Слабая
(разъедает стекло)
HCl
Сильный
восстановитель
HBr
Сильные
HI
Увеличение силы
Na2O·CaO·6SiO2 + 28HF = 2NaF + CaF2 + 6SiF4 + 14H2O
SiO2 + 4HF = SiF4 + 2H2O
13.
Получение хлороводородаI. Промышленные способы
1. Сжигание водорода в атмосфере хлора:
H2 + Cl2 = 2HCl
2. Хлорирование на свету (hν)
предельных углеводородов:
hν
СН4 + Сl2 → СН3Cl + HCl
hν
CH3Cl + Cl2 → CH2Cl2 + HCl
hν
CH2Cl2 + Cl2 → CHCl3 + HCl
hν
CHCl3 + Cl2 → CCl4 + HCl
14.
Механизм взаимодействия водорода ихлора на свету
: :
: :
: :
: :
: :: :: :
: :
: :
hν
:Cl-Cl: →
2:Cl·
:Cl· + H-H → H-Cl: + H·
H· +:Cl-Cl: → H-Cl:+ :Cl·…
Радикал - частица с неспаренным электроном.
Цепные реакции - процессы, протекающие
через цепь последовательных превращений.
15.
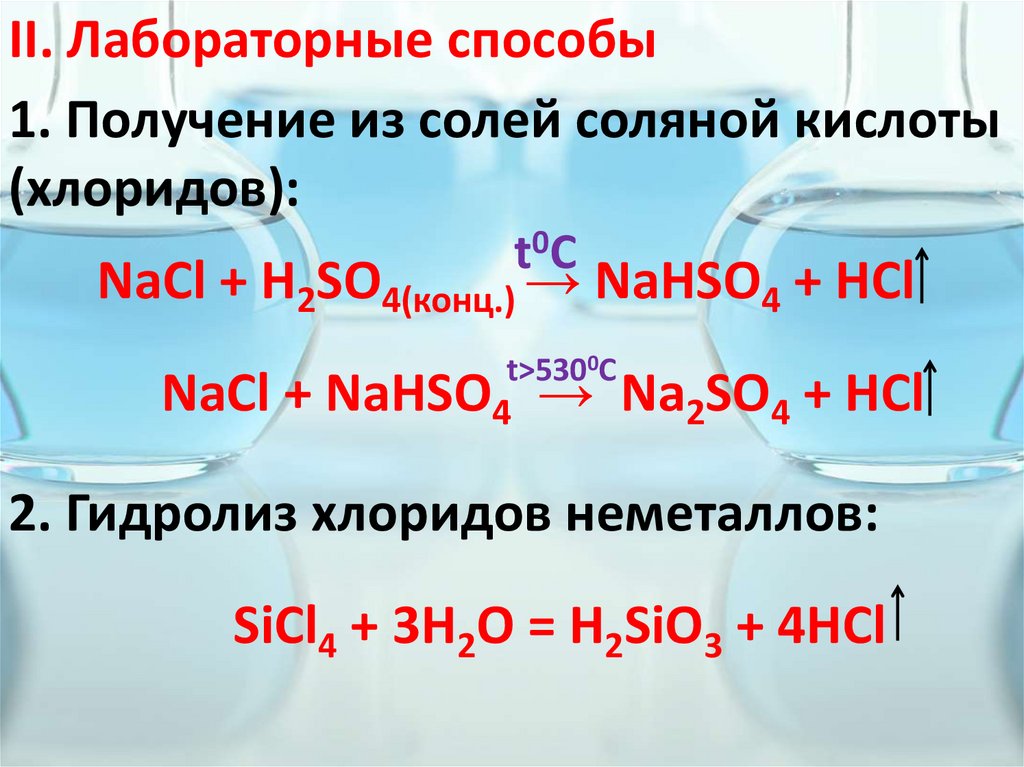
II. Лабораторные способы1. Получение из солей соляной кислоты
(хлоридов):
t0C
NaCl + H2SO4(конц.) → NaHSO4 + HCl
t>5300C
NaCl + NaHSO4 → Na2SO4 + HCl
2. Гидролиз хлоридов неметаллов:
SiCl4 + 3H2O = H2SiO3 + 4HCl
16.
Соляная кислота- раствор HCl в воде.
Физические свойства
1. Бесцветная жидкость (техническая жёлто-зелёного цвета) с резким запахом;
2. Концентрированная HCl - «дымит»;
3. Максимальная концентрация ≈40% HCl.
17.
Химические свойства HCl1. Сильная кислота:
HCl + H2O → H3O+ + Clупрощённо: HCl → H+ + ClКак изменяется окраска индикаторов в
растворах кислот ?
Лакмус Метиловый оранжевый Фенолфталеин -
18.
2. Взаимодействие с металлами (левее Нв ЭХРНМ):
Fe + 2HCl = FeCl2 + H2
3. Взаимодействие с основными и
амфотерными оксидами:
FeO + 2HCl = FeCl2 + H2O
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
4. Взаимодействие с основаниями:
Fe(OН)3 + 3HCl = FeCl3 + 3H2O
5. Взаимодействие с солями:
Na2S + 2HCl = 2NaCl + H2S
Pb(NO3)2 + 2HCl = PbCl2 + 2HNO3
19.
Галогениды металлов- соли галогеноводородных кислот.
NaCl, KI, CuBr2, FeCl3, AlF3 и др.
1. HHal и галогениды (кроме HF и F-)
окисляются сильными окислителями:
16HCl + 2KMnO4 = 2KCl + 2MnCl2 + 5Cl2 + 8H2O
5KCl + KClO3 + 3H2SO4 = 3K2SO4 + Cl2 + 3H2O
2KBr + 2H2SO4 (конц.) = K2SO4 + Br2 + SO2 + 2H2O
8HI + H2SO4 (конц.) = 4I2 + H2S + 4H2O
20.
2. Качественная реакция на HHal игалогениды (кроме HF и F-):
HHal + AgNO3 = AgHal + HNO3
NaHal + AgNO3 = AgHal + NaNO3
Ag+ + Cl- = AgCl
AgCl - белый творожистый осадок
Ag+ + Br- = AgBr
AgBr - желтоватый творожистый осадок
Ag+ + I- = AgI
AgI - жёлтый творожистый осадок
21.
Домашнее задание• §22, ответить на вопросы 1-7,
стр. 167, 168
• §23, ответить на вопросы 1-4,
стр. 174



















 Химия
Химия