Похожие презентации:
Соединения галогенов
1.
СОЕДИНЕНИЯГАЛОГЕНОВ
2.
К важнейшим соединениям галогенов относят галогеноводороды составаНЭ (Э — элемент галоген) и их водные растворы — галогеноводородные
кислоты, а также образуемые ими соли. Атомы в молекулах
галогеноводородов связаны ковалентной полярной одинарной σ-связью.
Важнейшее соединение хлора – соляная кислота HCl.
По физическим свойствам соляная кислота – бесцветный газ с резким
запахом, который тяжелее воздуха. Химическая связь – ковалентная
полярная.
Хорошо растворим в воде.
Соляная кислота = хлороводородная кислота. Эта кислота одноосновная,
т.к. около водорода нет индекса; эта кислота одноосновная, т.к. у
водорода степень окисления +1, у хлора (как у кислотного остатка) – 1.
В разбавленном растворе легко диссоциирует.
HCl=H++Cl-
3.
Главная характеристика для кислот – окраска индикатора: лакмус станет красным,метилоранж – розовым, фенолфталеин – бесцветным, индикаторная бумага –
красный.
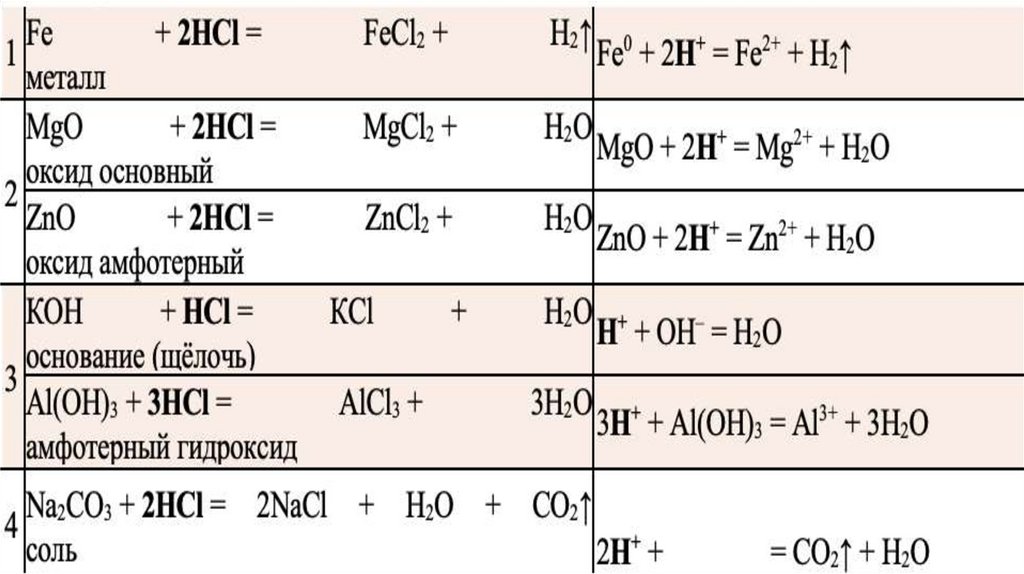
1)Соляная кислота взаимодействует с металлами, которые стоят в ряду активности до
водорода:
2HCl+Mg=MgCl2+H2
В этих реакциях водород выступает окислителем.
2)Соляная кислота реагирует с оксидами металлов:
2HCl+MgO=MgCl2+H2O
2H++MgO=Mg2++H2O
3)Соляная кислота реагирует со щелочами и нерастворимыми основаниями, где будет
образовываться соль+вода. Такая реакциях называется реакцией нейтрализации.
HCl+KOH=KCl+H2O
H++OH-=H2O
4) Соляная кислота реагирует с солями, но при условии, что образуется осадок, газ
или вода.
K2CO3+2HCl=2KCl+H2O+CO2
2H++CO32-=H2O+CO2
4.
5.
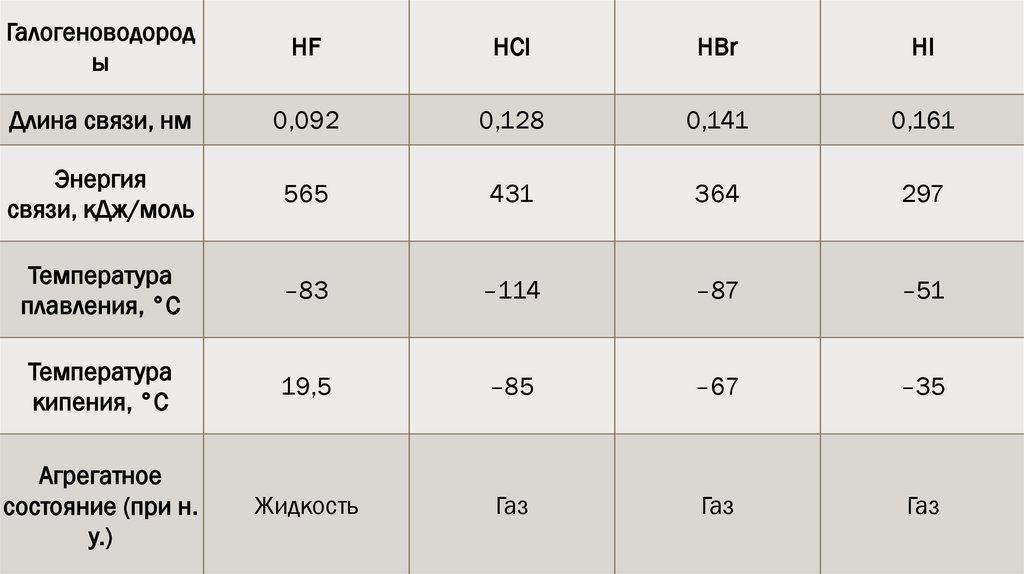
Галогеноводороды
HF
HCl
HBr
HI
Длина связи, нм
0,092
0,128
0,141
0,161
Энергия
связи, кДж/моль
565
431
364
297
Температура
плавления, °С
–83
–114
–87
–51
Температура
кипения, °С
19,5
–85
–67
–35
Агрегатное
состояние (при н.
у.)
Жидкость
Газ
Газ
Газ
6.
Фтороводородная кислота способна разрушать(«плавить») стекло Na2O ∙ CaO ∙ 6SiO2 в
соответствии с уравнением:
6НF + SiO2 = H2SiF6 + 2H2O
или
4HF(г) + SiO2 = SiF4↑ + 2H2O.
Галогеноводороды хорошо растворимы в воде и
представляют собой сильные кислоты: HBr → H++
Br–; HI → H+ + I–.
7.
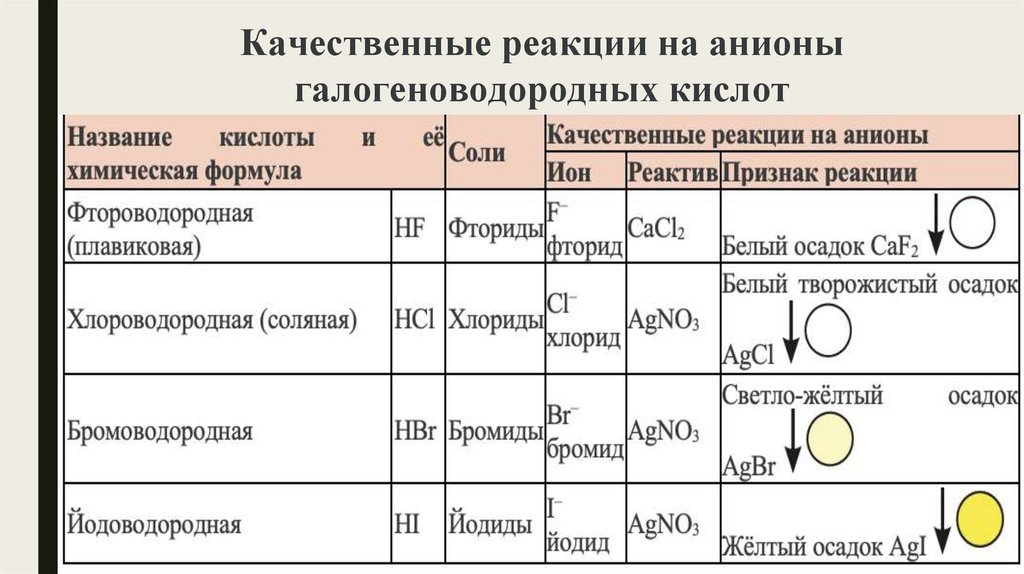
Качественные реакции на анионыгалогеноводородных кислот
8.
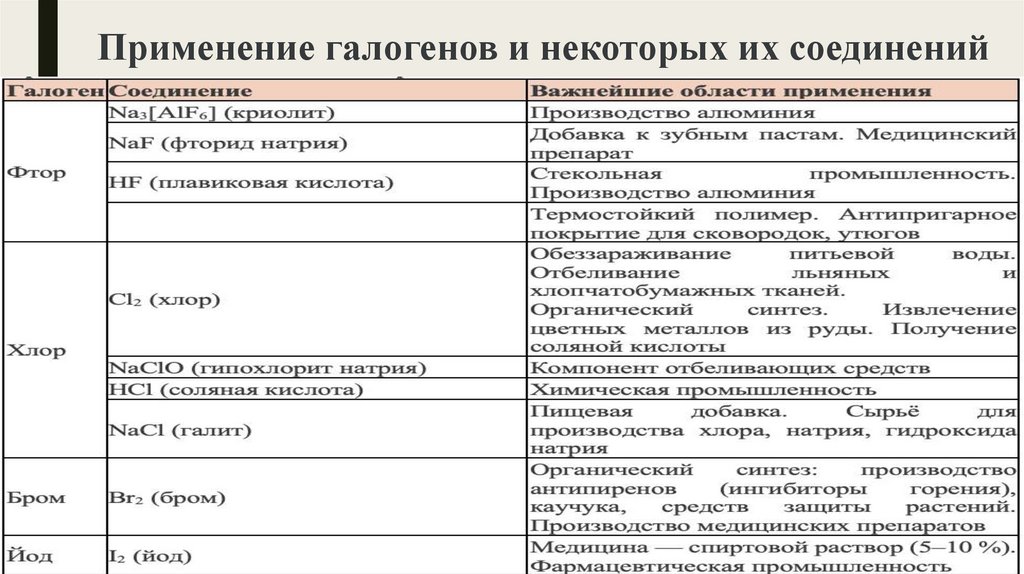
Применение галогенов и некоторых их соединений9.
№265, №278, №279,№280(а)
10.
Домашнее задание:параграф 31, №280 (б,в)






 Химия
Химия








