Похожие презентации:
Классификация химических реакций в неорганической и органической химии
1.
В романе Г.Р.Хаггарда «Клеопатра» естьследующие строки:
«…она вынула из уха одну из тех огромных
жемчужин… и… опустила жемчужину в уксус.
Наступило молчание, потрясенные гости, замерев,
наблюдали, как несравненная жемчужина
медленно исчезает в крепком уксусе. Вот от нее
не осталось и следа…».
2.
«Природа, по-видимому любитпревращения»
И. Ньютона
3.
Классификация химическихреакций в неорганической и
органической химии
4.
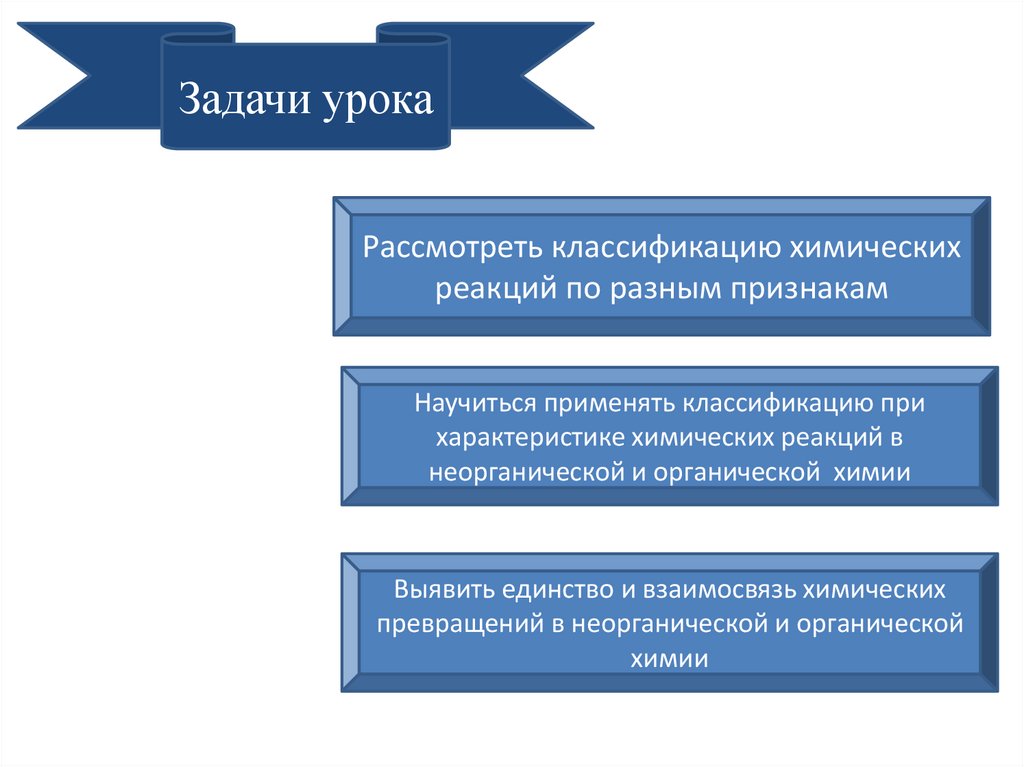
Задачи урокаРассмотреть классификацию химических
реакций по разным признакам
Научиться применять классификацию при
характеристике химических реакций в
неорганической и органической химии
Выявить единство и взаимосвязь химических
превращений в неорганической и органической
химии
5.
Признаки классификациихимических реакций :
1. По числу и составу исходных веществ и
продуктов реакции
2. По тепловому эффекту
3. По признаку обратимости
4. По признаку изменения степеней
окисления элементов
5. По агрегатному состоянию веществ
6. По наличию катализатора
6.
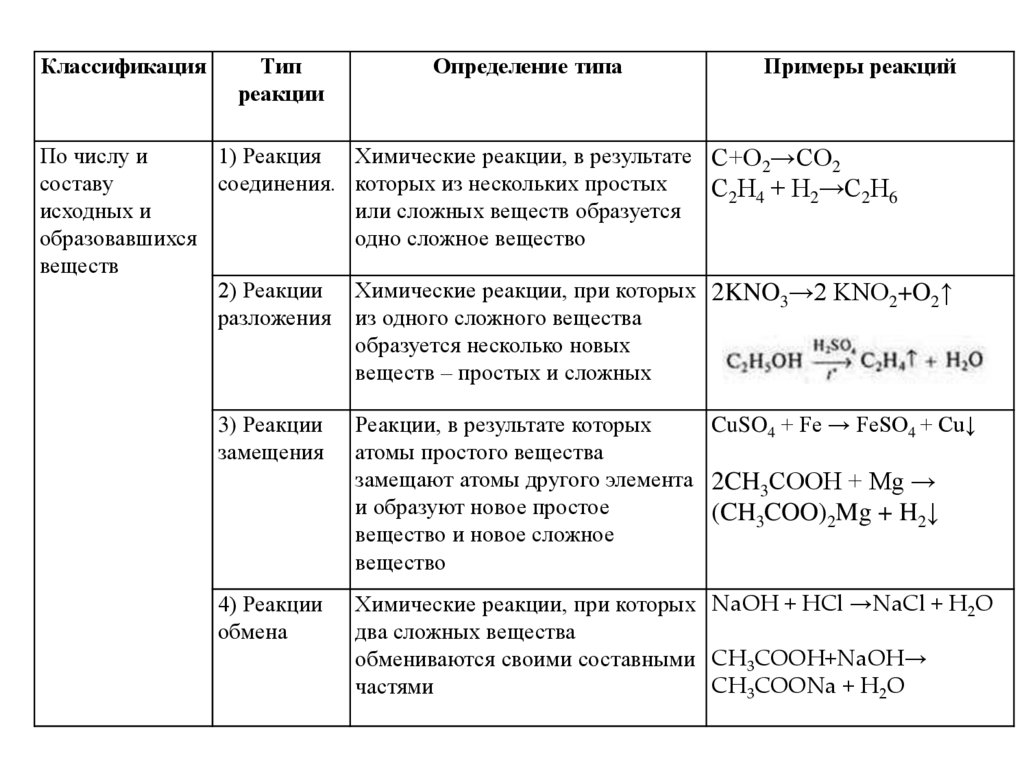
КлассификацияТип
реакции
По числу и
1) Реакция
составу
соединения.
исходных и
образовавшихся
веществ
2) Реакции
разложения
Определение типа
Примеры реакций
Химические реакции, в результате С+О2→СО2
которых из нескольких простых
С2Н4 + Н2→С2Н6
или сложных веществ образуется
одно сложное вещество
Химические реакции, при которых 2KNO3→2 KNO2+O2↑
из одного сложного вещества
образуется несколько новых
веществ – простых и сложных
3) Реакции
замещения
Реакции, в результате которых
CuSO4 + Fe → FeSO4 + Cu↓
атомы простого вещества
замещают атомы другого элемента 2CH3COOH + Mg →
и образуют новое простое
(CH3COO)2Mg + H2↓
вещество и новое сложное
вещество
4) Реакции
обмена
Химические реакции, при которых NaOH + HCl →NaCl + H2O
два сложных вещества
обмениваются своими составными CH3COOH+NaOH→
CH3COONa + H2O
частями
7.
По тепловому 1)Экзотермические Реакции, вэффекту
реакции
результате которых
выделяется тепло.
Как правило,
реакции горения,
многие реакции
соединения, в
органической
химии реакции
гидрирования,
галогенирования
4Р + 5О2 = 2Р2О5 + Q
CH4 + 2О2 → СО2 + 2H2O + Q
2)Эндотермически Реакции, в
t
Cu(OH)2 → CuO + H2O – Q
е реакции
результате которых
тепло поглощается
t
C8H18 → C8H16 + H2 – Q
8.
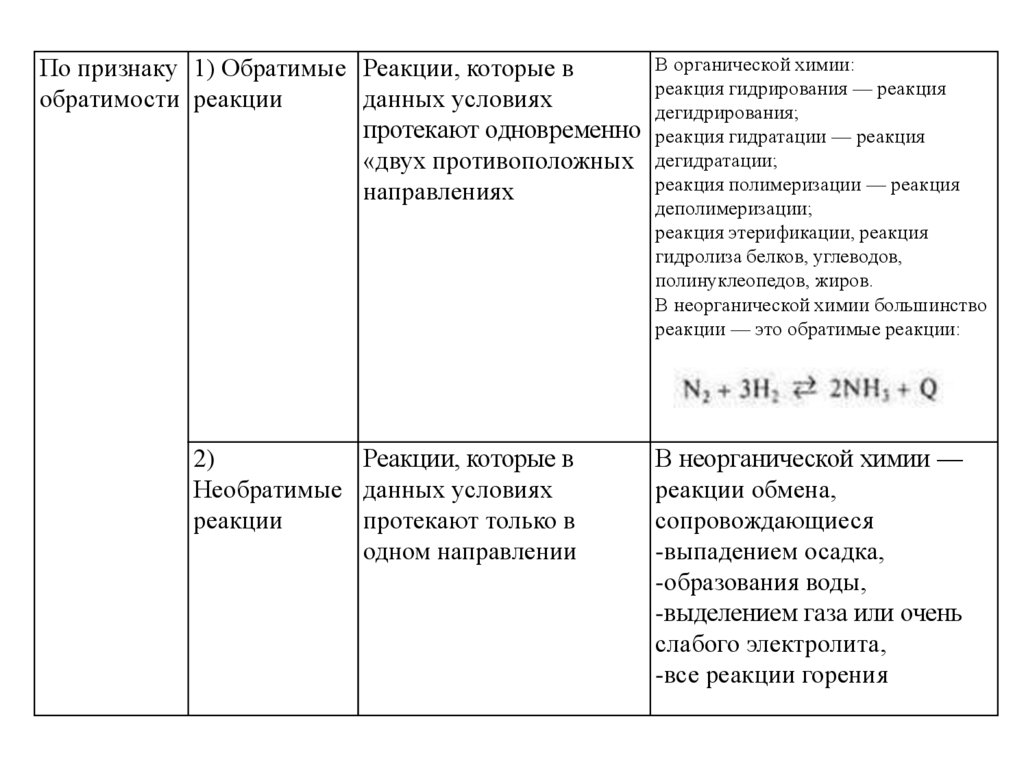
В органической химии:По признаку 1) Обратимые Реакции, которые в
реакция гидрирования — реакция
обратимости реакции
данных условиях
дегидрирования;
протекают одновременно реакция гидратации — реакция
«двух противоположных дегидратации;
реакция полимеризации — реакция
направлениях
деполимеризации;
реакция этерификации, реакция
гидролиза белков, углеводов,
полинуклеопедов, жиров.
В неорганической химии большинство
реакции — это обратимые реакции:
2)
Реакции, которые в
Необратимые данных условиях
реакции
протекают только в
одном направлении
В неорганической химии —
реакции обмена,
сопровождающиеся
-выпадением осадка,
-образования воды,
-выделением газа или очень
слабого электролита,
-все реакции горения
9.
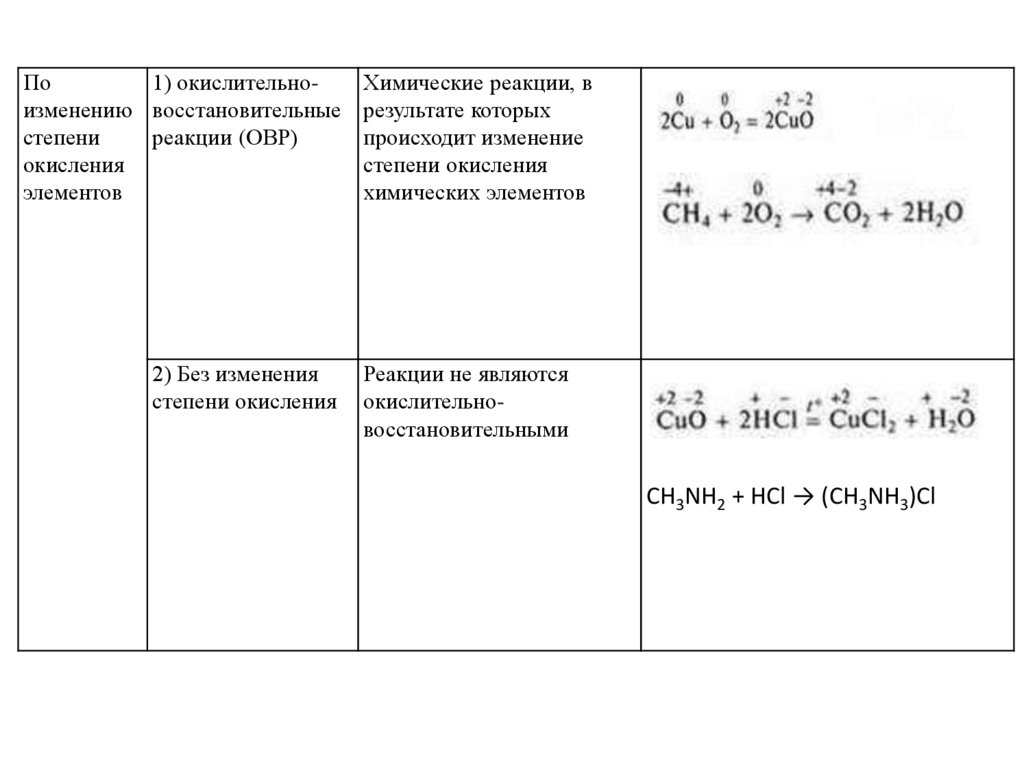
По1) окислительноизменению восстановительные
степени
реакции (ОВР)
окисления
элементов
2) Без изменения
степени окисления
Химические реакции, в
результате которых
происходит изменение
степени окисления
химических элементов
Реакции не являются
окислительновосстановительными
CH3NH2 + HCl → (CH3NH3)Cl
10.
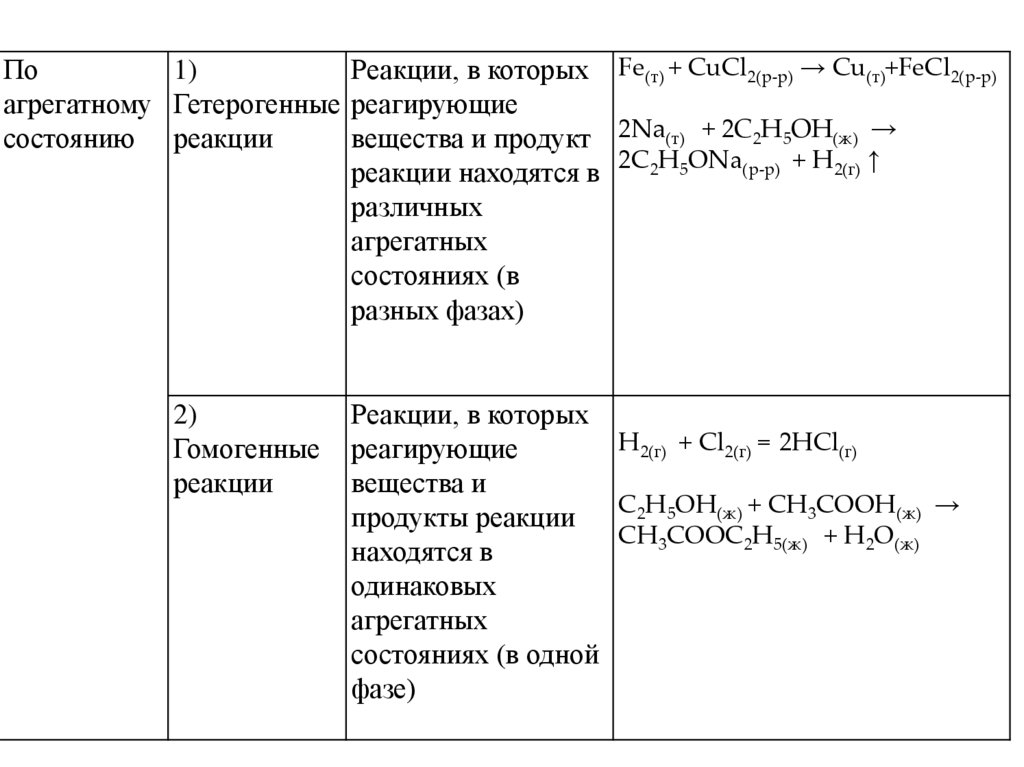
По1)
Реакции, в которых Fe(т) + CuCl2(р-р) → Cu(т)+FeCl2(р-р)
агрегатному Гетерогенные реагирующие
состоянию реакции
вещества и продукт 2Na(т) + 2C2H5OH(ж) →
реакции находятся в 2C2H5ONa(р-р) + H2(г) ↑
различных
агрегатных
состояниях (в
разных фазах)
2)
Гомогенные
реакции
Реакции, в которых
H2(г) + Cl2(г) = 2HCl(г)
реагирующие
вещества и
C2H5OH(ж) + CH3COOH(ж) →
продукты реакции
CH3COOC2H5(ж) + H2O(ж)
находятся в
одинаковых
агрегатных
состояниях (в одной
фазе)
11.
По наличию 1) Реакциикатализатора каталитические
Реакции, которые
идут с участием
катализатора
2) Реакции
Реакции без
некаталитические участия
катализатора
2Mg + O2 = 2MgO






 Химия
Химия








