Похожие презентации:
Простые эфиры
1.
ПРОСТЫЕ ЭФИРЫ2.
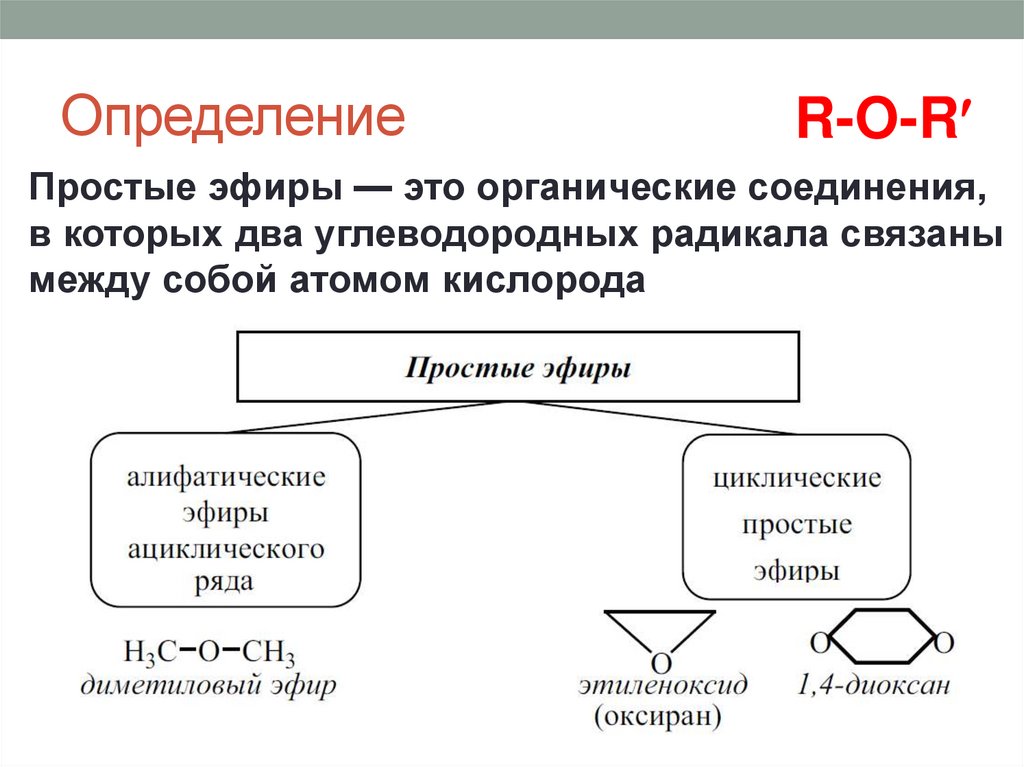
ОпределениеR-O-R
Простые эфиры — это органические соединения,
в которых два углеводородных радикала связаны
между собой атомом кислорода
3.
НоменклатураНизшие простые эфиры называют по радикальнофункциональной номенклатуре
Для симметричных эфиров используют умножающую
приставку ди-
4.
НоменклатураПростые эфиры сложного строения называют по
номенклатуре ИЮПАК как алкоксиалканы или
алкоксиарены
O-R – алкокси-группа
5.
Структурная изомерияИзомерия простых эфиров зависит от изомерии
радикалов, связанных с кислородом
• Изомерия строения цепи;
• Метамерия (изомерия, связанная с величиной
радикалов: диэтиловый (этоксиэтан) и
метилпропиловый (метоксипропан) эфиры);
• Межклассовая изомерия (простые эфиры изомерны
спиртам)
6.
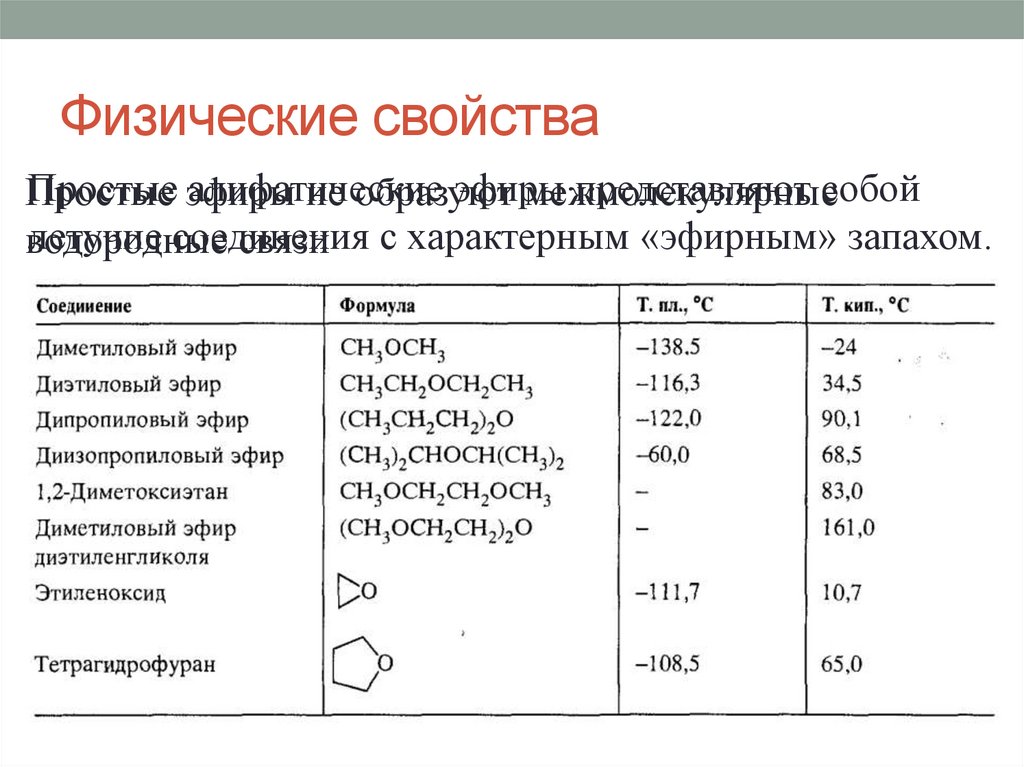
Физические свойстваПростые эфиры
алифатические
эфиры
представляют собой
не образуют
межмолекулярные
летучие соединения
водородные
связи с характерным «эфирным» запахом.
7.
Получение простых эфиров1. Межмолекулярная дегидратация
одноатомных спиртов
Наиболее старый способ, позволяющий получать лишь
симметричные эфиры из неразветвленных первичных
спиртов
8.
Получение простых эфиров1. Межмолекулярная дегидратация
одноатомных спиртов
В отличие от других вторичных и третичных спиртов
изопропиловый спирт в условиях кислотнокатализируемой конденсации также дает хороший выход
диизопропилового эфира
9.
Получение простых эфиров2. Синтез простых эфиров по А. Вильямсону
Образование простых эфиров происходит при
взаимодействии галогеналканов с алкоголятами
Для проведения реакции Вильямсона используют
первичные галогеналканы, так как вторичные и
третичные испытывают в условиях реакции SN
стерические затруднения
10.
Получение простых эфиров3. Алкилирование спиртов
11.
Получение простых эфиров4. Присоединение спиртов к алкенам
Протекает подобно реакции гидратации алкенов по
механизму электрофильного присоединения АE с
образованием эфиров в соответствии с правилом
Марковникова
12.
Получение простых эфиров4. Присоединение спиртов к алкенам
Легче проводить эту реакцию как алкоксимеркурирование алкенов, аналогично оксимеркурированию при
получении спиртов, с последующим демеркурированием посредством боргидрида натрия:
13.
Электронное строениеВ молекулах простых алифатических эфиров атом
кислорода находится в состоянии sp3-гибридизации
Связь С-О прочная и требует для расщепления
достаточно жестких условий. Поэтому простые эфиры
характеризуются высокой инертностью и устойчивы при
обычных условиях к действию кислот и щелочей,
металлическому натрию, металлорганическим
соединениям, РCl5 и другим
14.
Электронное строениеЭлектронная плотность связи С-О смещена к кислороду,
и на углероде возникает частичный «+» заряд
Это, с одной стороны, создает возможность его атаки
сильными нуклеофилами, а с другой – обуславливает
подвижность водорода у α-углеродного атома
15.
Химические свойстваПростые эфиры – малоактивные соединения, они значительно менее реакционноспособны, чем спирты.
Поэтому простые эфиры часто незаменимы в качестве
растворителей
16.
Химические свойства1. Свойства простых эфиров как оснований
Простые эфиры являются слабыми основаниями
Бренстеда-Лоури благодаря неподеленной электронной
паре атома кислорода, поэтому они способны
взаимодействовать с концентрированными сильными
кислотами (H2SO4, HCl) с образованием солей оксония:
17.
Химические свойства1. Свойства простых эфиров как оснований
Реакцию проводят при низких температурах в безводной
среде (например, растворяя простой эфир в холодной
концентрированной серной кислоте), так как
оксониевые соли нестойки, при действии воды они
гидролизуются до исходных соединений
18.
Химические свойства1. Свойства простых эфиров как оснований
Простые эфиры как основания Льюиса взаимодействуют
с кислотами Льюиса (AlCl3, BF3, ZnCl2, SnCl4), образуя в
качестве продуктов реакции очень прочные оксониевые
соединения – эфираты:
19.
Химические свойства1. Свойства простых эфиров как оснований
Простые эфиры образуют комплексы также со многими
металлорганическими соединениями, в том числе с
реактивами Гриньяра
20.
Химические свойства2. Расщепление связи С-О (реакции SN)
Простые эфиры не подвергаются щелочному гидролизу,
но возможно их кислотное расщепление, которое
осуществляют при нагревании (120–150ºС) простого
эфира с концентрированными (48%) водными
растворами НI или НВr
21.
Химические свойства2. Расщепление связи С-О (реакции SN)
В этих условиях происходит образование оксониевых
соединений, у которых связь С-О расшатывается из-за
сближенности одноименных положительных зарядов на
α-углеродном атоме и кислороде, облегчая атаку αуглерода нуклеофилом (анионом кислоты)
22.
Химические свойства2. Расщепление связи С-О (реакции SN)
Реакционная способность галогеноводородов зависит от
нуклеофильности галогенид-аниона, которая убывает от
аниона иода к фторид-иону
23.
Химические свойства3. Замещение α-водородного атома
Простые эфиры легко вступают в реакцию радикального
галогенирования в α-положении
Легкость и селективность
реакции радикального замещения
обусловлена стабильностью
образующегося радикала
24.
α-Хлорзамещенные простые эфирыα-Хлорзамещенные простые эфиры сравнительно легко
вступают в реакции нуклеофильного замещения с
образованием многочисленных производных по αуглероду, что широко используют в органическом
синтезе
25.
Химические свойства4. Окисление
Алифатические эфиры легко окисляются кислородом
воздуха на свету, при этом происходит процесс
автоокисления, что обусловлено повышенной
реакционной способностью α-С-Н-связи к
гомолитическому разрыву
При стоянии эфира в освещенном помещении, он
образует взрывоопасные гидропероксиды, которые
могут стать причиной взрывов при перегонке эфира
26.
Химические свойства4. Окисление
Поэтому эфир нельзя перегонять досуха
27.
Химические свойства4. Окисление
Перед очисткой эфира путем перегонки необходимо
провести реакцию на выявление гидропероксидов в
смеси добавлением раствора иодида калия,
приводящего в присутствии гидроперекиси к выделению
свободного иода
28.
ЦИКЛИЧЕСКИЕ ЭФИРЫ29.
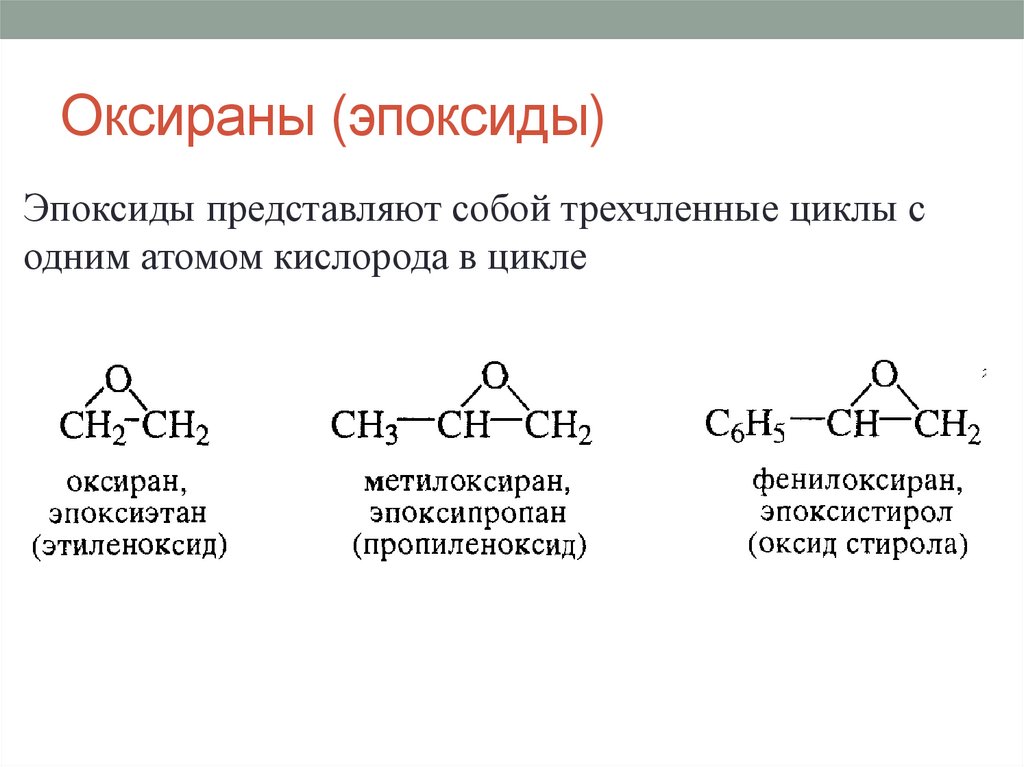
Оксираны (эпоксиды)Эпоксиды представляют собой трехчленные циклы с
одним атомом кислорода в цикле
30.
Получение эпоксидов1. Дегидрогалогенирование
галогенгидринов
Дегидрогалогенирование галогенгидринов
(внутримолекулярная реакция Вильямсона) протекает в
присутствии оснований:
31.
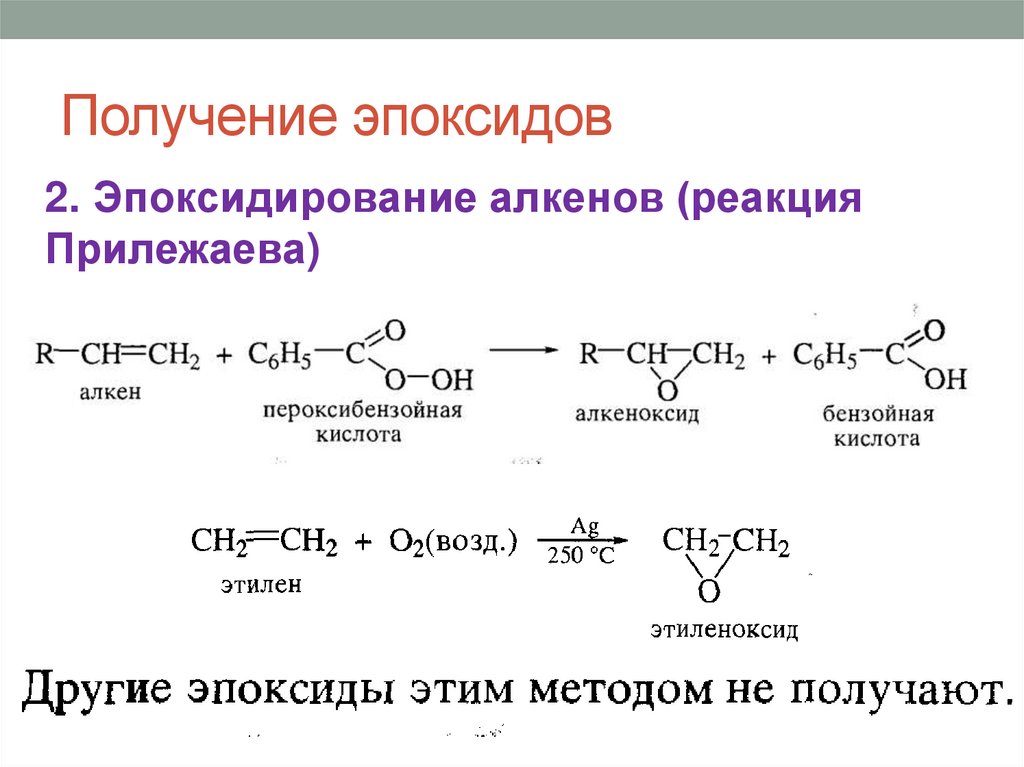
Получение эпоксидов2. Эпоксидирование алкенов (реакция
Прилежаева)
32.
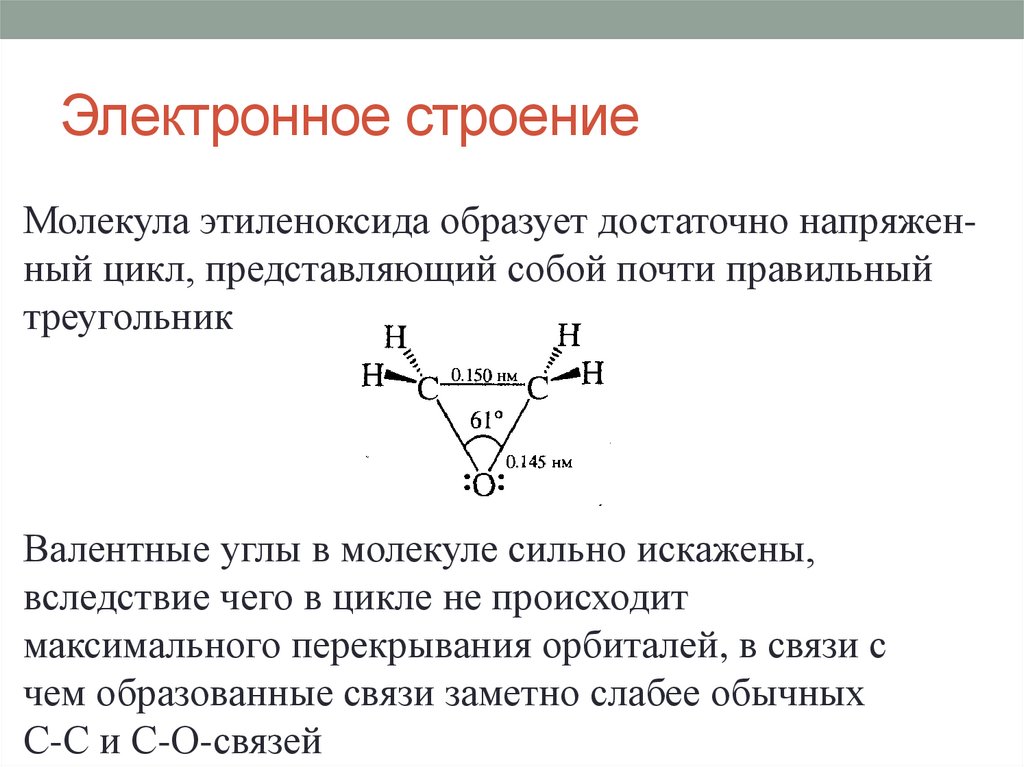
Электронное строениеМолекула этиленоксида образует достаточно напряженный цикл, представляющий собой почти правильный
треугольник
Валентные углы в молекуле сильно искажены,
вследствие чего в цикле не происходит
максимального перекрывания орбиталей, в связи с
чем образованные связи заметно слабее обычных
С-С и С-О-связей
33.
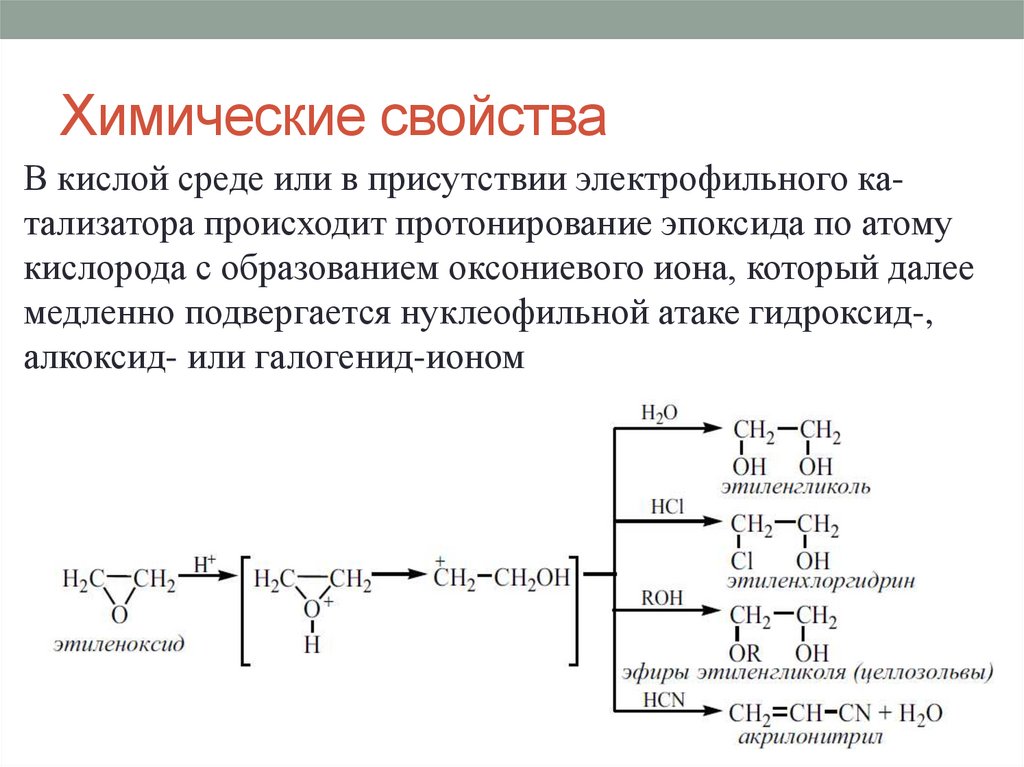
Химические свойстваВ кислой среде или в присутствии электрофильного катализатора происходит протонирование эпоксида по атому
кислорода с образованием оксониевого иона, который далее
медленно подвергается нуклеофильной атаке гидроксид-,
алкоксид- или галогенид-ионом



























 Химия
Химия








