Похожие презентации:
Электрофильные реакции
1. Лекция 5 электрофильные реакции
ЭЛЕКТРОФИЛЬНЫЕ реакции - гетеролитические реакцииорганических соедиений с электрофильными реагентами
(электрофилами).
К электрофилам относят ионы или молекулы, имеющие
низкую по энергии вакантную орбиталь - Н+, D+, Li+, Alk+, AlAlk3,
Hal+, BF3, SO3H+, NO+, NO+2 и др.- для принятия электронной
пары другой молекулы (иона).
Пример реакции
электрофильного замещения
в ароматическом ядре
2.
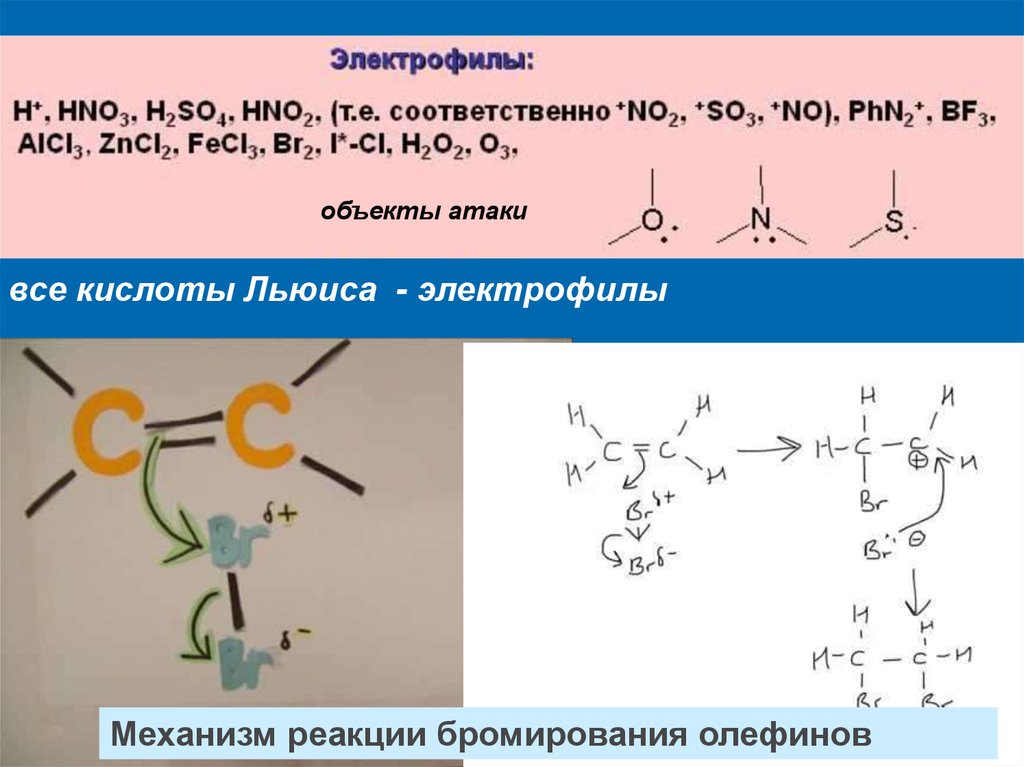
объекты атакивсе кислоты Льюиса - электрофилы
Механизм реакции бромирования олефинов
3. электрофильные реакции
замещения, присоединения, отщепленияsubstitution electrophilic reaction
SE1, SE2
для алифатического ряда соединений это
малая группа реакций по сравнению с
SEAr
ароматическим рядом
addition electrophilic reaction
elimination electrophilic
Ee
AdE1
AdE2
4. электрофильные реакции
замещенияsubstitution electrophilic reaction
SE1, SE2
для алифатического ряда соединений это
малая группа реакций по сравнению с
SEAr
ароматическим рядом
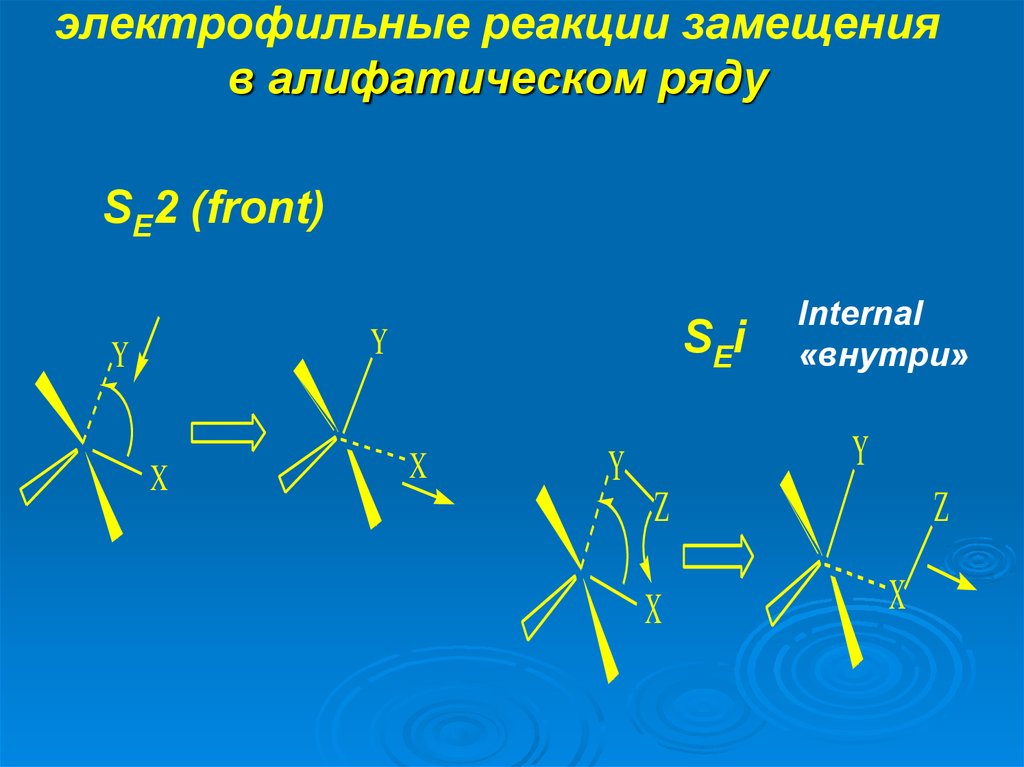
5. электрофильные реакции замещения в алифатическом ряду
Возможны три механизма р-ций:мономолекулярный
бимолекулярные
SE2 (back)
Substitution Electrophilic
SE1 ,
SE2
и
SEi
Internal
«внутри»
SE2 (front)
6. электрофильные реакции замещения в алифатическом ряду
SE2 (front)SEi
Y
Y
X
X
Internal
«внутри»
Y
Y
Z
X
Z
X
7. электрофильные реакции замещения в алифатическом ряду
SE1Y
+
-
R +X
R-X
аналогия:
SN1
SE2
SN2
+
R-Y + X
-
R +X
R-X
R-X
R-X
Y+
Y-
Y
-
+
Y
+
-
Y
R
R
+
X
X
-
+
-
R-Y + X
+
X
R-Y +
X
R-Y +
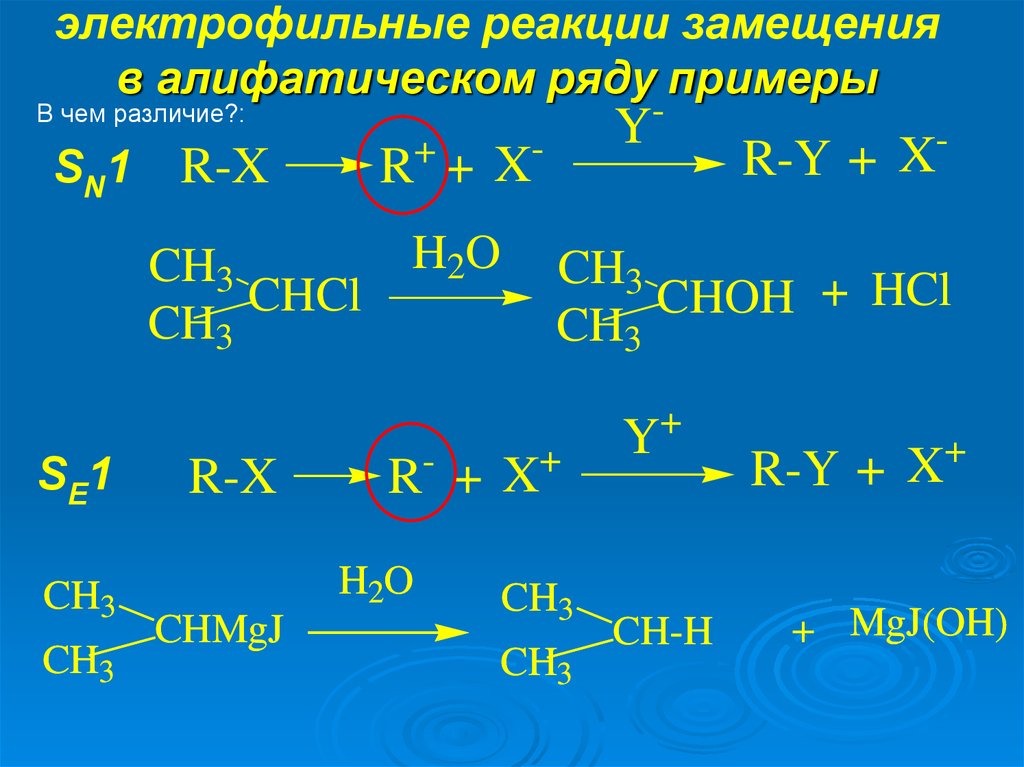
8. электрофильные реакции замещения в алифатическом ряду примеры
-В чем различие?:
SN1
R +X
R-X
CH3
CHCl
CH3
SE1
CH3
CH3
R-X
H2O
-
-
R-Y + X
CH3
CHOH + HCl
CH3
+
R +X
H2O
CHMgJ
Y
-
+
CH3
CH3
Y+
CH-H
+
X
R-Y +
+ MgJ(OH)
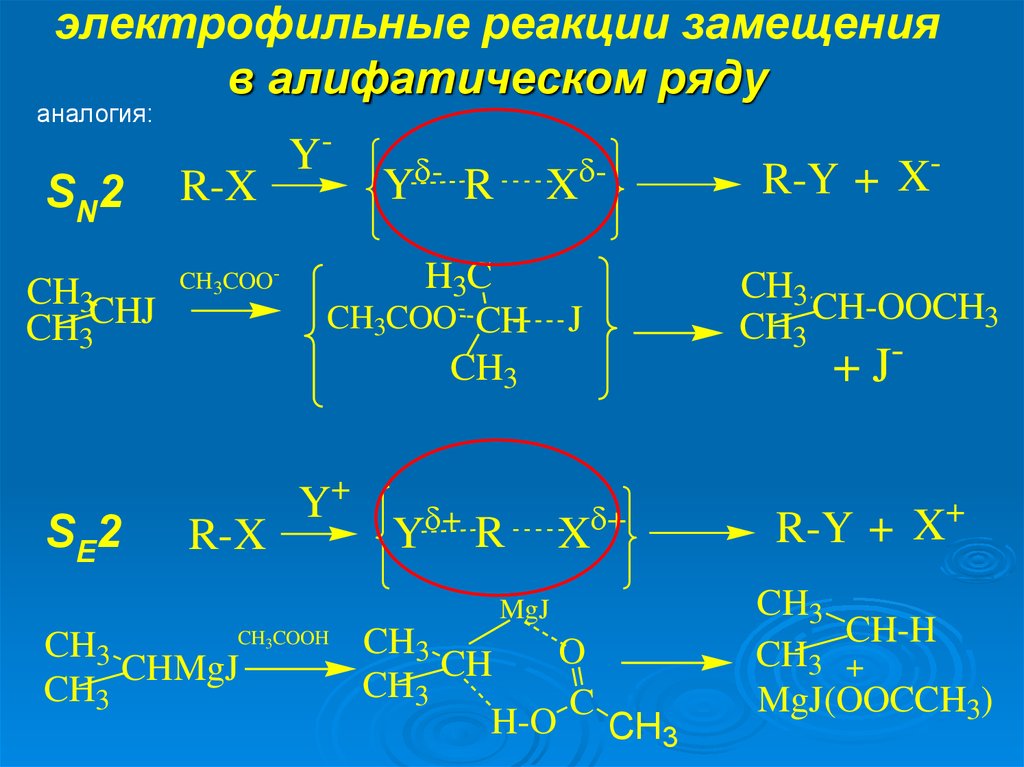
9. электрофильные реакции замещения в алифатическом ряду
аналогия:SN2
CH3CHJ
CH3
SE2
Y-
R-X
CH3COO-
R-X
-
Y
R
X
H3C
CH3COO- CH
CH3
Y+
Y
+
R
-
CH3
CH-OOCH3
CH3
J
+J
+
X
MgJ
CH COOH
CH3
CH3
O
CH
CHMgJ
CH3
CH3
C
H-O CH3
3
X
R-Y +
+
X
R-Y +
CH3
CH-H
CH3 +
MgJ(OOCCH3)
10.
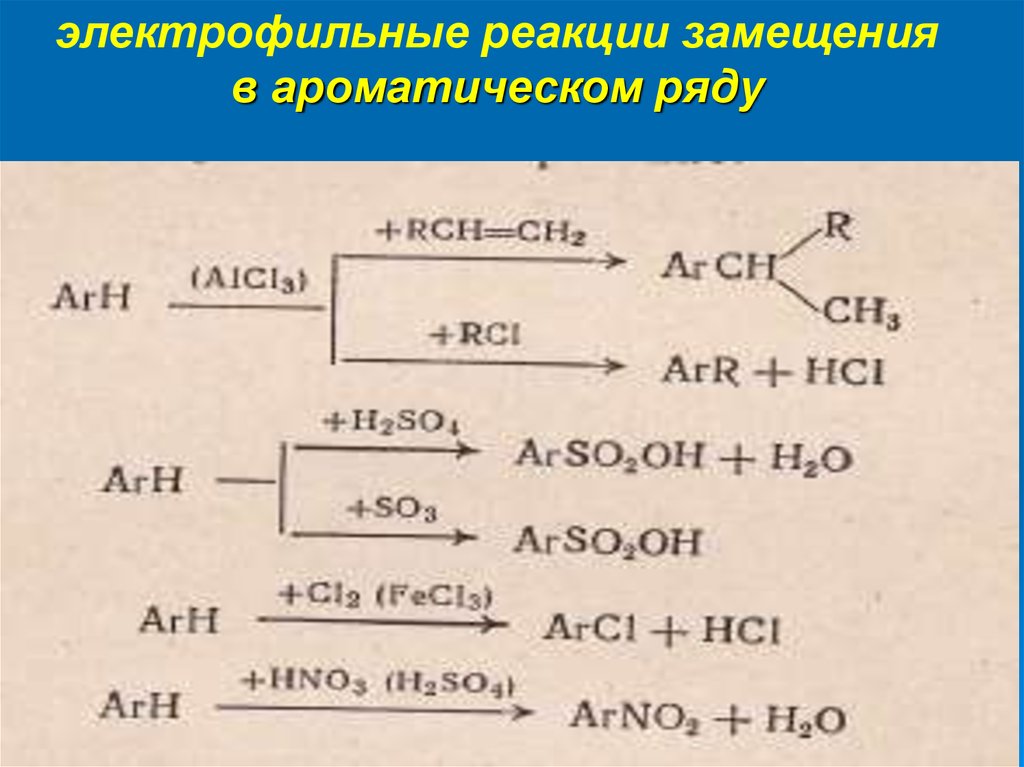
электрофильные реакции замещенияв ароматическом ряду
11.
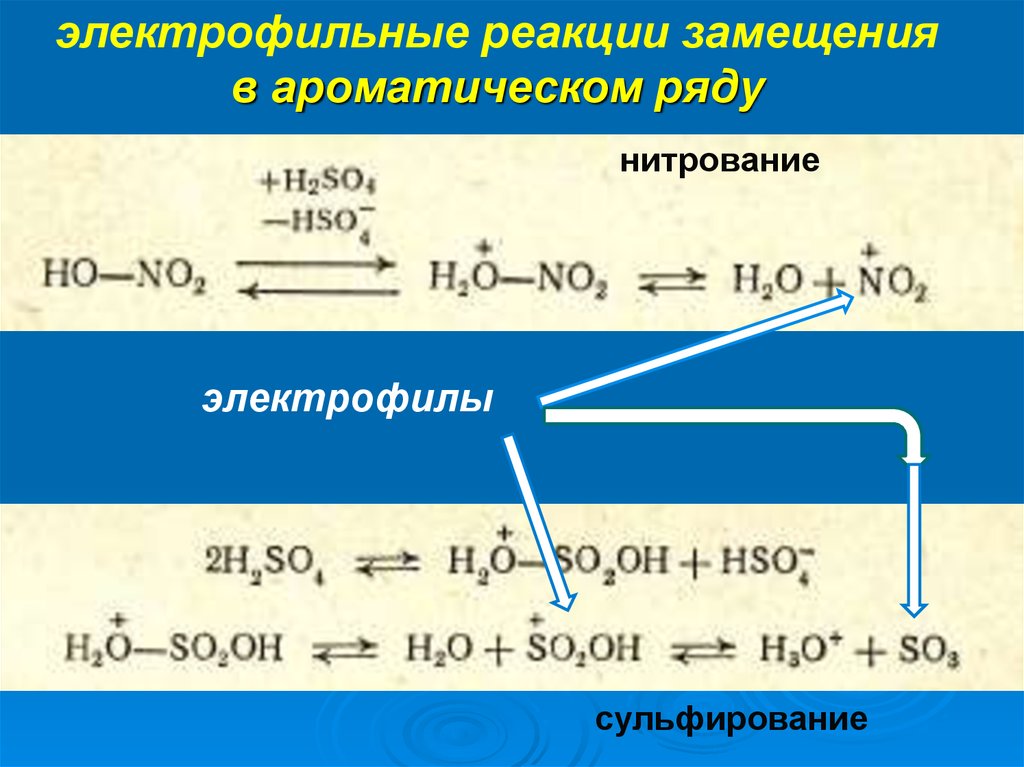
электрофильные реакции замещенияв ароматическом ряду
нитрование
электрофилы
сульфирование
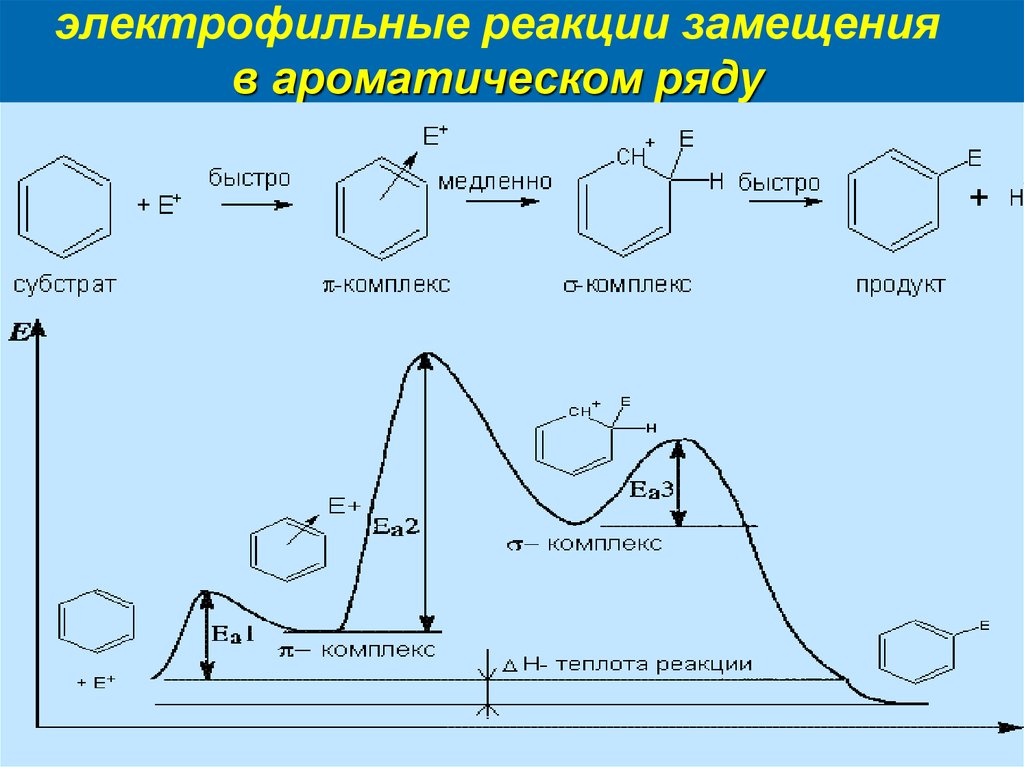
12. электрофильные реакции замещения в ароматическом ряду
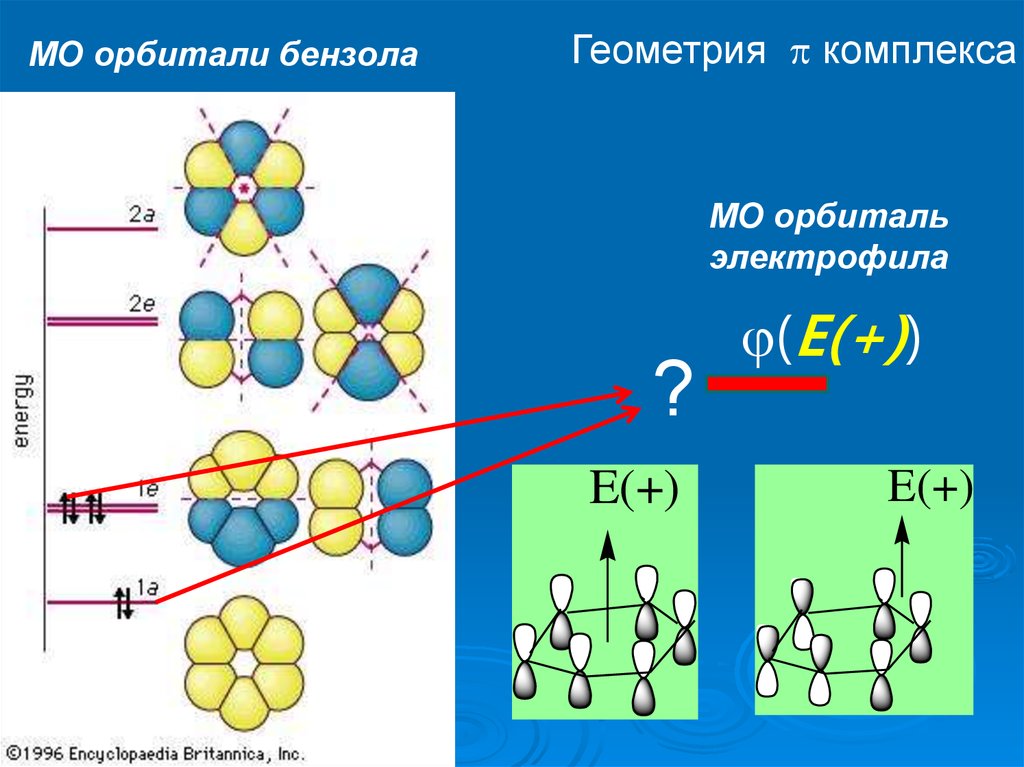
13.
МО орбитали бензолаГеометрия комплекса
МО орбиталь
электрофила
?
E(+)
(Е(+))
E(+)
14.
15.
Электрофильные реакцииЭлектрофильное замещение в ароматических системах
16.
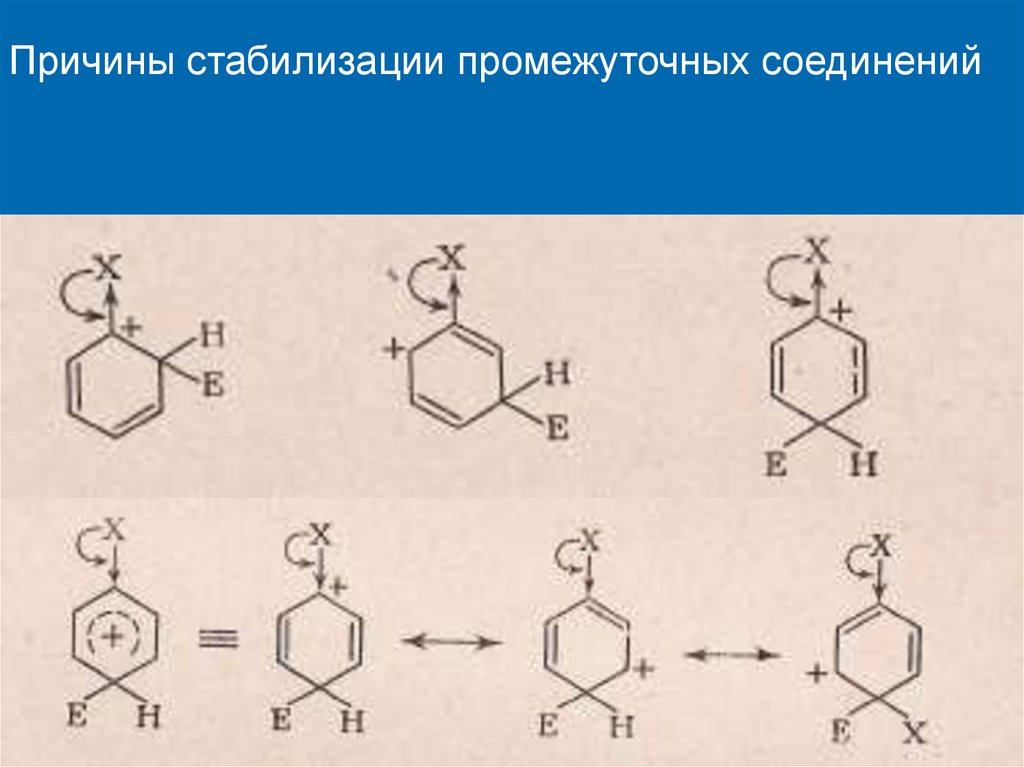
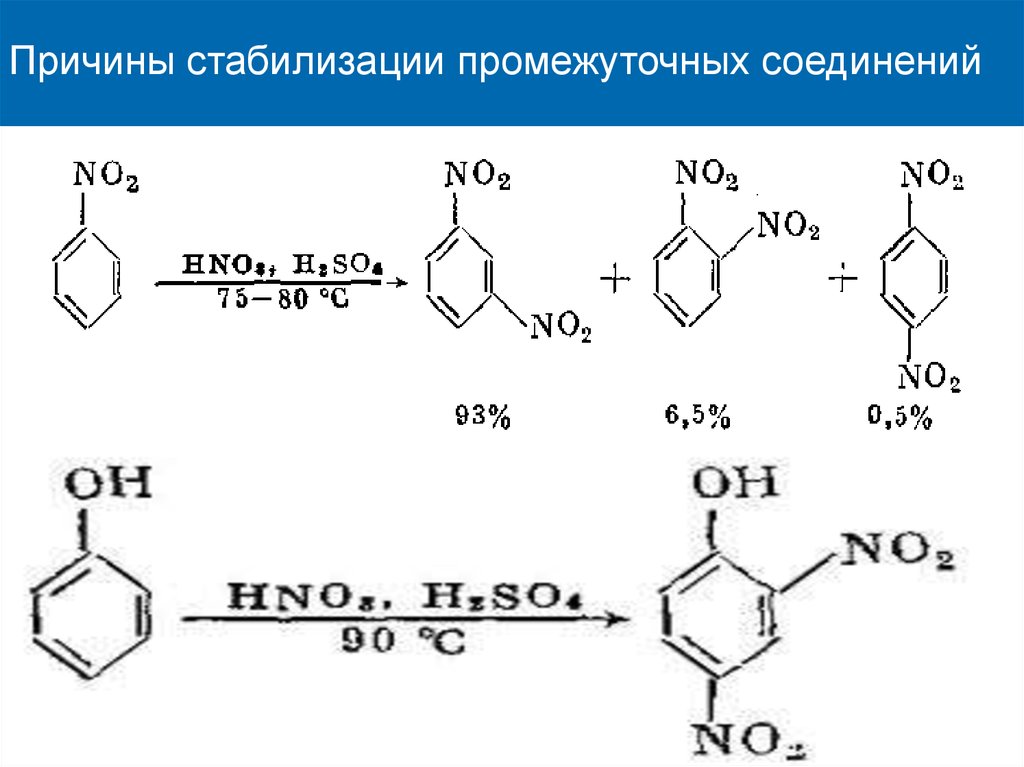
Причины стабилизации промежуточных соединений17.
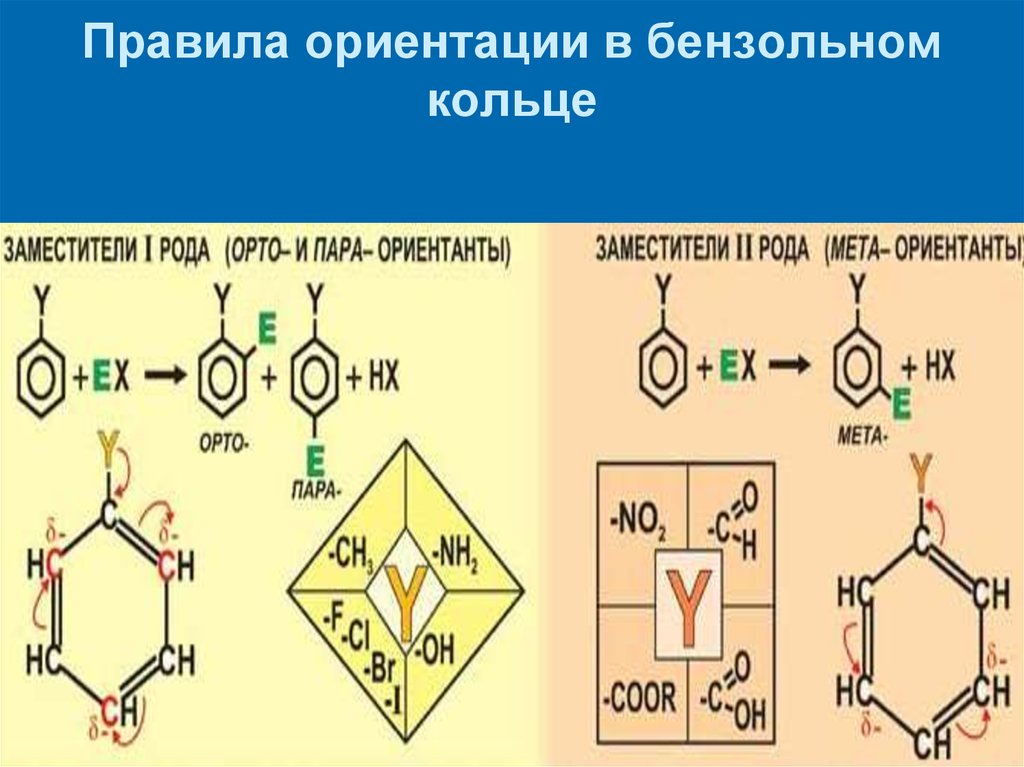
Причины стабилизации промежуточных соединений18. Правила ориентации в бензольном кольце
19.
kiLn
k0
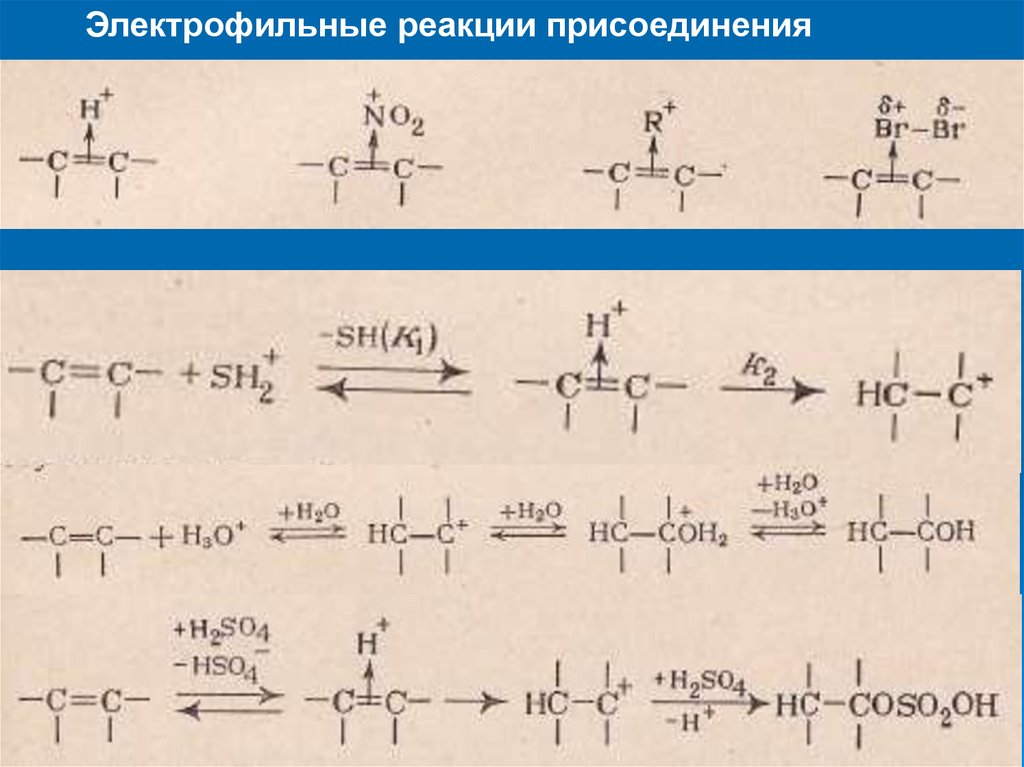
20. электрофильные реакции
присоединенияaddition electrophilic reaction
AdE1
AdE2
21.
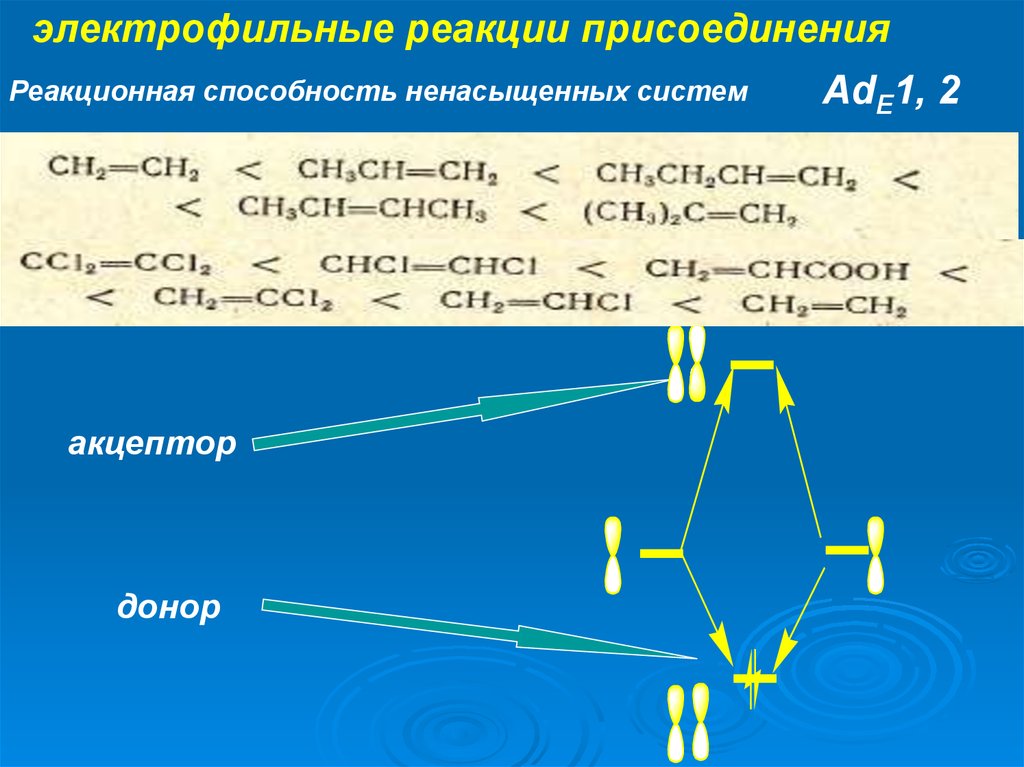
электрофильные реакции присоединенияРеакционная способность ненасыщенных систем
акцептор
донор
AdE1, 2
22.
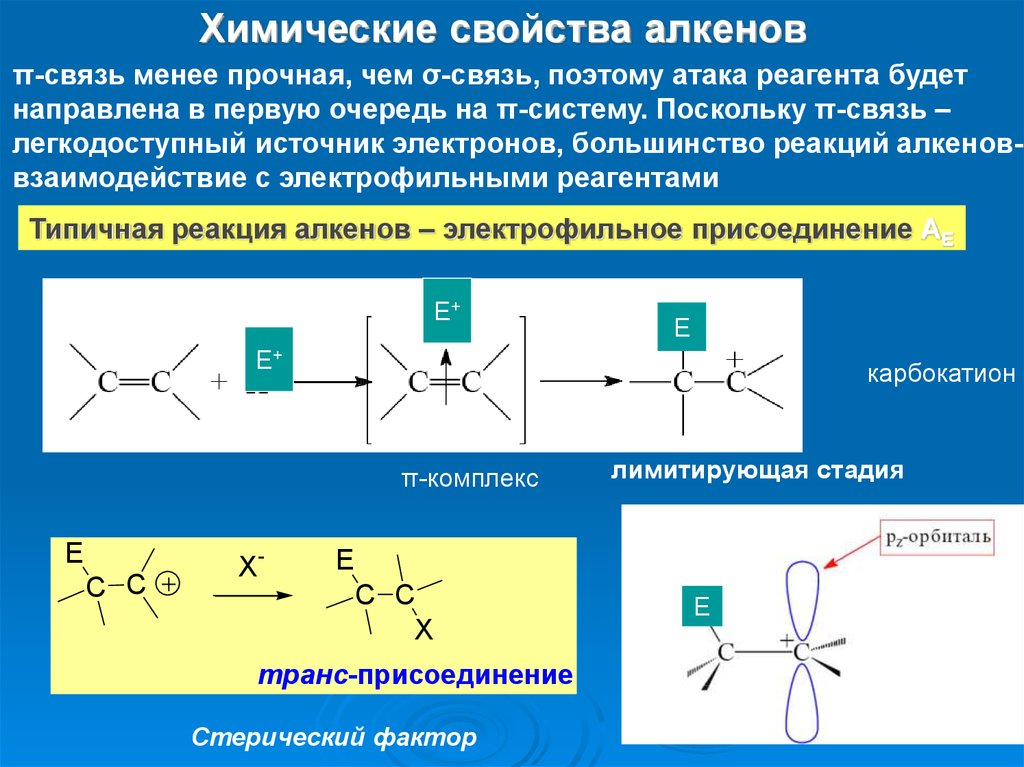
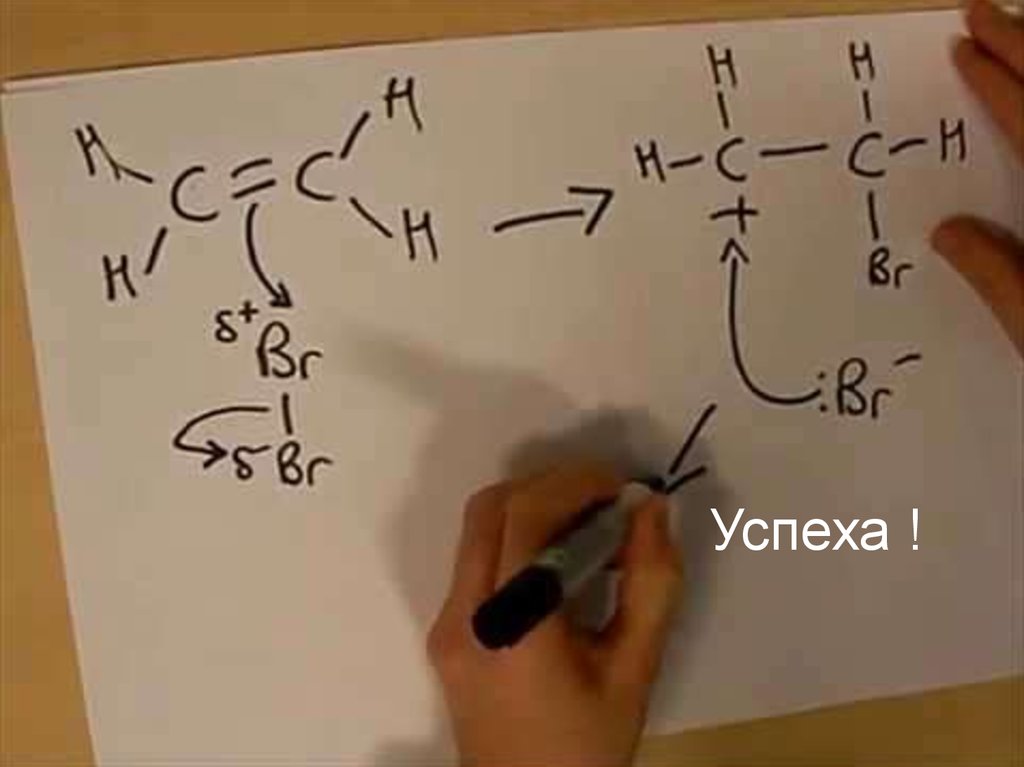
Химические свойства алкеновπ-связь менее прочная, чем σ-связь, поэтому атака реагента будет
направлена в первую очередь на π-систему. Поскольку π-связь –
легкодоступный источник электронов, большинство реакций алкеноввзаимодействие с электрофильными реагентами
Типичная реакция алкенов – электрофильное присоединение АЕ
E+
E
E+
карбокатион
π-комплекс
E
C C
X-
лимитирующая стадия
E
C C
X
транс-присоединение
Стерический фактор
E
23.
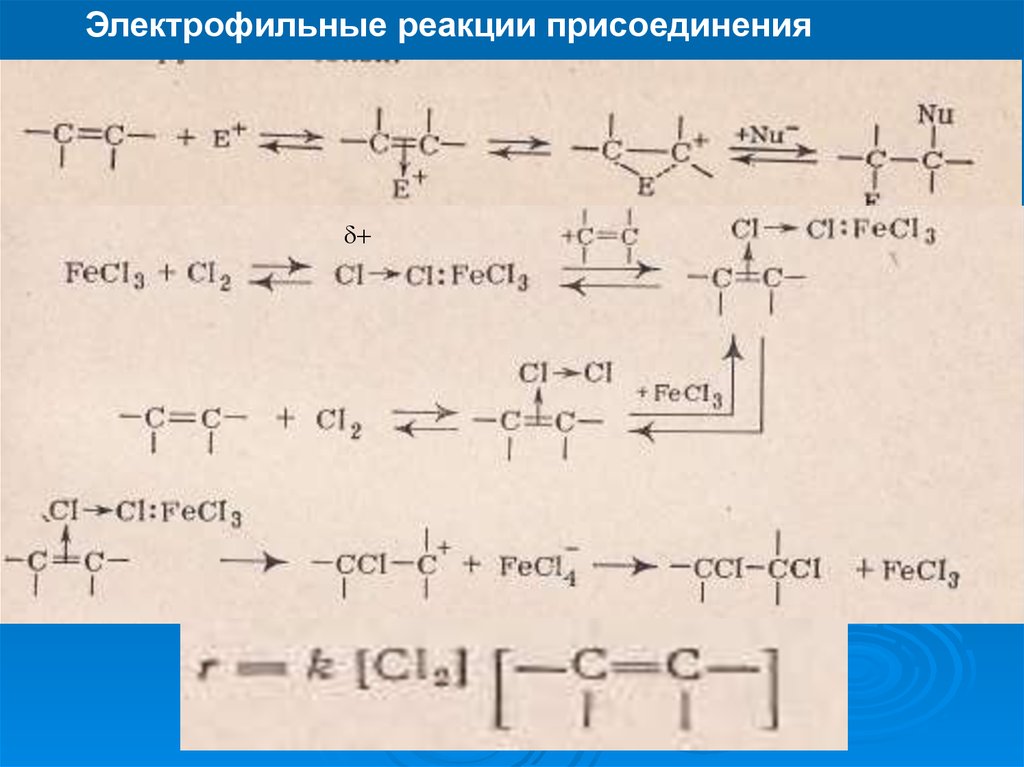
Электрофильные реакции присоединенияПрисоединение по двойной связи
24.
Электрофильные реакции присоединения25.
Электрофильные реакции присоединения+
26.
Электрофильные реакции присоединенияпромежуточный продукт
Активированный комплекс
27.
Электрофильные реакции присоединения28.
Взаимодействие с карбенамиC C
C C
C
H2
+ CH2
Карбены, являясь по сути электрофильными
агентами, способны присоединяться по
С=С-связи алкенов с образованием
циклоалканов.
Триплетный метилен реагирует нестереоспецифично:
H3C
H
H
H
C C
C C
или
H
CH3
H3C
CH3
h
+ CH2N2
газовая фаза
H3C CH3
C C
H
H
C
H2
Синглетный метилен реагирует стереоспецифично:
H
H
C C
H3C
CH3
H3C
H
C C
H
CH3
h
+ CH2N2
жидкая фаза
h
жидкая фаза
H3C CH3
C C
H
H
C
H2
H3C H
H C C CH3
C
H2
H3C H
+ H C C CH3
C
H2
29.
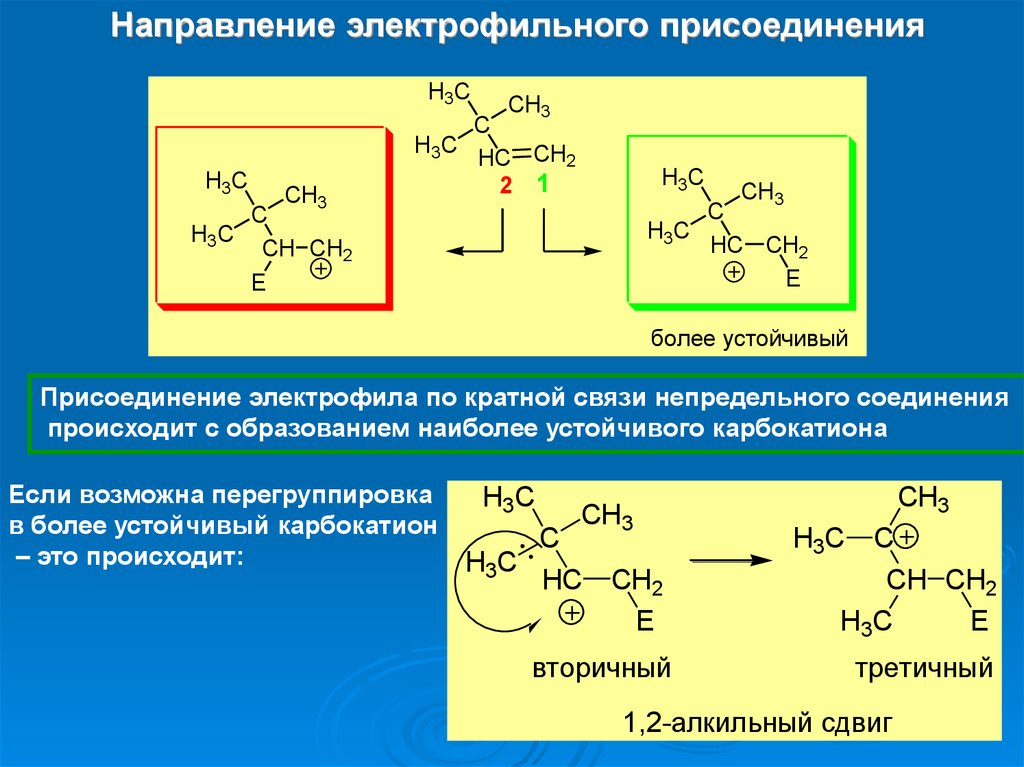
Направление электрофильного присоединенияH3C
H3C
H3C
CH3
CH3
C
H3C
HC CH2
2 1
H3C
CH3
C
H3C
HC CH2
E
C
CH CH2
E
более устойчивый
Присоединение электрофила по кратной связи непредельного соединения
происходит с образованием наиболее устойчивого карбокатиона
Если возможна перегруппировка
в более устойчивый карбокатион
– это происходит:
H3C
CH3
C
H3C
HC
CH3
H3C
CH2
E
C
CH CH2
H3C
E
вторичный
третичный
1,2-алкильный сдвиг
30.
Электрофильные реакции присоедиенияРеакционная способность ненасыщенных систем
?
31.
Основные закономерности гидратации алкенов:1. Кислотный катализ. Присоединение инициируется протоном;
2. Обратимость процесса гидратации;
3. Лимитирующая стадия – образование карбокатиона.
Присоединение протона происходит таким с образованием
наиболее устойчивого карбокатиона;
4. При образовании карбокатиона могут происходить перегруппировки
5. Гидратация алкенов приводит к образованию транс-продуктов;
6. Только в случае этилена может образовываться первичный спирт.
H
H H+
C C
H
H
H H
C C H
H H
H2O
H2O
C C
H
- H+
этилен
H
H+
C C
H
CH2CH3
1-фенилбутен-1
H
C C CH2CH3
H H
H2O
H2O H
C C CH2CH3
- H+
H H
OHH
H C C H
H H
этиловый
спирт
OH H
C C CH2CH3
H H
1-фенил-бутанол-1
32.
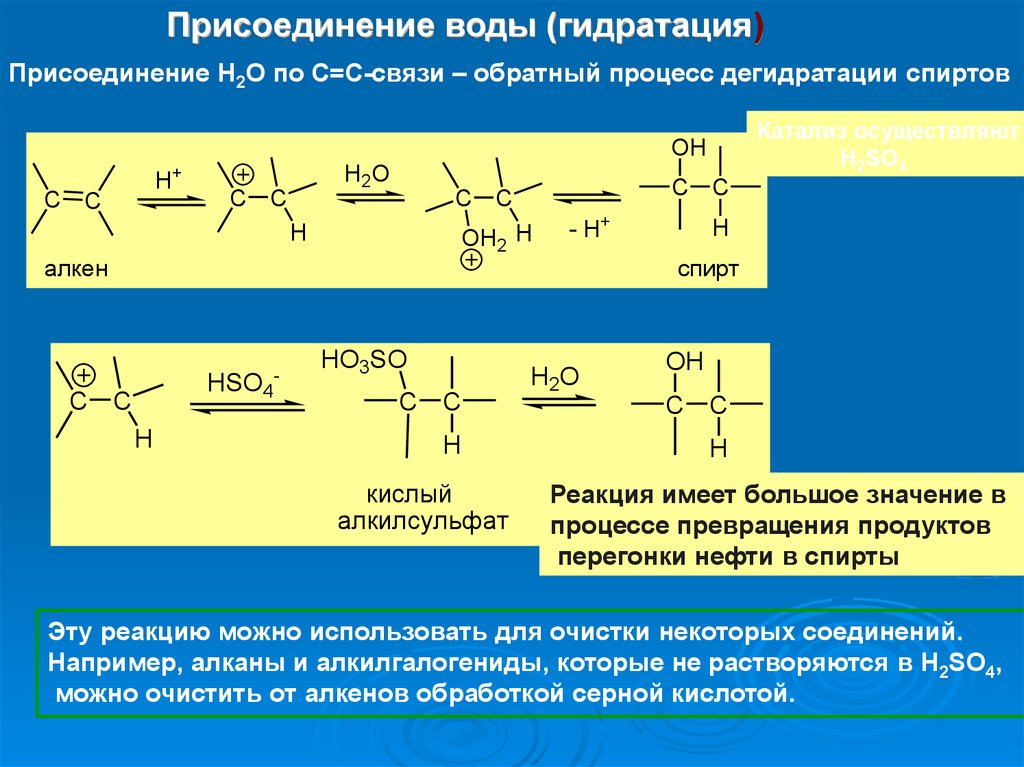
Присоединение воды (гидратация)Присоединение Н2О по С=С-связи – обратный процесс дегидратации спиртов
Катализ осуществляют
H2SO4
OH
H+
C C
H2O
C C
H
OH2 H
алкен
HSO4
C C
H
-
C C
C C
HO3SO
C C
H
кислый
алкилсульфат
- H+
H
спирт
H2O
OH
C C
H
Реакция имеет большое значение в
процессе превращения продуктов
перегонки нефти в спирты
Эту реакцию можно использовать для очистки некоторых соединений.
Например, алканы и алкилгалогениды, которые не растворяются в H2SO4,
можно очистить от алкенов обработкой серной кислотой.
33.
Электрофильные реакцииРеакционная способность ненасыщенных систем
кислотная изомеризация
34.
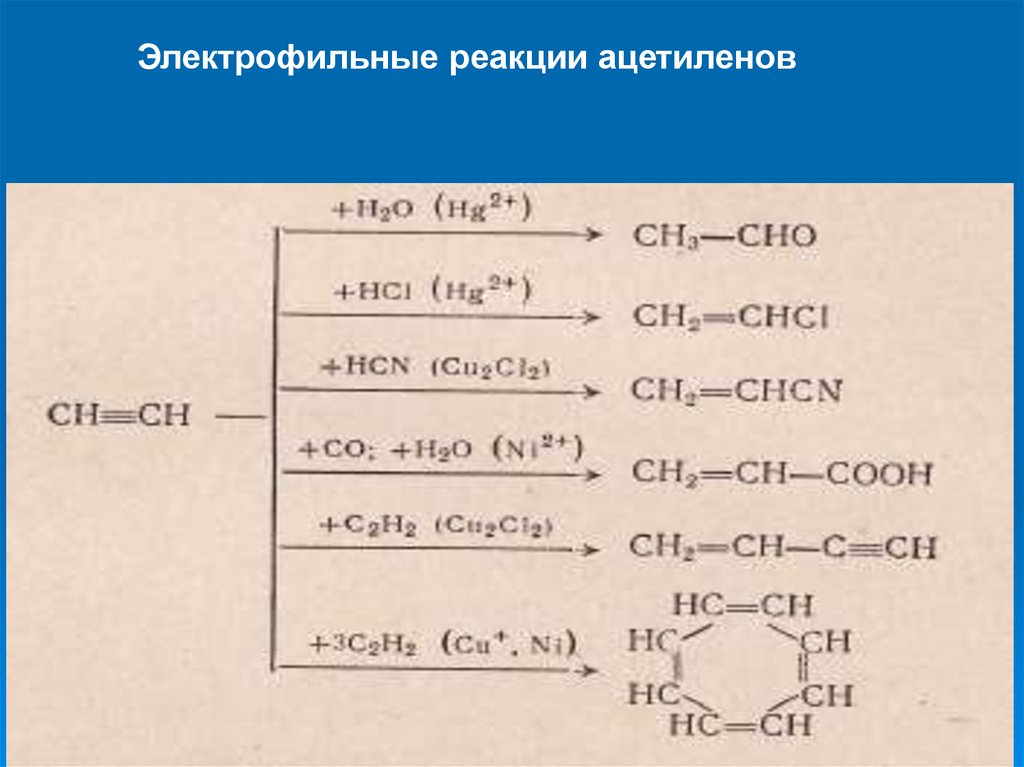
Электрофильные реакции ацетиленов35.
Электрофильные реакцииПрисоединение к ацетилену
36.
Общность и различие нуклеофильной иэлектрофильной атаки на олефин
Nu :
E (+)
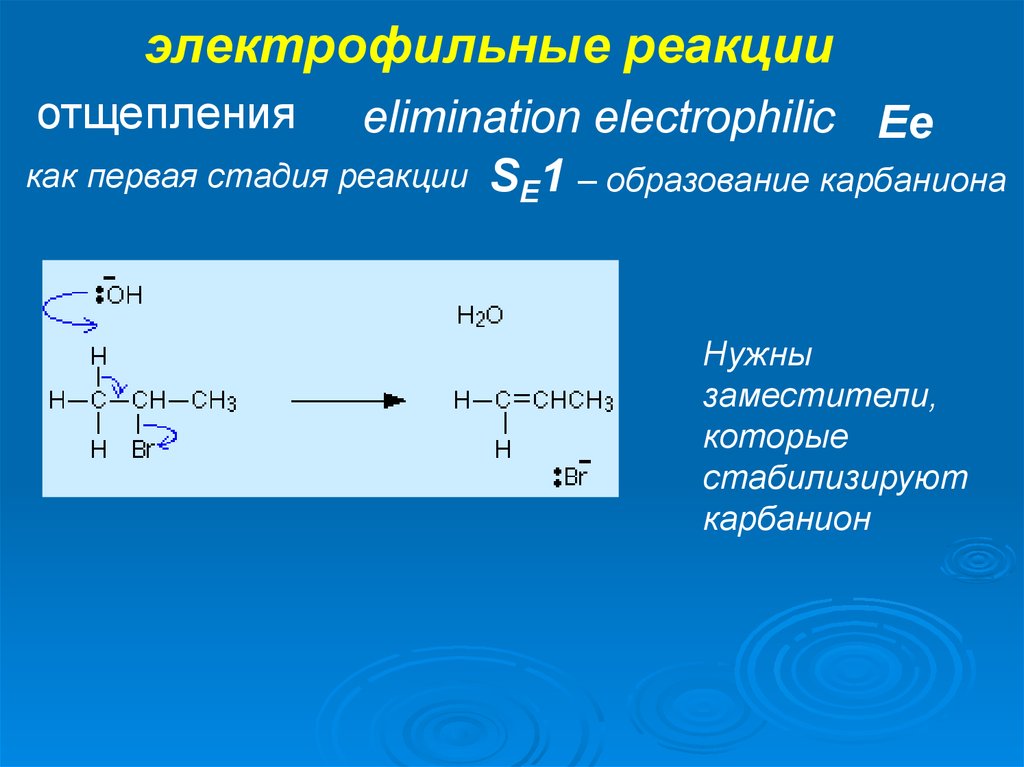
37. электрофильные реакции
отщепленияelimination electrophilic Ee
как первая стадия реакции SE1 – образование карбаниона
Нужны
заместители,
которые
стабилизируют
карбанион
38. электрофильные реакции
отщепленияelimination electrophilic Ee
как первая стадия реакции SE1 – образование карбаниона
Нужны
заместители,
которые
стабилизируют
карбанион



















 Химия
Химия








