Похожие презентации:
Физика полупроводников и полупроводниковых приборов. Основы зонной теории полупроводников
1.
Курс лекцийФизика полупроводников и
полупроводниковых приборов
Основы зонной теории полупроводников
1
2.
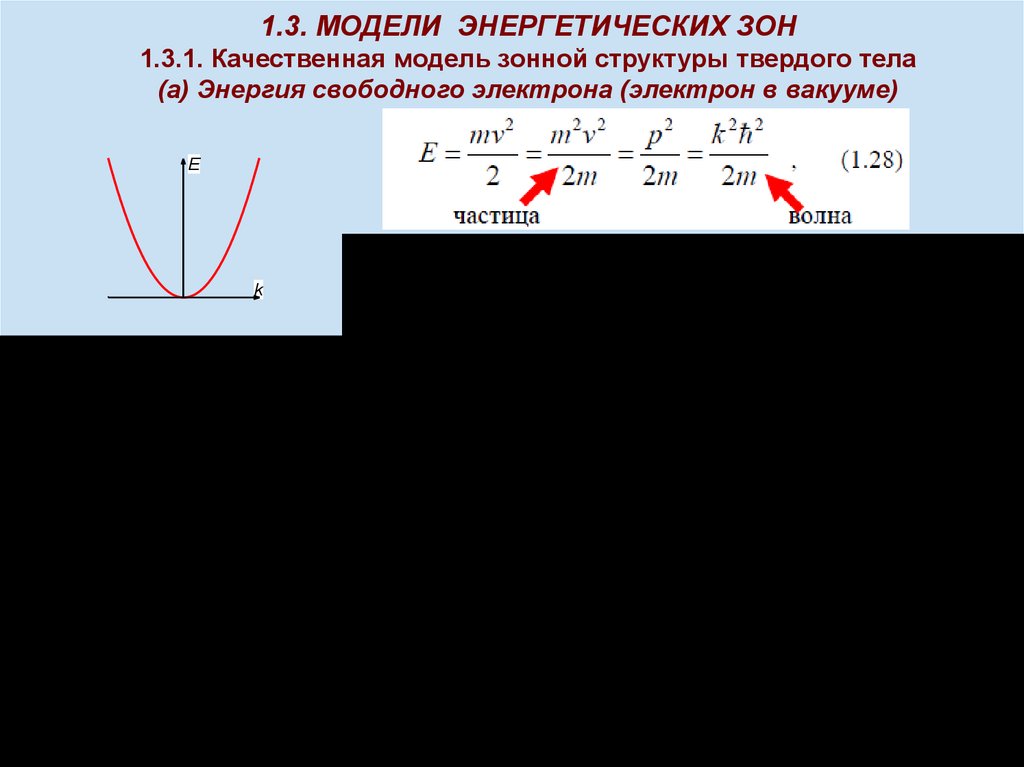
1.3. МОДЕЛИ ЭНЕРГЕТИЧЕСКИХ ЗОН1.3.1. Качественная модель зонной структуры твердого тела
(a) Энергия свободного электрона (электрон в вакууме)
E
k
,
k 2 ,
h =6,62х10-34 Дж·с
2
3.
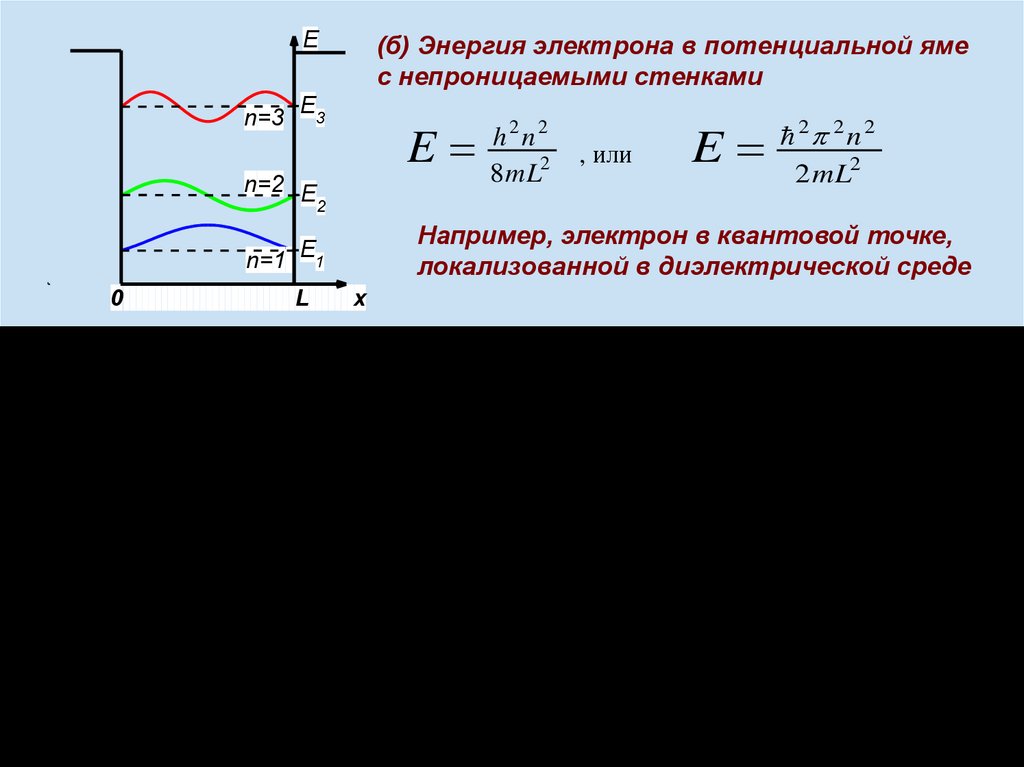
En=3
(б) Энергия электрона в потенциальной яме
с непроницаемыми стенками
E3
E
n=2 E
2
L
, или
E
2 2 n 2
2mL2
Например, электрон в квантовой точке,
локализованной в диэлектрической среде
n=1 E1
0
h2n2
8mL2
x
3
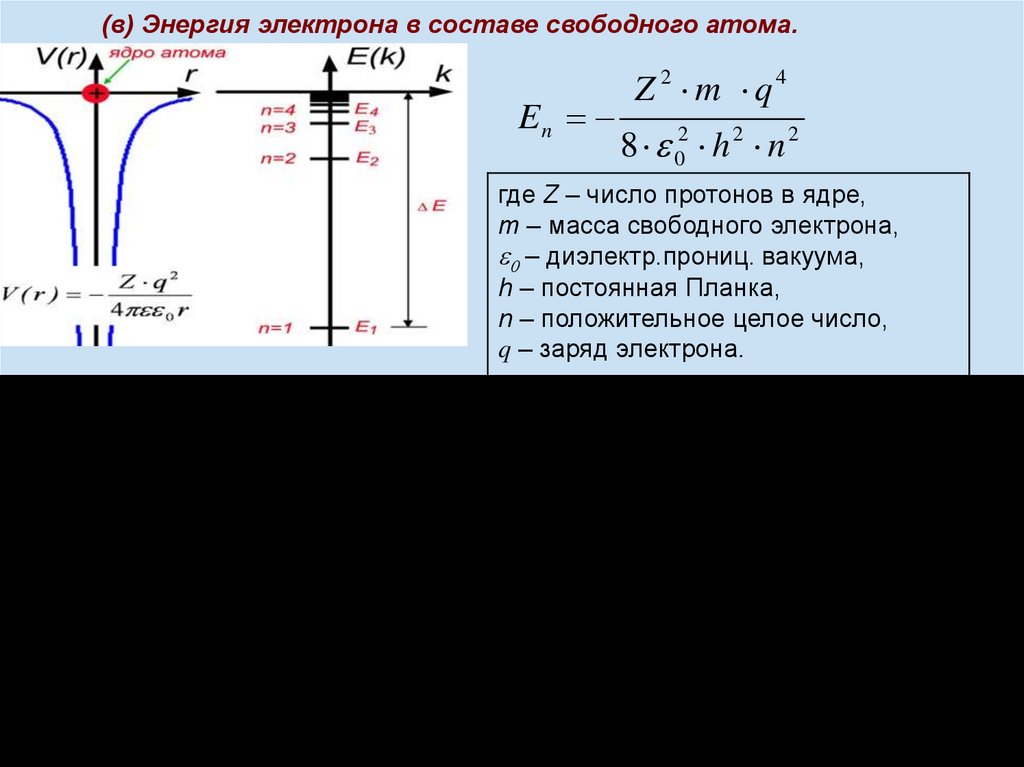
4.
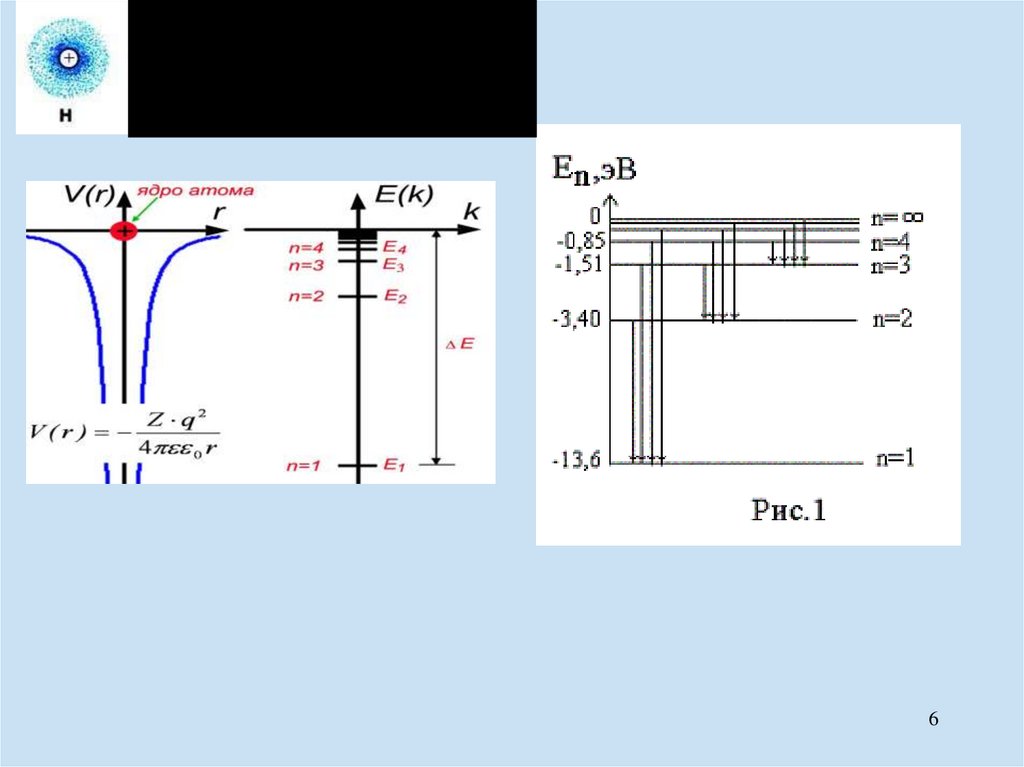
(в) Энергия электрона в составе свободного атома.En
Z 2 m q4
8 02 h 2 n 2
где Z – число протонов в ядре,
m – масса свободного электрона,
– диэлектр.прониц. вакуума,
h – постоянная Планка,
n – положительное целое число,
q – заряд электрона.
4
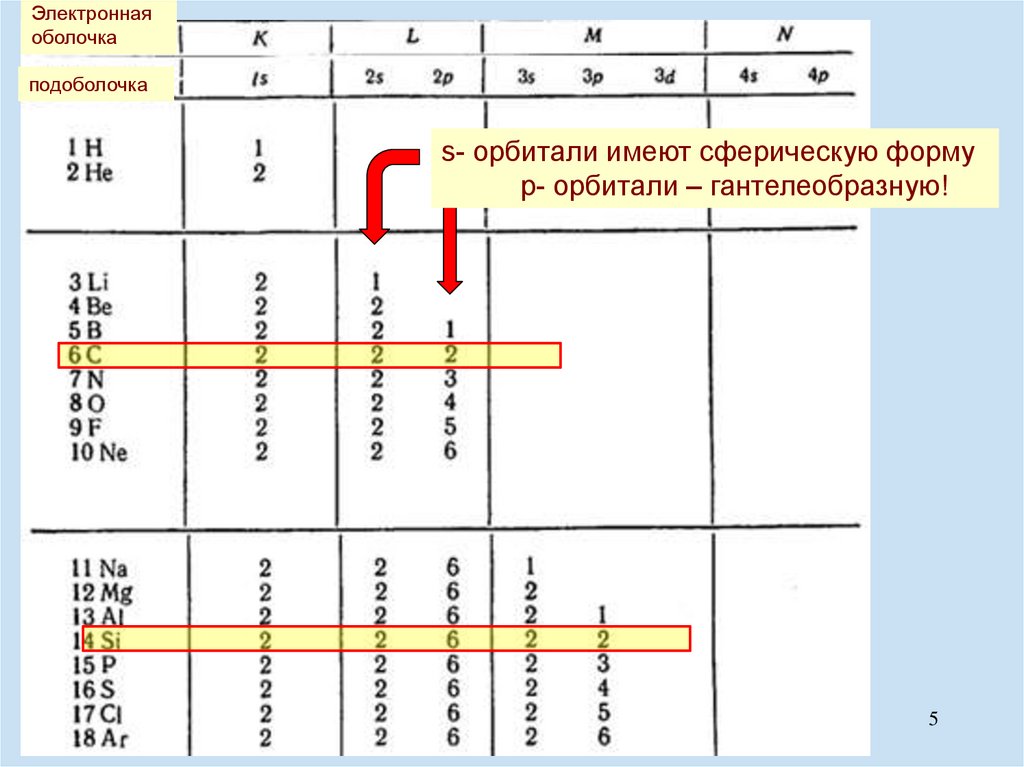
5.
Электроннаяоболочка
подоболочка
s- орбитали имеют сферическую форму
p- орбитали – гантелеобразную!
5
6.
67.
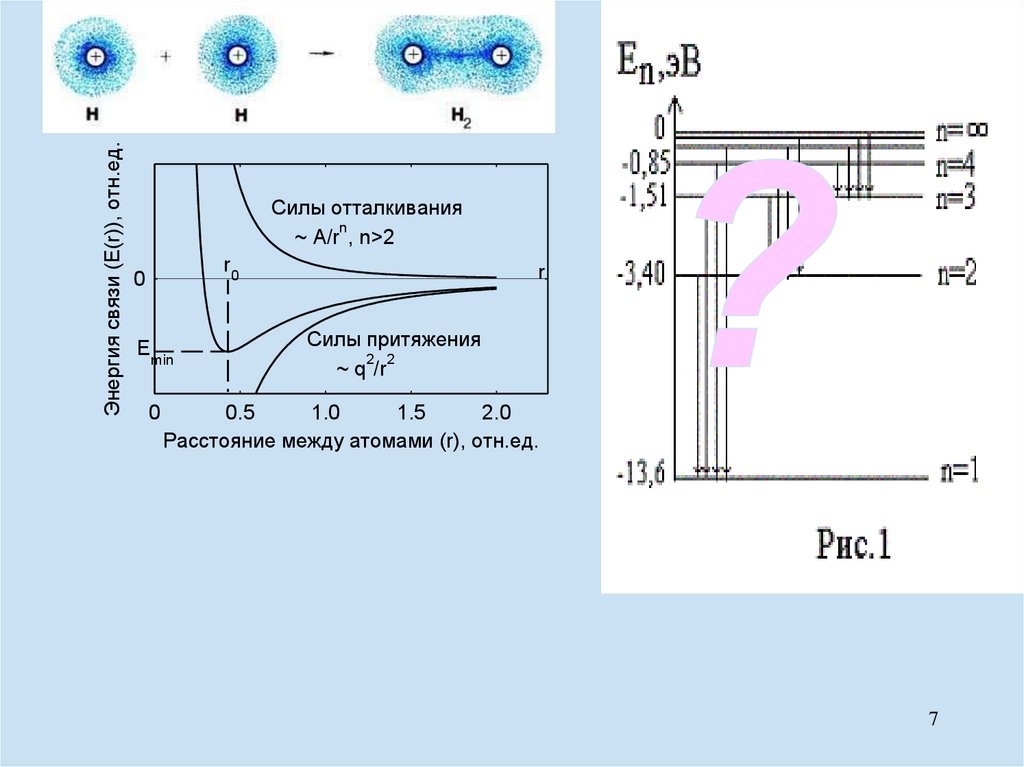
Энергия связи (E(r)), отн.ед.Силы отталкивания
n
~ A/r , n>2
r0
0
Emin
0
r
Силы притяжения
2 2
~ q /r
0.5
1.0
1.5
2.0
Расстояние между атомами (r), отн.ед.
7
8.
Принцип запрета Паули:два или более тождественных фермиона (частицы с
полуцелым спином) не могут в квантовой системе
одновременно находиться в одном и том же квантовом
состоянии (т.е. описываться одной и той же волновой
функцией)
8
9.
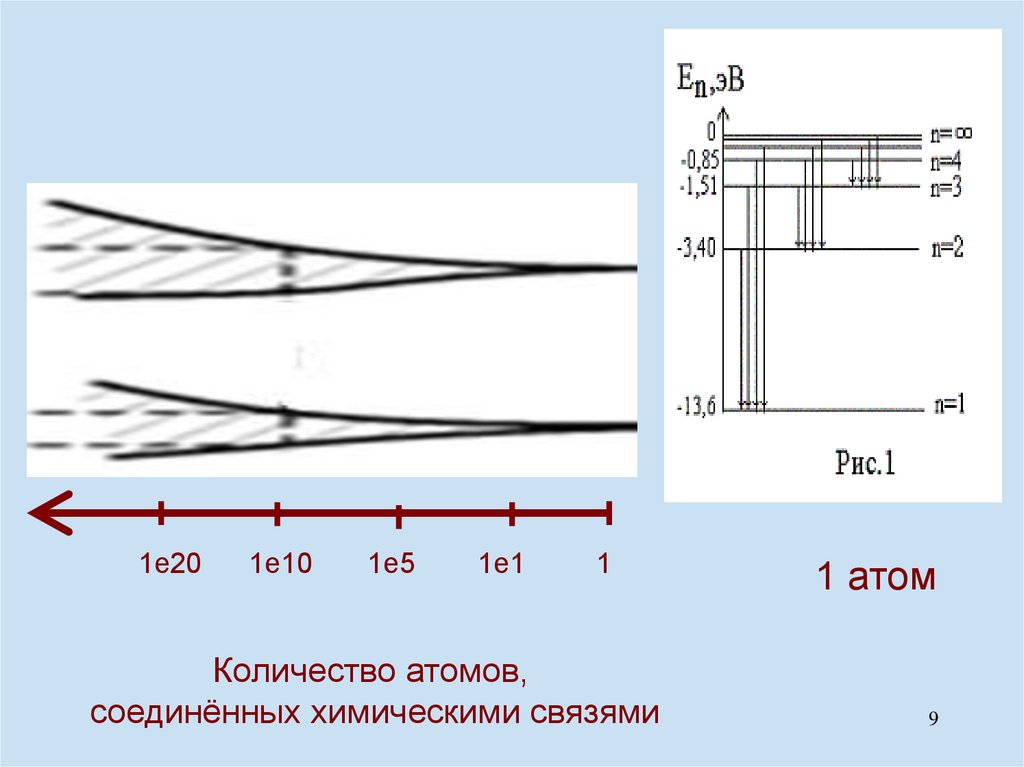
1е201е10
1е5
1е1
1
Количество атомов,
соединённых химическими связями
1 атом
9
10.
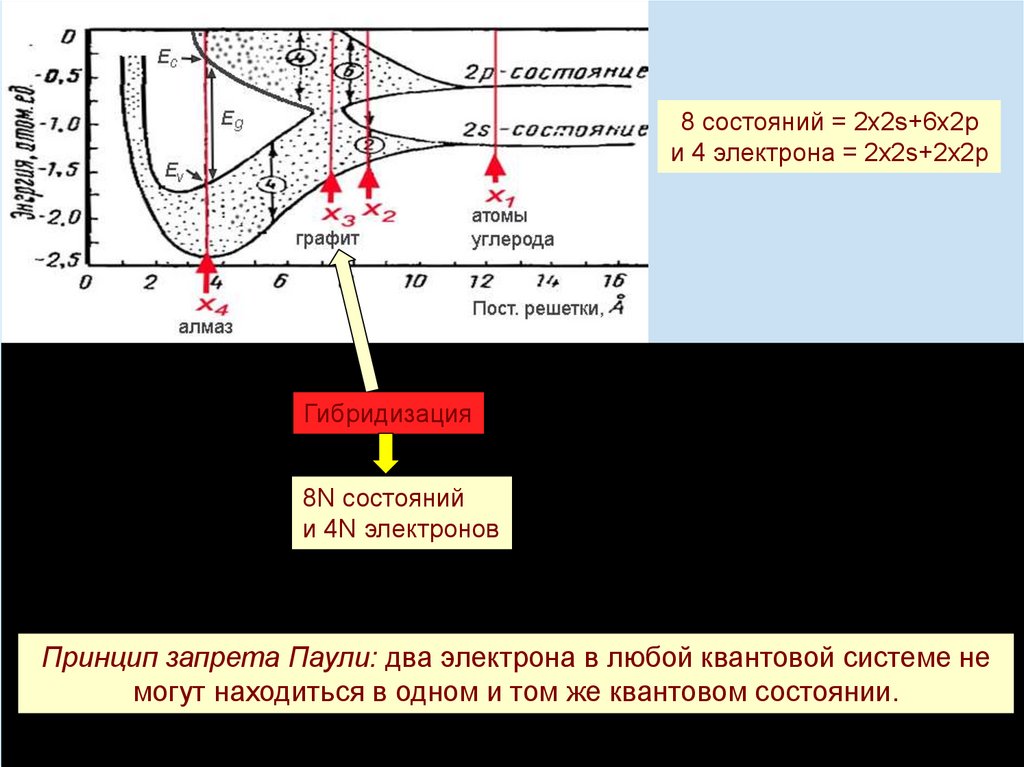
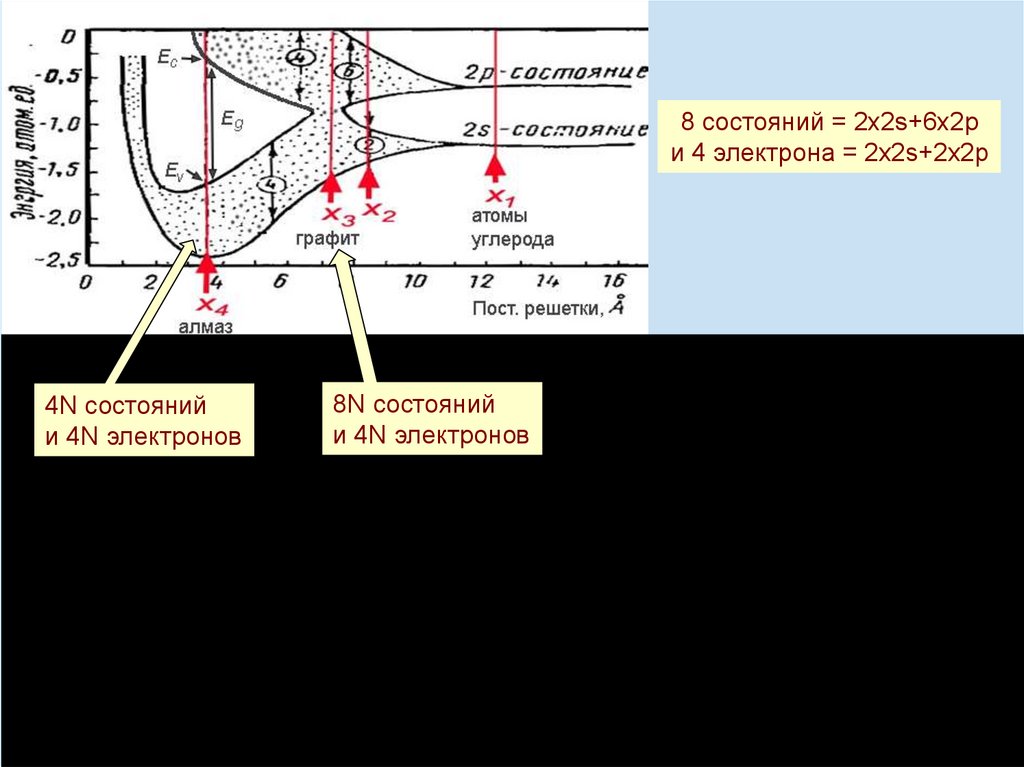
8 состояний = 2х2s+6х2pи 4 электрона = 2х2s+2х2p
Гибридизация
8N состояний
и 4N электронов
Принцип запрета Паули: два электрона в любой квантовой системе не
могут находиться в одном и том же квантовом состоянии.
10
11.
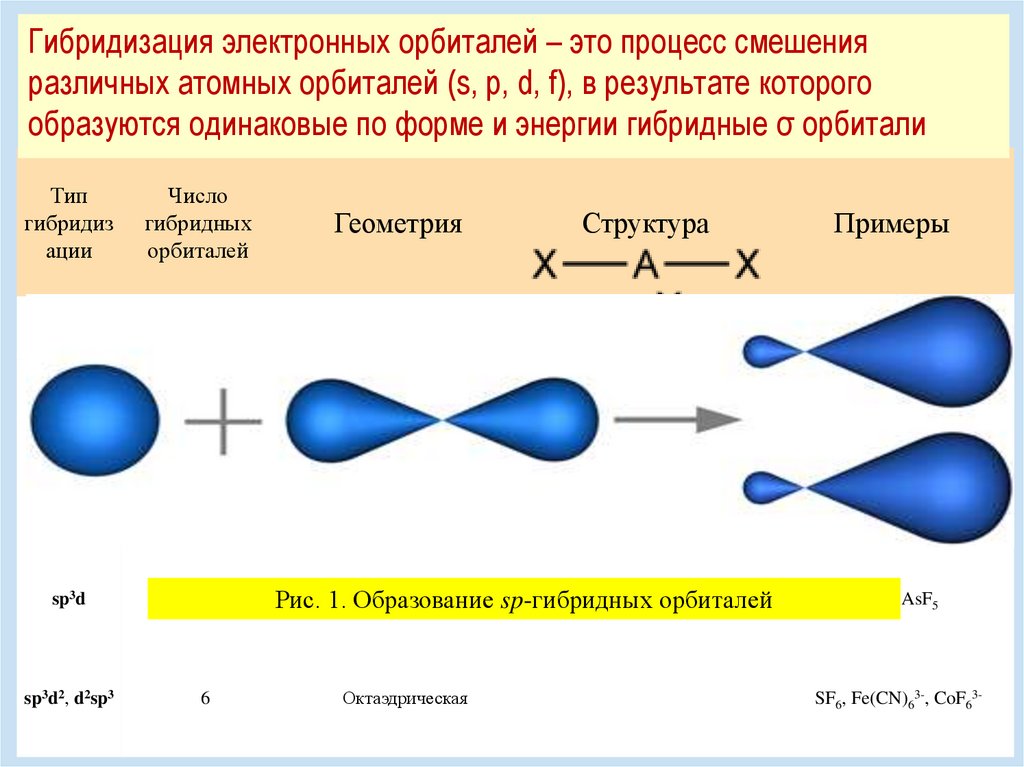
Гибридизация электронных орбиталей – это процесс смешенияразличных атомных орбиталей (s, p, d, f), в результате которого
образуются одинаковые по форме и энергии гибридные σ орбитали
Тип
гибридиз
ации
Число
гибридных
орбиталей
Геометрия
sp
2
Линейная
BeF2, CO2, NO2+
sp2
3
Треугольная
BF3, NO3-, CO32-
Структура
Примеры
sp3, d3s
4
Тетраэдрическая
CH4, ClO4-, SO42-,
NH4+
dsp2
4
Плоскоквадратная
[Ni(CN)4,](2-) [PdCl4]2-
sp3d
5
sp3d2, d2sp3
6
Рис. 1.Гексаэдрическая
Образование sp-гибридных орбиталей
Октаэдрическая
PCl5, AsF5
SF6, Fe(CN)63-, CoF63-
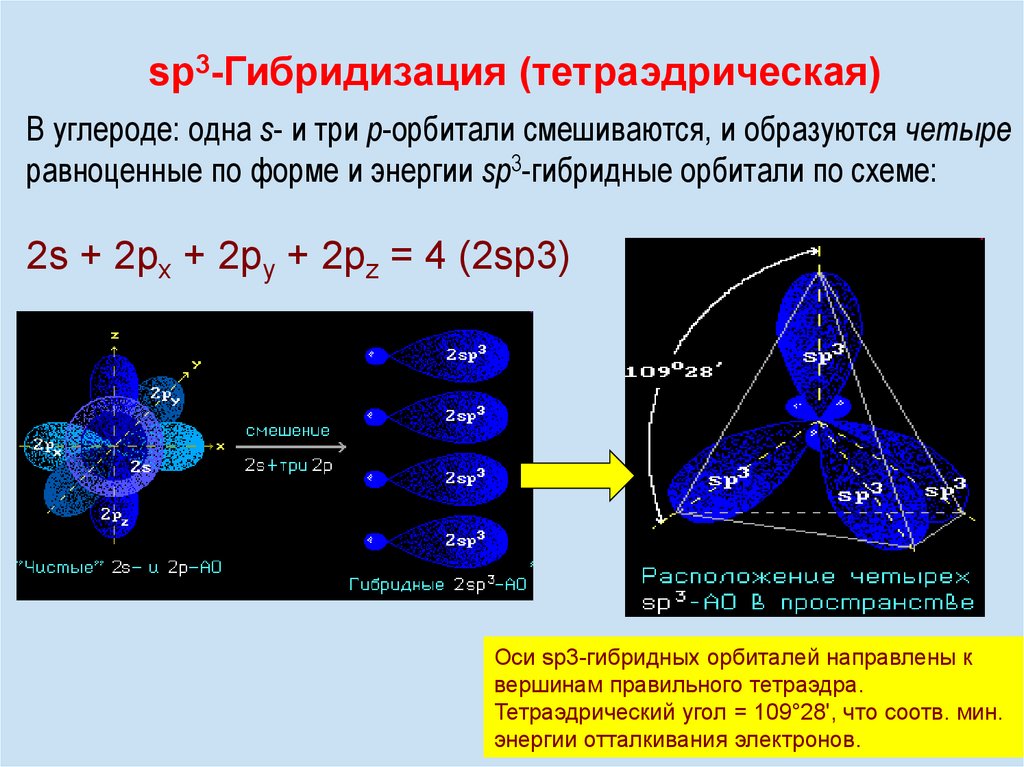
12.
sp3-Гибридизация (тетраэдрическая)В углероде: одна s- и три р-орбитали смешиваются, и образуются четыре
равноценные по форме и энергии sp3-гибридные орбитали по схеме:
2s + 2px + 2py + 2pz = 4 (2sp3)
Оси sp3-гибридных орбиталей направлены к
вершинам правильного тетраэдра.
Тетраэдрический угол = 109°28', что соотв.
12 мин.
энергии отталкивания электронов.
13.
8 состояний = 2х2s+6х2pи 4 электрона = 2х2s+2х2p
4N состояний
и 4N электронов
8N состояний
и 4N электронов
15
14.
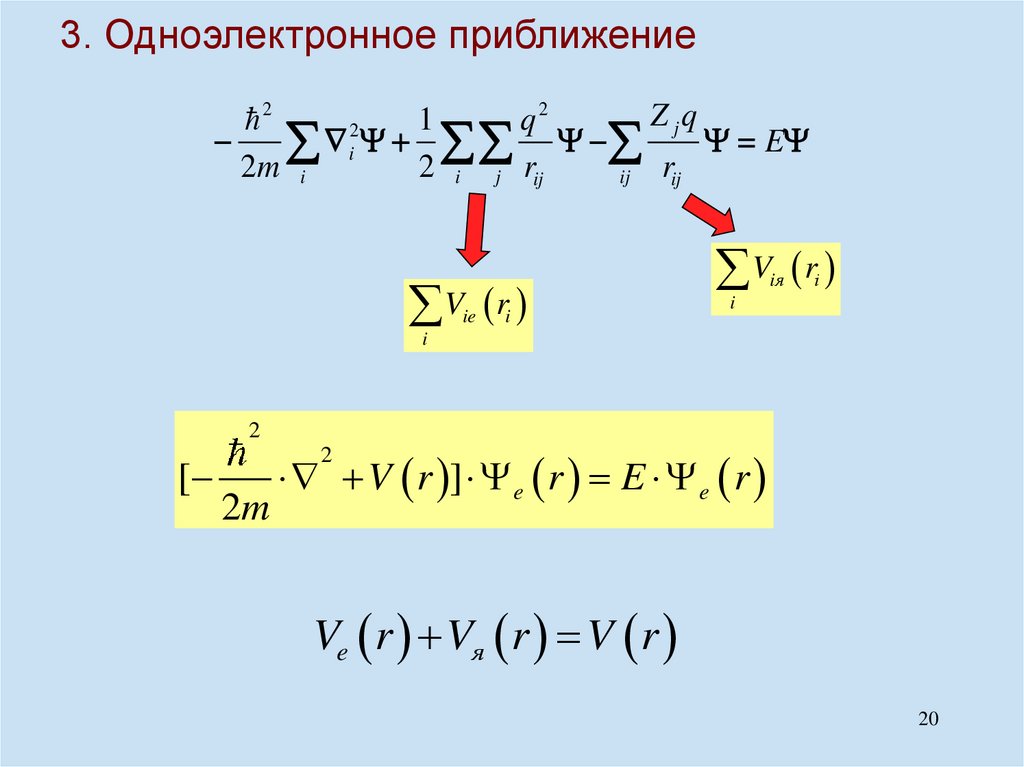
H = E ,Z jq
2
2
2
1
q2
1 Z j Znq
2
i
E
2m i
2
2 i j rij
2 j n R jn
rij
ij
P a
2
Ԧ
Ψ =







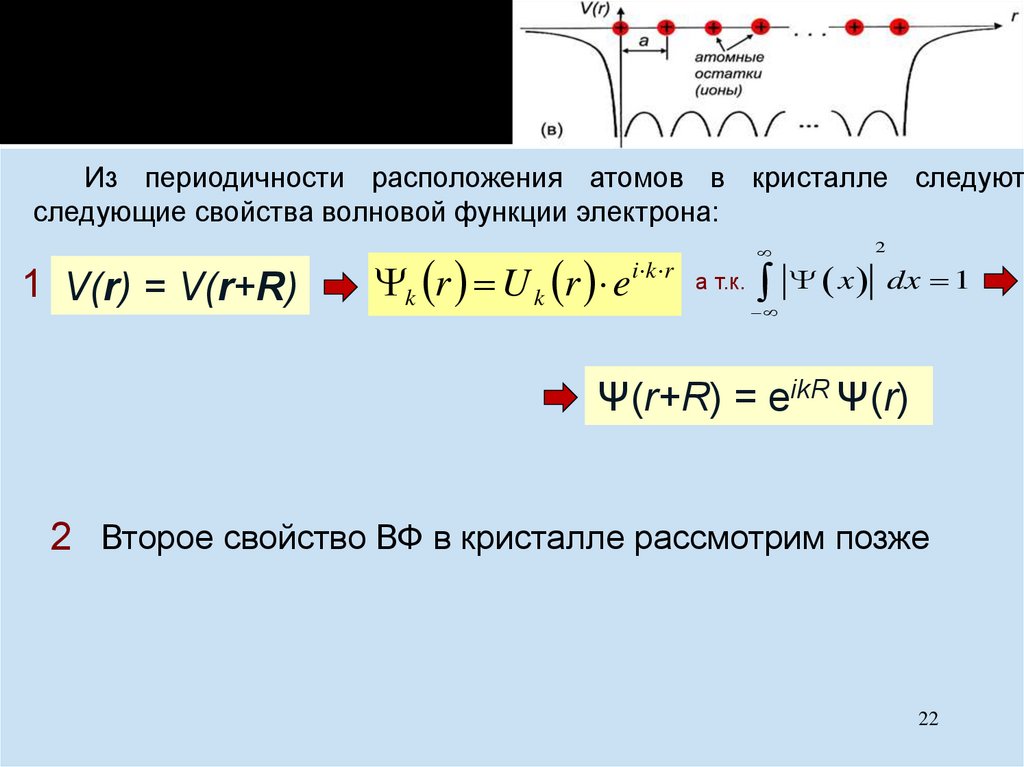
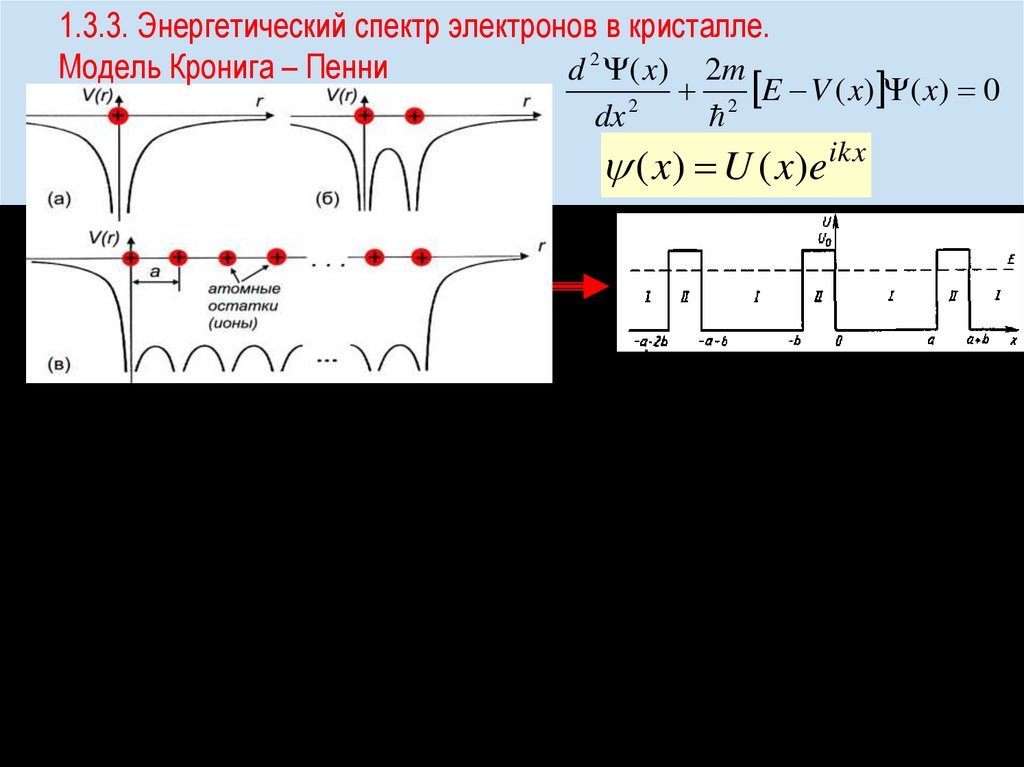



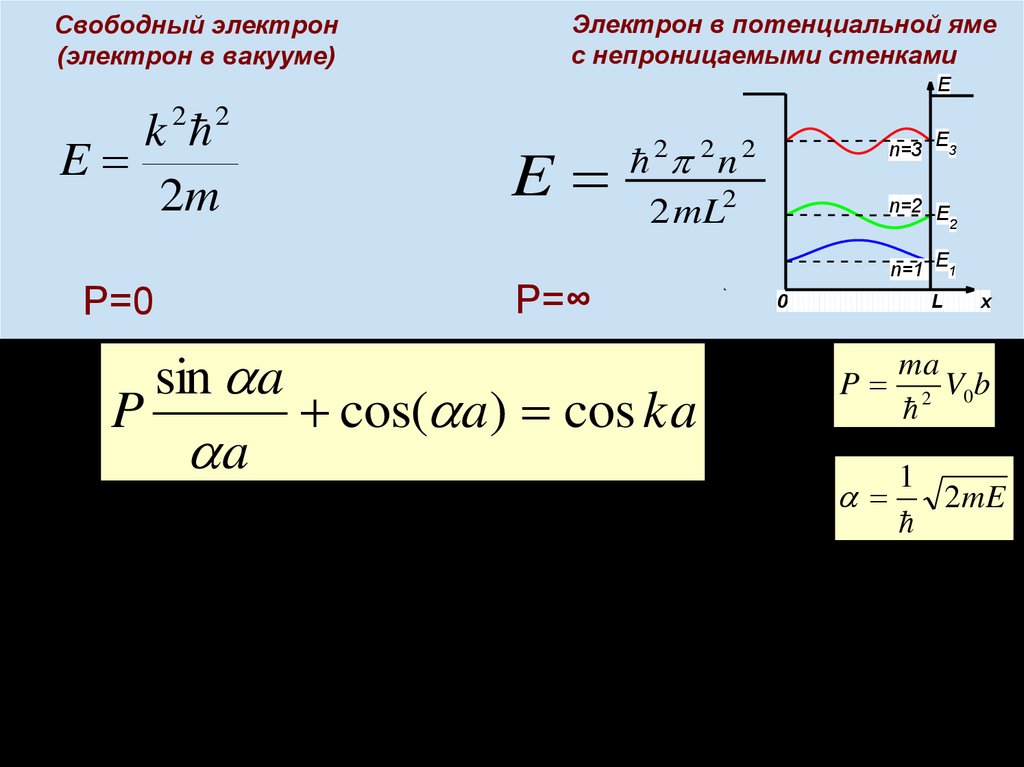
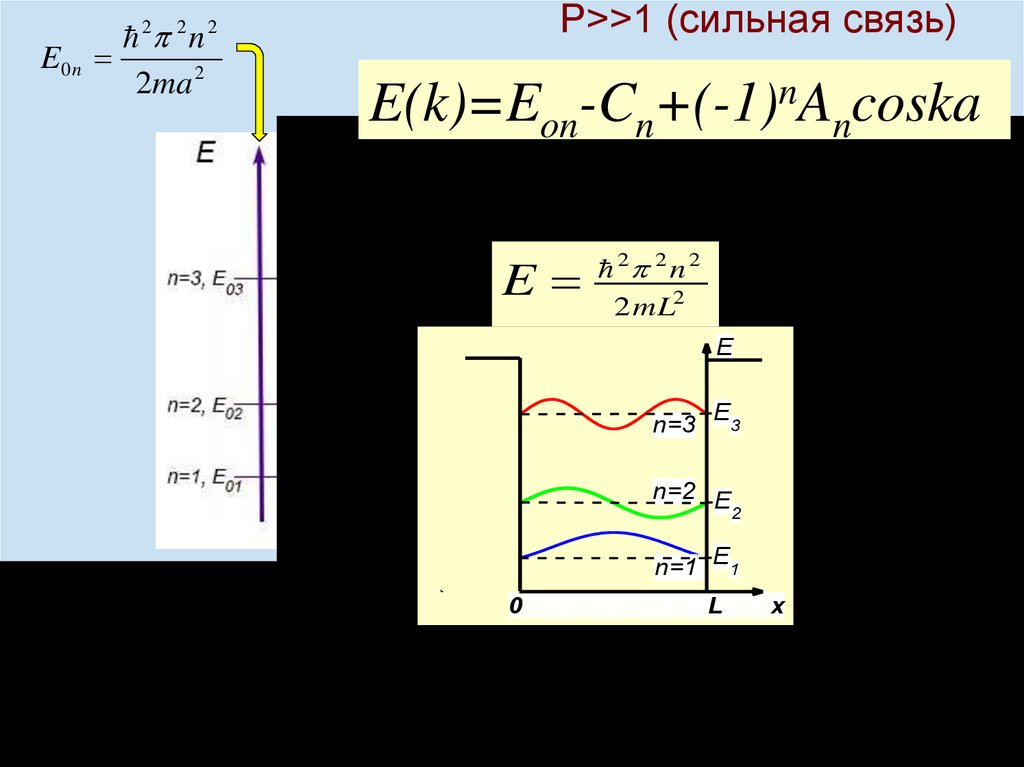










 Химия
Химия








