Похожие презентации:
Полифункциональные карбоновые кислоты. Лекция 4
1.
АГРАРНЫЙИССЛЕДОВАТЕЛЬСКИЙ
УНИВЕРСИТЕТ
Лекция -4
Тема: Полифункциональные карбоновые кислоты
Лектор: Саримбекова С.Н.
2.
Цель: ознакомить студентов со свойствамиполифункциональных соединений.
План:
1.Полифункциональные карбоновые
кислоты общая формула.
2.Оксикарбоновые кислоты
3.Альдегидо- и кето- кислоты
3.
Полифункциональными называютсоединения, в молекулах которых имеется
несколько одинаковых функциональных
групп.
Среди полифункциональных соединений,
участвующих в процессах
жизнедеятельности, наиболее широко
представлены соединения с
гидроксильными и карбоксильными
функциональными группами.
Специальный интерес представляют βдикарбонильные соединения. Соединения
с несколькими аминогруппами
встречаются реже.
4.
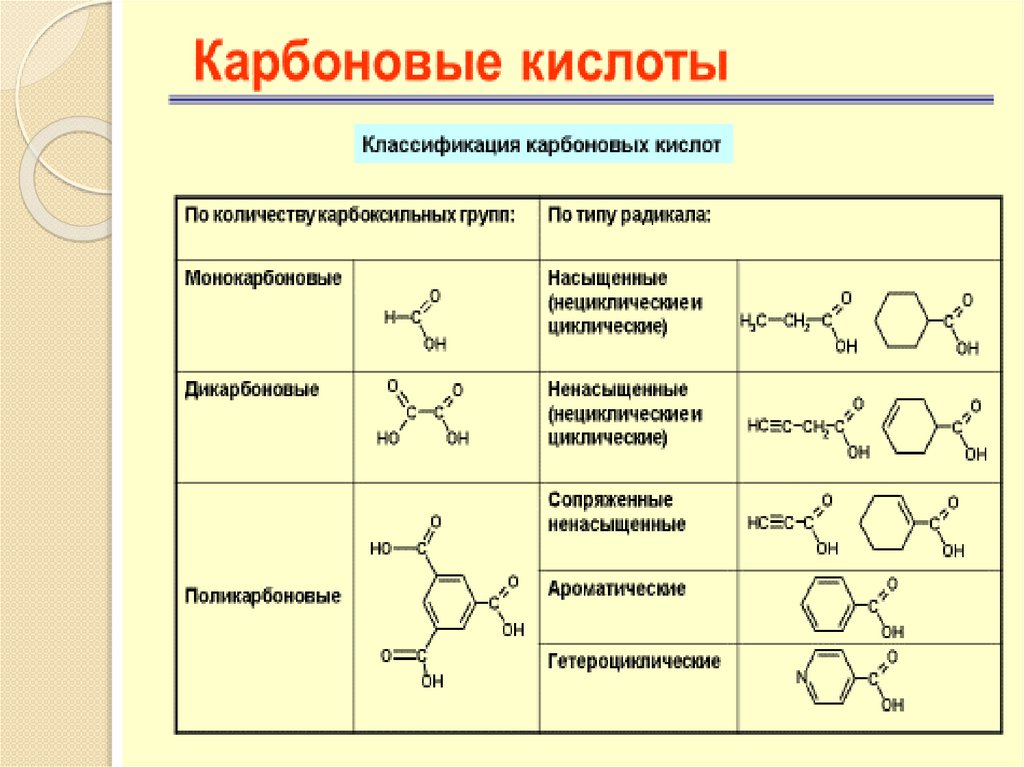
Карбоновые кислоты, содержащие в своемсоставе одну карбоксильную группу,
называют одноосновными, две двухосновными и т. д. Будут рассмотрены
некоторые представители дикарбоновых
кислот алифатического и ароматического
рядов ). Все они представляют собой
кристаллические вещества.
5.
6.
7.
8.
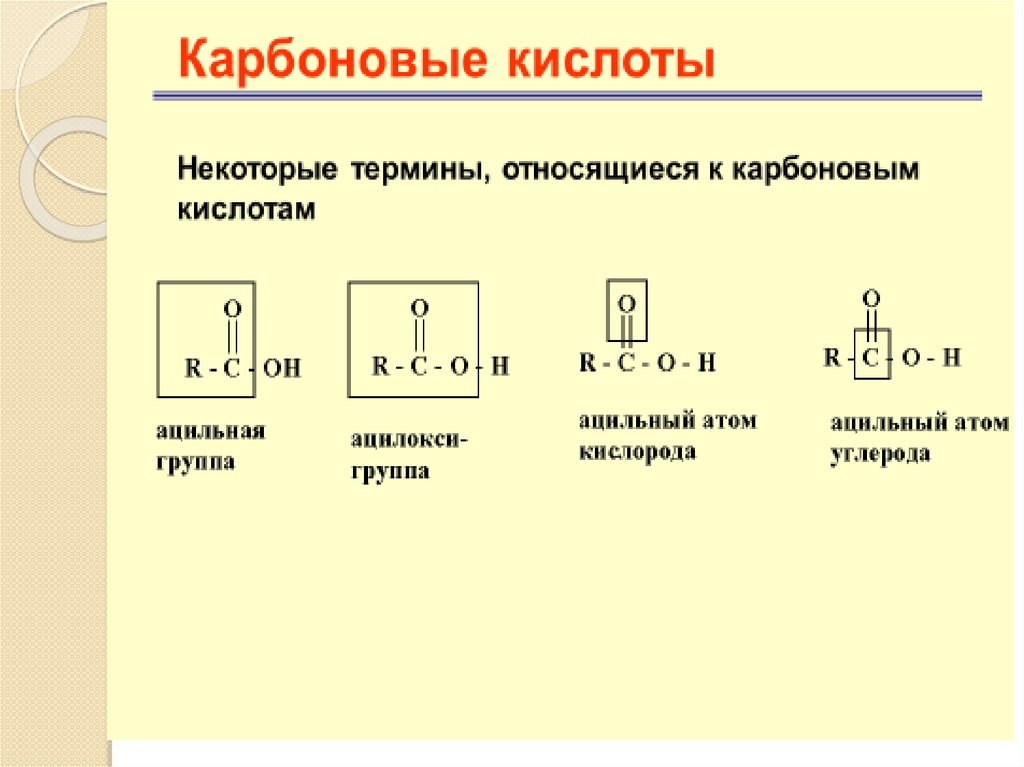
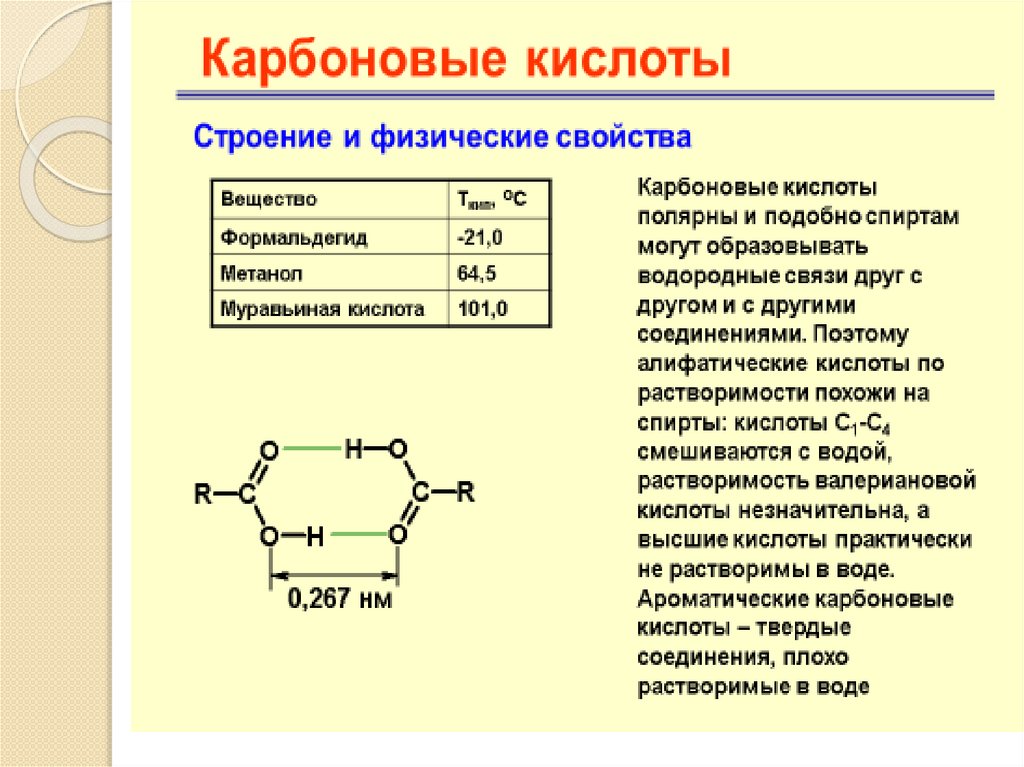
Карбоновые кислотыХимические свойства
Большинство реакций карбоновых кислот можно отнести к одному
из четырех основных типов:
1. Реакции сопровождающиеся разрывом -О – Н связей (кислотная
диссоциация, сольволиз)
2. Реакции по карбонильному углероду – атака нуклеофила :Y по
углероду карбонильной группы с последующим разрывом С – О
связи (образование сложных эфиров, образование ацилхлоридов,
восстановление гидридами)
3. Декарбоксилирование (электролиз по Кольбе, реакция
Хунсдиккера)
4. Реакции по -углеродному атому (галогенирование, реакции замещенных карбоновых кислот).
9.
Карбоновые кислотыРеакции карбоновых кислот, сопровождающиеся
разрывом О–Н-связи. Кислотность
В водном растворе карбоновые кислоты диссоциируют с
образованием карбоксилат-аниона и иона водорода
R
К a=
R
COOH + H 2O
[RCOO
+
COO + H 3O
+
] [H 3O ]
pKa= - lg Ka
[RCOOH]
Константы их кислотности Ка приблизительно равны 10-5 (pKa 5)
10.
Карбоновые кислотыПревращение в эфиры R-COOR1
Объемные группы, содержащиеся около реакционного центра в
кислоте или спирте, затрудняют реакцию. В некоторых случаях
пространственные препятствия для сближения молекул
настолько велики, что необходимы специальные методы
получения сложных эфиров.
Реакционная способность в реакции этерификации уменьшается
в ряду спиртов:
СН3ОН > первичные > вторичные > третичные;
в ряду кислот:
НСООН > СН3СООН > RСН2СООН > R1R2CНСООН >
R1R2R3CСООН
11.
Щавелевая кислота - простейшаядвухосновная кислота. Некоторые ее
соли, например оксалат кальция, трудно
растворимы и часто образуют камни в
почках и мочевом пузыре (оксалатные
камни). НООС-СООН .
Янтарная кислота в заметном
количестве была обнаружена в янтаре,
откуда получила название сама кислота и
ее производные сукцинаты
НООС-СН2-СН2-СООН
12.
Малеиновая и фумаровая кислоты -представители ненасыщенных
дикарбоновых кислот с одной двойной
связью . Фумаровая кислота участвует в
обменных процессах, протекающих в
организме.
HOOC-CH=CH-COOH – малеиновая
13.
Многоосновные гидроксикислоты.Рассматриваемые в этом разделе яблочная,
лимонная, изолимонная кислоты, а также
щавелевоуксусная и рассмотренные ранее
янтарная и фумаровая кислоты являются
участниками цикла трикарбоновых
кислот, называемого также циклом
лимонной кислоты, или циклом Кребса.
Это универсальный этап окислительного
катаболизма углеводов и других
соединений в присутствии кислорода.
14.
Яблочная кислота в значительныхколичествах содержится в незрелых яблоках,
рябине, фруктовых соках. В организме Lяблочная кислота образуется путем
гидратации фумаровой кислоты
Лимонная кислота содержится в плодах
цитрусовых (лимоны, апельсины), винограде,
крыжовнике, а также в листьях табака.
Биосинтез лимонной кислоты происходит по
типу альдольной конденсации из
щавелевоуксусной кислоты и
ацетилкофермента А
15.
Винные кислоты - представителидигидроксидикарбоновых кислот,
содержат два асимметрических атома
углерода и поэтому должны были бы
существовать в виде четырех
стереоизомеров, но в действительности
известны три стереоизомера
16.
D-(+)-Bинная кислота, илиобыкновенная винная кислота,
известна под названием виннокаменной
кислоты. Она содержится в винограде,
рябине. Кислая калиевая соль трудно
растворима в воде. Она осаждается в
винных бочках в виде так называемого
винного камня. При нейтрализации
этой соли гидроксидом натрия
образуется смешанная калиевонатриевая соль. Действием на нее
гидроксида меди(II) в щелочной среде
получают жидкость Фелинга - реактив
для обнаружения альдегидной группы
17.
. ОксокислотыОксокислотами называют соединения,
содержащие в молекуле одновременно
карбоксильную и альдегидную (или
кетонную) группы.
В соответствии с этим различают
альдегидокислоты и кетонокислоты.
Простейшей альдегидокислотой является
глиоксалевая (глиоксиловая) кислота,
которая обычно существует в виде гидрата
(НО)2СНСООН. Она содержится в
недозрелых фруктах, но по мере созревания ее
количество уменьшается.
Важную роль в биохимических процессах
играют кетонокислоты - пировиноградная,
ацетоуксусная и щавелевоуксусная
18.
L-(-)-Винная кислота в очень небольшомколичестве содержится в виноградных
винах.
Оксокислоты
Оксокислотами называют соединения,
содержащие в молекуле одновременно
карбоксильную и альдегидную (или
кетонную) группы.
В соответствии с этим различают
альдегидокислоты и кетонокислоты.
19.
Простейшей альдегидокислотойявляется глиоксалевая (глиоксиловая)
кислота, которая обычно существует в
виде гидрата (НО)2СНСООН. Она
содержится в недозрелых фруктах, но
по мере созревания ее количество
уменьшается.
Важную роль в биохимических
процессах играют кетонокислоты пировиноградная, ацетоуксусная и
щавелевоуксусная (
20.
Пировиноградная кислота являетсяодним из промежуточных продуктов
молочнокислого и спиртового брожения
углеводов. Своим названием
пировиноградная кислота обязана тому,
что впервые была выделена при
пиролизе виноградной кислоты.
Пировиноградная кислота
декарбоксилируется при нагревании с
разбавленной и декарбонилируется
(отщепляет СО) - с концент- рированной
серной кислотой.
21.
Щавелевоуксусная кислота одновременноявляется α- и β-оксокислотой. Она образуется
при окислении яблочной кислоты.
Далее щавелевоуксусная кислота при
конденсации с ацетилкоферментом А
превращается в лимонную кислоту.
Ацетоуксусная кислота - представитель βоксокислот. В свободном состоянии
представляет сиропообразную жидкость,
медленно выделяющую диоксид углерода.
Как продукт окисления 3-гидроксимасляной
кислоты наряду с продуктами ее
превращений накапливается в организме
больных сахарным диабетом (так называемые
ацетоновые, или кетоновые тела).
22.
Ацетоуксусный эфир - жидкость сприятным фруктовым запахом. Впервые
синтезирован более 100 лет назад, его
строение долгое время было предметом
острых дискуссий. Основная трудность
заключалась в том, что в результате его
химических превращений получались два
ряда производных - ацетоуксусной и 3гидроксикротоновой кислот, т. е.
ацетоуксусный эфир проявлял
двойственную реакционную способность.
23.
Оксокислоты проявляют многие свойства,характерные как для карбоновых кислот,
так и для альдегидов и кетонов.
Оксокислоты образуют производные по
карбоксильной группе – соли, сложные
эфиры амиды и т.д., по оксогруппе –
оксимы, гидразоны, гидроксинитрилы и
т.д.
24.
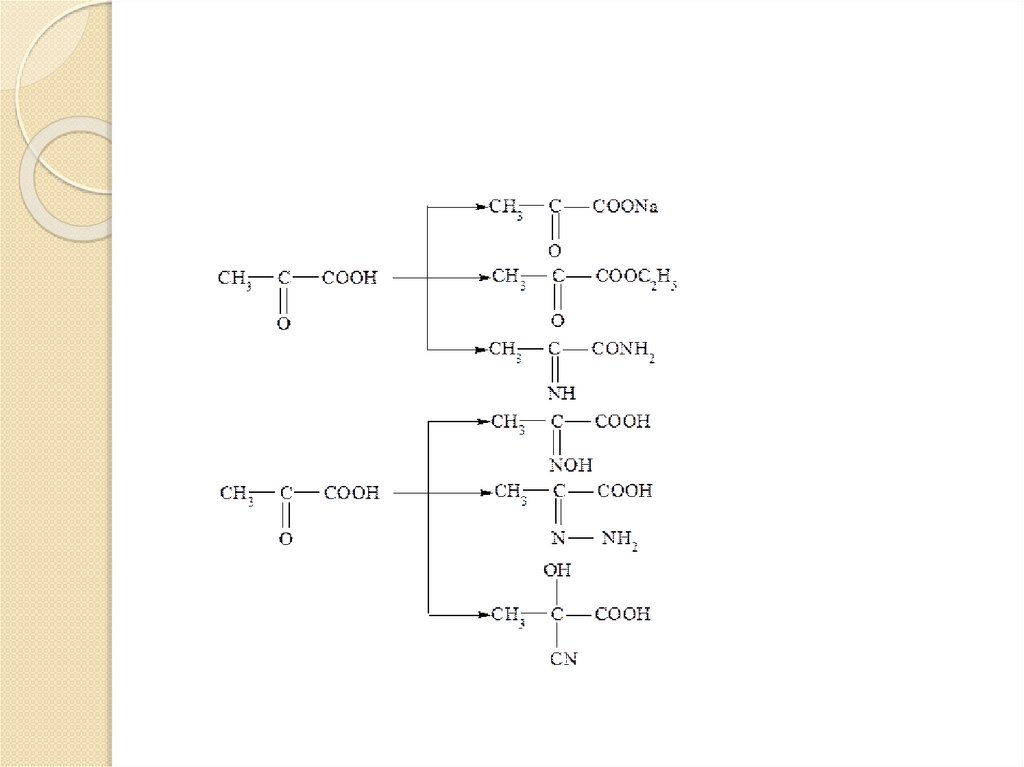
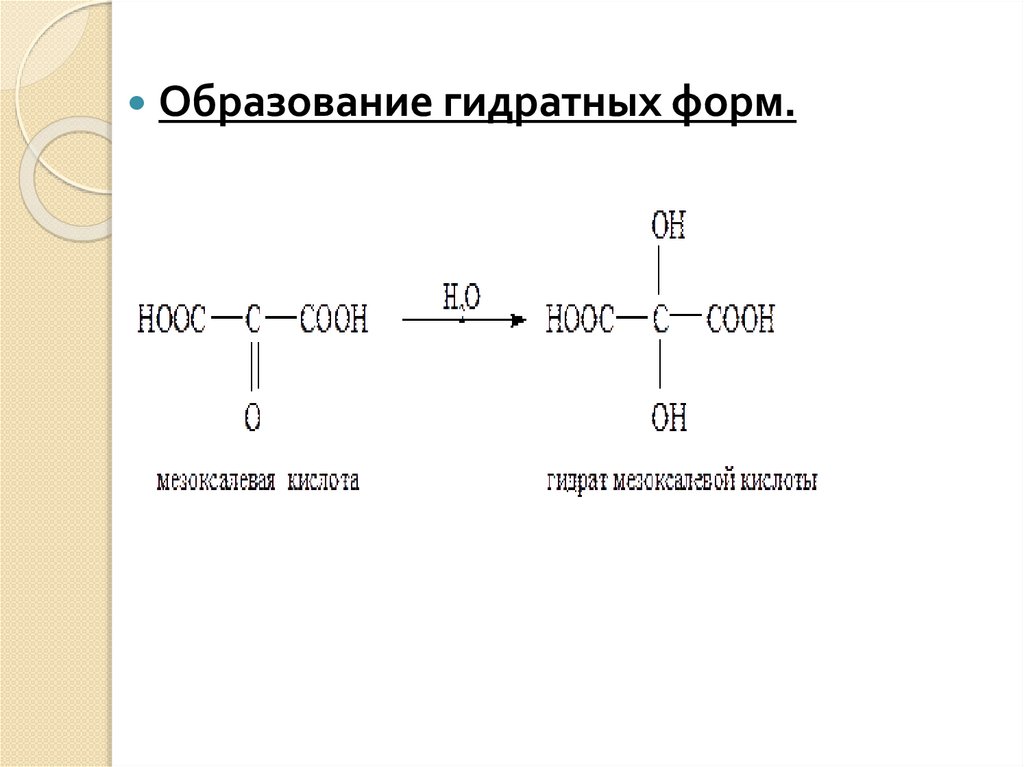
1. Образование гидратных форм.Оксокислоты проявляют многие свойства,
характерные как для карбоновых кислот,
так и для альдегидов и кетонов.
Оксокислоты образуют производные по
карбоксильной группе – соли, сложные
эфиры амиды и т.д., по оксогруппе –
оксимы, гидразоны, гидроксинитрилы и
т.д.
25.
26.
Образование гидратных форм.27.
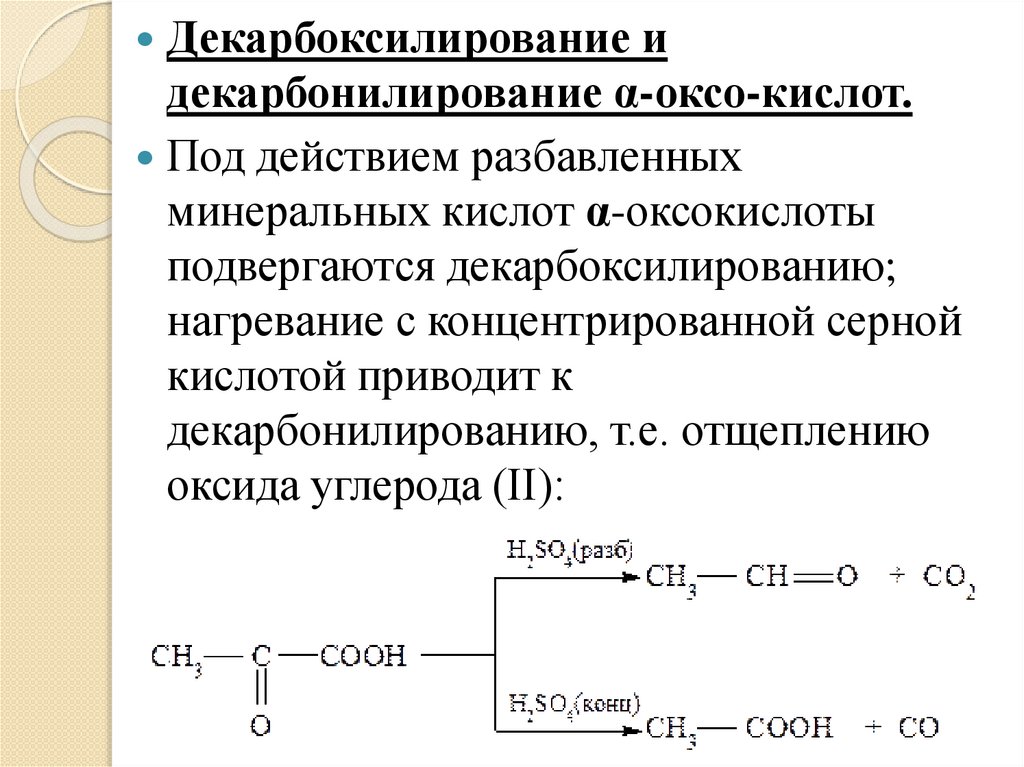
Декарбоксилирование идекарбонилирование α-оксо-кислот.
Под действием разбавленных
минеральных кислот α-оксокислоты
подвергаются декарбоксилированию;
нагревание с концентрированной серной
кислотой приводит к
декарбонилированию, т.е. отщеплению
оксида углерода (II):
28.
Тюкавкина Н.А., Бауков Ю.И.Биоорганическая химия. Учебник для
студентов медицинских вузов. - 7 изд. - М.:
Дрофа, 2008. - 542 с.
2. Руководство к лабораторным занятиям по
биоорганической химии. - 4 изд. / Под ред.
Н.А. Тюкавкиной. - М.: Дрофа, 2008. - 318 с.
3. Органическая химия. Специальный курс
(книга 2) / Под ред. Н.А. Тюкавкиной. - М.:
Дрофа, 2008. - 592 с.
4. Овчинников Ю.А. Биоорганическая химия. М.: Просвещение,1987. - 815 с.
5. Хлебников А.Ф., Новиков М.С. Современная
номенклатура органических соединений. СПб: НПО «Профессионал», 2004. - 432 с.
1.






















 Химия
Химия








