Похожие презентации:
Взаимное влияние атомов в молекулах
1.
д.х.н., проф. СПбГУКарцова Анна Алексеевна
2010
2.
1861 г. А.М. Бутлеров1869 г. В.В. Марковников
H3C
CH CH2
HBr
H3C
CH CH3
Br
F3C
CH CH2
HBr
F3C
(по правилу)
CH2 CH2Br
(против правила)
2
3.
ЭЛЕКТРОННЫЕ ЭФФЕКТЫ ЗАМЕСТИТЕЛЕЙ(ДОНОРНЫЕ, АКЦЕПТОРНЫЕ)
ИЗМЕНЕНИЕ ЭЛЕКТРОННОЙ ПЛОТНОСТИ В
МОЛЕКУЛЕ
РЕАКЦИОННАЯ СПОСОБНОСТЬ
I. Индуктивный эффект
δ+
δ-
С―С―С―С
Х
δ-
δ+
С―С―С―С
У
-I
F3C
+I
-I
H3C
+I
ЭО
CH CH2
CH CH2
Сsp3
Csp2
Csp
2,5
2,8
3,2
3
4.
II. Эффект сопряжения (мезомерный эффект, ± М)а) π-π-сопряжение
Бутадиен-1,3
бензол
б) р-π-сопряжение
+М
+М
δ+
O
фенол
H
O
H
4
5.
ЭЛЕКТРОННАЯ ИНТЕРПРЕТАЦИЯПРАВИЛА МАРКОВНИКОВА
а)
AdE
б)
1
H3C
а)
H 3C
(R
CH2
CH2
CH2
)
CH CH2
?
H+
б)
H3C
( R'
CH
CH
CH3
R'
)
5
6.
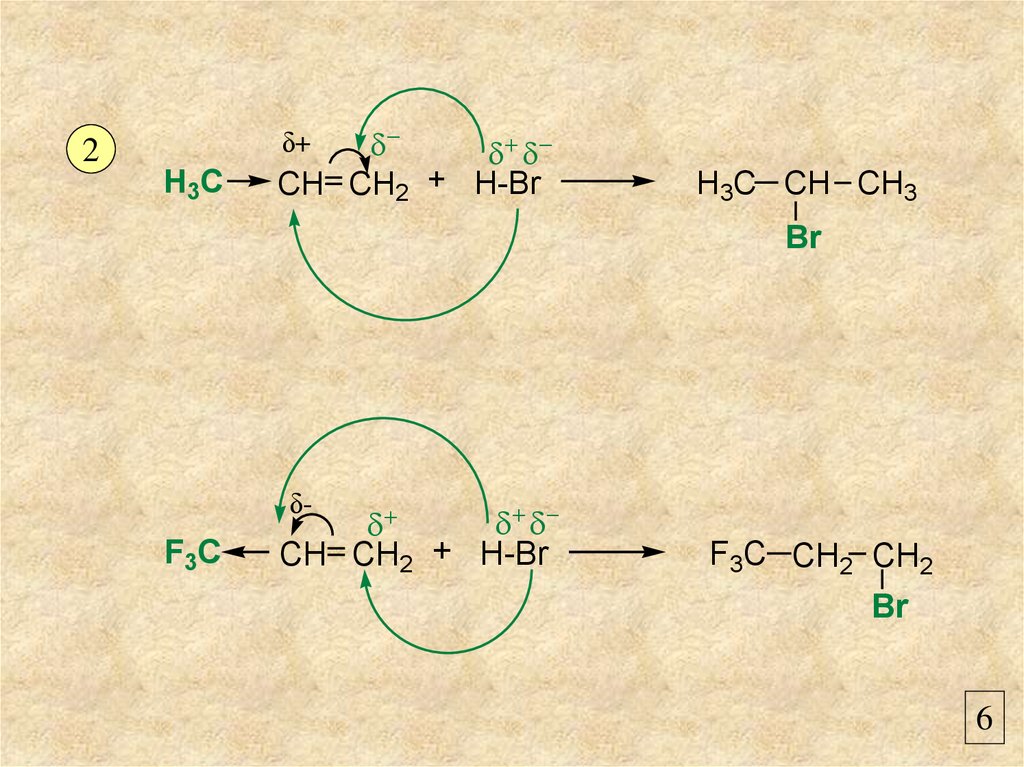
2H3C
CH CH2 + H-Br
δ+
H3C CH CH3
Br
F3C
δ-
CH CH2 + H-Br
F3C CH2 CH2
Br
6
7.
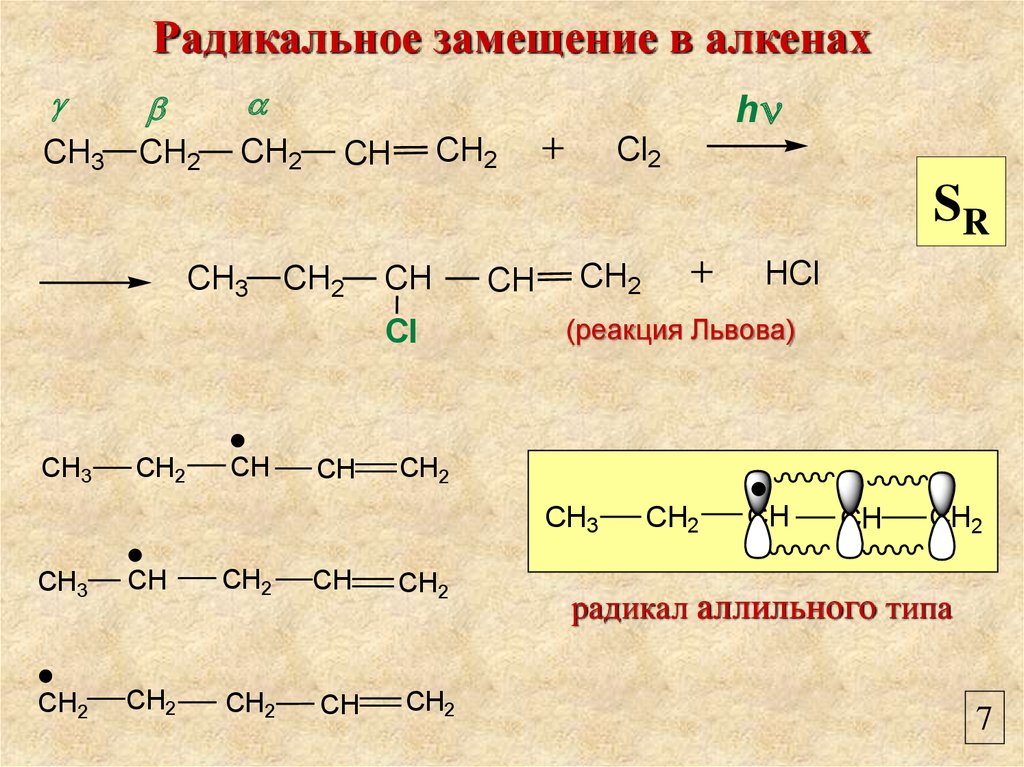
Радикальное замещение в алкенахCH3
CH2
CH2
h
Cl2
CH2
CH
SR
CH3
CH2
CH
Cl
CH3
CH2
CH
CH
CH
HCl
CH2
(реакция Львова)
CH2
CH3
CH3
CH
CH2
CH
CH2
CH2
CH2
CH2
CH
CH2
CH2
CH
CH
CH2
радикал аллильного типа
7
8.
CH2CH2
8
CH3
CH2 CH2 CH3
CH2 CH2 CH3
+ Br2
FeBr3
CH2 CH2 CH3
Br
SE
+
- HBr
Br
CH2
Br
CH2
CH3
+ Br2
h
- HBr
CH
CH2
CH3
SR
9.
HCH
CH2
CH3
CH2
CH
CH3
CH2
CH2
CH2
C
H
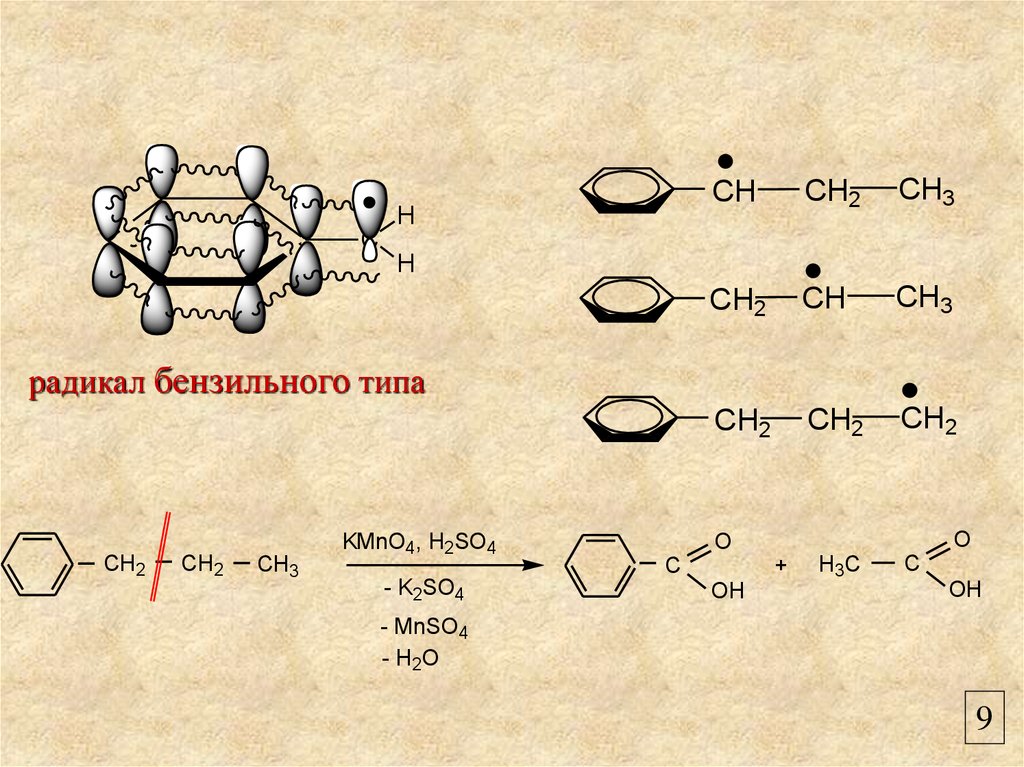
радикал бензильного типа
CH2
CH2
CH3
KMnO4, H2SO4
- K2SO4
O
O
+
C
OH
H3C
C
OH
- MnSO4
- H2O
9
10.
Строение молекулы толуола.Взаимное влияние атомов в молекулах на примере толуола
Реакции ионного замещения
Реакции радикального замещения
(сравнение с метаном)
(сравнение с бензолом)
CH3
CH3
CH2Cl
Br
CH3
+ Cl2
Br2 / FeBr3
о-Бромтолуол
- HBr
CH3
hν
+ HCl
Бензилхлорид
Масштабная модель
молекулы толуола
CH4 + Cl2
hν
CH3Cl + HCl
Метилхлорид
CH3
Br
п-Бромтолуол
Br
Реакция окисления
(сравнение с метаном и бензолом)
COOH
CH3
+I-эффект
KMnO4, H2SO4
Br2 / FeBr3
- HBr
Бензойная кислота
Бромбензол
CH4
KMnO4, H2SO4
X
;
KMnO4, H2SO4
X
10
11.
ВЗАИМНОЕ ВЛИЯНИЕ АТОМОВ В МОЛЕКУЛЕНА ПРИМЕРЕ ФЕНОЛА
OH
R OH
Как природа радикала влияет
на кислотные свойства ?
Как «ОН-группа» изменила
реакционную способность
бензольного кольца ?
11
12.
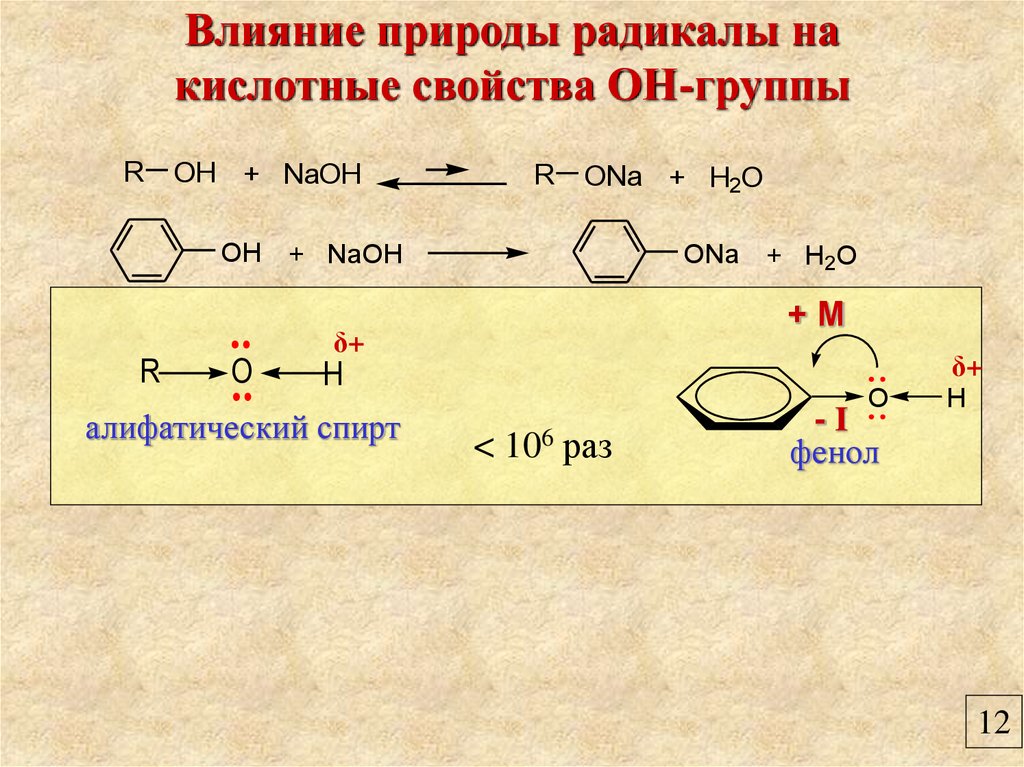
Влияние природы радикалы накислотные свойства ОН-группы
R
OH + NaOH
R
ONa + H2O
OH + NaOH
ONa + H2O
+М
δ+
R
O
δ+
H
алифатический спирт
O
<
106
раз
-I
фенол
H
12
13.
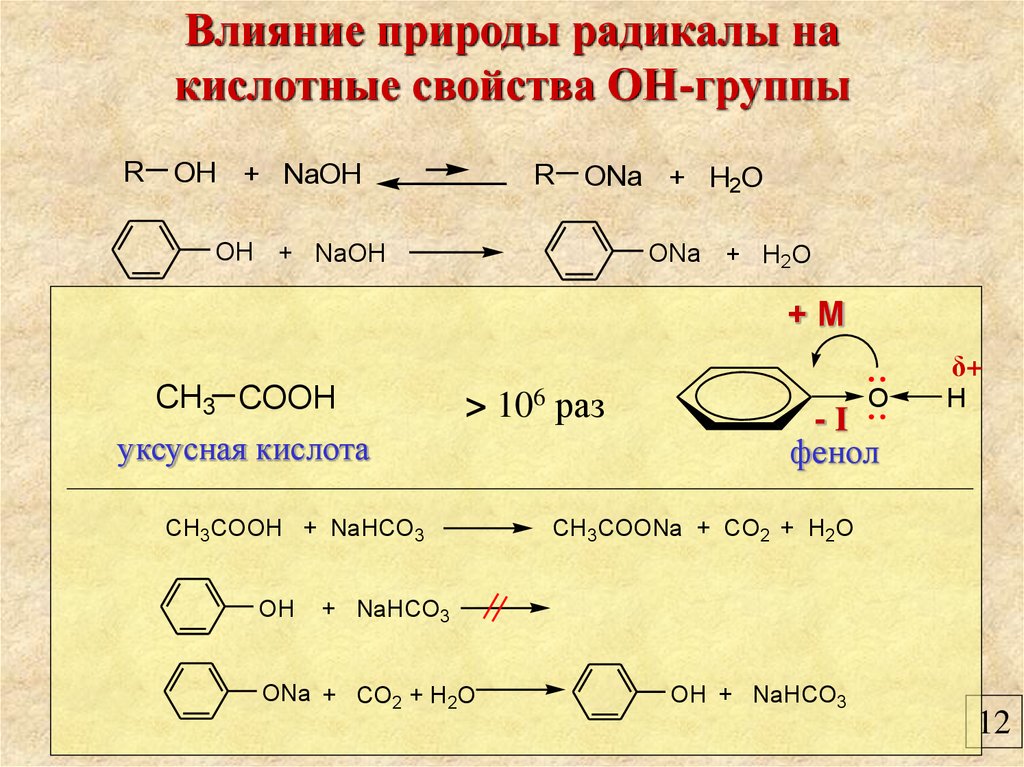
Влияние природы радикалы накислотные свойства ОН-группы
R
OH + NaOH
R
ONa + H2O
OH + NaOH
ONa + H2O
+М
δ+
CH3 COOH
> 106 раз
уксусная кислота
CH3COOH + NaHCO3
OH
O
-I
фенол
H
CH3COONa + CO2 + H2O
+ NaHCO3
ONa + CO2 + H2O
OH + NaHCO3
12
14.
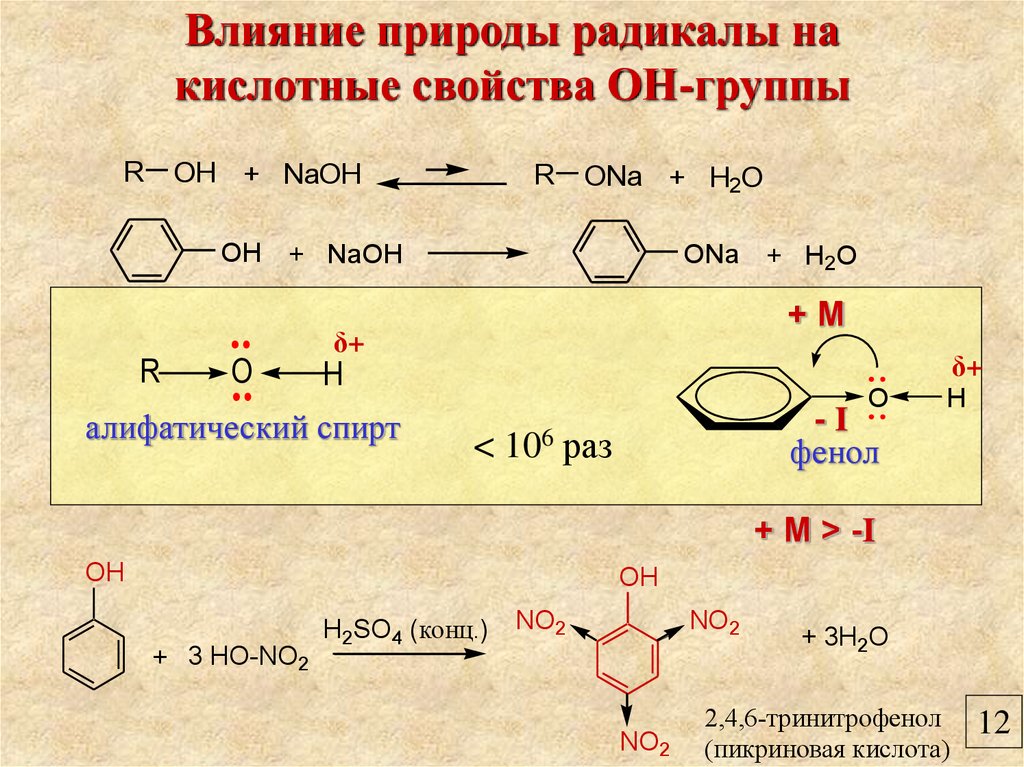
Влияние природы радикалы накислотные свойства ОН-группы
R
OH + NaOH
R
ONa + H2O
OH + NaOH
ONa + H2O
+М
δ+
R
O
δ+
H
алифатический спирт
O
<
106
-I
фенол
раз
H
+ М > -I
OH
OH
+ 3 HO-NO2
H2SO4 (конц.)
NO2
NO2
NO2
+ 3H2O
2,4,6-тринитрофенол
(пикриновая кислота)
12
15.
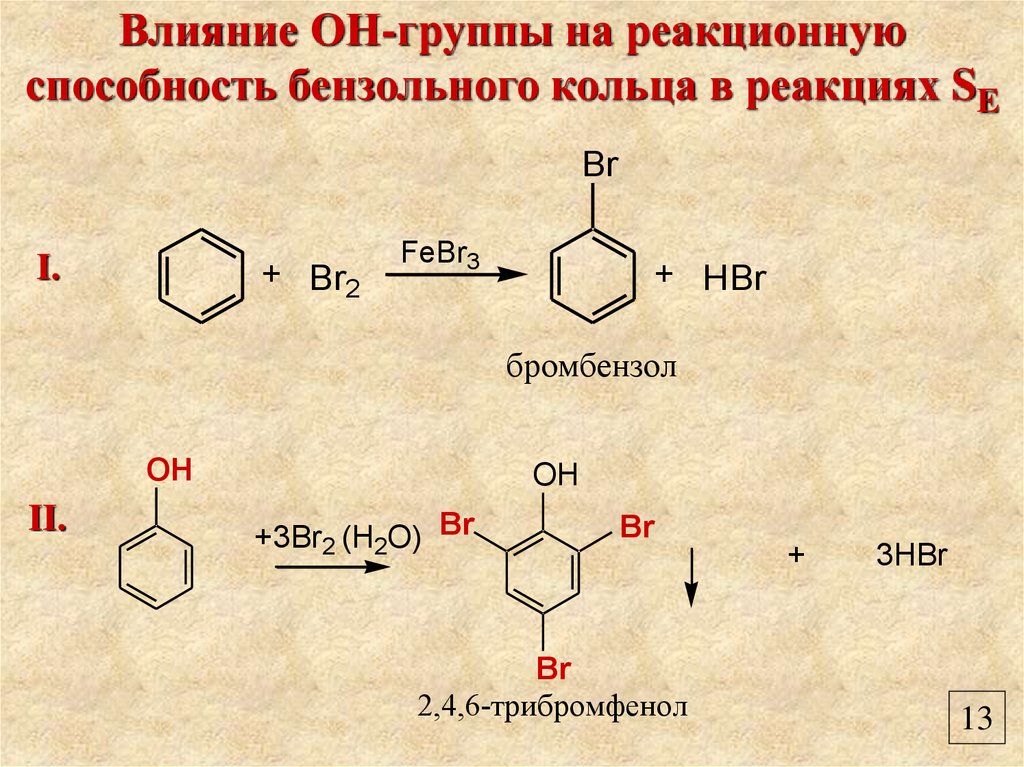
Влияние ОН-группы на реакционнуюспособность бензольного кольца в реакциях SE
Br
I.
+ Br2
FeBr3
+ HBr
бромбензол
OH
II.
OH
+3Br2 (H2O) Br
Br
Br
2,4,6-трибромфенол
+
3HBr
13
16.
+Br
Br + FeBr3
Х+
+
Br
Br Br FeBr3
+ [FeBr4]
+М
O
H
фенол
14
17.
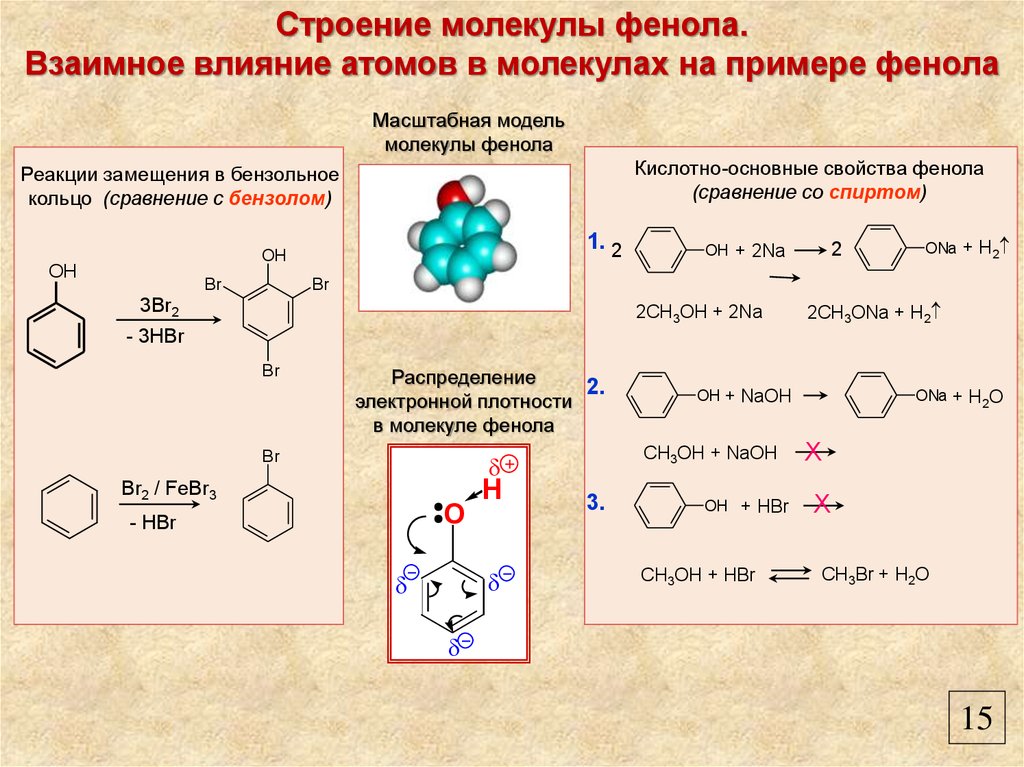
Строение молекулы фенола.Взаимное влияние атомов в молекулах на примере фенола
Масштабная модель
молекулы фенола
Кислотно-основные свойства фенола
(сравнение со спиртом)
Реакции замещения в бензольное
кольцо (сравнение с бензолом)
1. 2
OH
OH
Br
2
OH + 2Na
ONa + H2
Br
3Br2
2CH3OH + 2Na
2CH3ONa + H2
- 3HBr
Br
Распределение
2.
электронной плотности
в молекуле фенола
Br
CH3OH + NaOH
Br2 / FeBr3
O
- HBr
H
OH + NaOH
3.
OH + HBr
CH3OH + HBr
ONa + H2O
X
X
CH3Br + H2O
15
18.
NaOH, 300 oC, 250 атмOH
Cl
- NaCl
CH2
Cl
NaOH
- NaCl
CH2
OH
+М
Cl
-I
CH2
Cl
-I
16
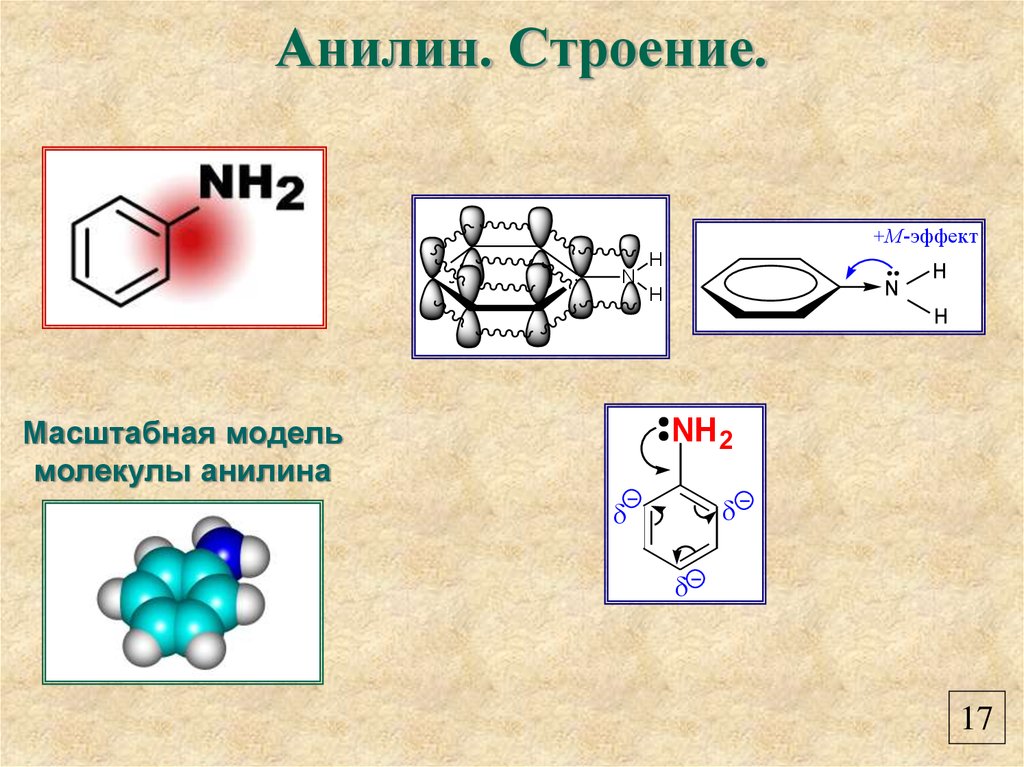
19. Анилин. Строение.
+M-эффектH
N
N
H
H
H
Масштабная модель
молекулы анилина
NH 2
17
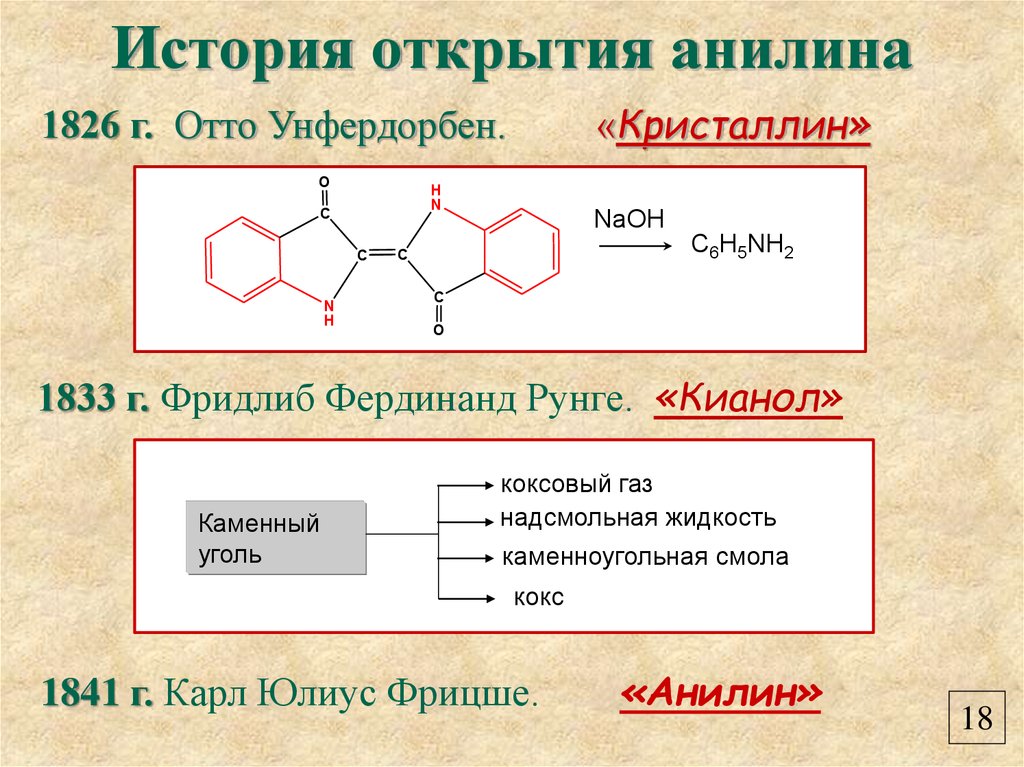
20. История открытия анилина
1826 г. Отто Унфердорбен.O
H
N
C
C
N
H
«Кристаллин»
NaOH
C6H5NH2
C
C
O
1833 г. Фридлиб Фердинанд Рунге. «Кианол»
Каменный
уголь
коксовый газ
надсмольная жидкость
каменноугольная смола
кокс
1841 г. Карл Юлиус Фрицше.
«Анилин»
18
21. Реакция Зинина
Н.Н. Зинин(1812 – 1880)
1842 г. Н.Н. Зинин. «Бензидам»
NO2
Fe, HCl
NH2
+ 6H
- 2 H2O
1845 г. – Гофман доказал идентичность
кристаллина, кианола, бензидама и анилина
Август Вильгельм
Гофман
(1818 – 1892)
19
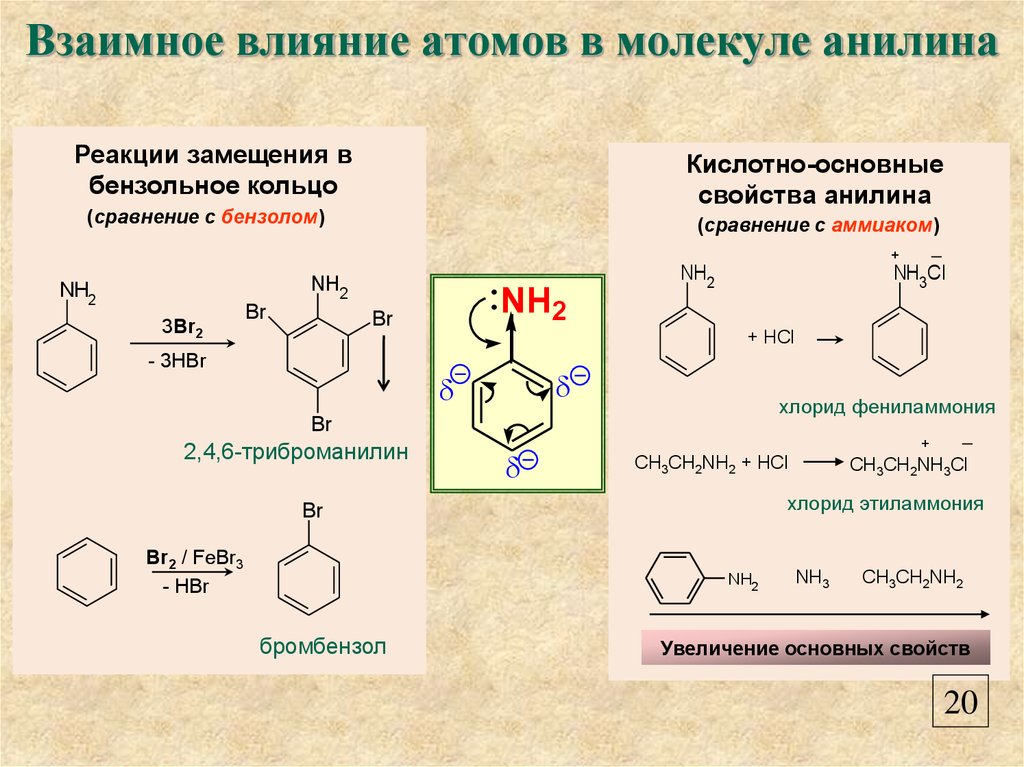
22. Взаимное влияние атомов в молекуле анилина
Реакции замещения вбензольное кольцо
Кислотно-основные
свойства анилина
(сравнение с бензолом)
(сравнение с аммиаком)
─
+
NH2
NH2
3Br2
Br
NH2
Br
- 3HBr
NH2
NH3Cl
+ HCl
хлорид фениламмония
Br
2,4,6-триброманилин
+
CH3CH2NH2 + HCl
NH2
бромбензол
CH3CH2NH3Cl
хлорид этиламмония
Br
Br2 / FeBr3
- HBr
─
NH3
CH3CH2NH2
Увеличение основных свойств
20
23.
RR
OH
O
C
O
«OH»
H
R
O
C
H
O
AdN
21
24.
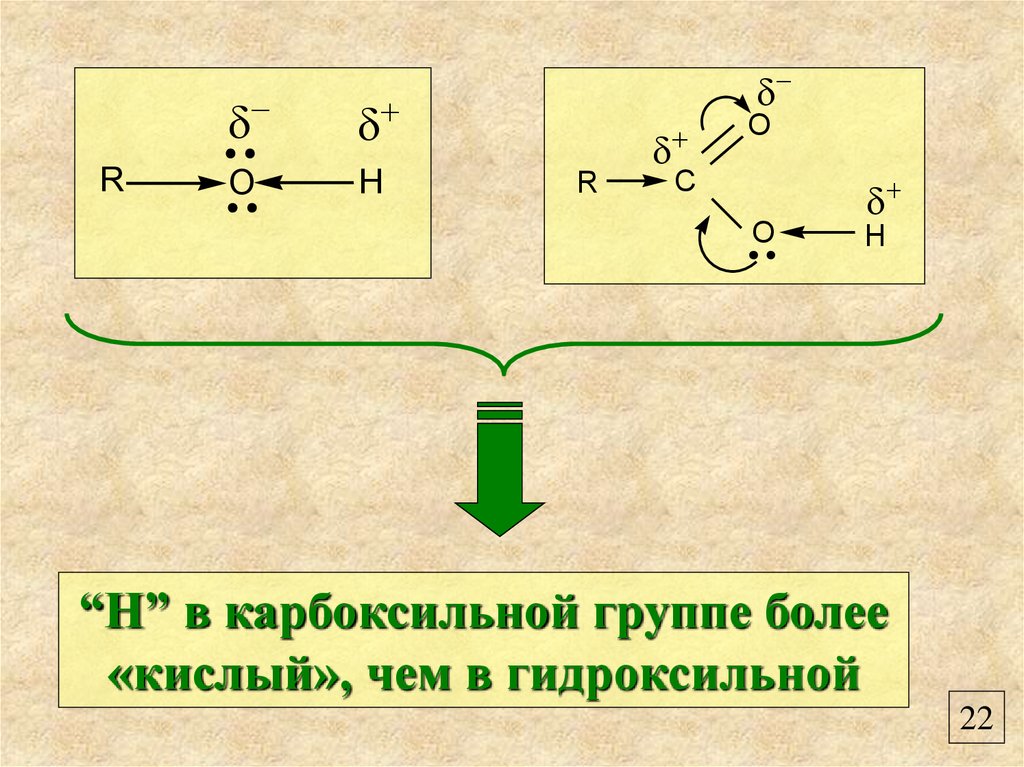
RO
H
R
O
C
O
H
“Н” в карбоксильной группе более
«кислый», чем в гидроксильной
22
25.
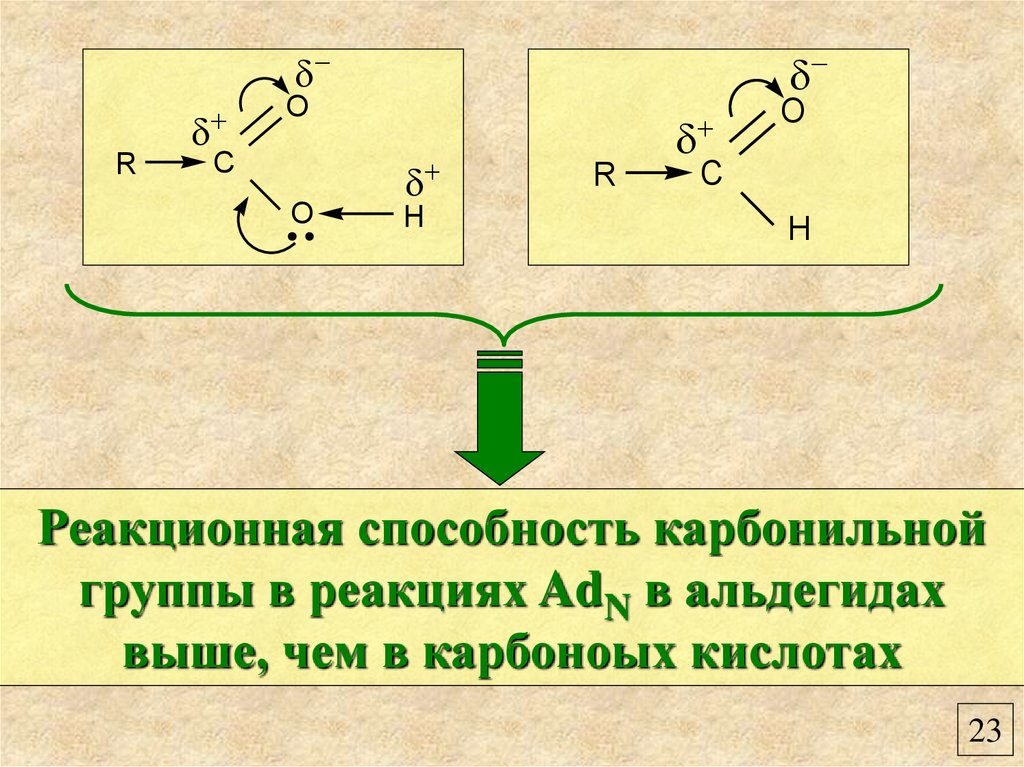
RO
C
O
H
R
O
C
H
Реакционная способность карбонильной
группы в реакциях AdN в альдегидах
выше, чем в карбоноых кислотах
23













 Химия
Химия