Похожие презентации:
Азотсодержащие производные углеводородов. Нитросоединения. Аминосоединения
1.
Азотсодержащие производные углеводородов.Нитросоединения. Классификация, номенклатура, изомерия. Физические
свойства алифатических и ароматических нитросоединений.
Получение нитросоединений реакциями нитрования алканов и аренов,
алкилированием солей азотистой кислоты.
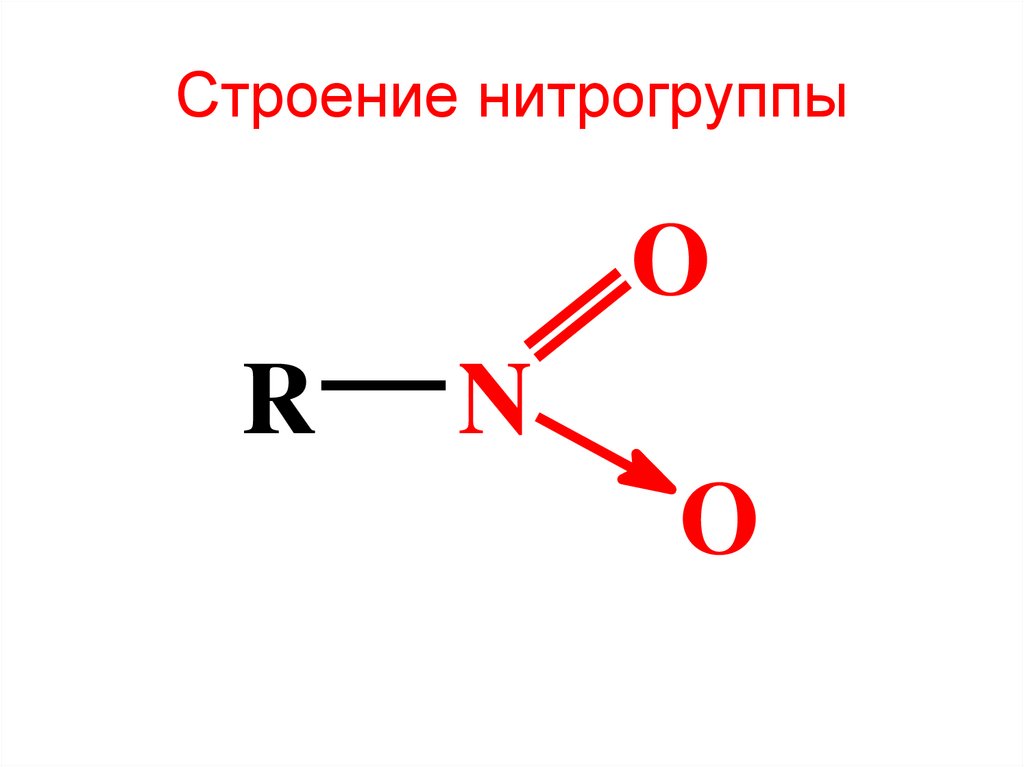
Строение нитрогруппы, понятие о донорно-акцепторной связи.
Химические свойства: восстановление по Зинину, таутомерия, C-Hкислотность, реакции с азотистой кислотой. Влияние нитрогруппы на SE-реакции в
бензольном кольце: реакции нитрования, сульфирования, галогенирования.
Основные представители: нитрометан, нитробензол, тринитротолуол.
Экологические проблемы производства и применения нитросоединений.
Токсичность.
Амины. Классификация, изомерия, номенклатура.
Получение
аминов
восстановлением
нитросоединений,
нитрилов,
алкилированием аммиака. Физические свойства, влияние водородной связи на
физические свойства аминов.
Химические свойства: основность, реакции алкилирования, ацилирования,
взаимодействие с азотистой кислотой. Четвертичные аммониевые соли, их
применение. Аминогруппа как электронодонорный заместитель бензольного
кольца. Галогенирование, нитрование, сульфирование ароматических аминов.
Качественные реакции аминов.
Важнейшие представители: анилин, толуидин, их использование в
производстве лекарственных веществ, красителей, синтетических волокон.
2.
НИТРОСОЕДИНЕНИЯпроизводные углеводородов, в молекулахкоторых
один
или
несколько
атомов
водорода замещены на нитрогруппу -NO2
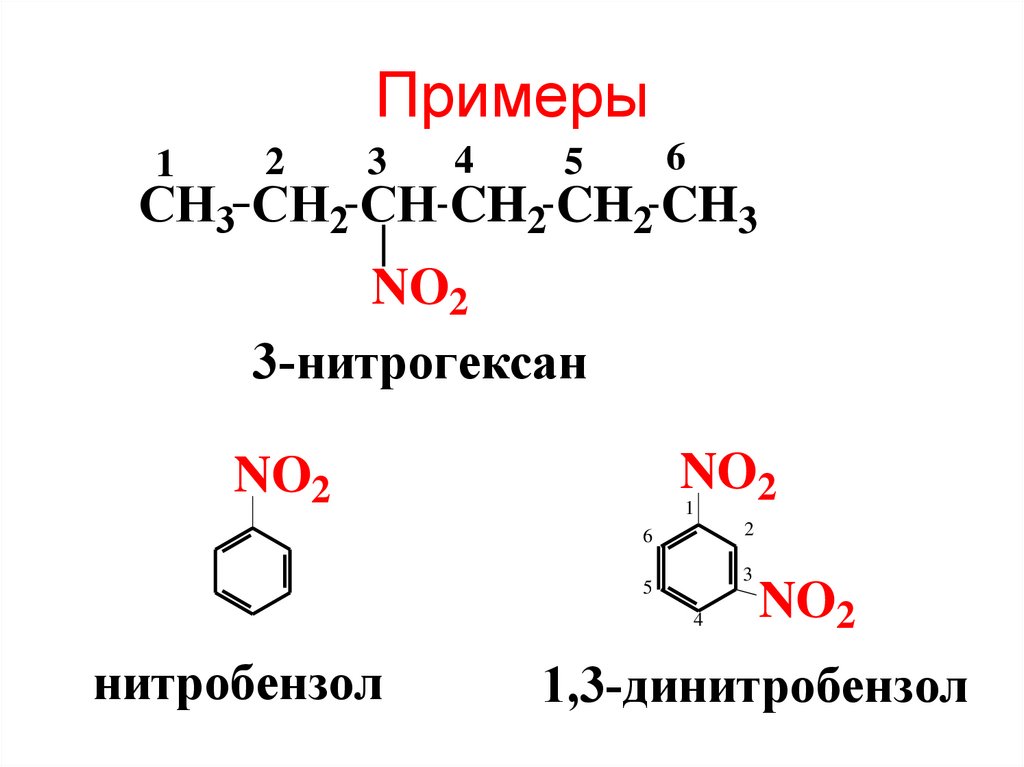
Названия нитросоединений образуют от
названия углеводорода, добавляя префикс
нитро- с указанием номера атома углерода
при нитрогруппе
3. Примеры
12
3
4
6
5
CH3 CH2 CH CH2 CH2 CH3
NO2
3-нитрогексан
NO2
NO2
1
2
6
3
5
4
нитробензол
NO2
1,3-динитробензол
4.
Способы получения1. Реакции нитрования алканов
2. Нитрование аренов
3.Замещение галогена на нитрогруппу
действием нитритов
См. хим. св-ва этих классов соединений
5.
Физические свойства нитросоединенийНитроалканы
представляют
собой
бесцветные
жидкости
с
высокими
температурами кипения: нитрометан, Т.кип.
101,2оС; нитроэтан, Т.кип. 114оС.
Нитроарены- жидкие или твердые вещества
желтоватого цвета.
6. Строение нитрогруппы
OR
N
O
7.
8.
ХИМИЧЕСКИЕ СВОЙСТВА1. Реакции восстановления
нитрогруппы;
2.Реакции по α-углеродному атому;
3. Реакции по ароматическому кольцу
(реакции электрофильного
замещения)
9.
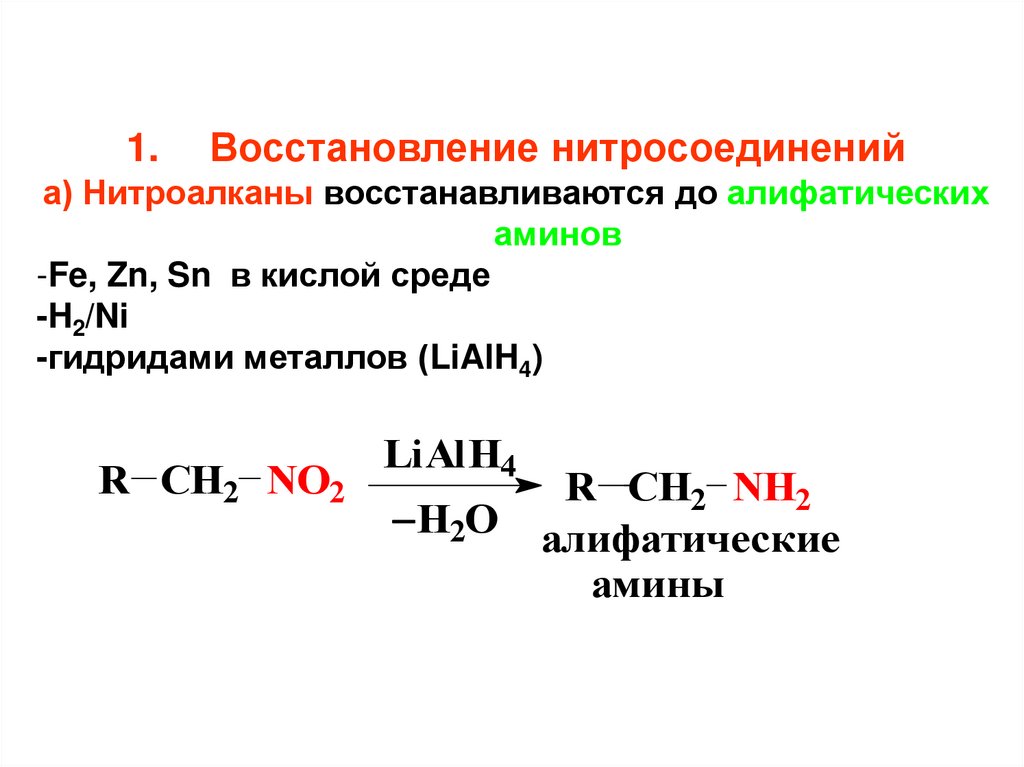
1.Восстановление нитросоединений
а) Нитроалканы восстанавливаются до алифатических
аминов
-Fe, Zn, Sn в кислой среде
-H2/Ni
-гидридами металлов (LiAlH4)
R CH2 NO2
LiAlH4
H2O
R CH2 NH2
алифатические
амины
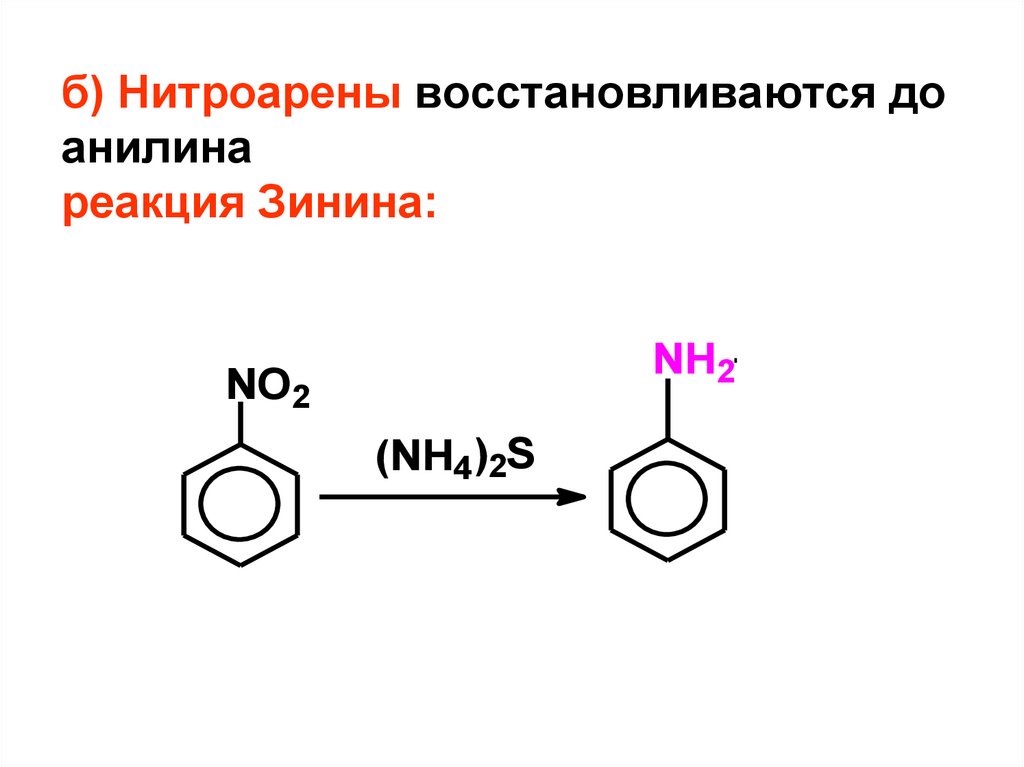
10. б) Нитроарены восстановливаются до анилина реакция Зинина:
NH2NO2
(NH4)2S
11.
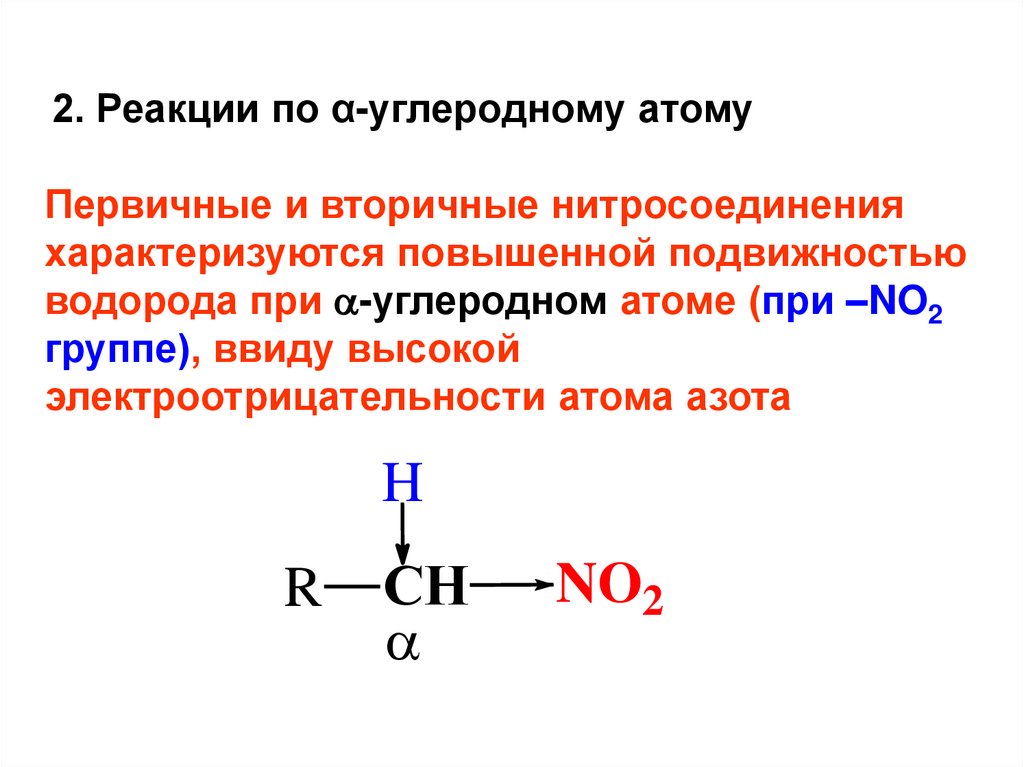
2. Реакции по α-углеродному атомуПервичные и вторичные нитросоединения
характеризуются повышенной подвижностью
водорода при -углеродном атоме (при –NO2
группе), ввиду высокой
электроотрицательности атома азота
H
R
CH
NO2
12.
а) Реакции со щелочью - первичные ивторичные нитросоединения медленно
растворяются в щелочах с образованием
солей аци-нитроформы.
H
CH3CH
O
N
нитроформа
O
NaOH CH3CH N
ONa
O
H2O ацинитроформа
Нитро-форма и аци-нитроформа являются
изомерами- таутомерами, находящимися в
состоянии динамического равновесия.
13.
б) реакции с азотистой кислотойПервичные и вторичные нитроалканы можно
отличить друг от друга и от третичных
нитросоединений
реакцией
с
азотистой
кислотой (0-5 oC)
NaNO2+HCl→HNO2 + NaCl
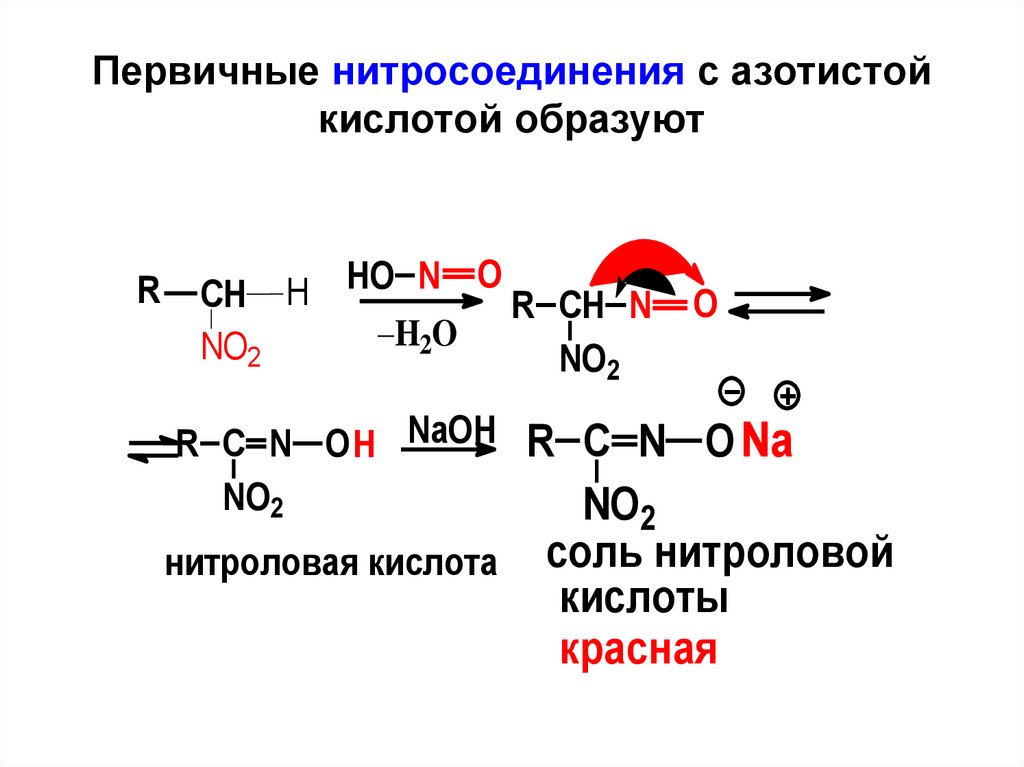
14. Первичные нитросоединения с азотистой кислотой образуют
RO
HO
N
H
CH
R CH N
H2O
NO2
NO2
R C N O H NaOH
NO2
O
R C N O Na
NO2
нитроловая кислота соль нитроловой
кислоты
красная
15.
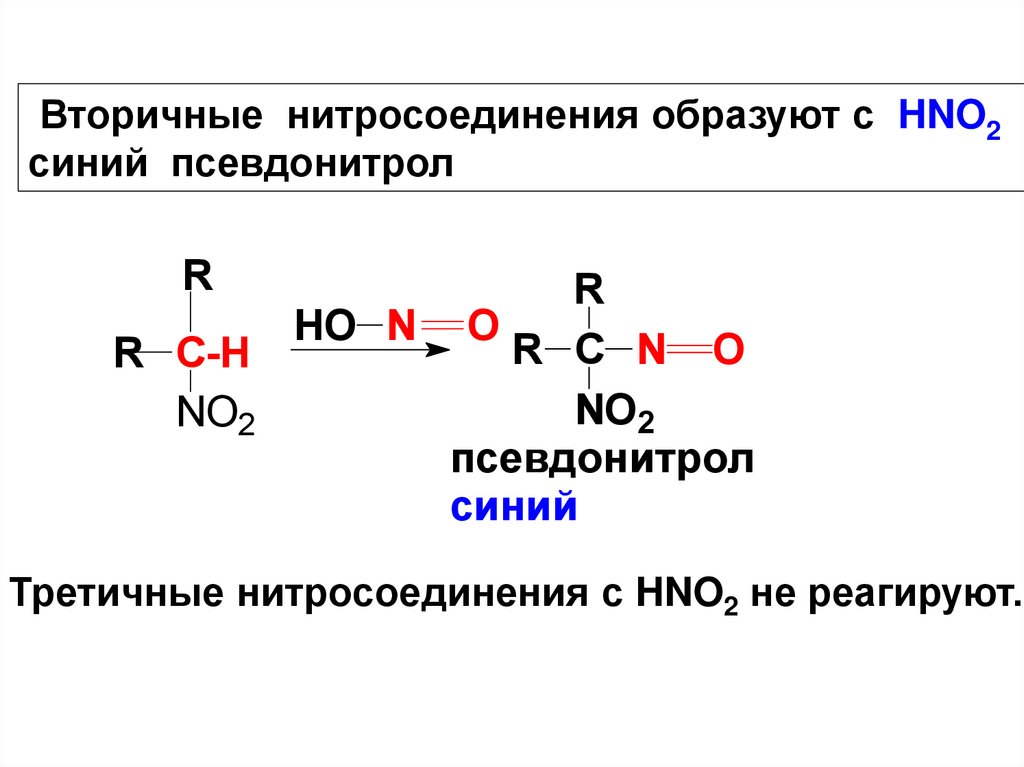
Вторичные нитросоединения образуют с HNO2синий псевдонитрол
R
R C-H
NO2
R
HO N O
R C N O
NO2
псевдонитрол
синий
Третичные нитросоединения с HNO2 не реагируют.
16.
3. Реакции нитроаренов по ароматическомукольцу.
Нитрогруппа
в
аренах
уменьшает
электронную плотность за счет –I
и –Mэффектов.
Поэтому
в
реакциях
SE
нитроарены
взаимодействуют
только
с
сильными электрофильными реагентами при
повышенных
температурах
(реакции
нитрования, сульфирования)
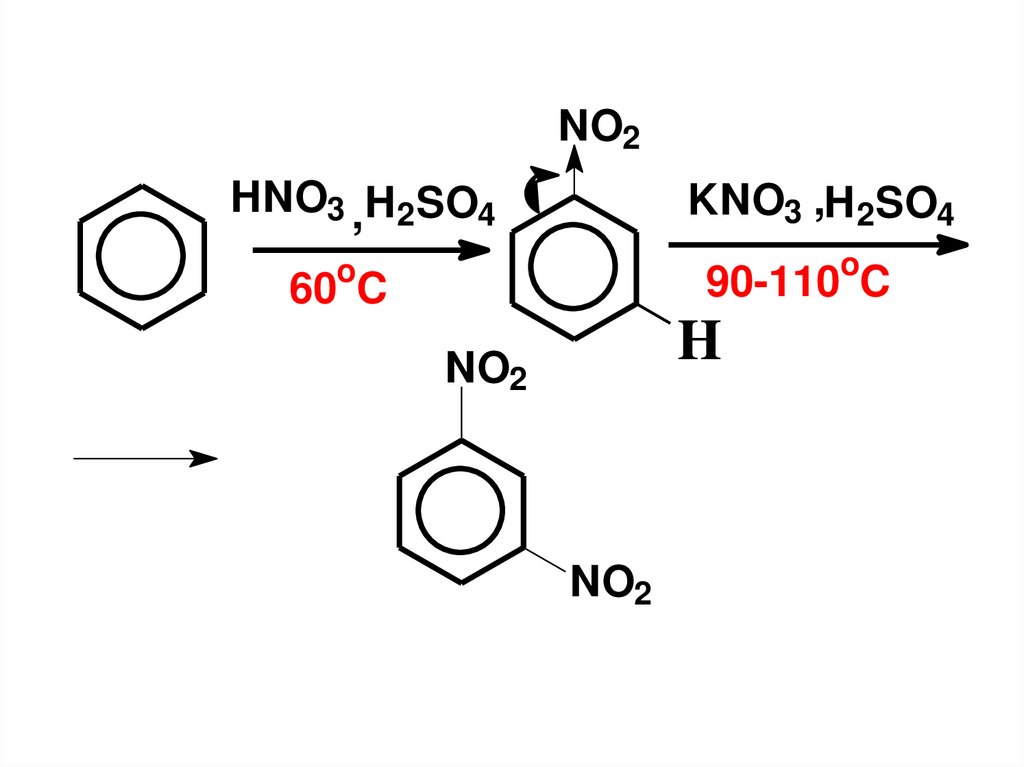
17.
NO2HNO3 , H2SO4
KNO3 ,H2SO4
o
o
90-110 C
60 C
H
NO2
NO2
18.
NO2NO2
H2SO4
SO3
SO3H
19. Применение нитросоединений 1. Полинитрозамещенные углеводороды применяют: - в медицине (нитроглицерин, нитронг, тринитролонг)
Применение нитросоединений1. Полинитрозамещенные
углеводороды применяют:
- в медицине (нитроглицерин, нитронг,
CH2 CH CH2
тринитролонг)
ONO2 ONO2 ONO2
тринитроглицерин
20.
-в производстве взрывчатыхвеществ (тринитротолуол или
тротил, тринитрат целлюлозы).
-2. Нитрометан и нитробензол
применяют в качестве
растворителей,
3. Нитробензол- в производстве
анилина
21. Токсичные свойства нитросоединений
Нитросоединения(особенно
ароматические) проникают в организм
через органы дыхания, пищеварения и
кожу, частично выделяются с мочой.
Симптомы острого отравления —
раздражение слизистых оболочек глаз и
дыхательных путей, возбуждение. При
тяжелых отравлениях—отек легких,
судороги, поражение печени.
22.
Аминосоединенияпроизводные аммиака, в молекуле которогоатомы водорода замещены углеводородными
радикалами
В зависимости от числа углеводородных групп
различают:
R NH2
первичные амины
R NH
R' вторичные амины
R N R''
R'
третичные амины
23.
В зависимости от природы углеводородныхзаместителей различают амины алифатические,
ароматические и алкилароматические.
NH2
C H3C H2NH2
CH2NH2
24.
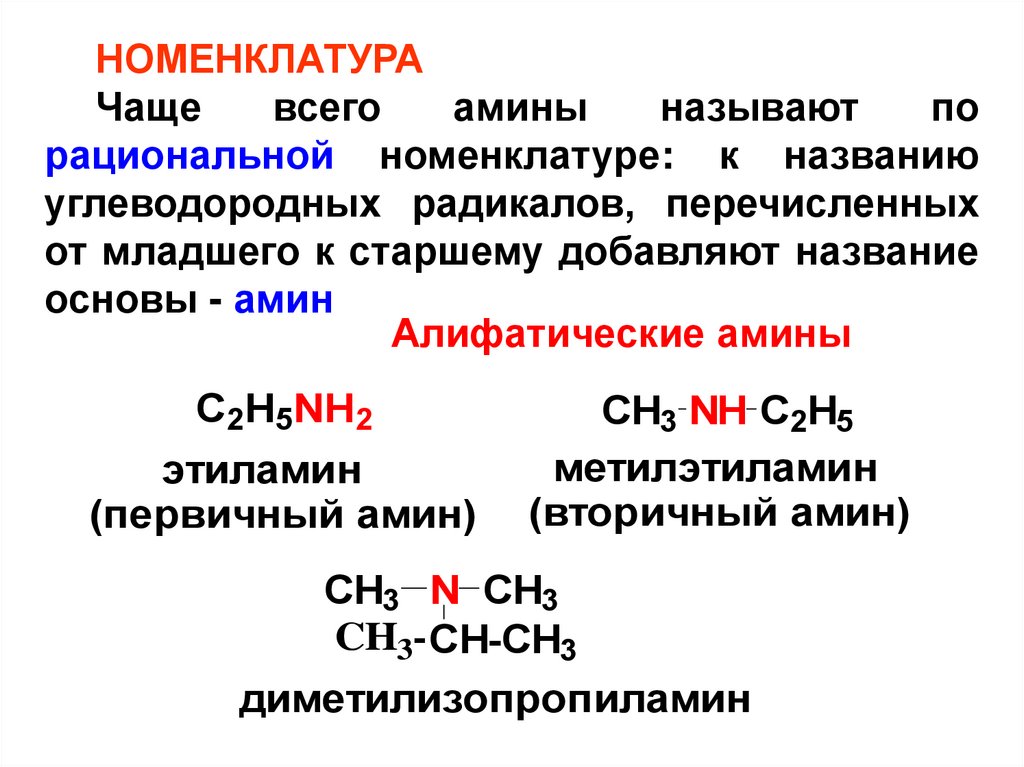
НОМЕНКЛАТУРАЧаще
всего
амины
называют
по
рациональной номенклатуре: к названию
углеводородных радикалов, перечисленных
от младшего к старшему добавляют название
основы - амин
Алифатические амины
C2H5NH2
этиламин
(первичный амин)
CH3 NH C2H5
метилэтиламин
(вторичный амин)
CH3 N CH3
CH3- CH-CH3
диметилизопропиламин
25.
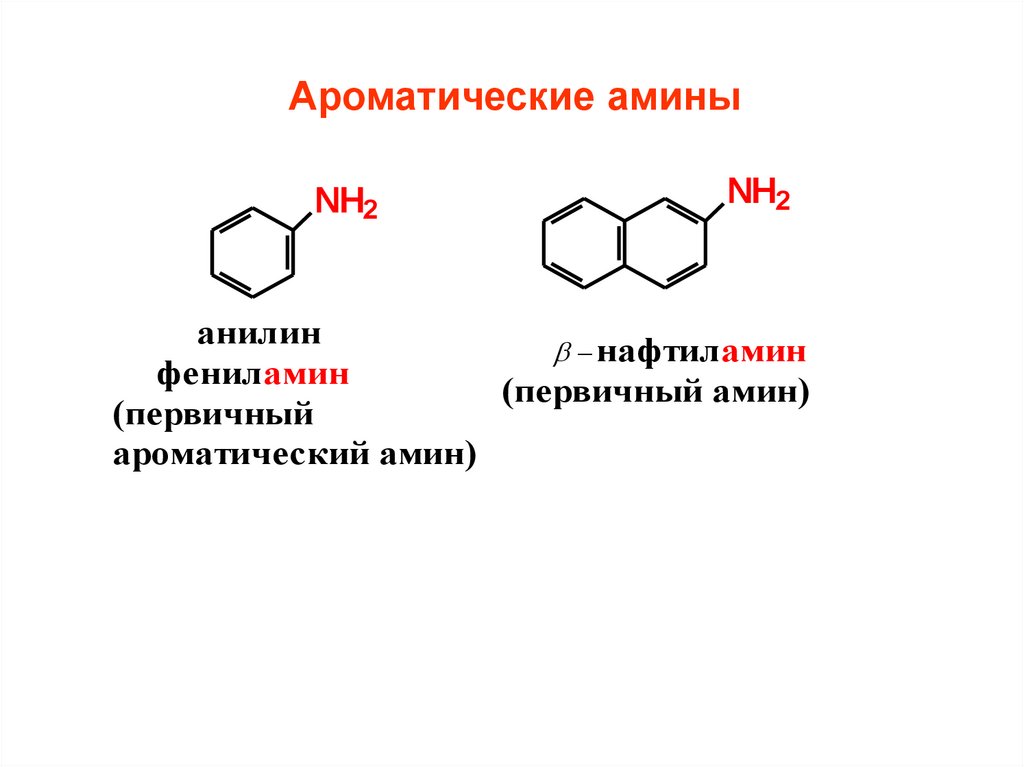
Ароматические аминыNH2
NH2
анилин
нафтиламин
фениламин
(первичный амин)
(первичный
ароматический амин)
26.
Пономенклатуре
ИЮПАК
названия
алифатических аминов образуют от названий
соответствующих углеводородов (алканов)
прибавлением суффикса –амин. Номер
углерода при аминогруппе помещают перед
названием алкана
CH3 CH CH2CH3
NH2
2-бутанамин
27.
Если к атому азота присоединены различныеуглеводородные заместители, то за основу
названия принимают название самой длинной
углеродной цепи, непосредственно связанной с
атомом азота. Более короткие углеводородные
группы
перечисляются
в
префиксе
в
алфавитном порядке совместно с обозначением
N
CH3 CH2 CH CH2 CH3
NH-CH3
N-метил-3-пентанамин
28.
СТРОЕНИЕ и ФИЗИЧЕСКИЕ СВОЙСТВАВ аммиаке и в аминах атом азота находится в
sp3-гибридизациии образует 4 sp3-гибридные
орбитали.
H
N
H H
29.
30.
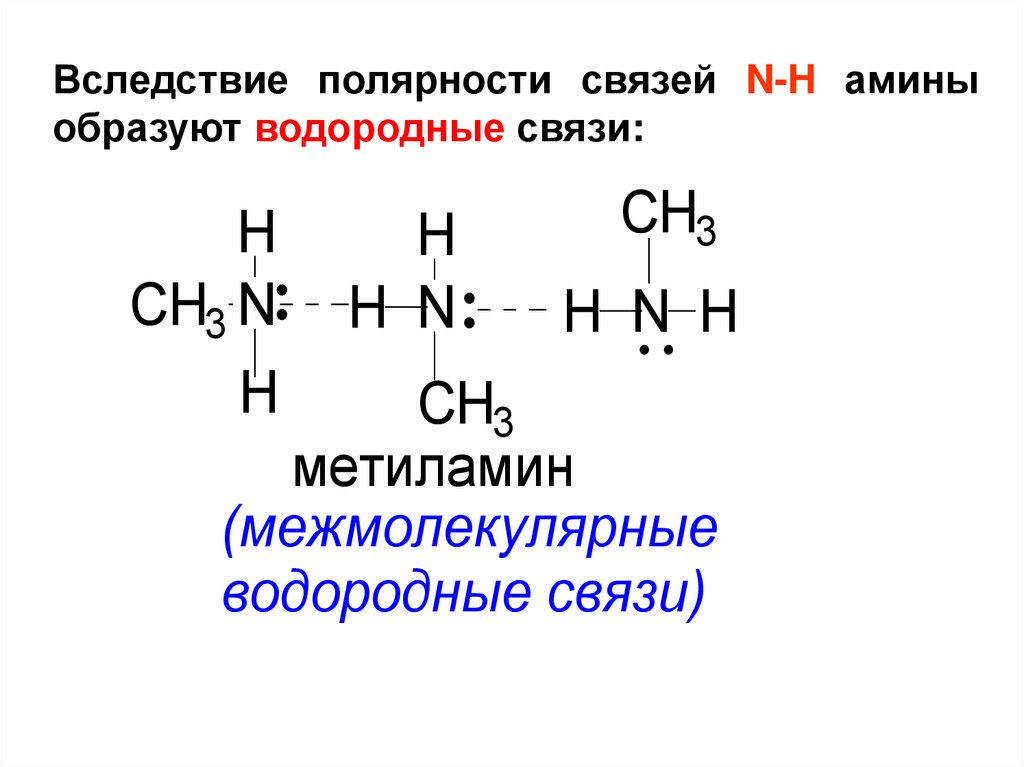
Вследствие полярности связей N-H аминыобразуют водородные связи:
H
CH3 N
H
H
H N
CH3
H N H
CH3
метиламин
(межмолекулярные
водородные связи)
31.
Эти связи менее прочны, чем у воды, поэтомуТ. кип. аминов ниже , чем у воды и спиртов
метанол-Ткип. 640С
метиламин – газ (т. кип.-6,5 оС), остальные
амины- жидкости или твердые вещества.
32.
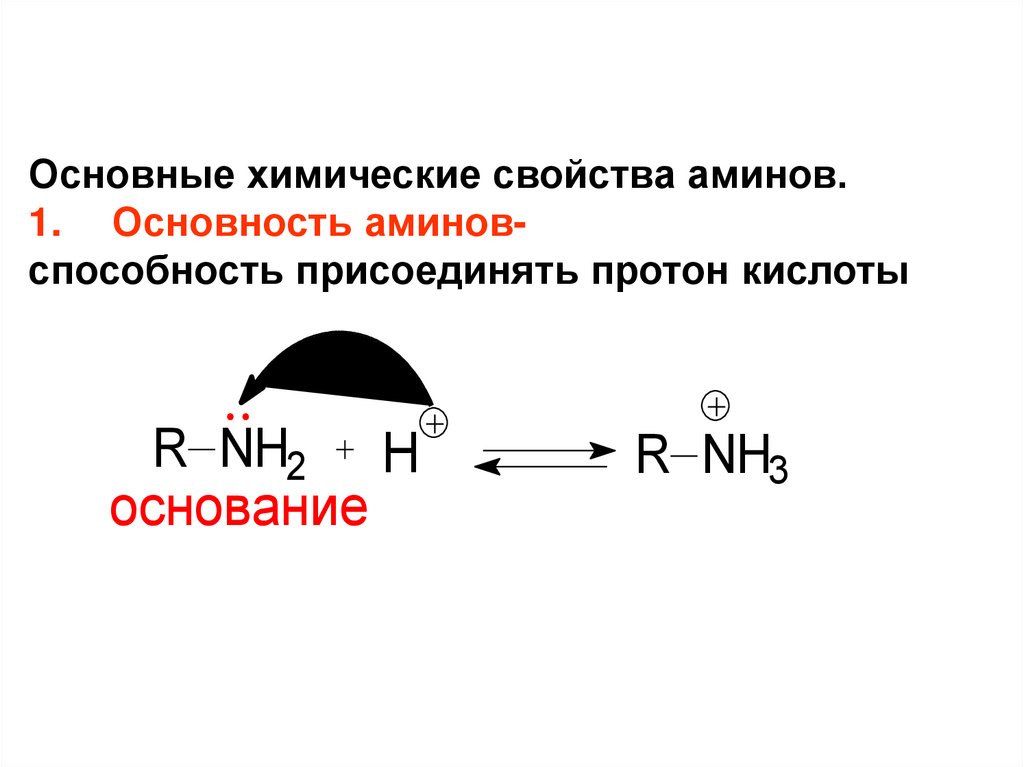
Основные химические свойства аминов.1. Основность аминовспособность присоединять протон кислоты
R NH2
основание
H
R NH3
33.
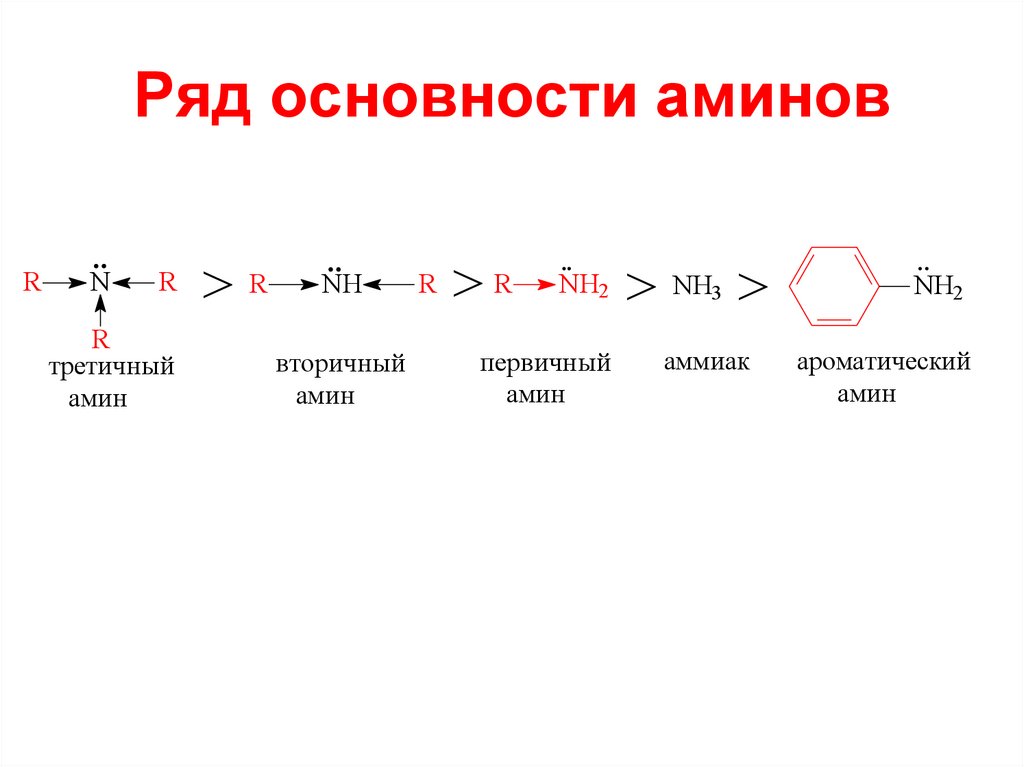
Ряд основности аминовR
N
R
R
третичный
амин
>R
NH
вторичный
амин
R
>R
NH2
> NH >
NH2
первичный
амин
аммиак
ароматический
амин
3
34. Ряд основности аминов
2. Алкилирование аминогруппы можнопроводить галогеналканами (реакция
Гофмана)
или
спиртами
(в
промышленности). Алкилироваться могут
первичные, вторичные и третичные
амины.
R NH2 + R1 Br
первичный
амин
OH
R NH2 R1 Br
соль вторичного
амина
R NH R1 + H2O+ Br
вторичный
амин
OH
35. 2. Алкилирование аминогруппы можно проводить галогеналканами (реакция Гофмана) или спиртами (в промышленности). Алкилироваться
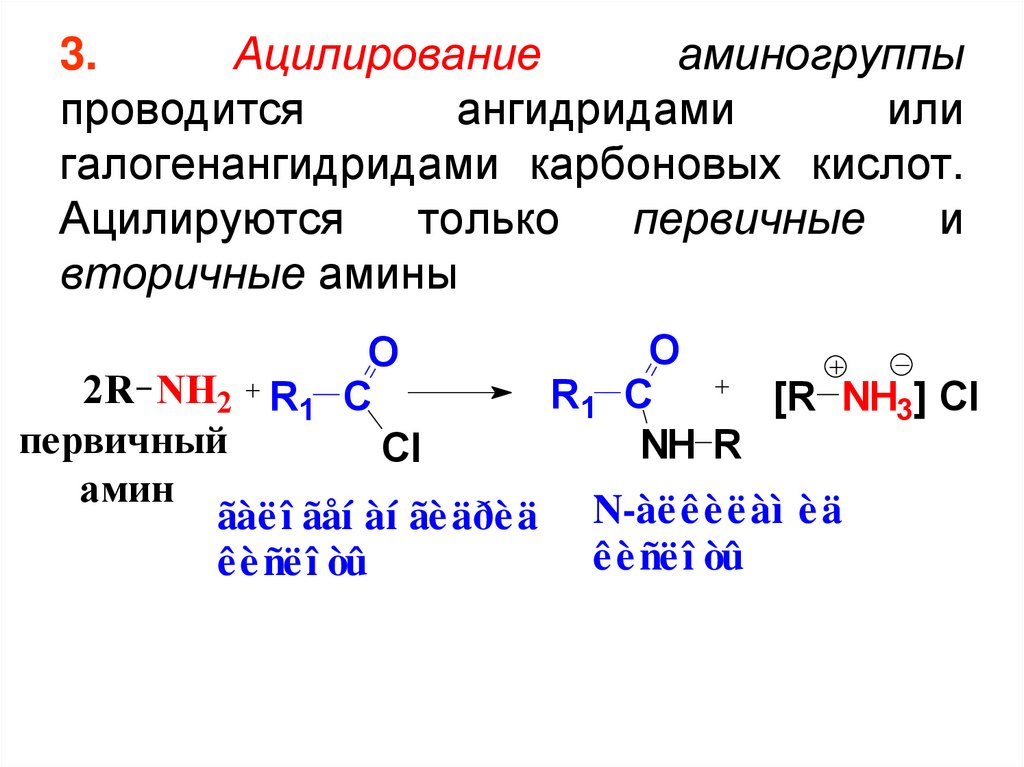
3.Ацилирование
аминогруппы
проводится
ангидридами
или
галогенангидридами карбоновых кислот.
Ацилируются
только
первичные
и
вторичные амины
O
O
2R NH2 R1 C
R1 C
[R NH3] Cl
первичный
NH R
Cl
амин
ãàë î ãåí àí ãè äðè ä N-àë ê è ë àì è ä
ê è ñë î òû
ê è ñë î òû
36. 3. Ацилирование аминогруппы проводится ангидридами или галогенангидридами карбоновых кислот. Ацилируются только первичные и
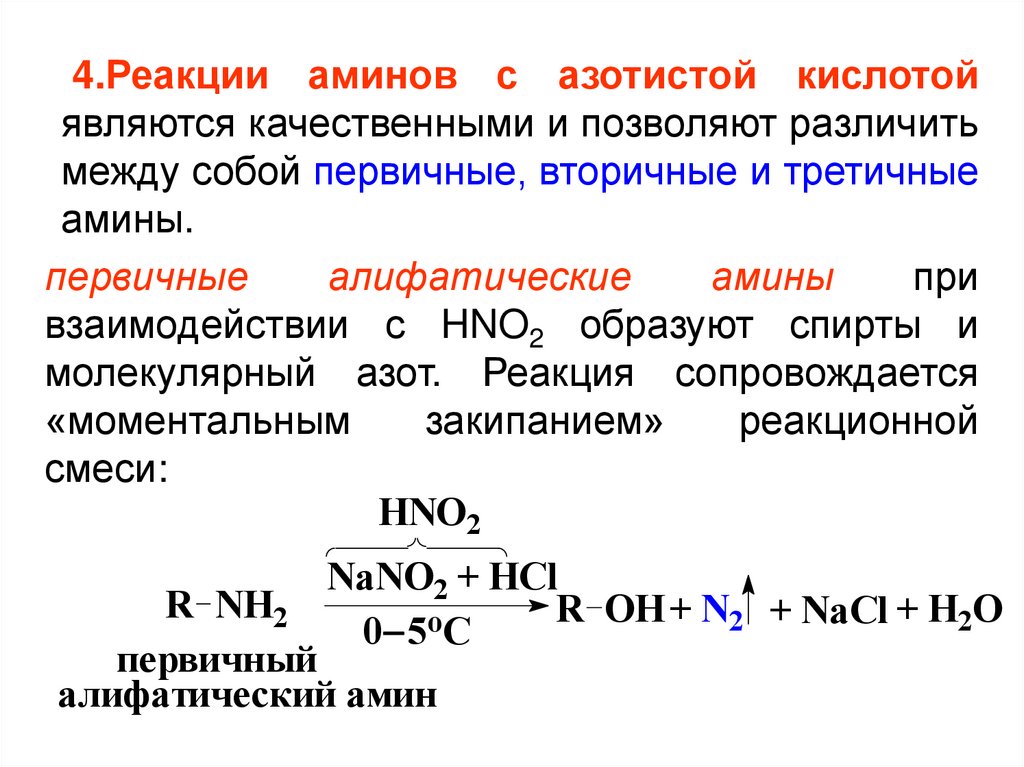
4.Реакции аминов с азотистой кислотойявляются качественными и позволяют различить
между собой первичные, вторичные и третичные
амины.
первичные
алифатические
амины
при
взаимодействии с HNO2 образуют спирты и
молекулярный азот. Реакция сопровождается
«моментальным
закипанием»
реакционной
смеси:
HNO2
NaNO2 + HCl
R OH + N2 + NaCl + H2O
o
0 5 C
R NH2
первичный
алифатический амин
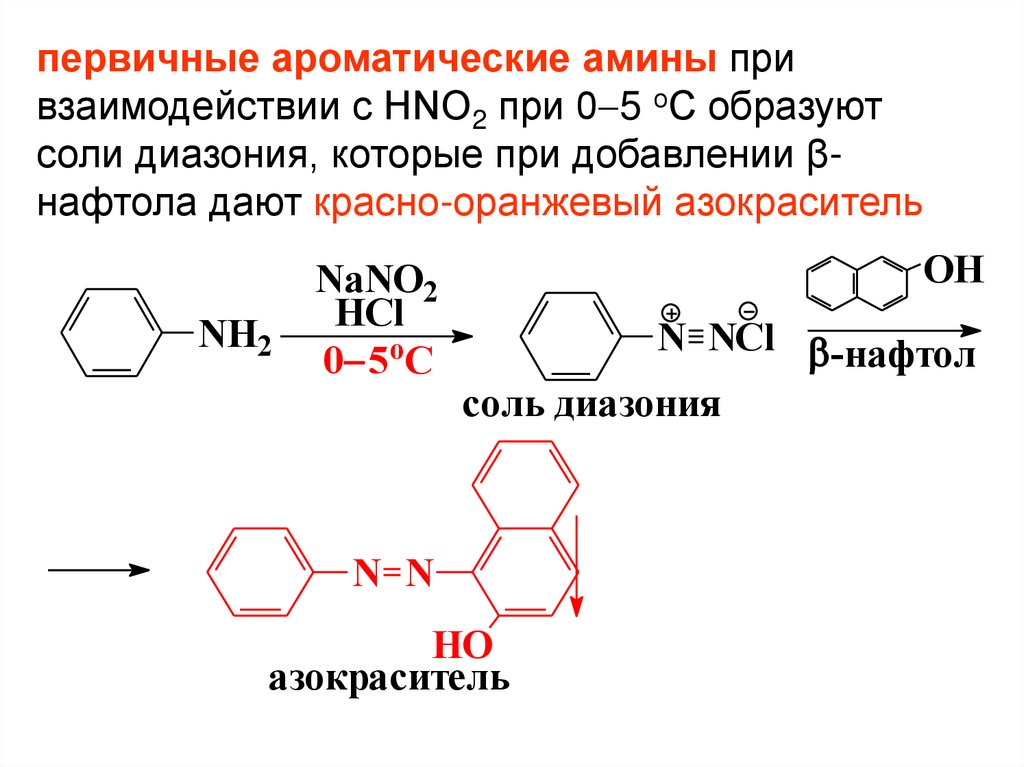
37.
первичные ароматические амины привзаимодействии с HNO2 при 0 5 оС образуют
соли диазония, которые при добавлении βнафтола дают красно-оранжевый азокраситель
NH2
NaNO2
HCl
0 5oC
OH
N NCl -нафтол
соль диазония
N N
HO
азокраситель
38.
вторичные амины при взаимодействии с HNO2образуют N-нитрозосоединения, которые
выпадают в виде желтых осадков или тяжелых
маслянистых жидкостей
R NH R1
NaNO2
HCl
0 5oC
R N R1 + H2O
N=O
N- нитрозодиалкиламин
39.
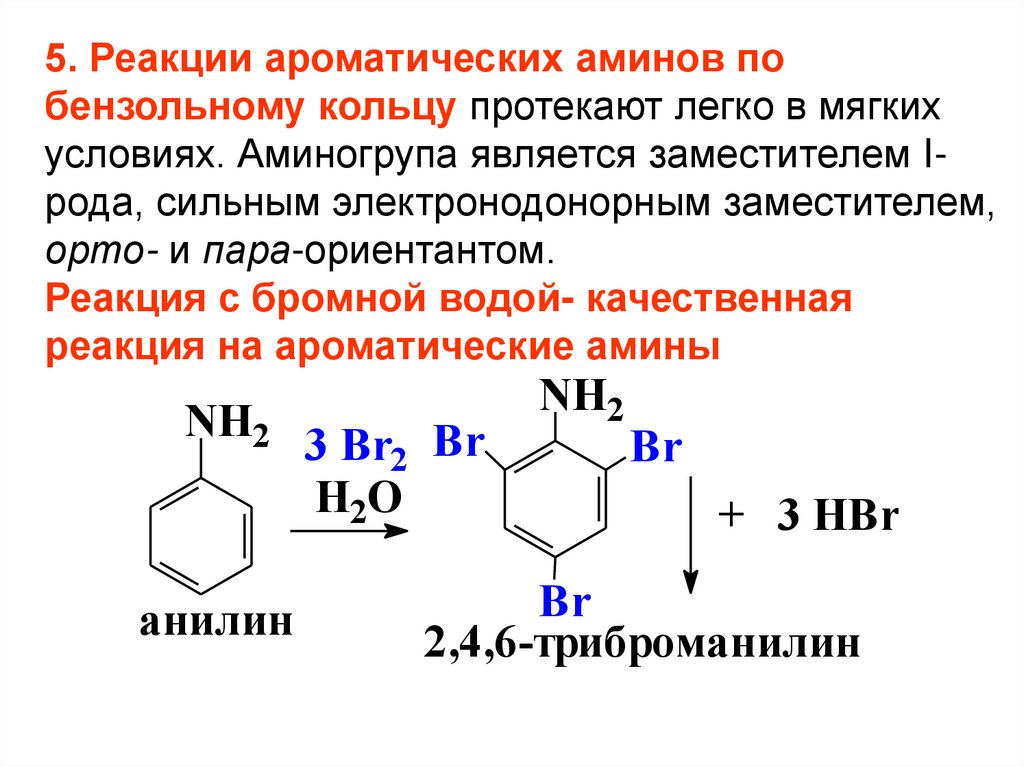
5. Реакции ароматических аминов побензольному кольцу протекают легко в мягких
условиях. Аминогрупа является заместителем Iрода, сильным электронодонорным заместителем,
орто- и пара-ориентантом.
Реакция с бромной водой- качественная
реакция на ароматические амины
NH2
анилин
3 Br2 Br
H2O
NH2
Br
+ 3 HBr
Br
2,4,6-триброманилин
40.
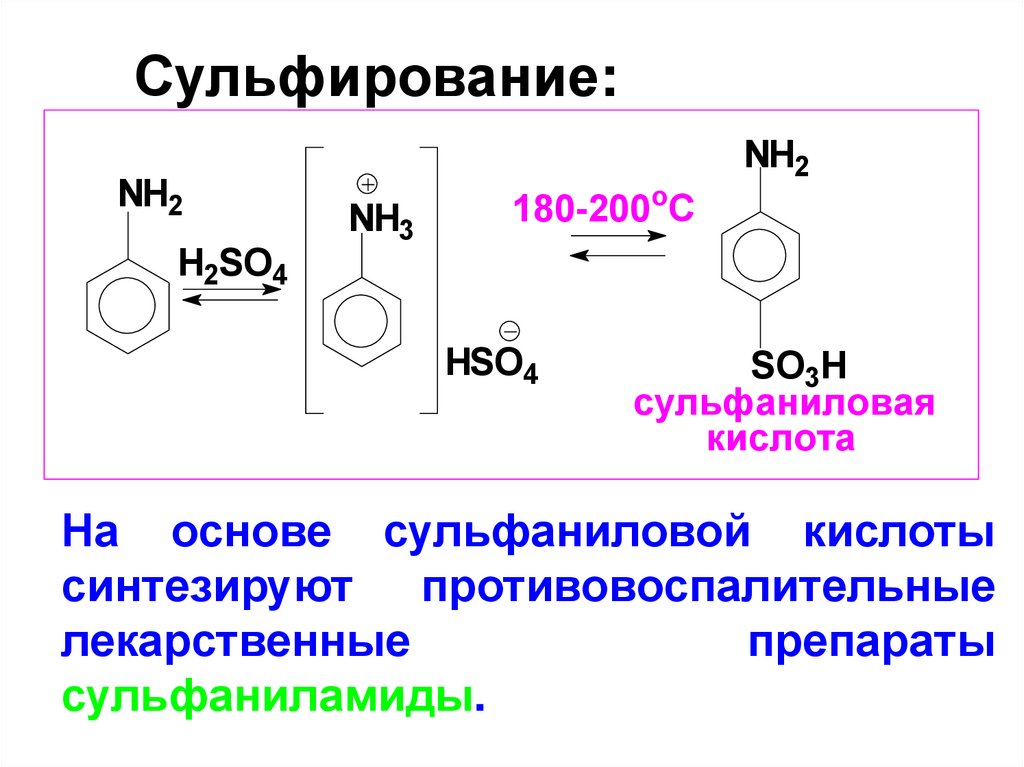
Сульфирование:NH2
H2SO4
NH3
180-200оС
HSO4
NH2
SO3H
сульфаниловая
кислота
На основе сульфаниловой кислоты
синтезируют противовоспалительные
лекарственные
препараты
сульфаниламиды.
41.
Основные представители аминовАлифатические диамины – исходные
соединения
для
получения
полиамидов, например, найлона,
широко
применяемого
для
изготовления волокон, полимерных
пленок, а также узлов и деталей в
машиностроении
(полиамидные
зубчатые передачи).
42.
Анилин-в производствеазокрасителей
43. Анилин-в производстве азокрасителей
44.
45.
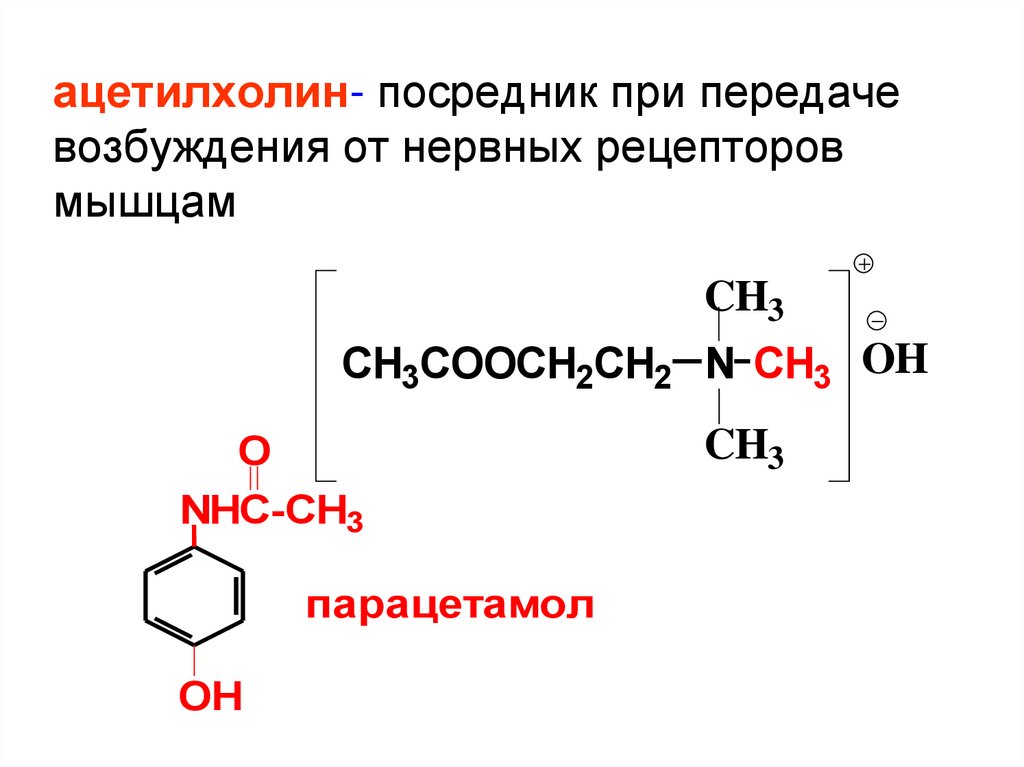
ацетилхолин- посредник при передачевозбуждения от нервных рецепторов
мышцам
CH3
CH3COOCH2CH2 N CH3 OH
O
NHC-CH3
парацетамол
OH
CH3
46.
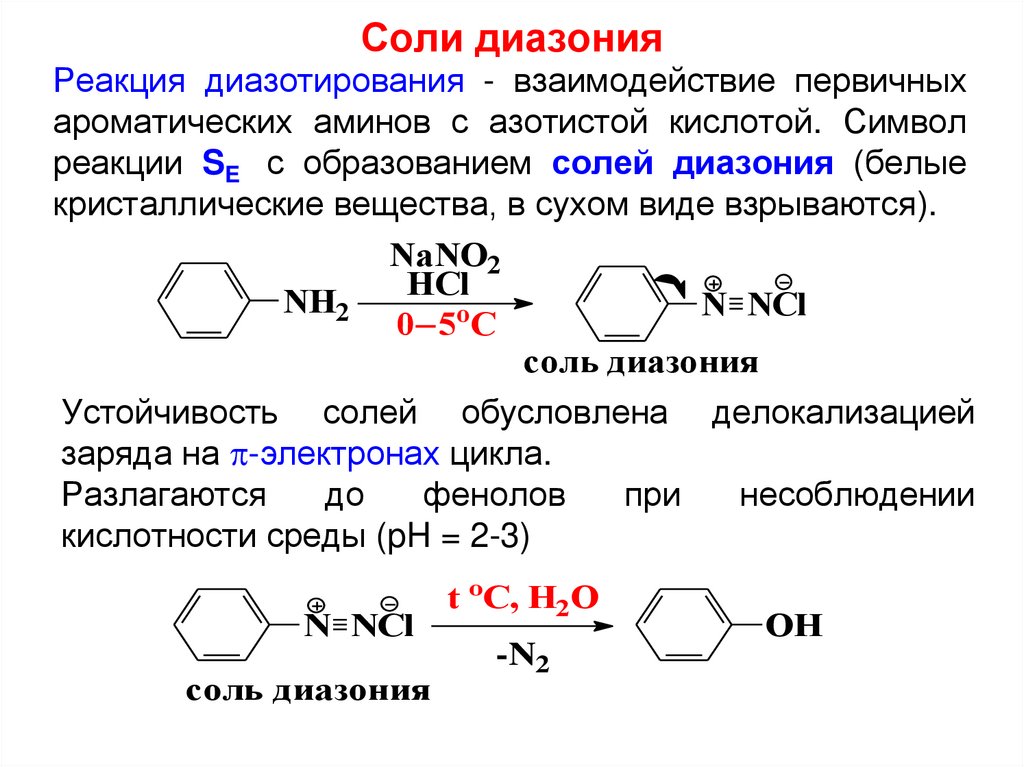
Соли диазонияРеакция диазотирования - взаимодействие первичных
ароматических аминов с азотистой кислотой. Символ
реакции SE с образованием солей диазония (белые
кристаллические вещества, в сухом виде взрываются).
NaNO2
HCl
NH2
N NCl
o
0 5 C
соль диазония
Устойчивость солей обусловлена делокализацией
заряда на -электронах цикла.
Разлагаются
до
фенолов
при
несоблюдении
кислотности среды (pH = 2-3)
N NCl
соль диазония
t oC, H2O
-N2
OH
47. Соли диазония
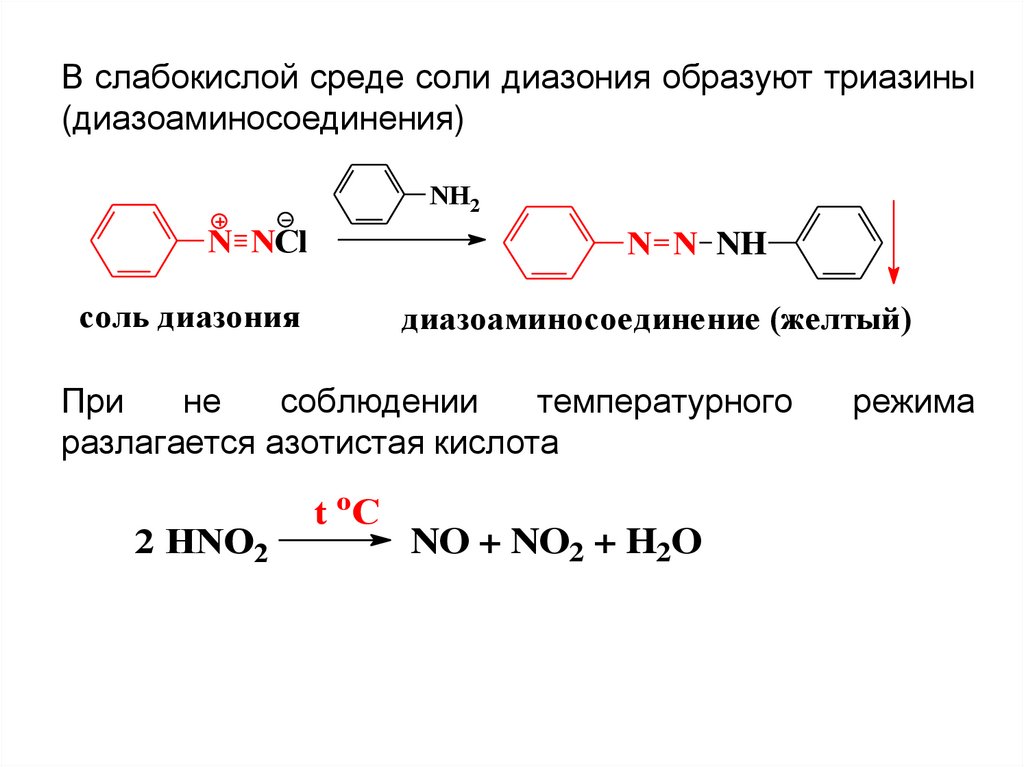
В слабокислой среде соли диазония образуют триазины(диазоаминосоединения)
NH2
N NCl
N N NH
соль диазония
диазоаминосоединение (желтый)
При
не
соблюдении
температурного
разлагается азотистая кислота
2 HNO2
t oC
NO + NO2 + H2O
режима
48.
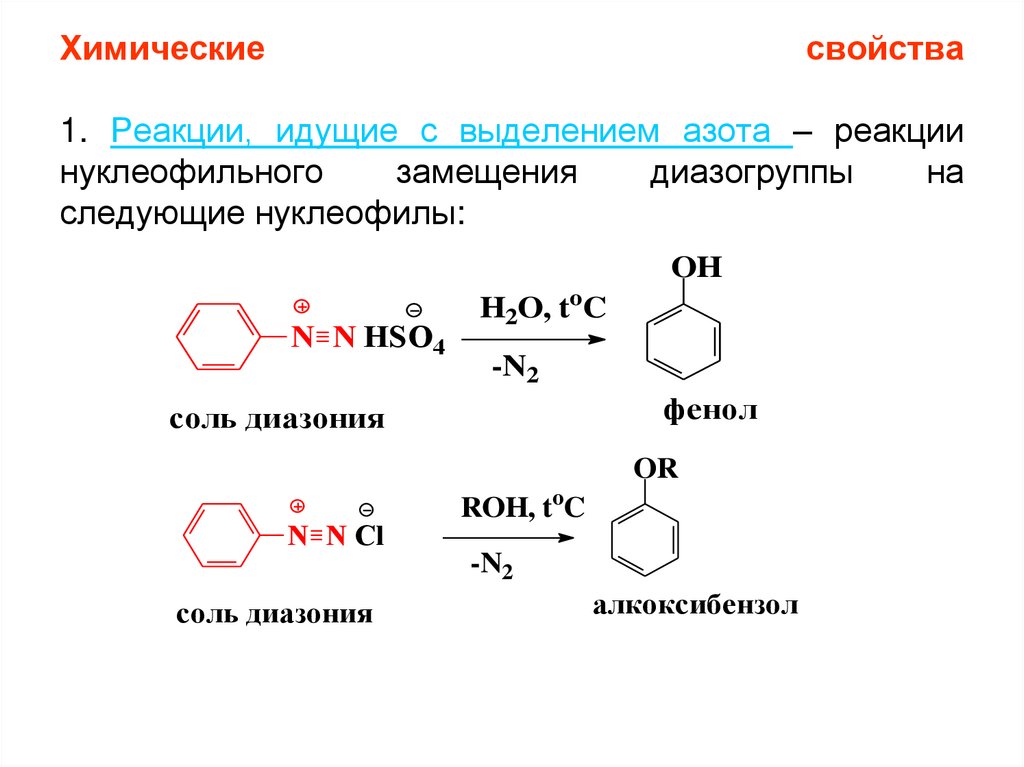
Химическиесвойства
1. Реакции, идущие с выделением азота – реакции
нуклеофильного
замещения
диазогруппы
на
следующие нуклеофилы:
OH
N N HSO4
H2O, toC
-N2
фенол
соль диазония
OR
N N Cl
ROH, toC
-N2
соль диазония
алкоксибензол
49. Химические свойства 1. Реакции, идущие с выделением азота – реакции нуклеофильного замещения диазогруппы на следующие
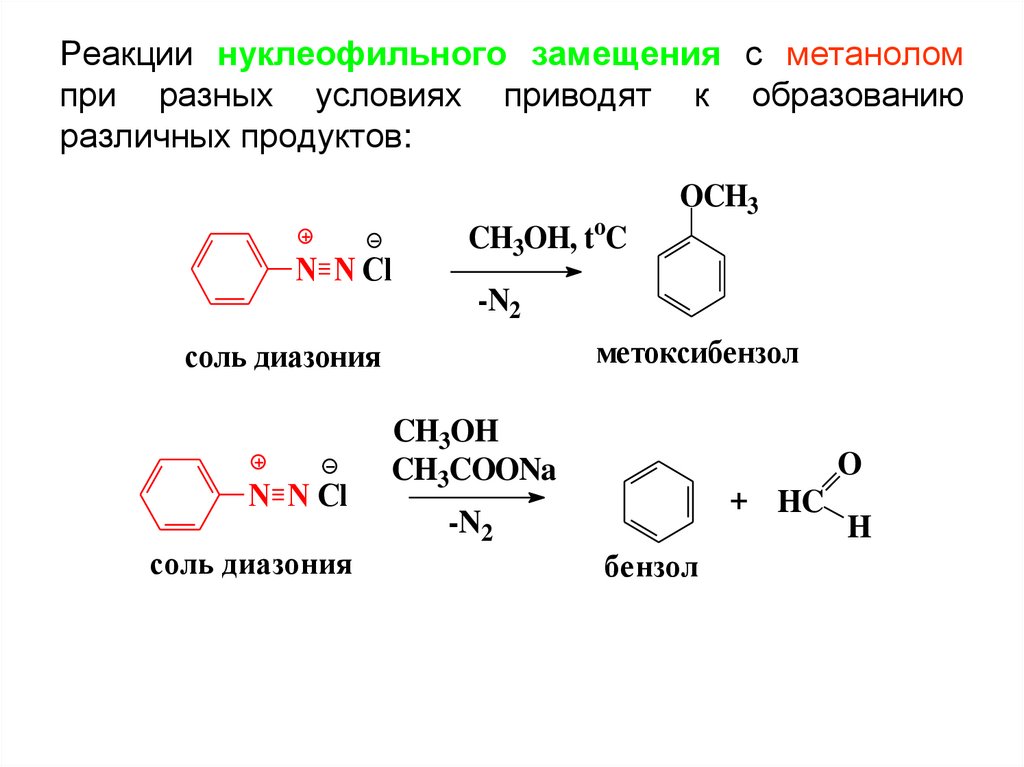
Реакции нуклеофильного замещения с метаноломпри разных условиях приводят к образованию
различных продуктов:
N N Cl
CH3OH, toC
OCH3
-N2
метоксибензол
соль диазония
N N Cl
соль диазония
CH3OH
CH3COONa
O
+ HC
-N2
бензол
H
50. Реакции нуклеофильного замещения с метанолом при разных условиях приводят к образованию различных продуктов:
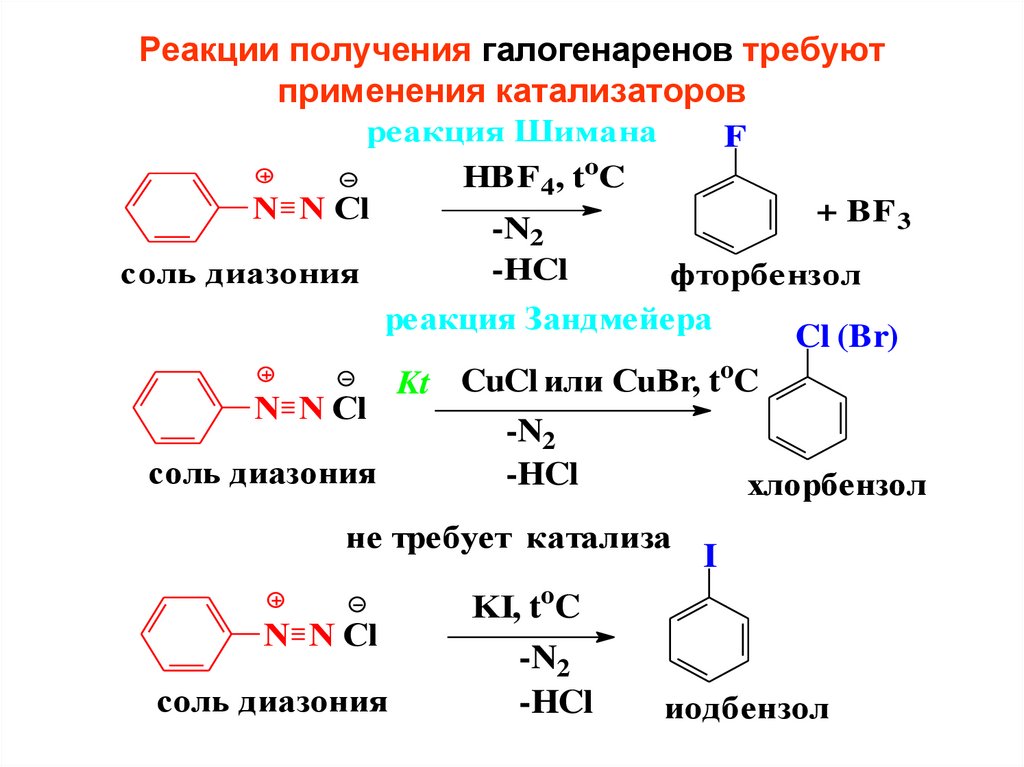
Реакции получения галогенаренов требуютприменения катализаторов
реакция Шимана
F
HBF 4, toC
N N Cl
+ BF 3
-N2
-HCl
соль диазония
фторбензол
реакция Зандмейера
Cl (Br)
Kt CuCl или CuBr, toC
N N Cl
-N2
соль диазония
-HCl
хлорбензол
не требует катализа
N N Cl
соль диазония
I
KI, toC
-N2
-HCl
иодбензол
51. Реакции получения галогенаренов требуют применения катализаторов
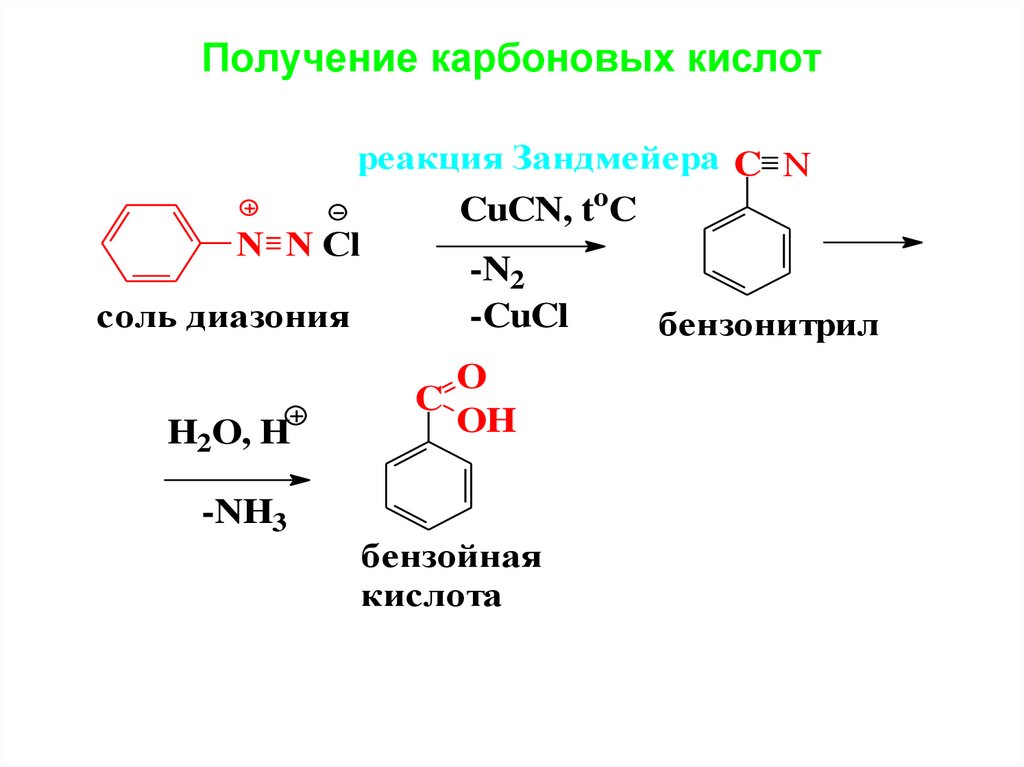
Получение карбоновых кислотреакция Зандмейера C N
CuCN, toC
N N Cl
-N2
-CuCl
соль диазония
бензонитрил
H2O, H
-NH3
O
C
OH
бензойная
кислота
52. Получение карбоновых кислот
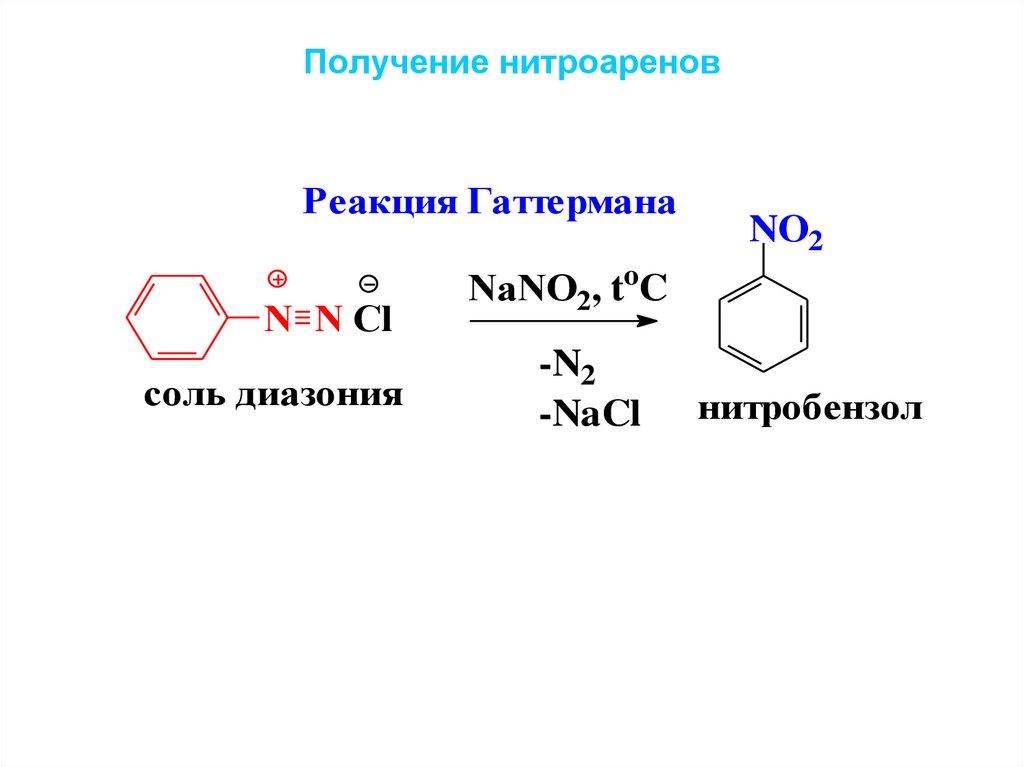
Получение нитроареновРеакция Гаттермана
N N Cl
соль диазония
NO2
NaNO2, toC
-N2
-NaCl
нитробензол
53. Получение нитроаренов
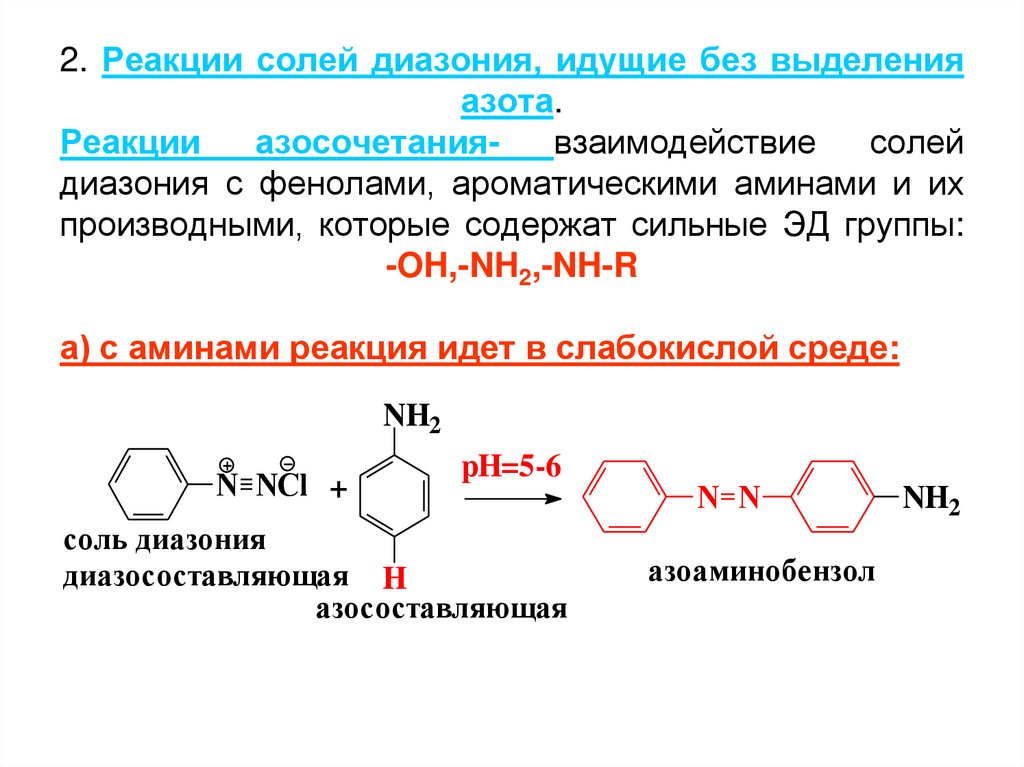
2. Реакции солей диазония, идущие без выделенияазота.
Реакции
азосочетаниявзаимодействие
солей
диазония с фенолами, ароматическими аминами и их
производными, которые содержат сильные ЭД группы:
-OH,-NH2,-NH-R
а) с аминами реакция идет в слабокислой среде:
NH2
N NCl +
pH=5-6
соль диазония
диазосоставляющая H
азосоставляющая
N N
азоаминобензол
NH2
54. 2. Реакции солей диазония, идущие без выделения азота. Реакции азосочетания- взаимодействие солей диазония с фенолами,
В сильнокислой среде амин превращается в соль,теряет ЭД свойства и не участвует в реакции
азосочетания
NH2
NH3Cl
HCl
азосоставляющая
55. В сильнокислой среде амин превращается в соль, теряет ЭД свойства и не участвует в реакции азосочетания
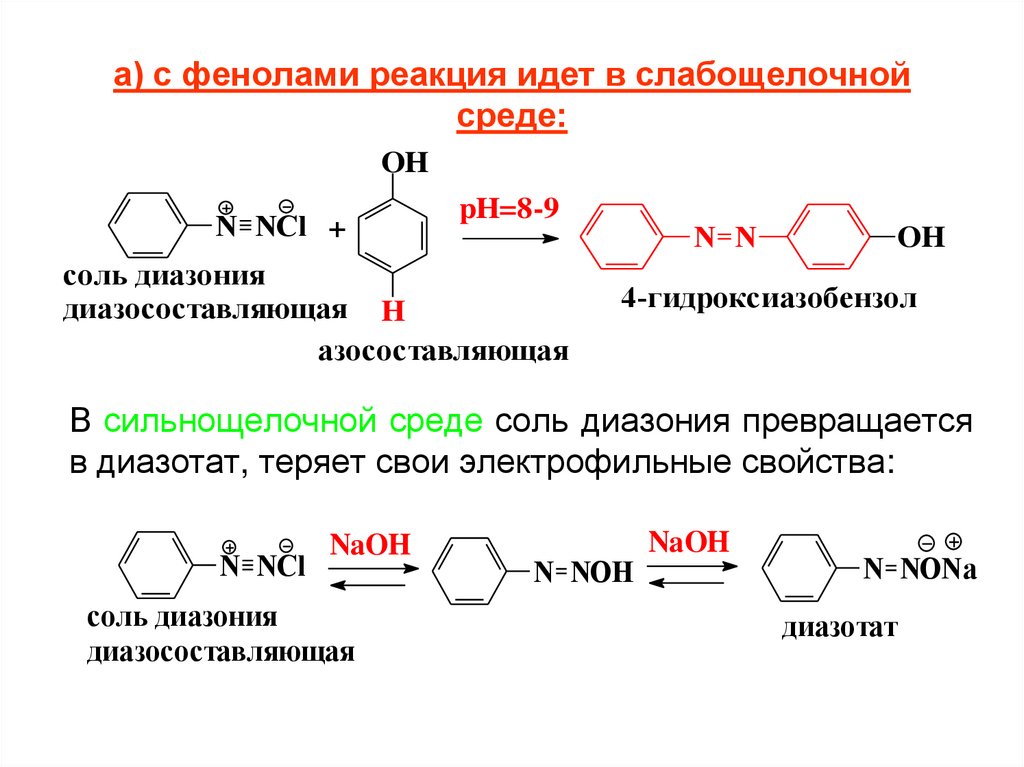
а) с фенолами реакция идет в слабощелочнойсреде:
OH
N NCl +
pH=8-9
соль диазония
диазосоставляющая H
азосоставляющая
N N
OH
4-гидроксиазобензол
В сильнощелочной среде соль диазония превращается
в диазотат, теряет свои электрофильные свойства:
N NCl
NaOH
соль диазония
диазосоставляющая
N NOH
NaOH
N NONa
диазотат
























 Химия
Химия








