Похожие презентации:
Л1 теория
1.
БИООРГАНИЧЕСКАЯХИМИЯ
Список литературы:
1. Тюкавкина Н.А., Бауков Ю.И.
Биоорганическая химия, М., 2012, 2014
2. Под ред. Белоконовой Н.А. Учебное пособие
к практическим занятиям по биоорганической
химии, Екатеринбург: УГМА, 2015.
2.
ВведениеБиоорганическая химия изучает строение,
ф.-х. свойства, биологические функции
органических веществ, участвующих в
процессах жизнедеятельности.
ОБЪЕКТЫ ИЗУЧЕНИЯ
БИОПОЛИМЕРЫ
БИОРЕГУЛЯТОРЫ
-пептиды, белки;
-полисахариды;
-нуклеиновые кислоты;
-липиды
-витамины;
-гормоны;
- синтетические
лекарственные в-ва
3.
ТЕОРЕТИЧЕСКИЕ ОСНОВЫБИООРГАНИЧЕСКОЙ ХИМИИ
4.
Гибридизация орбиталей атома углеродаЭлектронная формула атома С
в основном состоянии:
22s22p2
С
1s
+6
в возбужденном состоянии:
22s12p3
С*
1s
+6
Гибридизация – это «перемешивание» атомных
орбиталей с целью выравнивания их по форме
и энергии
Для атома С характерно три типа гибридизации:
5.
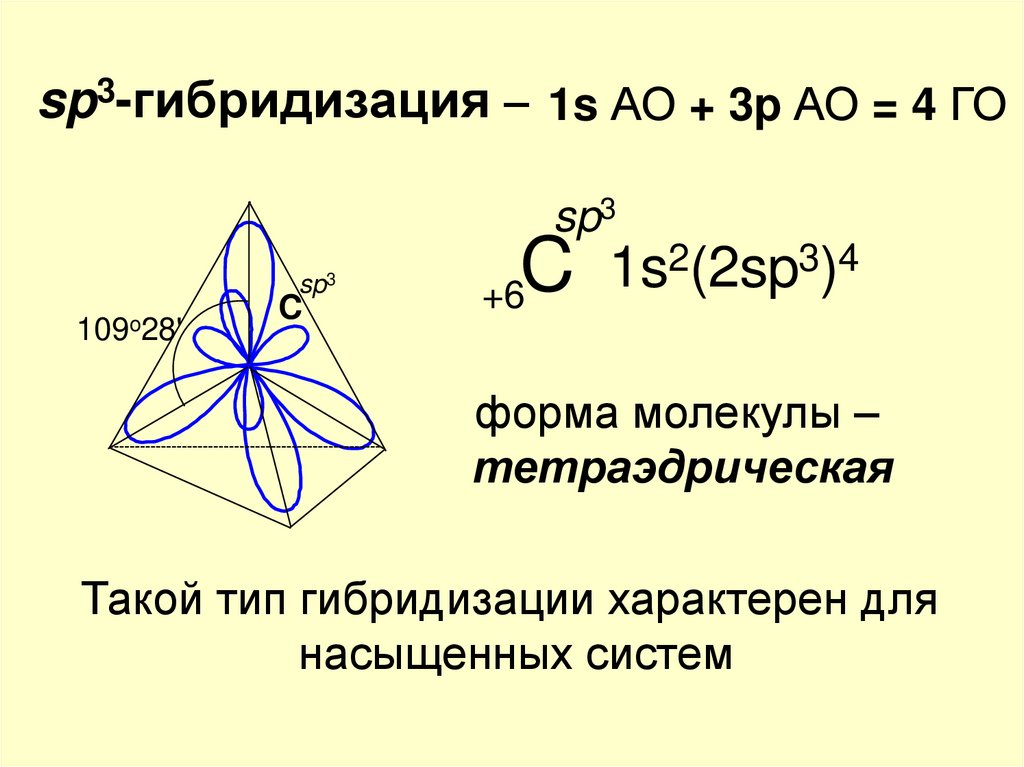
sp3-гибридизация – 1s АО + 3p АО = 4 ГОsp3
sp3
109o28'
C
2(2sp3)4
1s
+6C
форма молекулы –
тетраэдрическая
Такой тип гибридизации характерен для
насыщенных систем
6.
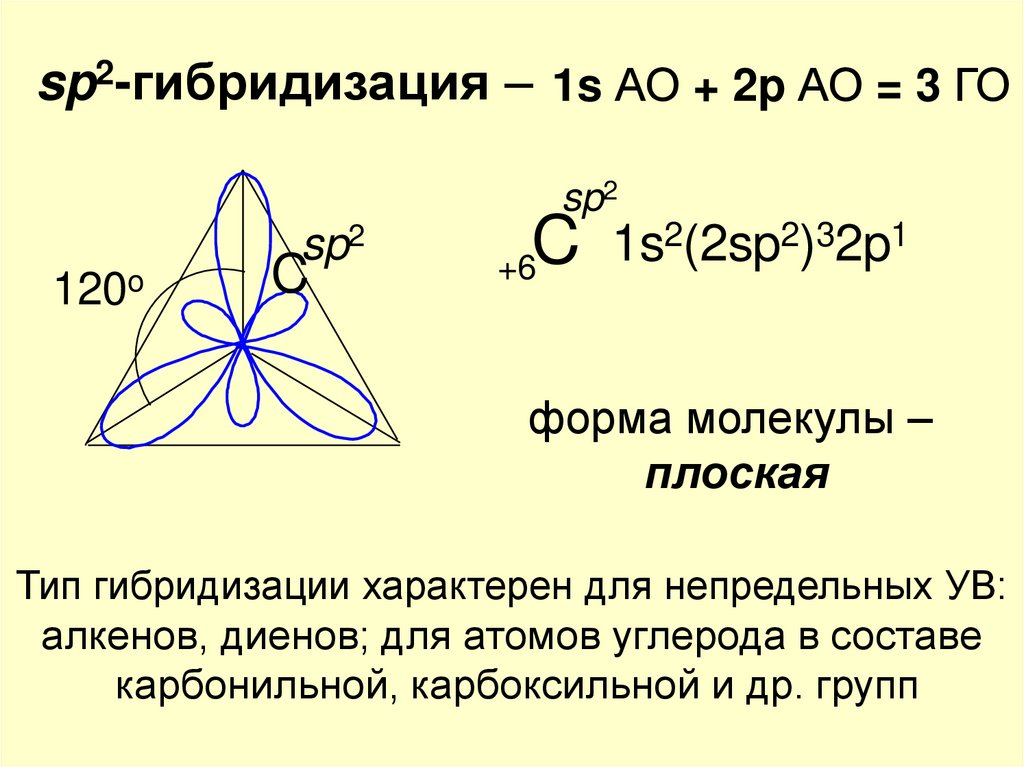
sp2-гибридизация – 1s АО + 2p АО = 3 ГОsp2
sp2
120o
C
2(2sp2)32p1
1s
C
+6
форма молекулы –
плоская
Тип гибридизации характерен для непредельных УВ:
алкенов, диенов; для атомов углерода в составе
карбонильной, карбоксильной и др. групп
7.
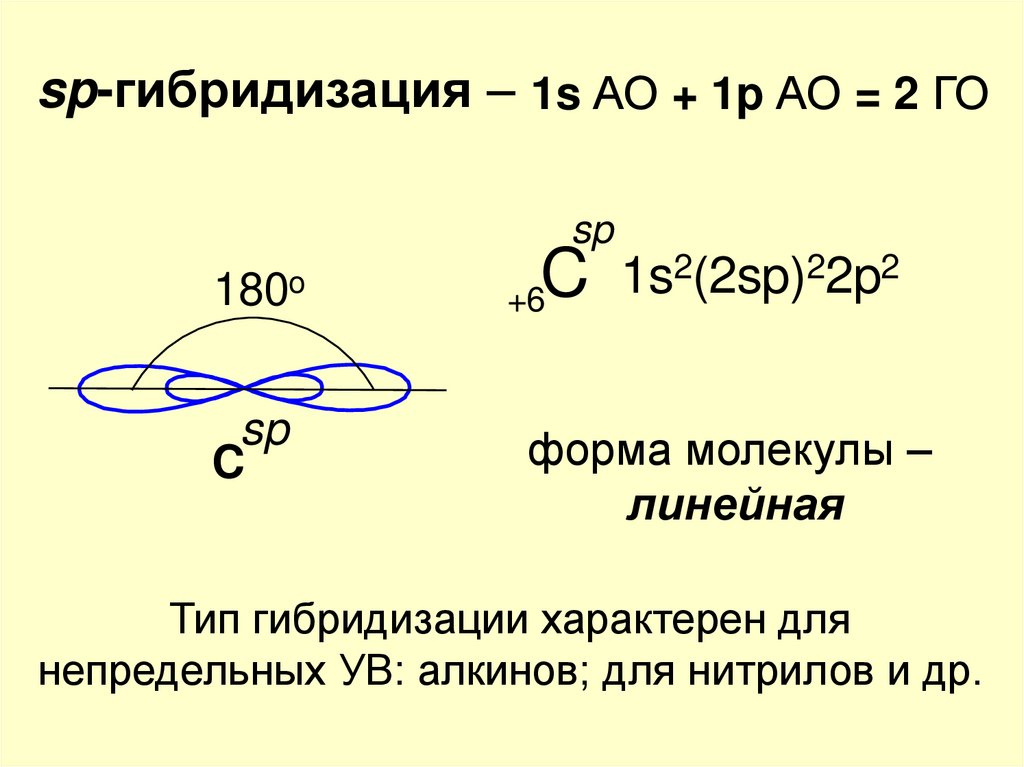
sp-гибридизация – 1s АО + 1p АО = 2 ГОsp
180o
sp
C
2(2sp)22p2
1s
C
+6
форма молекулы –
линейная
Тип гибридизации характерен для
непредельных УВ: алкинов; для нитрилов и др.
8.
Сопряжение и ароматичностьКовалентная связь
локализованная
делокализованная
электроны поделены
между ядрами двух
связываемых атомов
электроны поделены
между ядрами более
двух атомов
Делокализованные связи характерны для сопряженных
систем, т.е. систем, содержащих чередующиеся кратные
связи (π-π-сопряжение), а также чередующиеся кратные
связи и гетероатом, содержащий НЭП на р-АО
(р-π-сопряжение).
9.
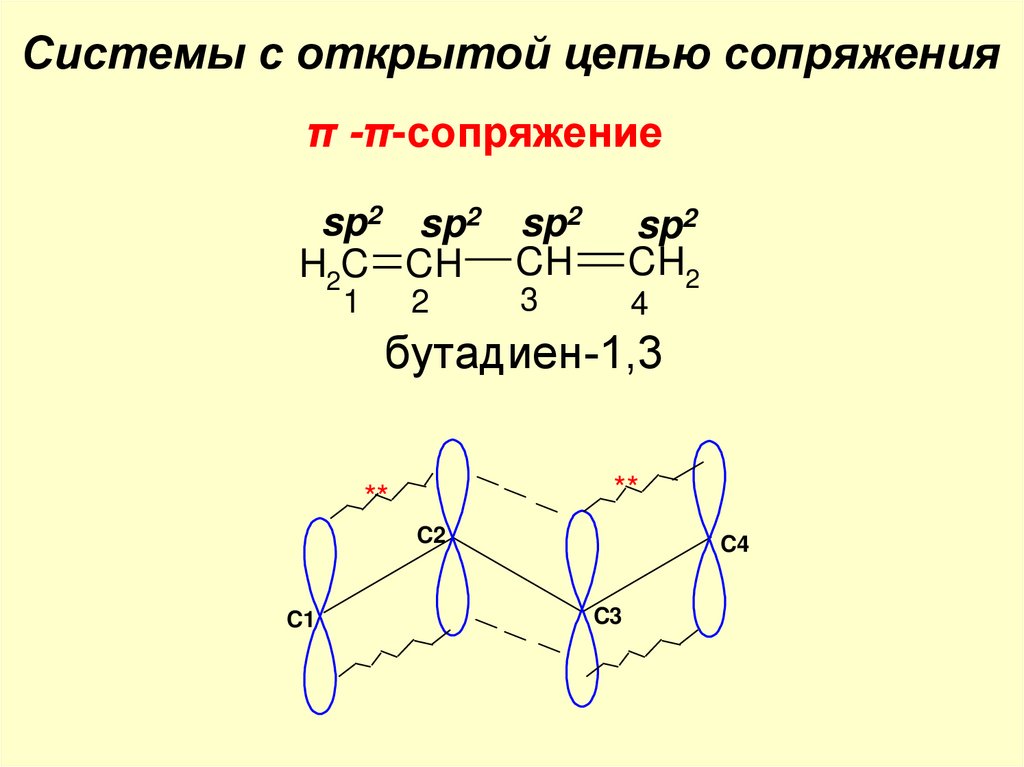
Системы с открытой цепью сопряженияπ -π-сопряжение
sp2 sp2 sp2
H2C CH CH
1
2
sp2
CH2
3
4
бутадиен-1,3
**
**
C2
C1
C4
C3
10.
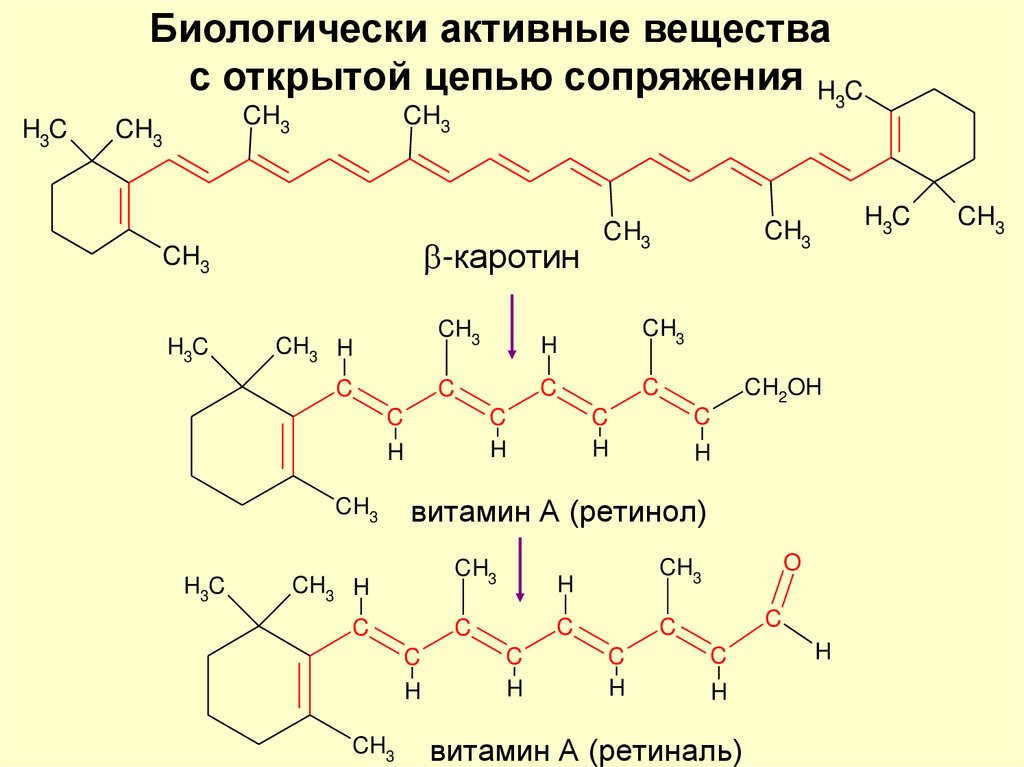
Биологически активные веществас открытой цепью сопряжения H3C
H3C
CH3
CH3
CH3
-каротин
CH3
H3C
CH3 H
C
CH3
H
CH3
C
C
C
CH3
H3C
H
витамин А (ретинол)
CH3 H
C
C
H
CH3
CH2OH
C
C
H
C
H
C
H
H3C
CH3
CH3
CH3
H
CH3
C
C
C
C
H
C
H
O
C
C
H
витамин А (ретиналь)
H
CH3
11.
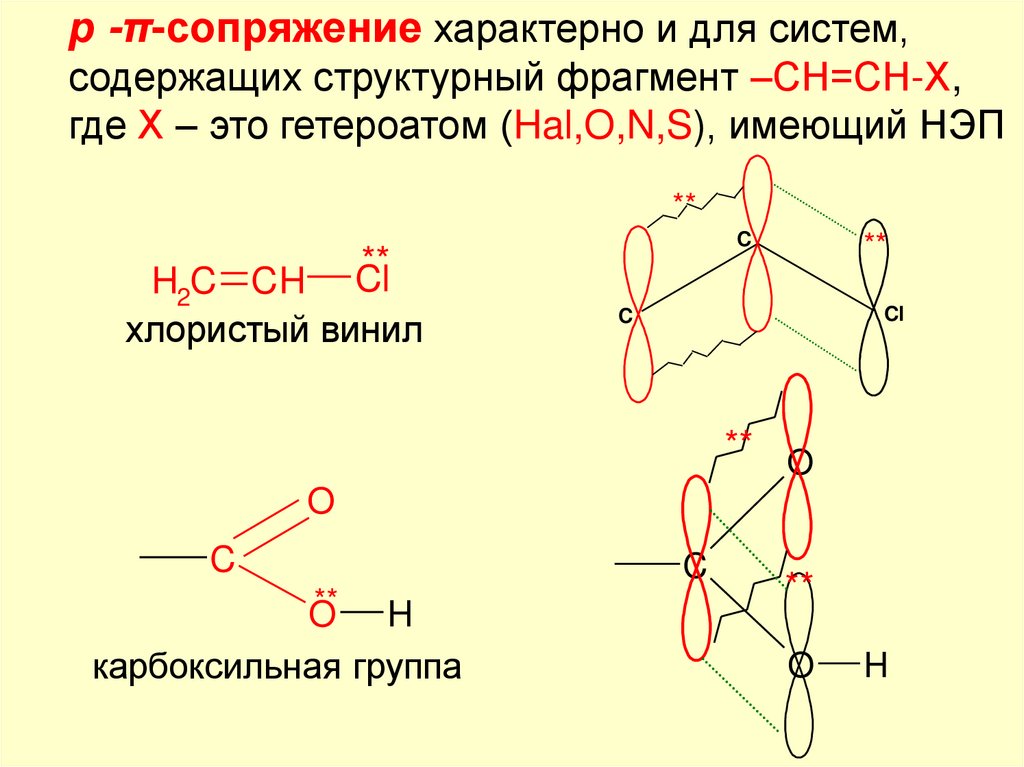
р -π-сопряжение характерно и для систем,содержащих структурный фрагмент –СН=СН-Х,
где Х – это гетероатом (Hal,O,N,S), имеющий НЭП
**
**
H2C CH Cl
хлористый винил
C
**
Cl
C
** O
O
C
C
**
O H
карбоксильная группа
**
O
H
12.
Сопряжение – это образование в молекуле единогоделокализованного электронного облака в
результате перекрывания негибридных p-АО.
Это приводит:
-к выравниванию длин связей (одинарные –
укорачиваются, кратные – удлиняются);
-к энергетической стабилизации сопряженных
систем. Чем больше цепь сопряжения, тем
более термодинамически устойчивым
будет соединение.
Выигрыш в энергии, получаемый в результате
сопряжения, называется энергией сопряжения
(энергией делокализации).
13.
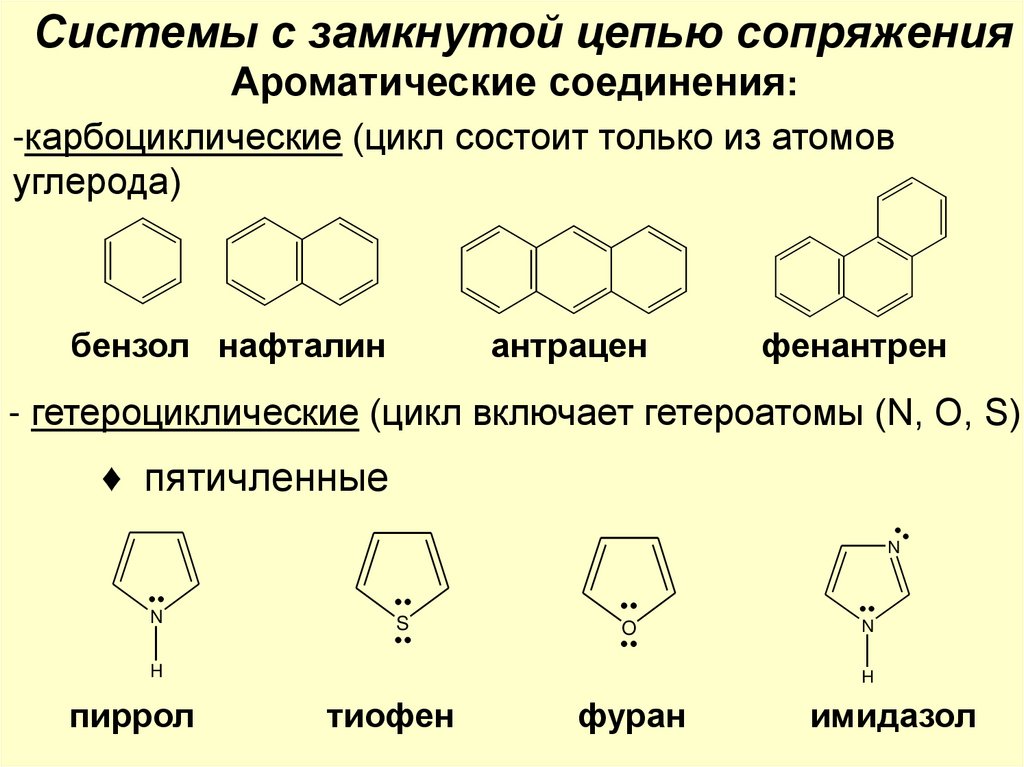
Системы с замкнутой цепью сопряженияАроматические соединения:
-карбоциклические (цикл состоит только из атомов
углерода)
бензол нафталин
антрацен
фенантрен
- гетероциклические (цикл включает гетероатомы (N, O, S)
♦ пятичленные
N
N
S
O
H
пиррол
N
H
тиофен
фуран
имидазол
14.
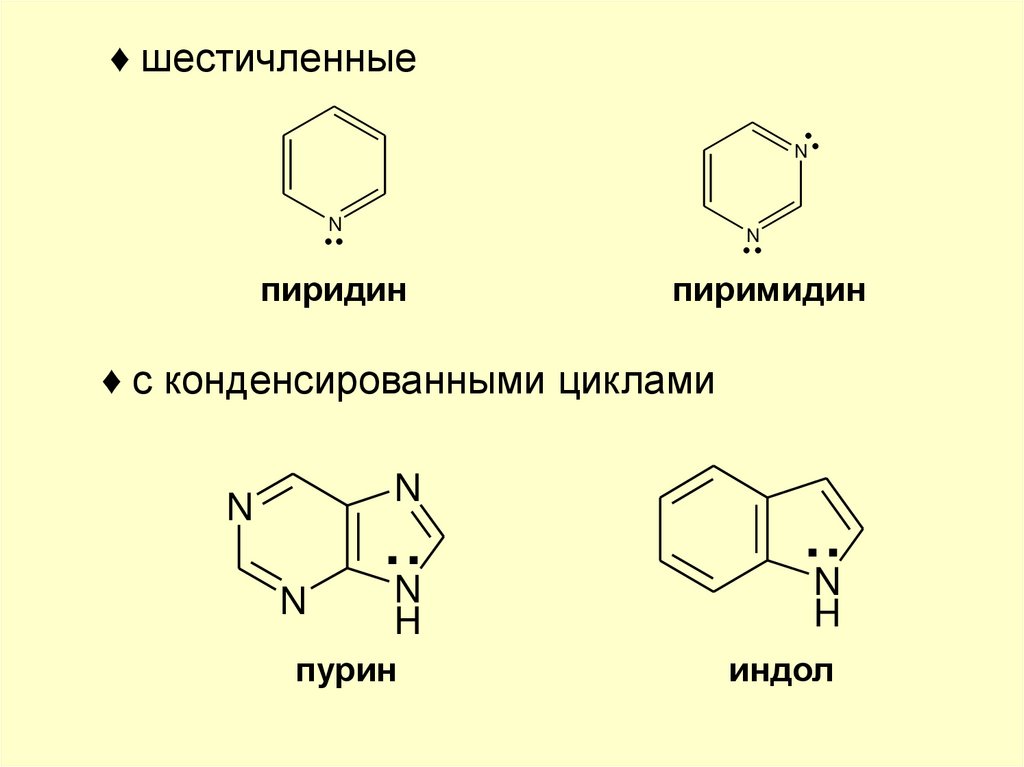
♦ шестичленныеN
N
N
пиридин
пиримидин
♦ с конденсированными циклами
N
N
..
N
N
H
пурин
..N
H
индол
15.
Ароматические соединения – это циклическиесопряженные системы, обладающие общими
признаками в строении (критерии ароматичности)
и свойствах.
Критерии ароматичности
1. Плоский цикл
2. Наличие замкнутой сопряженной системы,
состоящей из делокализованных р-электронов
3. Число таких электронов должно быть равно
4n+2, где n=0,1,2,3… (натуральное число) –
правило Хюккеля
16.
Общие свойства ароматических веществ-повышенная термодинамическая стабильность
по сравнению с сопряженными системами с
отрытой цепью;
-устойчивость к действию окислителей
и температуры;
-склонность к реакциям замещения,
а не присоединения.
17.
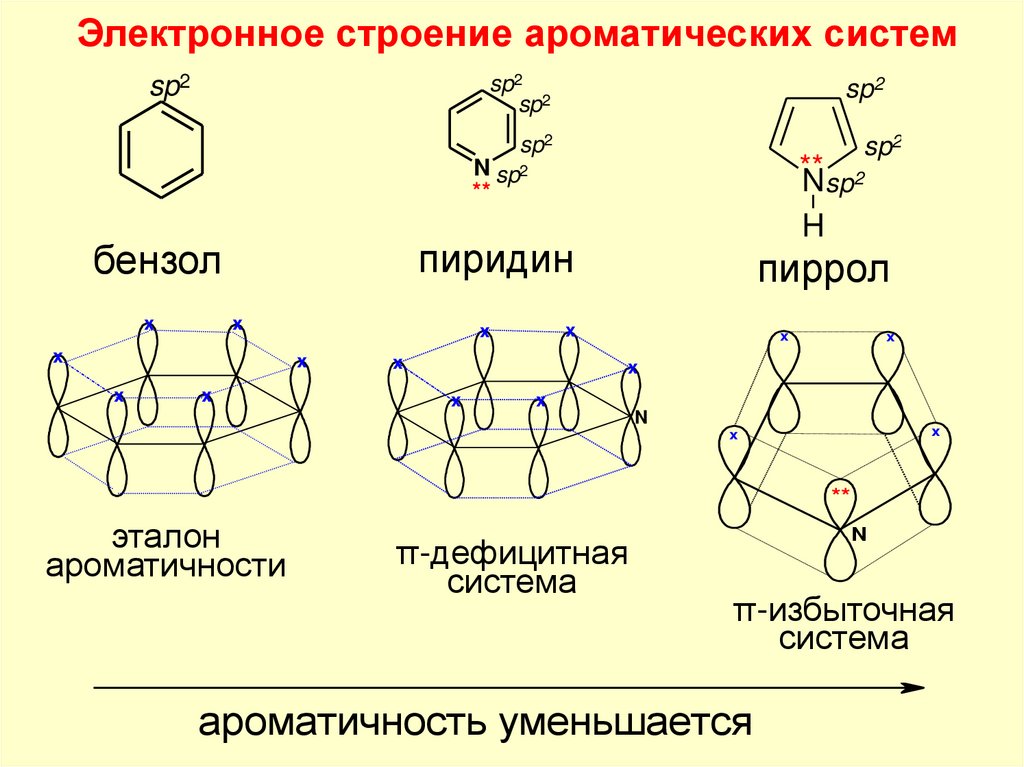
Электронное строение ароматических системsp2
sp2
sp2
sp2
sp2
sp2
N sp2
**
пиридин
бензол
x
x
x
x
пиррол
x
x
x
x
**
Nsp2
H
x
x
x
x
x
x
N
x
x
**
эталон
ароматичности
π-дефицитная
система
N
π-избыточная
система
ароматичность уменьшается
18.
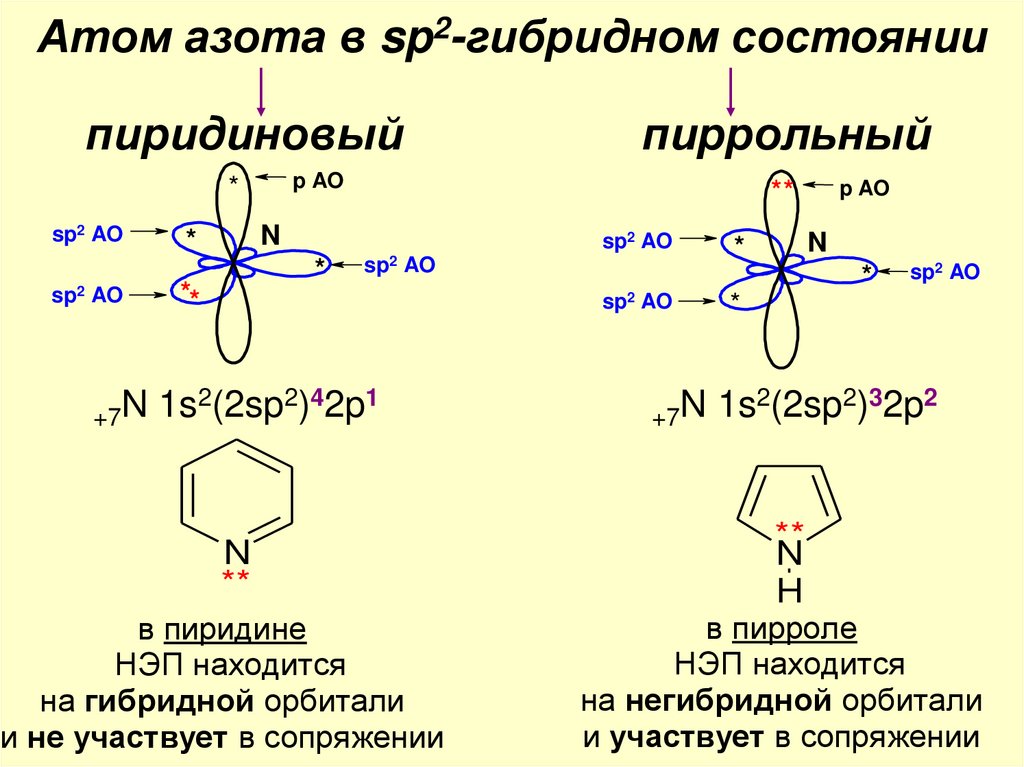
Атом азота в sp2-гибридном состояниипиридиновый
p AO
*
sp2 AO
sp2 AO
**
N
*
sp2 AO
*
**
пиррольный
sp2 AO
p AO
N
*
*
sp2 AO
sp2 AO
*
2
2 4
1
+7N 1s (2sp ) 2p
2
2 3
2
+7N 1s (2sp ) 2p
N
**
**
N
H
в пиридине
НЭП находится
на гибридной орбитали
и не участвует в сопряжении
в пирроле
НЭП находится
на негибридной орбитали
и участвует в сопряжении
19.
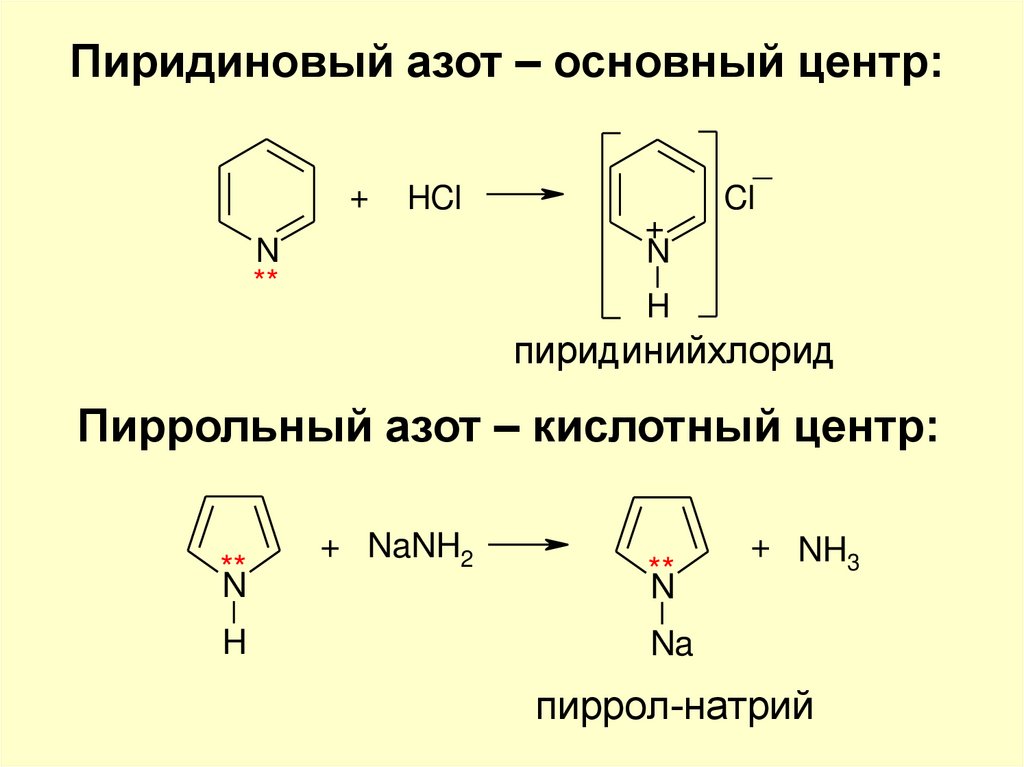
Пиридиновый азот – основный центр:+
HCl
N
**
+
N
_
Cl
H
пиридинийхлорид
Пиррольный азот – кислотный центр:
**
N
H
+ NaNH2
**
N
+ NH3
Na
пиррол-натрий
20.
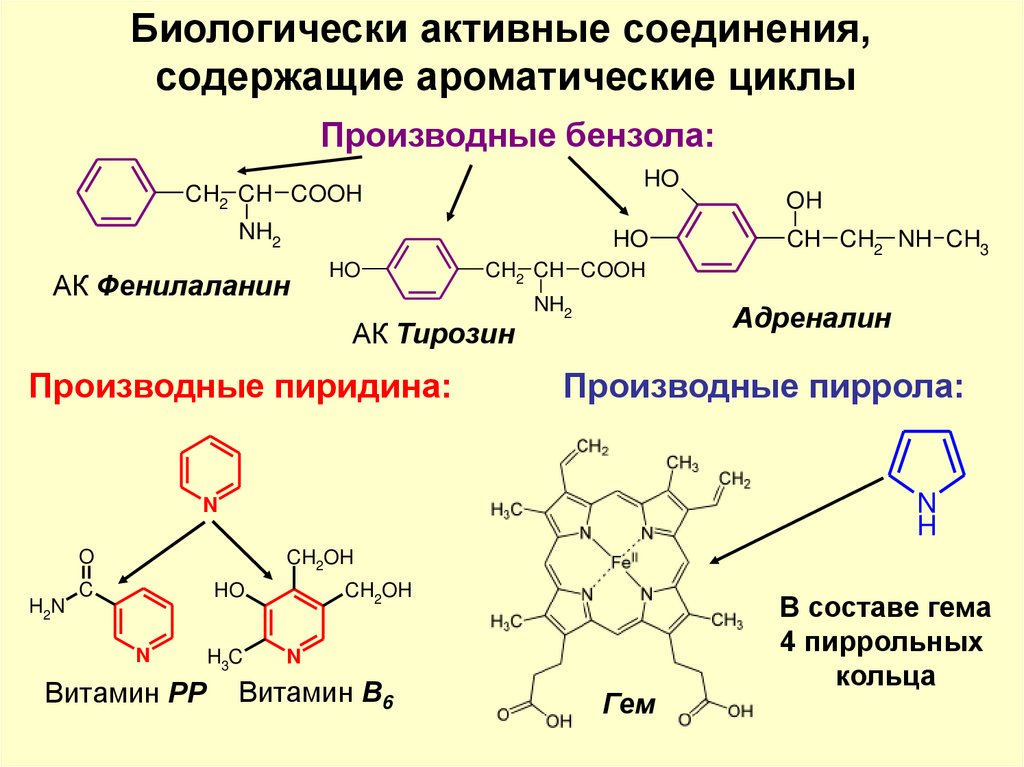
Биологически активные соединения,содержащие ароматические циклы
Производные бензола:
HO
CH2 CH COOH
OH
NH2
HO
АК Фенилаланин
HO
CH2 CH COOH
АК Тирозин
Производные пиридина:
NH2
Адреналин
Производные пиррола:
N
H
N
O
H2N
CH CH2 NH CH3
CH2OH
C
CH2OH
HO
N
Витамин РР
H3C
N
Витамин В6
Гем
В составе гема
4 пиррольных
кольца
21.
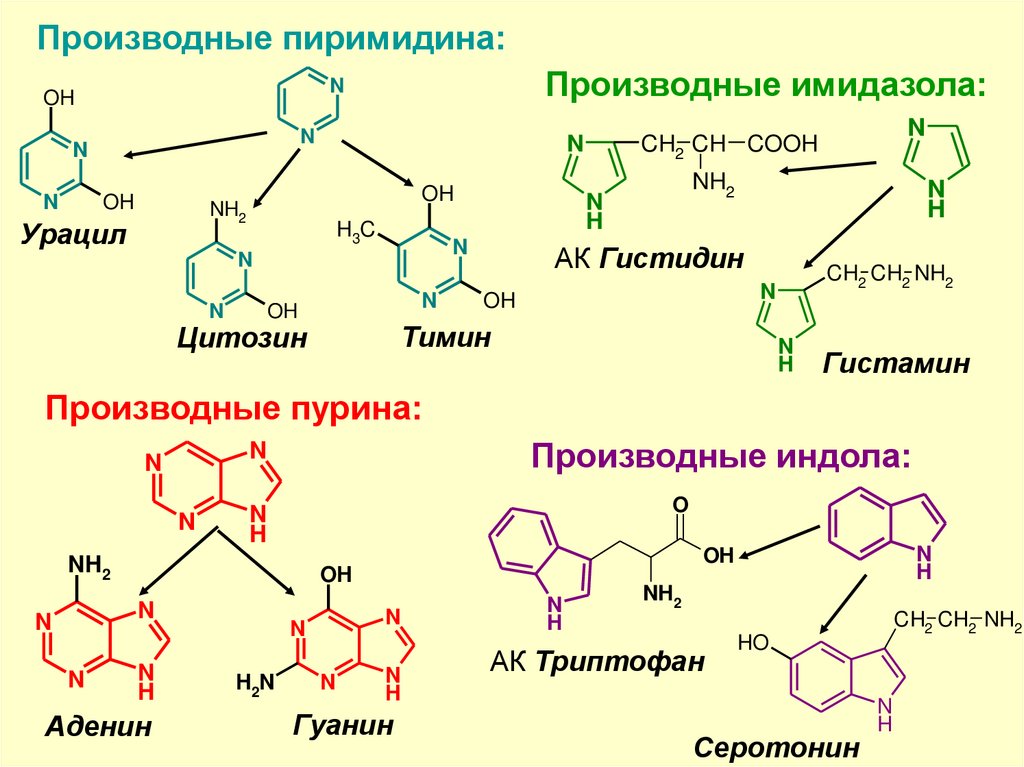
Производные пиримидина:N
N
N
Производные имидазола:
N
OH
OH
N
OH
NH2
Урацил
H3C
N
N
OH
NH2
N
H
N
N
N
H
АК Гистидин
CH2 CH2 NH2
N
OH
Тимин
Цитозин
N
CH2 CH COOH
N
H
Гистамин
Производные пурина:
Производные индола:
N
N
N
O
N
H
NH2
OH
N
N
N
N
H
Аденин
N
N
H2N
N
N
H
OH
N
H
Гуанин
N
H
NH2
АК Триптофан
CH2 CH2 NH2
HO
Серотонин
N
H
22.
Электронные эффекты23.
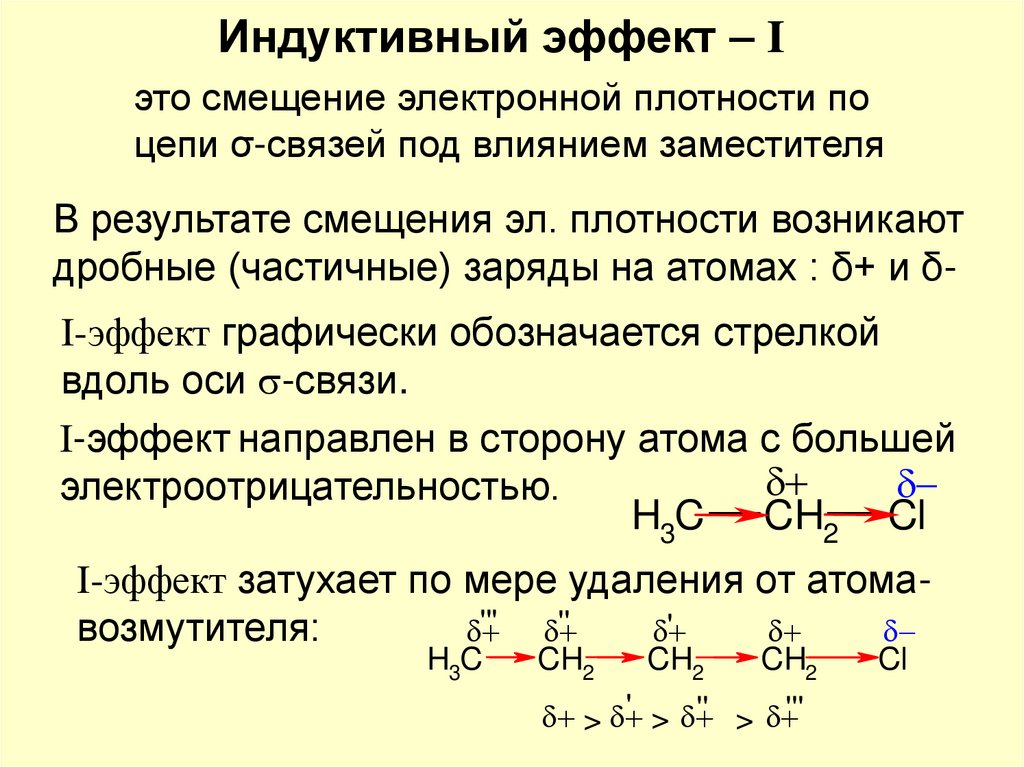
Индуктивный эффект – Iэто смещение электронной плотности по
цепи σ-связей под влиянием заместителя
В результате смещения эл. плотности возникают
дробные (частичные) заряды на атомах : δ+ и δI-эффект графически обозначается стрелкой
вдоль оси -связи.
I-эффект направлен в сторону атома с большей
электроотрицательностью.
H3C CH2 Cl
I-эффект затухает по мере удаления от атома'''
''
'
возмутителя:
H3C
CH2
CH2
CH2
' >
'' > '''
>
Cl
24.
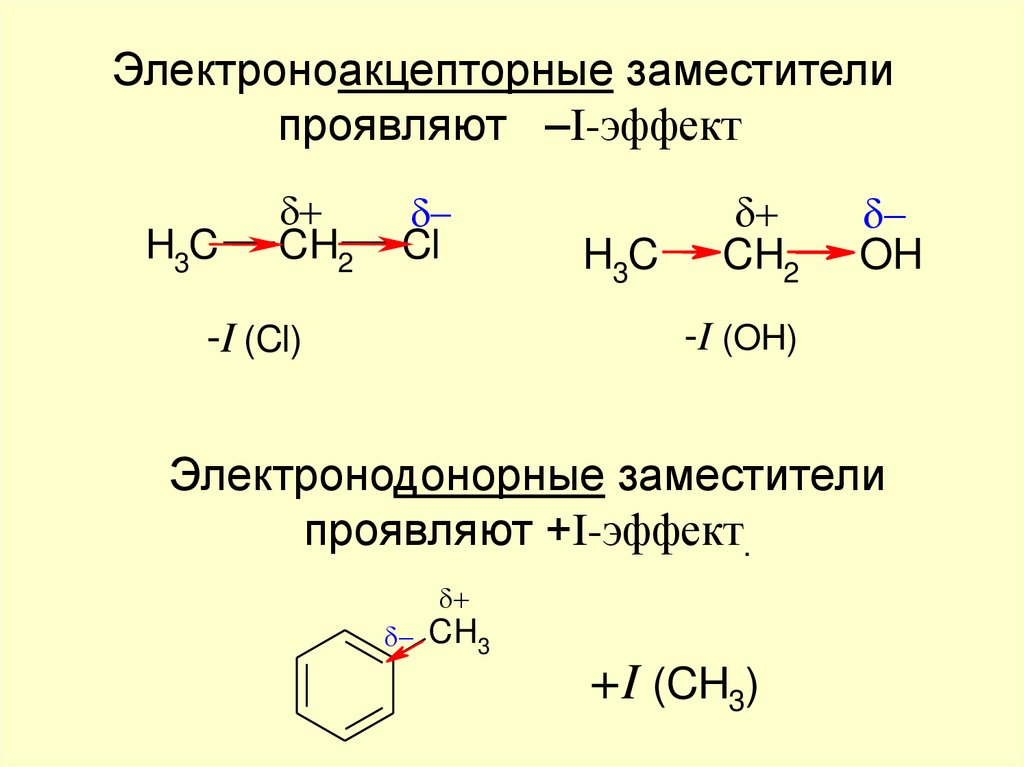
Электроноакцепторные заместителипроявляют –I-эффект
H3C
CH2
Cl
H3C
CH2
OH
-I (OH)
-I (Cl)
Электронодонорные заместители
проявляют +I-эффект.
CH3
+I (CH3)
25.
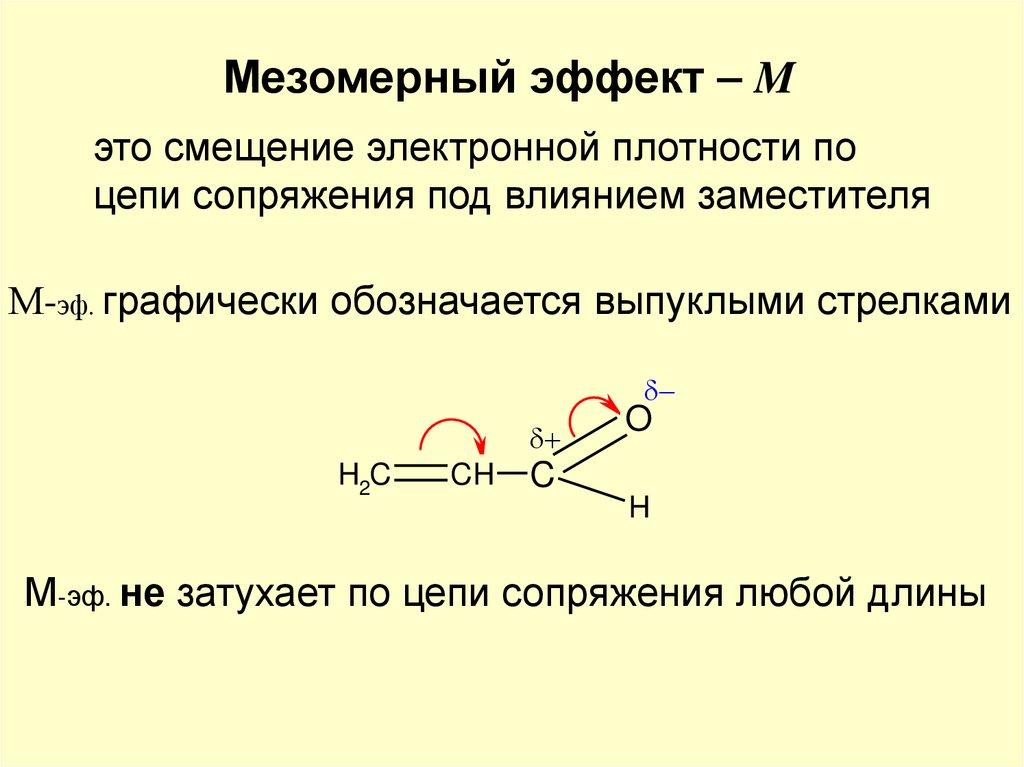
Мезомерный эффект – Mэто смещение электронной плотности по
цепи сопряжения под влиянием заместителя
М-эф. графически обозначается выпуклыми стрелками
H2C
CH
O
C
H
М-эф. не затухает по цепи сопряжения любой длины
26.
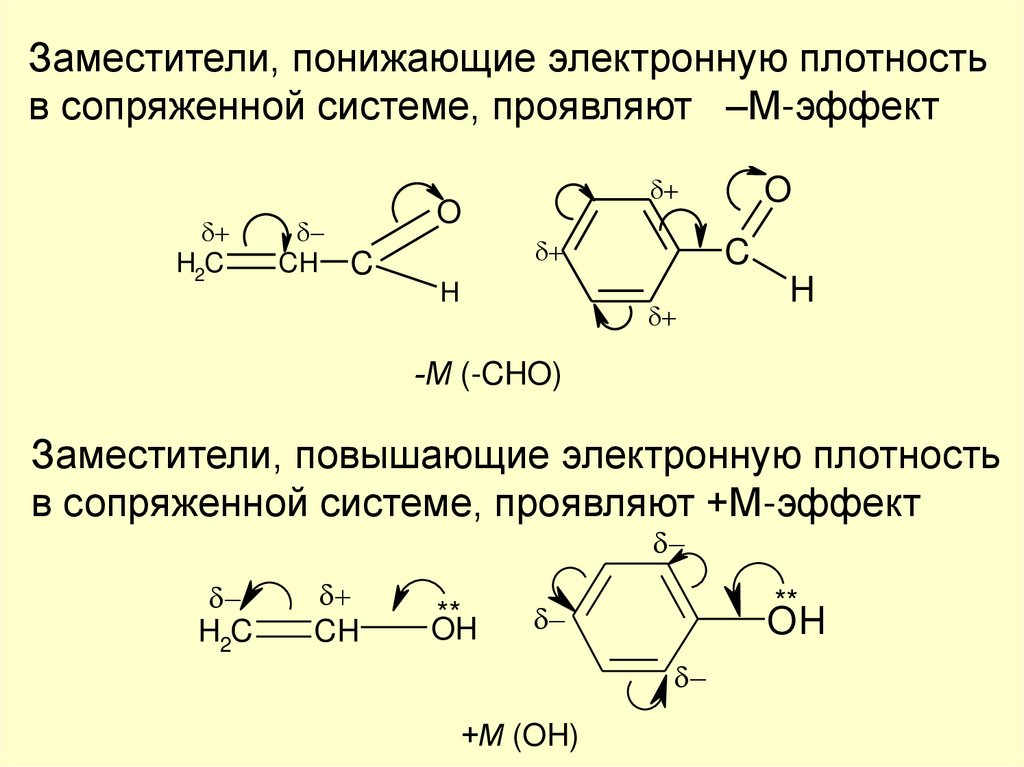
Заместители, понижающие электронную плотностьв сопряженной системе, проявляют –М-эффект
H2C
CH C
O
H
O
C
H
-М (-CHO)
Заместители, повышающие электронную плотность
в сопряженной системе, проявляют +М-эффект
H2C
CH
**
OH
**
OH
+М (OH)
27.
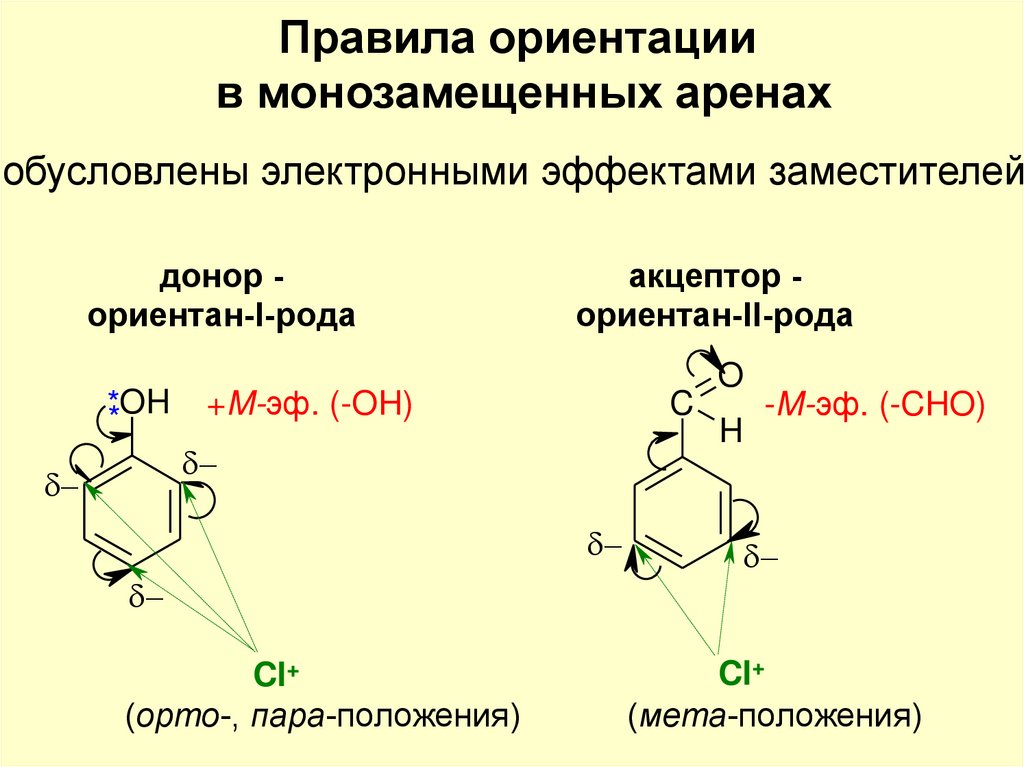
Правила ориентациив монозамещенных аренах
обусловлены электронными эффектами заместителей
донор ориентан-I-рода
**OH
акцептор ориентан-II-рода
+M-эф. (-OH)
C
Cl+
(орто-, пара-положения)
O
H
-M-эф. (-CHO)
Cl+
(мета-положения)
28.
КИСЛОТНЫЕ И ОСНÓВНЫЕСВОЙСТВА
ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
29.
В соответствии с протолитической теориейБренстеда-Лоури
кислотами могут быть нейтральные молекулы
и катионы;
органические основания должны иметь
либо атом с НЭП (нейтральные молекулы),
либо быть анионами.
30.
Количественная оценка кислотно-основных свойствКа - константа кислотности
чем больше Ка, тем сильнее кислота
Ka (CH3COOH) = 1,75·10-5
pКа - показатель кислотности
pKa = -lgKa
чем меньше pКа, тем сильнее кислота
31.
pKb - показатель основностиpKb = 14 - pKa
чем меньше pКb, тем сильнее основание
32.
Качественная оценка кислотно-основных свойствКИСЛОТЫ БРЕНСТЕДА
Факторы, влияющие на силу кислот:
1. природа атома в кислотном центре
Элемент и связанный с ним атом водорода
называют кислотным центром.
Различают CH-, NH-, OH-, SH-кислоты
кислотность возрастает
33.
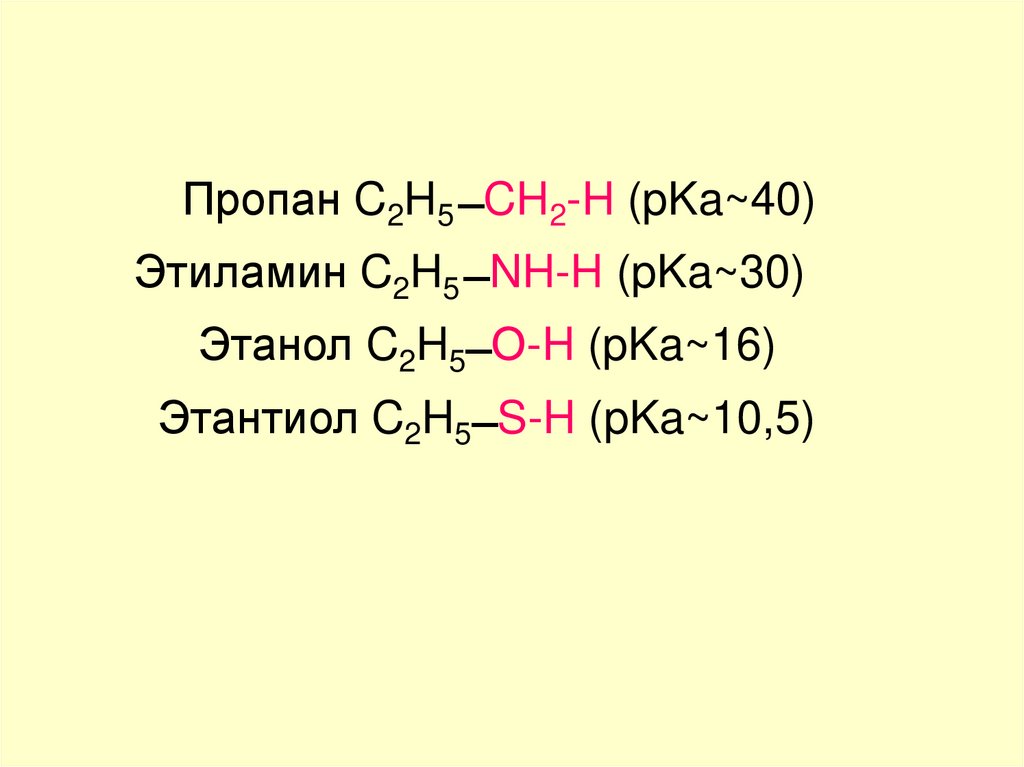
Пропан C2H5 ̶ CH2-H (pKa~40)Этиламин C2H5 ̶ NH-H (pKa~30)
Этанол C2H5 ̶ О-H (pKa~16)
Этантиол C2H5 ̶ S-H (pKa~10,5)
34.
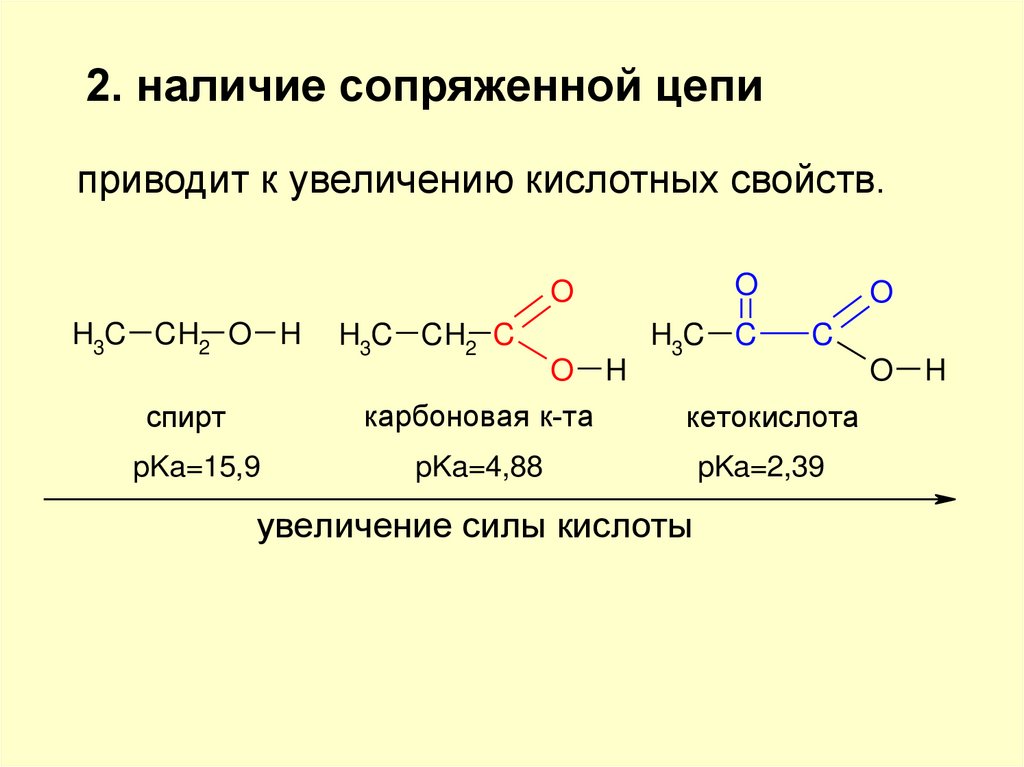
2. наличие сопряженной цепиприводит к увеличению кислотных свойств.
O
O
H3C CH2 O H
H3C CH2 C
O
H
H3C C
O
C
спирт
карбоновая к-та
кетокислота
pKa=15,9
pKa=4,88
pKa=2,39
увеличение силы кислоты
O
H
35.
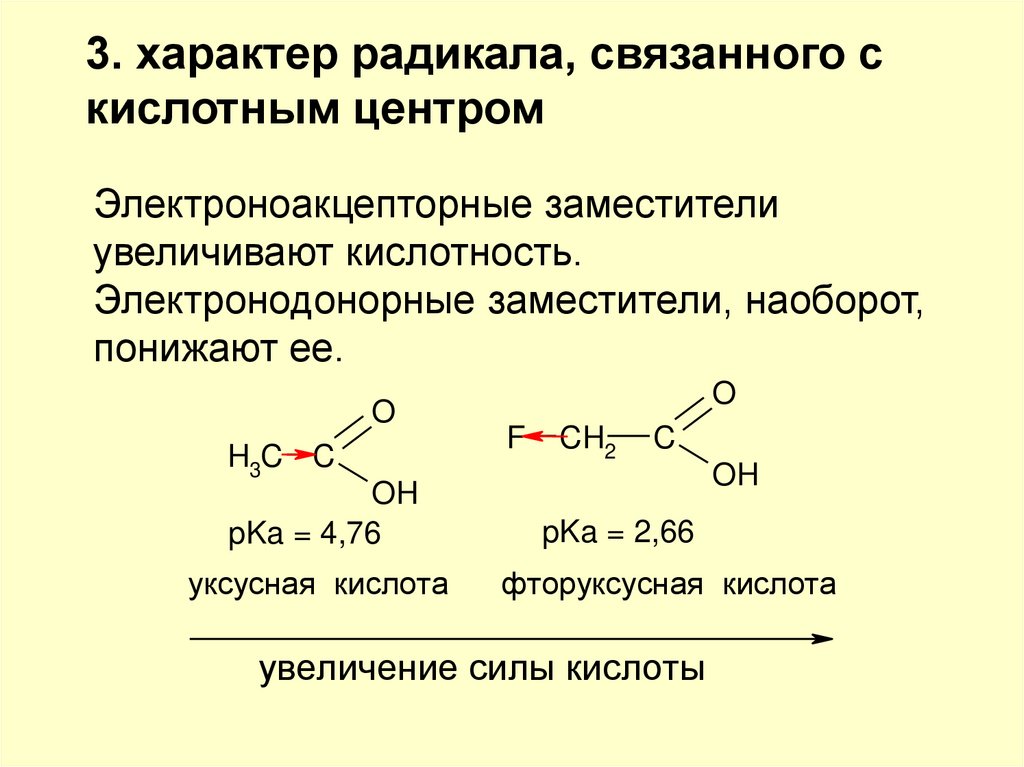
3. характер радикала, связанного скислотным центром
Электроноакцепторные заместители
увеличивают кислотность.
Электронодонорные заместители, наоборот,
понижают ее.
O
H3C C
OH
pKa = 4,76
уксусная кислота
O
F
CH2
C
OH
pKa = 2,66
фторуксусная кислота
увеличение силы кислоты
36.
ОСНОВАНИЯ БРЕНСТЕДАДля качественной оценки оснóвности используют
те же факторы, что и для оценки кислотности.
Но ВЛИЯНИЕ этих факторов на силу оснований
ПРОТИВОПОЛОЖНО.
















 Химия
Химия








