Похожие презентации:
tipy_khr_2_1
1. Классификация химических реакций в неорганической химии
2. Химические реакции -
Химические реакции это химические процессы, в результате которых изодних веществ образуются другие, отличающиеся от
них по составу и (или) строению.
При химических реакциях обязательно
происходит изменение веществ, при котором
рвутся старые и образуются новые связи между
атомами
Реагенты
Продукты
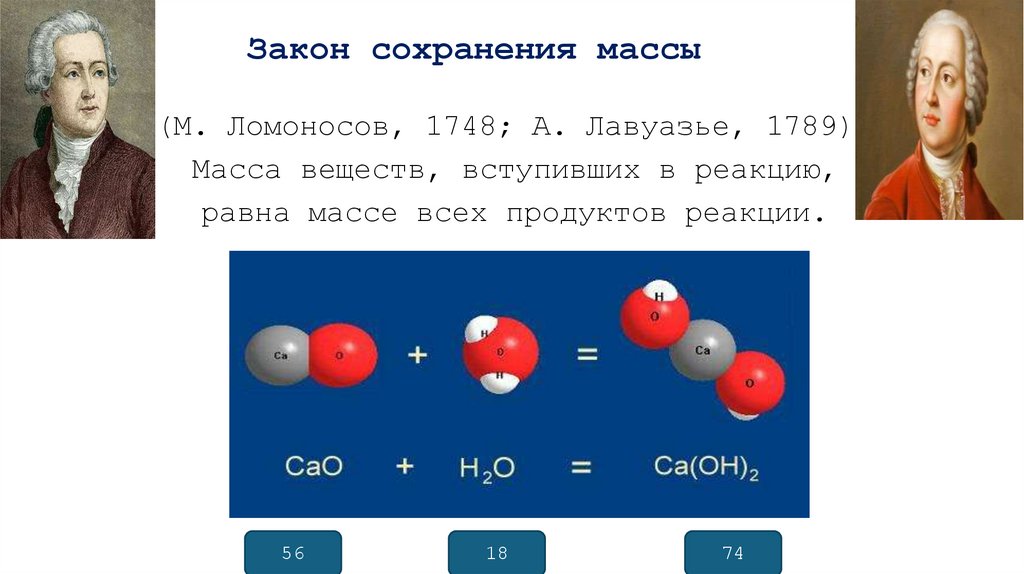
3. Закон сохранения массы
(М. Ломоносов, 1748; А. Лавуазье, 1789)Масса веществ, вступивших в реакцию,
равна массе всех продуктов реакции.
56
18
74
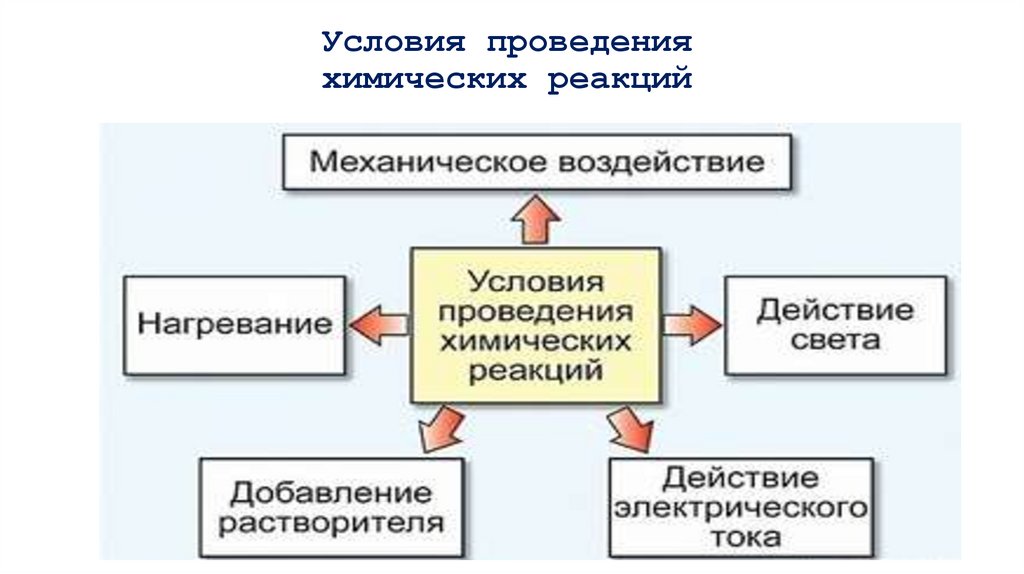
4. Условия проведения химических реакций
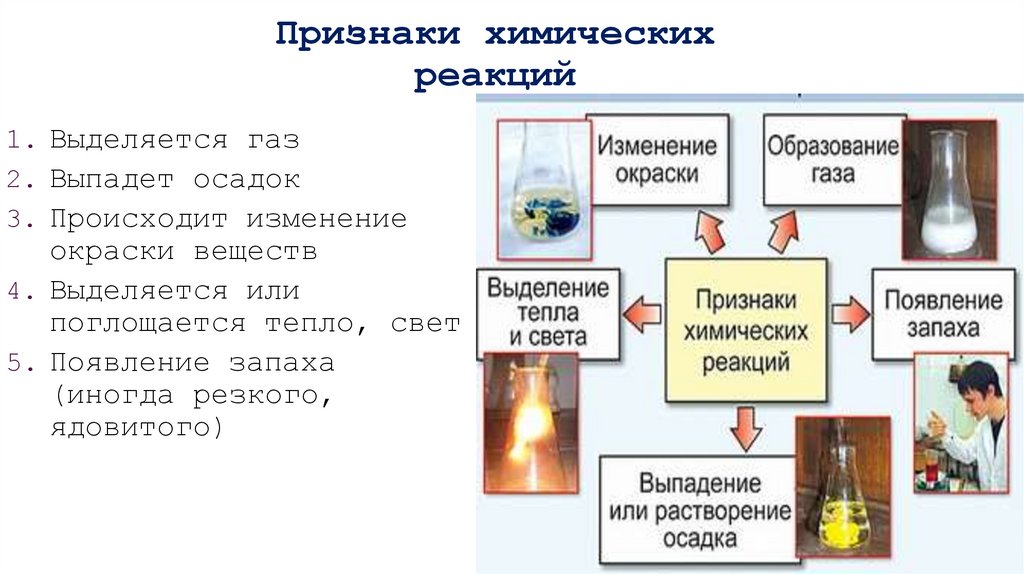
5. Признаки химических реакций
1. Выделяется газ2. Выпадет осадок
3. Происходит изменение
окраски веществ
4. Выделяется или
поглощается тепло, свет
5. Появление запаха
(иногда резкого,
ядовитого)
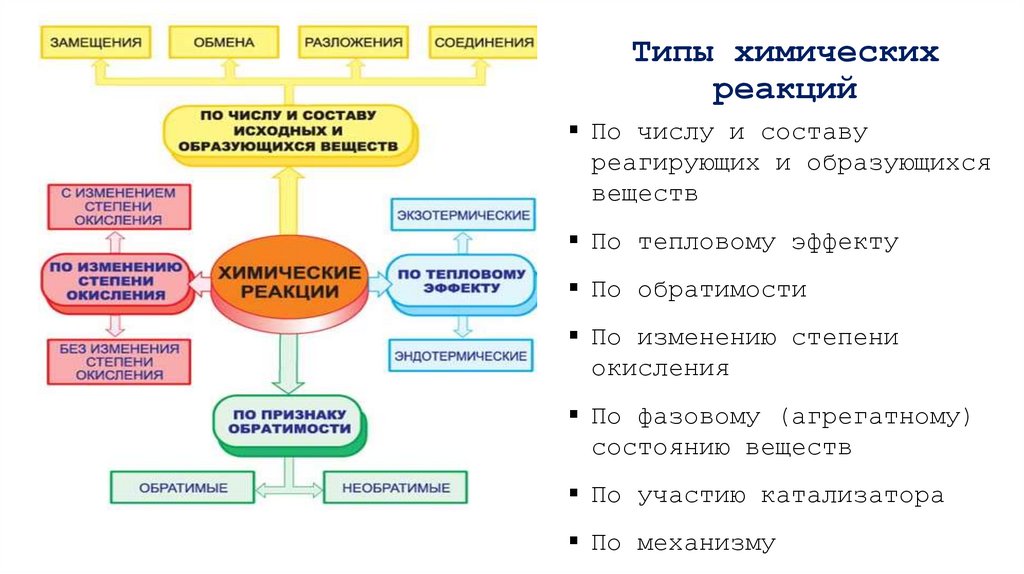
6. Типы химических реакций
По числу и составуреагирующих и образующихся
веществ
По тепловому эффекту
По обратимости
По изменению степени
окисления
По фазовому (агрегатному)
состоянию веществ
По участию катализатора
По механизму
7. 1. По составу реагирующих веществ:
Реакции, идущие без изменения состава веществВ неорганической химии к таким реакциям можно
отнести процессы получения аллотропных модификаций одного
химического элемента, например:
С (графит) <=> С (алмаз)
3О2 (кислород) <=> 2О3 (озон)
Sn (белое олово) <=> Sn (серое олово)
S (ромбическая) <=> S (пластическая)
Р (красный) <=> Р (белый)
Реакции, идущие с изменением состава вещества
Реакции разложения
Реакции соединения
Реакции замещения
Реакции обмена
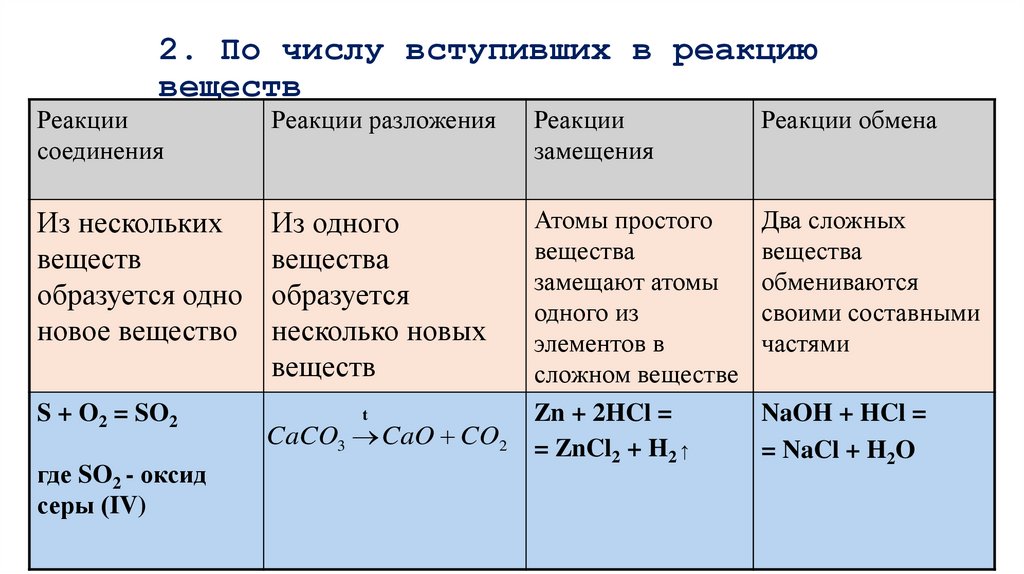
8. 2. По числу вступивших в реакцию веществ
Реакциисоединения
Реакции разложения
Реакции
замещения
Реакции обмена
Из нескольких
веществ
образуется одно
новое вещество
Из одного
вещества
образуется
несколько новых
веществ
Атомы простого
вещества
замещают атомы
одного из
элементов в
сложном веществе
Zn + 2HCl =
= ZnCl2 + H2↑
Два сложных
вещества
обмениваются
своими составными
частями
S + O2 = SO2
где SO2 - оксид
серы (IV)
t
CaCO3 CaO CO2
NaOH + HCl =
= NaCl + H2O
9. Реакции соединения -
Реакции соединения -это реакции, в результате которых из двух илинескольких простых или сложных веществ образуется
одно более сложное.
С + О2 →CO2
2Сu + O2 →2CuO
Na2O + CO2 → Na2CO3
https://yandex.ru/video/preview/72473608010
10. Реакции разложения -
Реакции разложения -это реакции, в результате которых из одного веществаполучается несколько новых веществ.
2HgO → 2Hg + O2
CaCO3 →CaO + CO2
2KMnO4 →K2MnO4+ MnO2 + O2
https://yandex.ru/video/preview/51826699440
11.
https://yandex.ru/video/preview/5182669944018573890
12. Реакции замещения -
Реакции замещения -это реакции между простым и сложным веществом, врезультате которых атомы простого вещества замещают
атомы одного из химических элементов в сложном
веществе.
Zn +2HCl → ZnCl2 +H2
CuSO4 + Fe →Cu + FeSO4
2Na + 2H2O →2NaOH + H2
13. Реакции обмена -
Реакции обмена -это реакции, между двумя сложными веществами, припротекании которых их молекулы обмениваются своими
составными частями.
CuSO4 + 2NaOH→Сu(OH)2↓+ Na2SO4
2HNO3 + Ba(OH)2→ Ba(NO3)2 + 2Н2О
NH4Cl + KOH → KCl + NH3↑+ H2O
https://yandex.ru/video/preview/13802766253439578771
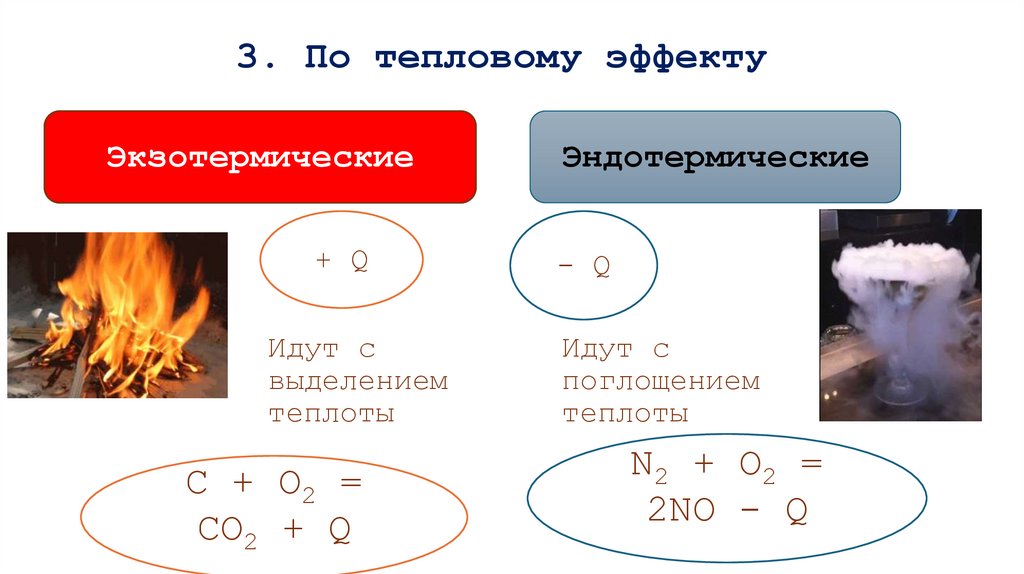
14. 3. По тепловому эффекту
Экзотермические+ Q
Идут с
выделением
теплоты
С + O2 =
СO2 + Q
Эндотермические
- Q
Идут с
поглощением
теплоты
N2 + O2 =
2NO - Q
15. По тепловому эффекту
Экзотермические реакцииЭкзотермические реакции – реакции, протекающие с выделением
энергии во внешнюю среду. К ним относятся почти все реакции
соединения. Экзотермические реакции, которые протекают с выделением
света, относят к реакциям горения, например:
4Р + 5О2
Q
= 2Р2О5 +
Эндотермические реакции
Эндотермические реакции – реакции, протекающие с поглощением
энергии. К ним относятся почти все реакции разложения,
например:
t
Обжиг известняка:
СаСО3 CaO + CO2 - Q
Уравнение химической реакции с указанием теплового эффекта
называют термохимическим уравнением, например:
H2(г)+ Cl2(г) = 2HCl(г) + 92.3 кДж
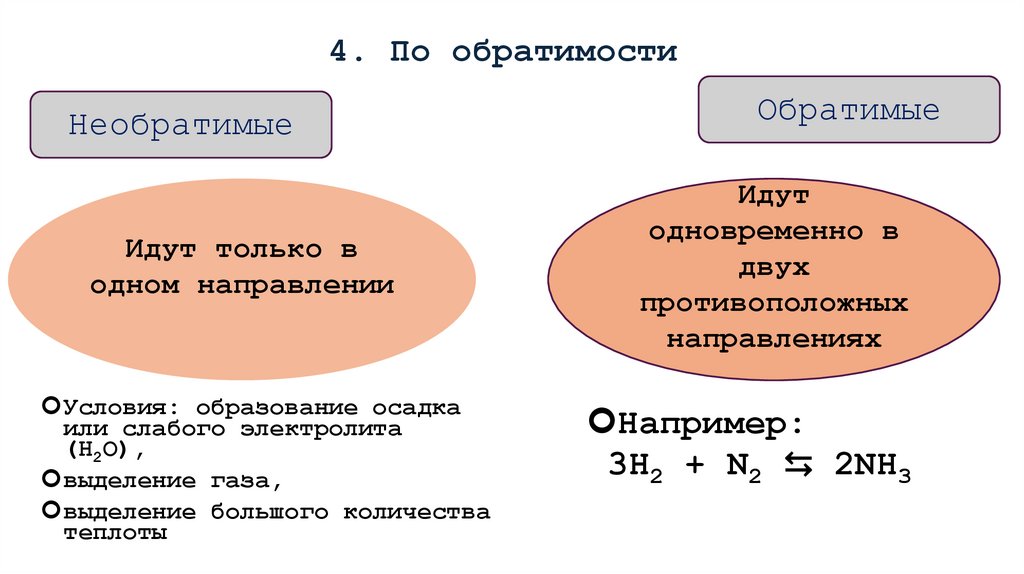
16. 4. По обратимости
НеобратимыеИдут только в
одном направлении
Условия: образование осадка
или слабого электролита
(Н2О),
выделение газа,
выделение большого количества
теплоты
Обратимые
Идут
одновременно в
двух
противоположных
направлениях
Например:
3H2 + N2 ⇆ 2NH3
17.
Необратимые реакции:Необратимые реакции протекают в данных условиях только в
одном направлении. К таким реакциям можно отнести все реакции
обмена,
сопровождающиеся
образованием
осадка,
газа
или
малодиссоциирующего вещества (воды) и все реакции горения.
H 2 SO4 BaCl 2 BaSO4 2HCl
Обратимые реакции
Обратимые реакции в данных условиях протекают одновременно
в двух противоположных направлениях. Таких реакций подавляющее
большинство. Например:
2SO2 + O2 <=> 2SO3
N2 +3H2
<=> 2NH3
18. 5. По изменению степени окисления
Окислительно –восстановительные
реакции
• Идут с изменением степени
окисления
2Na + Cl2 = 2NaCl
Без изменения
степени окисления
элементов
• CaCO3 = CaO + CO2
19.
Окислительно-восстановительные реакцииОВР– реакции, идущие с изменением степеней окисления элементов.
К ним относится множество реакций, в том числе все реакции
замещения, а также те реакции соединения и разложения, в которых
участвует хотя бы одно простое вещество:
0
0
+2
+1
-2
+2
а) Mg + H2SO4 = MgSO4 + H2
+2
0
0
б)
0
2Мg + O2 = 2MgO
+2
Mg – 2e¯ Mg – окисление
0
Mg – 2e¯ Mg
2
окисление
-2
+1
0
2Н + 2e¯ H2 – восстановление
0
O2 + 4e¯ 2O
восстановление
1
20. Не окислительно-восстановительные реакции
Неокислительно-восстановительные
реакции
–
реакции, идущие без изменения степеней окисления
элементов.
К ним относятся все реакции ионного обмена,
например:
Na2CO3 + 2HCl = 2NaCl + Н2СО3
многие реакции соединения :
Li2O + H2O = 2LiOH
а также многие реакции разложения:
t
2Fe(OH)3 Fe 2O3 + 3H2O
21. 6. По фазовому состоянию веществ
ГомогенныеГетерогенные
Между веществами нет
поверхности раздела фаз
Реакция идет на поверхности
раздела фаз (т-г, т-ж, ж-г, тт)
• H2(г) + Cl2(г) =
2HCl(г)
22. По фазовому состоянию реагирующих веществ
Гетерогенные реакции:Гетерогенные реакции – реакции, в которых реагирующие вещества
реакции находятся в разных агрегатных состояниях (в разных фазах):
и
продукты
FeO(т) + СО(г) Fe(т) + СО2(г) + Q
2Al(т) + 3СuСl2 (р-р) = 3Сu(т) + 2AlCl3(р-р)
CaC2(т) + 2H2O(ж) = C2H2 + Ca(OH)2(р-р)
Гомогенные реакции:
Гомогенные реакции – реакции, в которых реагирующие вещества и продукты
реакции находятся в одном агрегатном состоянии (в одной фазе):
2С2Н6(г) + 7О2(г) 4СО2(г) + 6Н2О(г)
2 SO2(г) + O2(г) = 2SO3(г) +Q
H2(г) + F2(г) = 2HF(г)
23. 7. По участию катализатора:
7.Катализаторы
По участию катализатора:
–
это
вещества,
участвующие
в
химической
реакции
изменяющие ее скорость или направление, но по окончании реакции остающиеся
неизменными качественно и количественно.
Некаталитические реакции:
Некаталитические реакции - реакции, идущие без участия катализатора:
t
2HgO 2Hg + O2
t
2Al + 6HCl 2AlCl3 + 3H2
Каталитические реакции:
Каталитические реакции – реакции, идущие с участием катализатора:
2KClO3
MnO2
=
2KCl + 3O2
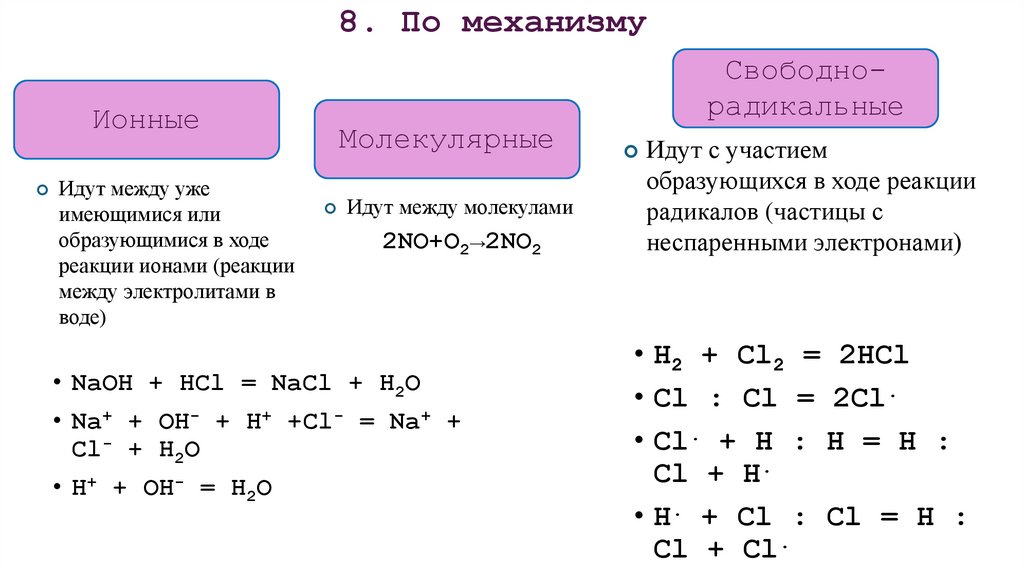
24. 8. По механизму
ИонныеИдут между уже
имеющимися или
образующимися в ходе
реакции ионами (реакции
между электролитами в
воде)
Свободнорадикальные
Молекулярные
Идут между молекулами
2NO+O2→2NO2
• NaOH + HCl = NaCl + H2O
• Na+ + OH- + H+ +Cl- = Na+ +
Cl- + H2O
• H+ + OH- = H2O
Идут с участием
образующихся в ходе реакции
радикалов (частицы с
неспаренными электронами)
• H2 + Cl2 = 2HCl
• Cl : Cl = 2Cl.
• Cl. + H : H = H :
Cl + H.
• H. + Cl : Cl = H :
Cl + Cl.
25. Закрепление
1. Расставьте коэффициенты в следующихуравнениях реакций. Определите типы реакций:
1. СаСО3 → СаО + CO2
2. Na2SO4 + ВаСl2 → NaСl + ВаSO4
3. SO3 + H2O → H2SO4
4. Cu +HNO3(конц) →Cu(NO3)2 + NO2↑+ H2O
5. Fe(OH)3 → Fe2O3 + H2O
6. Аl2(SO4)3 + NaOH → Na2SO4 + Аl(OH)3↓
26. Закрепление.
2. Напишите уравнения реакций по названиям исходныхвеществ и продуктов реакций. Определите типы реакций.
• Сульфат магния + гидроксид натрия →
гидроксид магния + сульфат натрия.
• Хлорид калия + нитрат серебра →
нитрат калия + хлорид серебра.
• Железо + соляная кислота →
хлорид железа (II) + водород.
• Оксид меди + оксид азота (V) → нитрат меди.
• Железо + сера → сульфид железа (II).


















 Химия
Химия








