Похожие презентации:
Пятичленные гетероциклы с одним гетероатомом
1.
Пятичленные гетероциклы с однимгетероатомом
X
X = NH - ПИРРОЛ, X=S - ТИОФЕН, Х=О - ФУРАН
2.
MeN
Me
NH
HN
HO2C
Fe
N
N
CO2 H
Me
N
N
N
H
N
HO 2C
порфирин
H2N
порфобилиногeн
Me
I
HO 2C
V
гeм
II
Me
O
O
Me
C20H39
H
N
O
Mg
N
N
H
O
Me
N
Me
H
Et
O
P
CH2OH
H
H
N
HO
H
N
Me
..N
Me
O
Me
Me
O
хлорофилл-а
III
O
O
H
MeO 2C
H
H2NOC
Me
CONH2
H
H
N
H
Co
Me
Me
H2NOC
N
N
2+
Me
Me
CONH2
N
H
H
Me
Me
CN CONH2
CONH2
втимин В12
IV
3.
HOOH
NO2
H
HOCH2
O
O
H
OH
аскорбиновая кислота
витамин С
CH2SH
MeNH
S
N
H
NHMe
O
фурфурилтиол
O
(запах жарeного кофe)
(лeчeниe язвы жeлудка)
ранитидин
O
NH
HN
H
H
H
S
(CH2 )4 CO2 H
(+)-биотин (витамин Н)
4.
Типы образования связейX
X
C-X
C(3)-C(4)
X
C(2)-C(3)
X
C(2)-C(3) + C(4)-C(5)
5.
Образование связи C-ХИз 1,4-дикарбонильных соединений (метод ПааляКнорра)
Me
Me
N
H
NH3
Me
O O
Me
NH3
RNH2
бензол Me
O
O
Me
Me
R
OH
Me
Me
HO NH2 O
Me
HO
- 2 H2O
Me
N
H
Me
N
N
H
Me
Me
6.
MeRNH2 +
Me
O O
Me
HO
NHR O
Me
O
Me Me
NR
HO
Me
N
R
Me
Me
N
Me
O
Me Me
R
A.R.Katrizki, Tetrahedron, 43, 5171 (1987)
NHR
7.
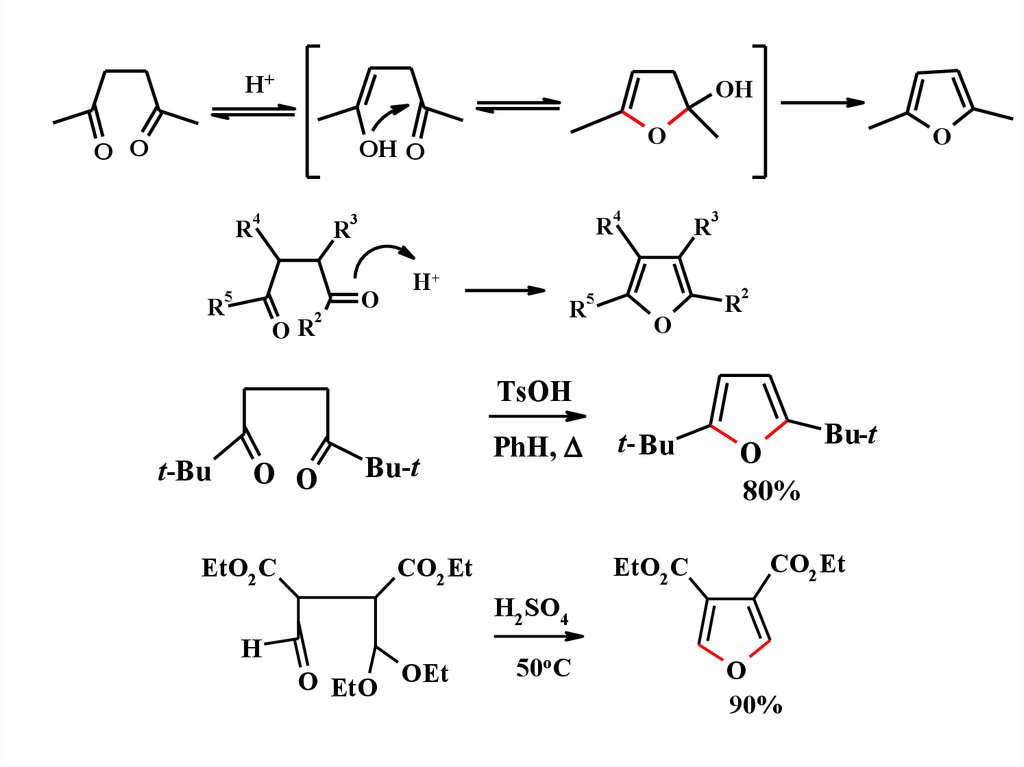
H+OH
O O
O
OH O
4
2
3
R
R
5
R
4
3
R
O
H+
OR
R
2
5
R
O
O
R
TsOH
t-Bu
O O
Bu-t
EtO2 C
PhH,
t- Bu
EtO2 C
CO2 Et
O
80%
CO2 Et
H2SO4
H
O EtO
OEt
50oC
Bu-t
O
90%
8.
RR
P4S10
R
O O
или H2S/HCl R
R
S
~ 40%
Реактив Лоуссона
MeO
P
S
MeO
S
S
P
S
Tetrahedron Lett., 41 (22), 5061 (1985)
R
9.
EtEt
NaSH/EtOH
1 дн, 20оС
Me
Et
S
65%
Me
P2S3
Me
O
O
O Na+
180oC Me
S
70%
P2S3
Na+- O
O
O
O Na+ 180oC
S
45%
Et
10.
Реакция ЮрьеваH2 S
NH3
H2 O
S
H2 S
O
H2 O
NH3
Al2O3, 350-400oC
N
H
11.
Специфические методы образования связи C-XПолучение пиррола из аммонийной соли слизевой кислоты
HO
+NH -O C
4
2
OH
CO2- NH4+
HO
OH
HO2 C
CO2 H
+ NH3
NH3
-2H2O HO C
2
CO2 H
-2CO2
Ber., 42, 2506 (1909)
[O]
N
H
40-50%
12.
[4+2]-Циклоприсоединение аминов к активированным бутадиенамRNH2
N
R
A.Padwa, B.H.Norman, Tetrah.Lett., 29, 3041 (1988)
PhSO2
H2 C
CH2
SO2 Ph
RNH2
PhSO2
H2 C
CH2NHR
SO2 Ph
R
DDQ
SO2 Ph
N
SO2 Ph
SO2 Ph
N
PhSO2
R
N
R
90%
R=Bu, Bn, CH2-o-C6H3Me, CH2(CH2)nOH, n=1-3
13.
1R
C
O
1
CH2
H2C
O
O
SO2Ph
R
С
RNH2/CH2Cl2/MeOH
20оС, 3 ч
1
SO2Ph
R
N
N
R
R
1
R = Me, Ph; R = i-Bu, s-Bu, t-Bu, Bz, CH2(CH2)2OH
Расширение азиридинового цикла
Mo(CO)5
N
Mo(CO)6
Ph
N
Ph
Ph
CO2Me
CHCO2Me
Heterocycles, 22, 859 (1984)
N
H
91%
CO2Me
14.
Синтез пирролов из 4-аминоацетиленов и фуранов изалк-3-ин-1,2-диолов (5 эндо-диг-циклизация)
I
Ph
CO2Me
TosNH
I
I2, K2CO3
MeCN, 0oC
DBU
20oC Ph
CO2Me ДМФА
Ph
20oC
N
Tos
74%
90%
Chem. Commun., 2207 (1998)
N
DBU
N
1,8-диазабициклоундец-7-ен
Y
Y
Y
X
X
X
z:
z:
z:
sp3 X: экзо-тет
sp2 X: экзо-триг
X Y
z:
sp2
Y: эндо-триг
N
H
sp X: экзо-диг
X Y
z:
sp Y: эндо-диг
CO2Me
15.
OHI
I2, Na2 CO3
Bu
Ph
MeCN, 20°C
HO
J. Org. Chem., 62, 5327 (1997)
Bu
O
Ph
16.
Синтез фуранов из алкенилсульфониевых солей и 1,3дикарбонильных соединенийO
O
+
Me
O
t-BuOK
+ SEt2 ТГФ
0°C
Br-
SEt2
+
OK
Me
O
O
Br-
Me
TsOH
Me
O
Me
J. Org. Chem., 59, 5970 (1994)
O
17.
Синтез фуранов из пентиноновBr
Me
O
O
O
Me
_
OEt
Me
OEt
EtONa, EtOH
ДМФА, 20°C
O
HO
O
O
Me
H2 C
OEt
O
OEt
O
~ H+
Me
Me
OEt
O
Synthesis, 581 (1974)
O
CH2 CO2Me
+ ArI
Pd(PPh3)4, K2CO3
ДМФА, 100°С
ArCH2
O
CH2 CO2Me
Ar = m-FC6H4 (87%)
J.Org.Chem., 62, 5327 (1997)
18.
Синтeз фурана из фурфуролаCHO
H
OH
HO
OH
H
CH2 OH
H
O
OH
12% HCl
H
H
CHO
CHO
H
H
H
OH
H
OH
CH2 OH
CH2 OH
H
OH H+
H
CHO
H
OH O
O
CHO
CHO
O
100%
NaOH
O
200°C
O
CO2 H
или
Ag2O/CuO
Ni
O
°
CHO 280 C
O
19.
Синтeз фуранов из мeркурпроизводныхацилпропаргиловых спиртов
H
R
1
R
OH
HgCl2
H
R
O
OH R
HgCl
Cl
R
HgCl
Cl
O
1
MeOH, Et3N
O
CO2Me
Cl
CO, LiPdCl4
R
1
R
O
R
1
Heterocycles,
18, 397 синтeза
(1982)
Промышлeнныe
мeтоды
тиофeна
n-C4H9 + 4S
Ph
700°C
C6 H4 OMe-p
S
Me
180°C
+ 3H2S
S
70%
C6 H4 OMe-p
Ph
S


















 Химия
Химия