Похожие презентации:
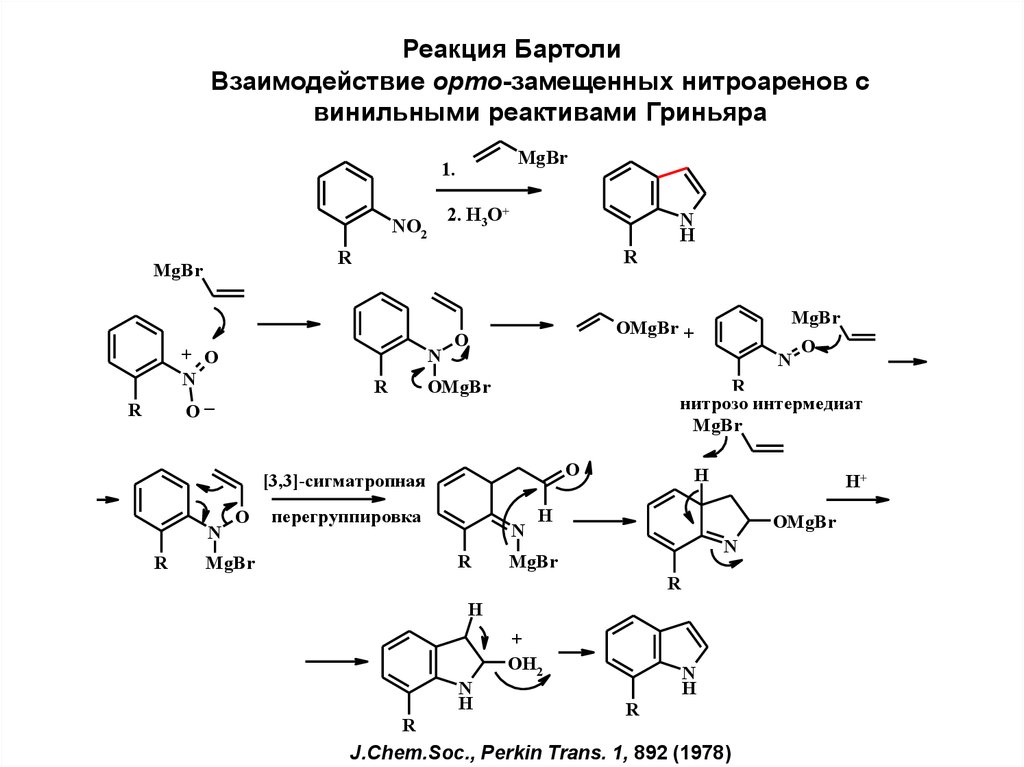
Реакция Бартоли. Взаимодействие орто-замещенных нитроаренов с винильными реактивами Гриньяра
1.
Реакция БартолиВзаимодействие орто-замещенных нитроаренов с
винильными реактивами Гриньяра
MgBr
1.
2. H3O+
NO2
R
R
MgBr
+ O
N
_
O
R
N
H
N
R
O
N
R
O
O
перегруппировка
N
R
MgBr
H
H+
H
OMgBr
N
MgBr
R
H
N
H
R
O
R
нитрозо интермедиат
MgBr
OMgBr
[3,3]-сигматропная
N
MgBr
OMgBr +
+
OH2
N
H
R
J.Chem.Soc., Perkin Trans. 1, 892 (1978)
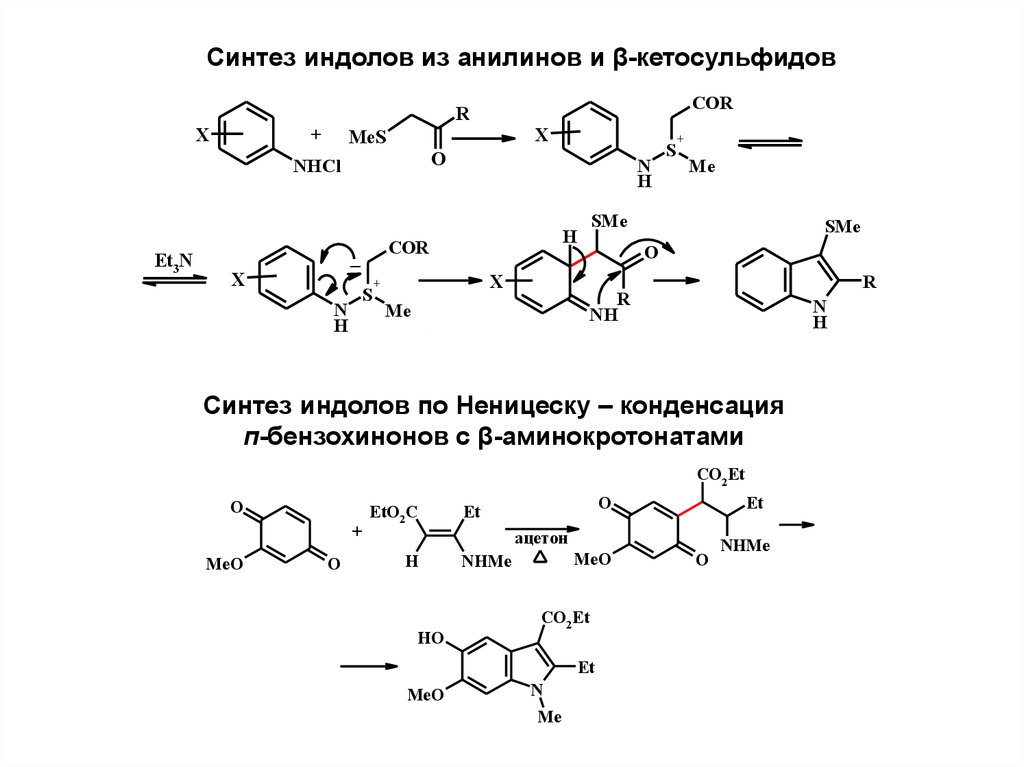
2.
Синтез индолов из анилинов и β-кетосульфидов+
X
X
MeS
O
NHCl
Et3N
COR
R
S
N
H
Me
SMe
O
X
+
+
SMe
H
COR
_
X
N
H
S
R
R
NH
Me
N
H
Синтез индолов по Неницеску – конденсация
п-бензохинонов с β-аминокротонатами
CO2 Et
O
+
MeO
O
EtO2 C
O
Et
Et
ацeтон
H
HO
MeO
NHMe
CO2 Et
Et
MeO
N
Me
O
NHMe
3.
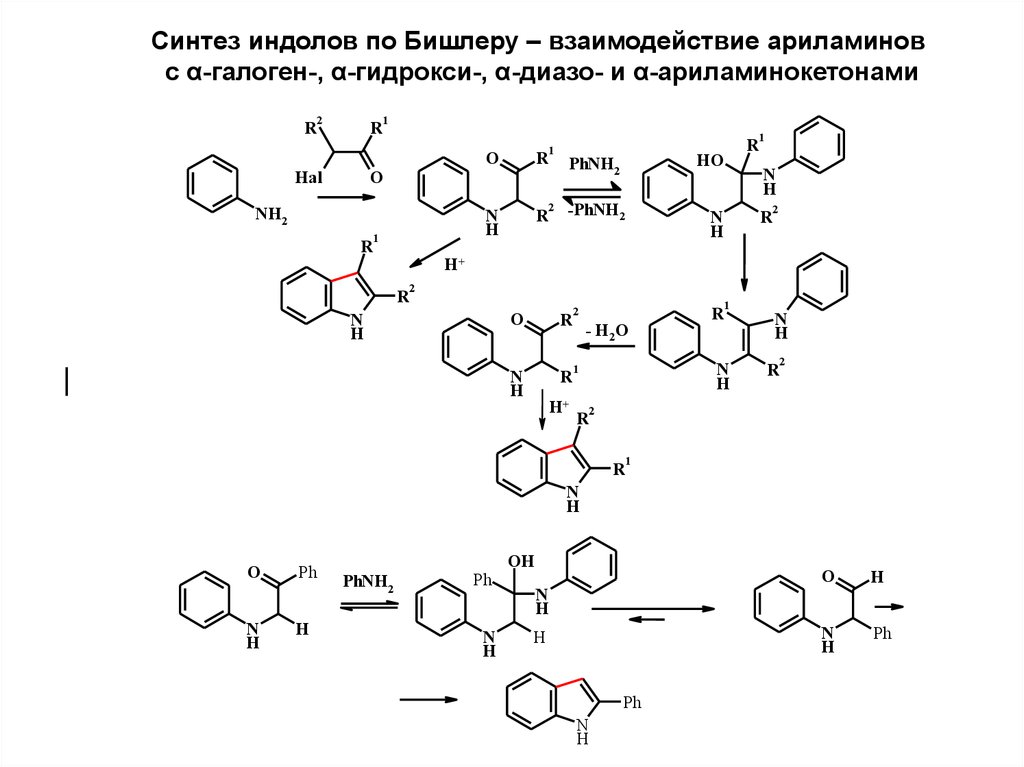
Синтез индолов по Бишлеру – взаимодействие ариламиновс α-галоген-, α-гидрокси-, α-диазо- и α-ариламинокетонами
R
2
R
Hal
1
O
R
N
H
R
1
O
NH2
R
1
2
R
HO
PhNH2
-PhNH2
1
N
H
N
H
R
2
H+
R
2
N
H
O
R
N
H
R
H+
2
- H2O
1
N
H
1
R
R
N
H
R
2
2
R
1
N
H
O
N
H
Ph
H
OH
PhNH2
Ph
N
H
N
H
H
Ph
N
H
O
H
N
H
Ph
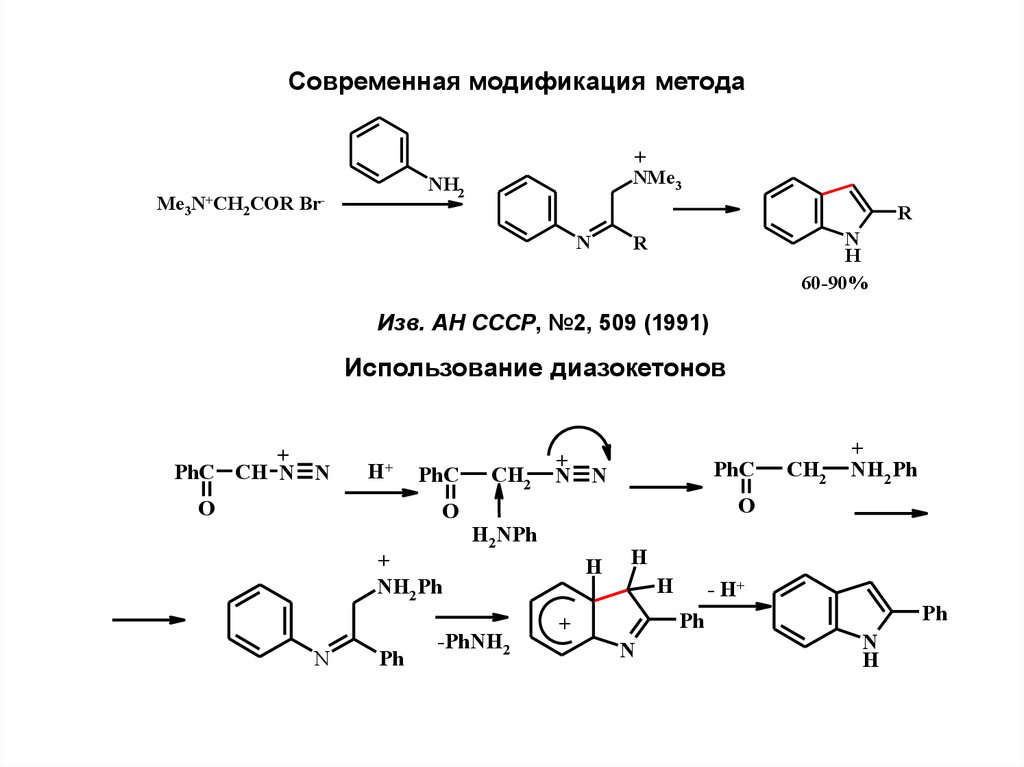
4.
Современная модификация методаMe3
N+CH
2COR
+
NMe3
NH2
Br-
R
N
N
H
60-90%
R
Изв. АН СССР, №2, 509 (1991)
Использование диазокетонов
+
PhC CH N N
H+
O
PhC
O
+
NH2 Ph
N
Ph
CH2
+
N N
PhC
CH2
+
NH2 Ph
O
H2NPh
-PhNH2
H
H
H
- H+
Ph
+
N
Ph
N
H
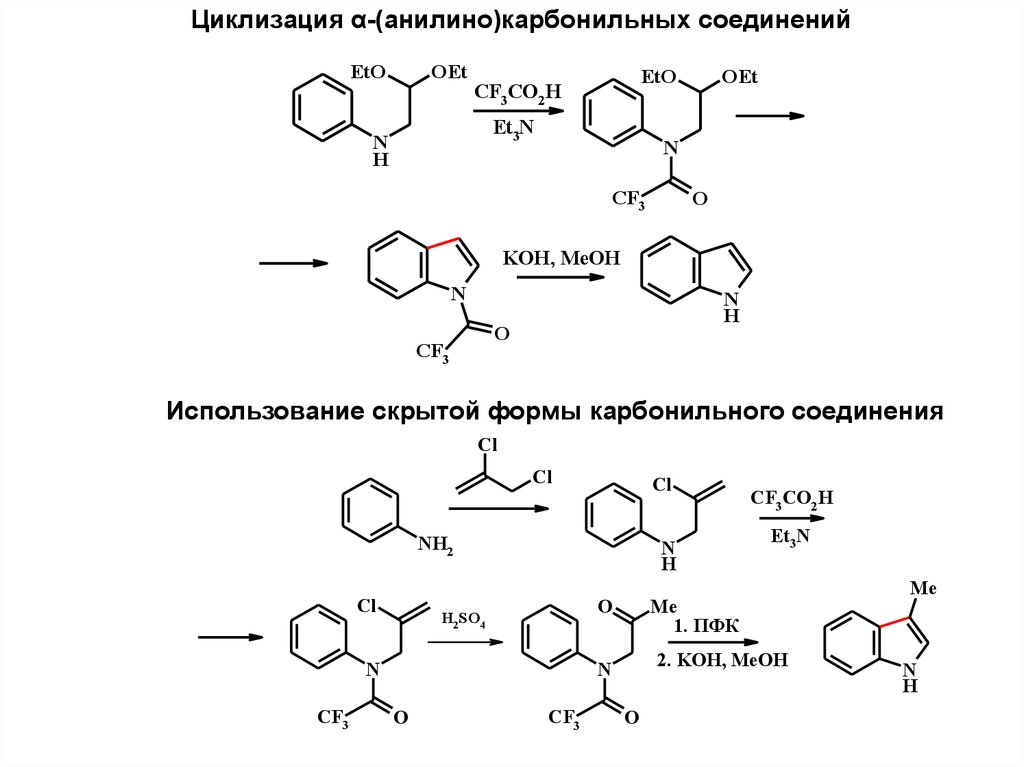
5.
Циклизация α-(анилино)карбонильных соединенийEtO
OEt
EtO
CF3 CO2 H
Et3N
N
H
OEt
N
CF3
O
KOH, MeOH
N
N
H
O
CF3
Использование скрытой формы карбонильного соединения
Cl
Cl
Cl
NH2
Cl
N
H
O
H2SO4
N
CF3
CF3
Et3N
Me
1. ПФК
2. KOH, MeOH
N
O
CF3 CO2 H
O
Me
N
H
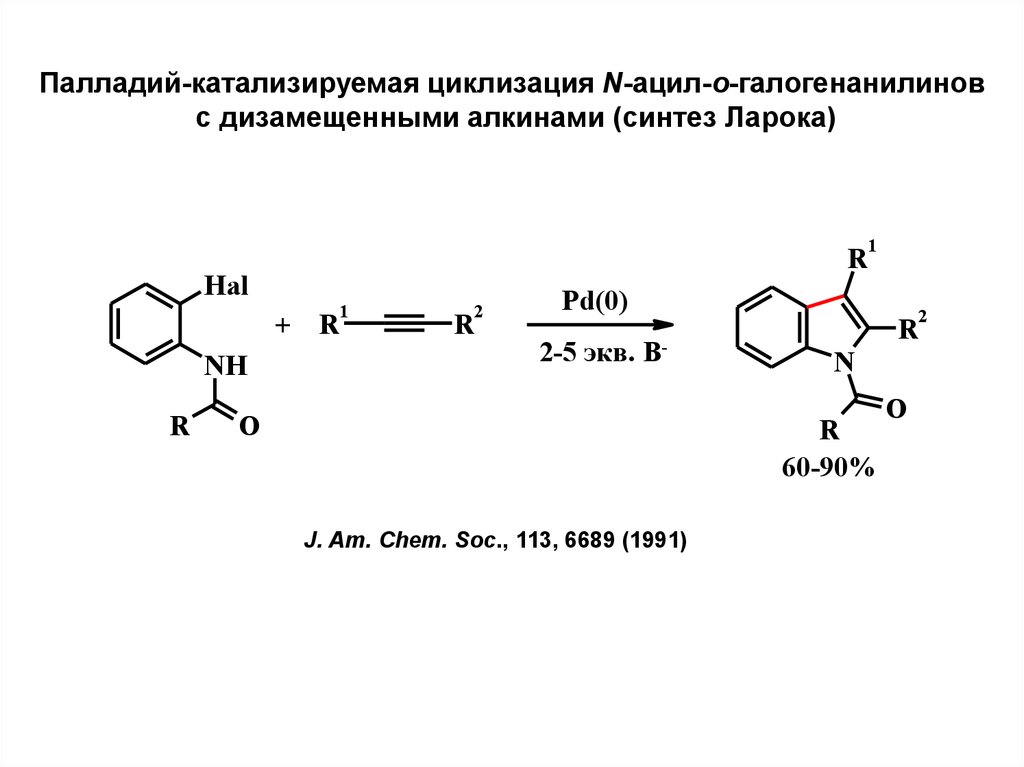
6.
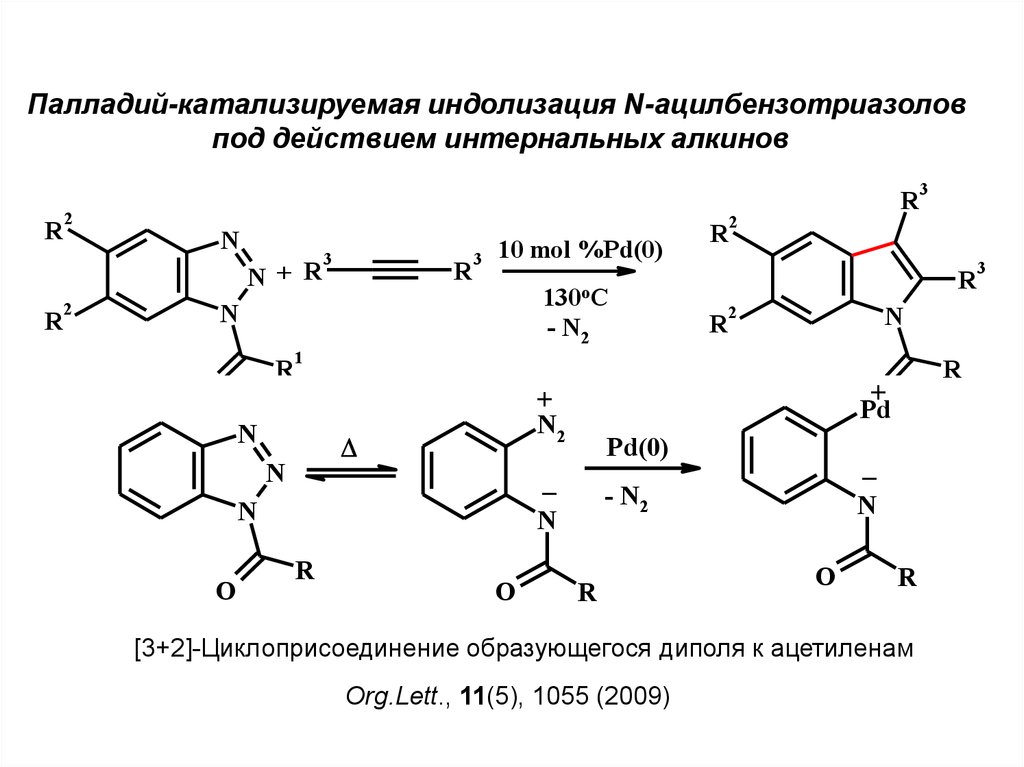
Палладий-катализируемая циклизация N-ацил-о-галогенанилиновс дизамещенными алкинами (синтез Ларока)
R
Hal
+ R
NH
R
1
R
2
1
Pd(0)
2-5 экв. B-
O
R
N
R
60-90%
J. Am. Chem. Soc., 113, 6689 (1991)
O
2
7.
Палладий-катализируемая индолизация N-ацилбензотриазоловпод действием интернальных алкинов
R
2
N
N + R
R
2
3
R
3
10 mol %Pd(0)
130oC
- N2
N
R
O
2
R
N
2
N
Pd(0)
_
N
N
R
O
R
O
+
Pd
+
N2
_
N
- N2
R
O
R
[3+2]-Циклоприсоединение образующегося диполя к ацетиленам
Org.Lett., 11(5), 1055 (2009)
3
R
1
N
O
R
R
3
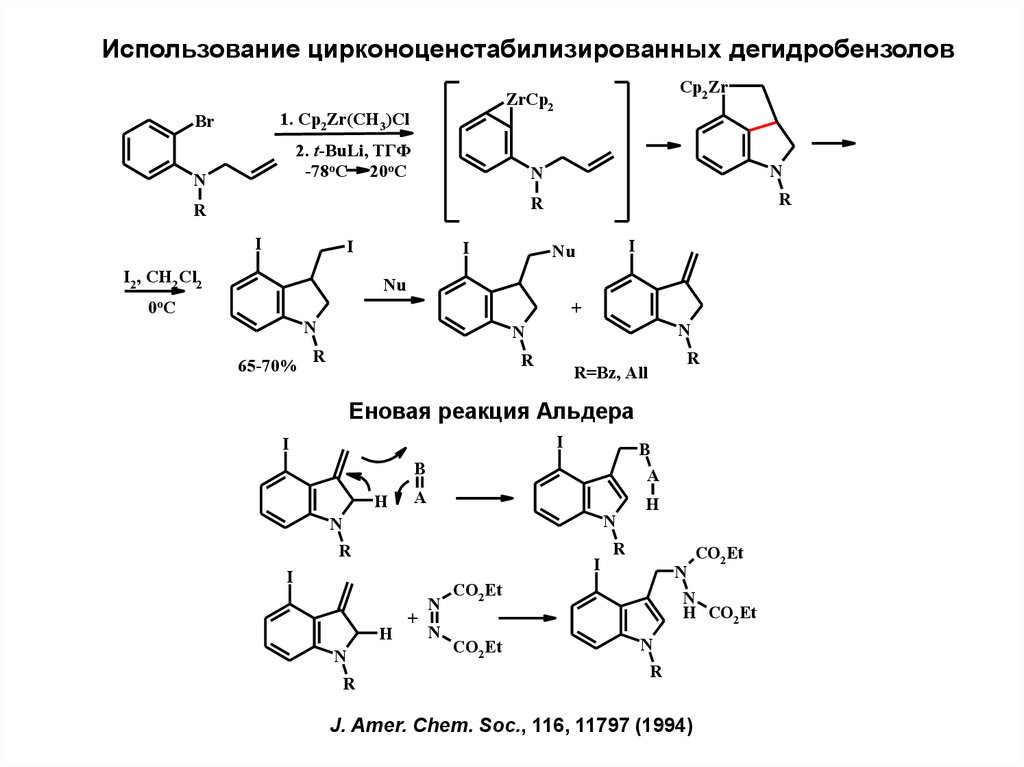
8.
Использование цирконоценстабилизированных дегидробензолов1. Cp2Zr(CH3)Cl
Br
2. t-BuLi, ТГФ
-78oC 20oC
N
Cp2 Zr
ZrCp2
N
N
R
R
R
I
I
I2, CH2 Cl2
I
I
Nu
Nu
0o C
+
N
65-70%
N
N
R
R
R
R=Bz, All
Еновая реакция Альдера
I
I
B
B
H
A
A
N
N
R
I
I
H
N
R
+
N
N
H
R
N
CO2 Et
CO2 Et
CO2 Et
N
H CO2 Et
N
R
J. Amer. Chem. Soc., 116, 11797 (1994)
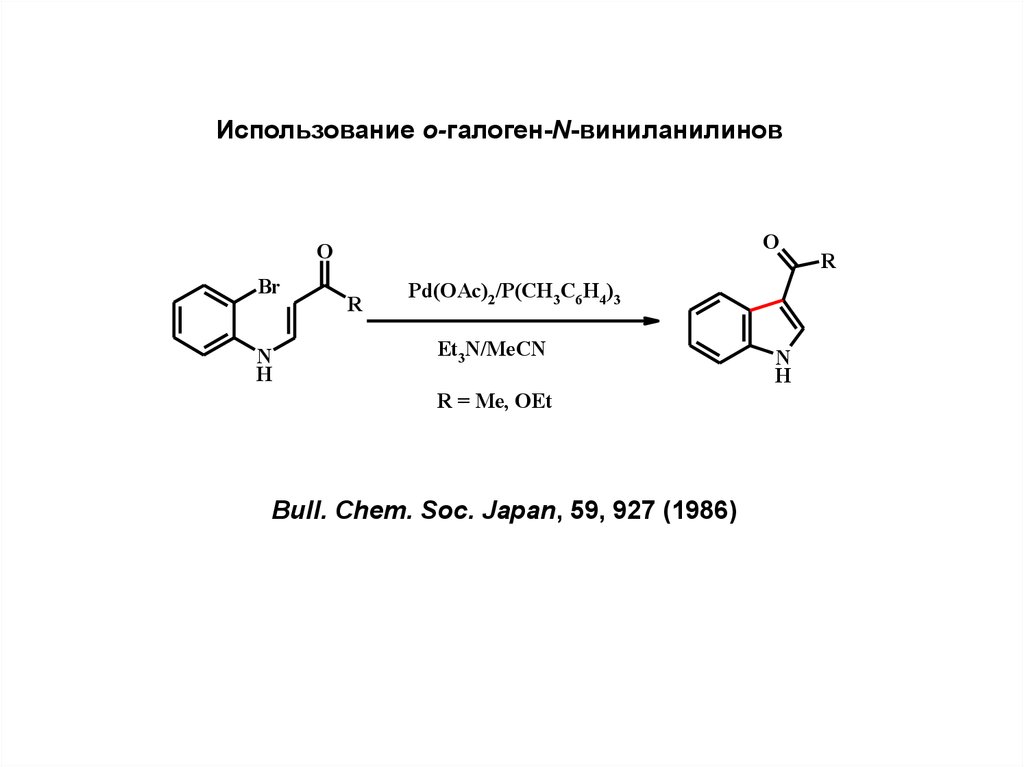
9.
Использование о-галоген-N-виниланилиновO
O
Br
N
H
R
Pd(OAc)2/P(CH3C6H4 )3
Et3N/MeCN
R = Me, OEt
Bull. Chem. Soc. Japan, 59, 927 (1986)
N
H
R
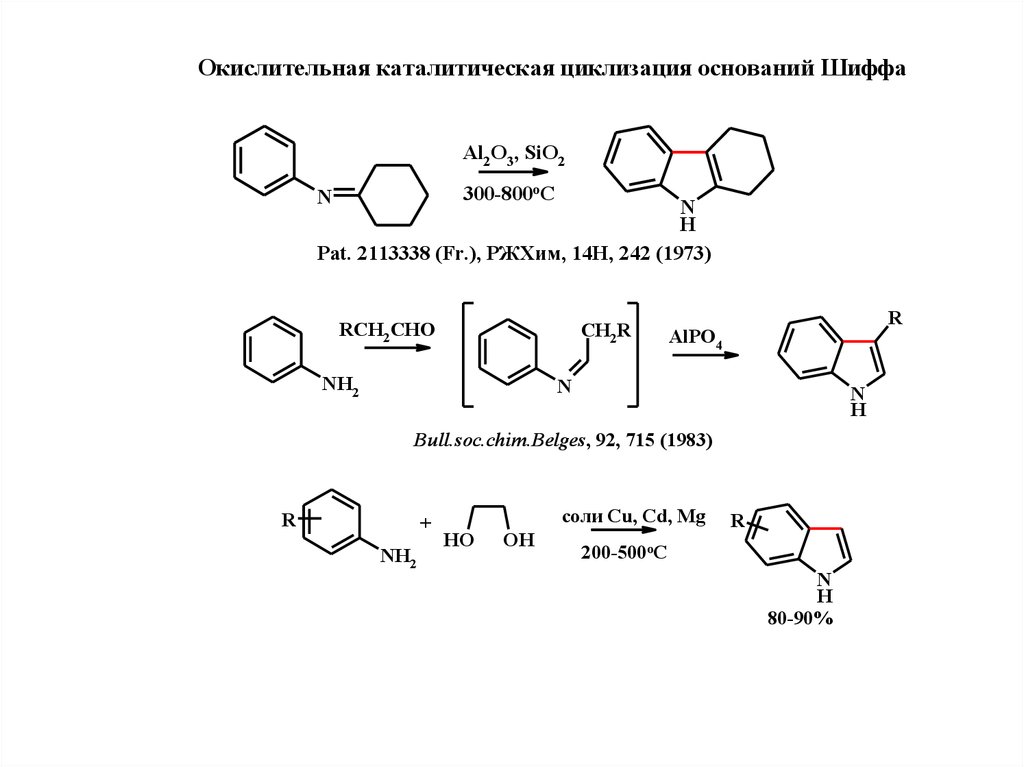
10.
Окислитeльная каталитичeская циклизация оснований ШиффаAl2 O3, SiO2
300-800oC
N
N
H
Pat. 2113338 (Fr.), РЖХим, 14Н, 242 (1973)
RCH2 CHO
CH2R
NH2
R
AlPO4
N
N
H
Bull.soc.chim.Belges, 92, 715 (1983)
R
+
NH2
соли Cu, Cd, Mg
HO
OH
R
200-500oC
N
H
80-90%
11.
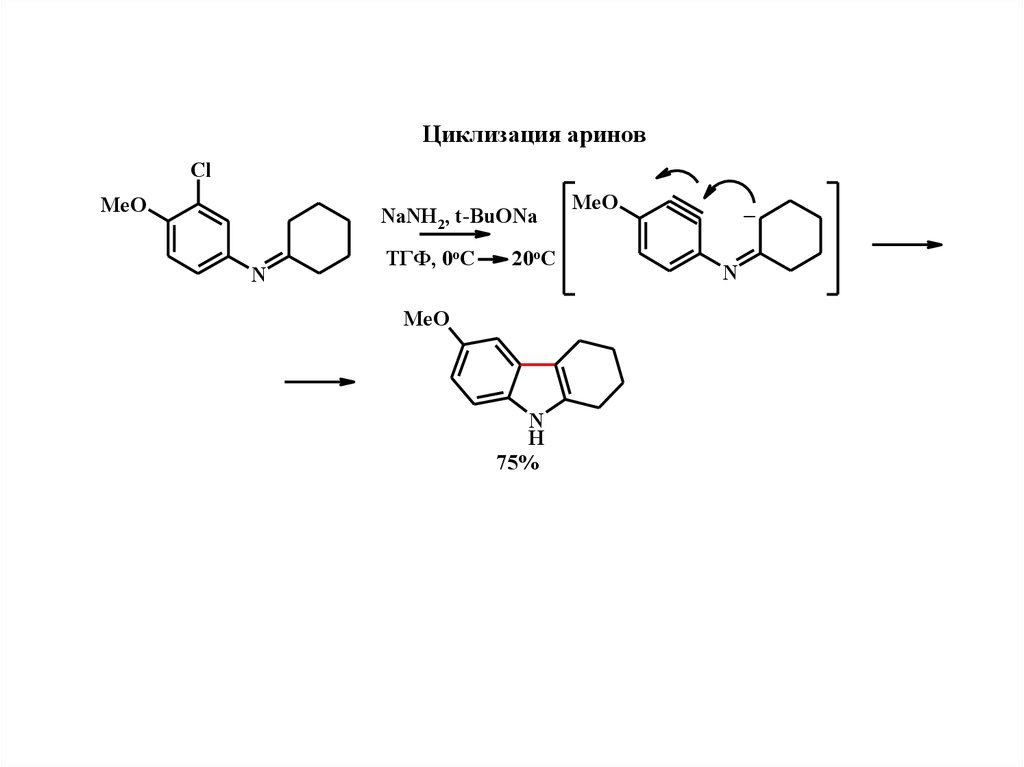
Циклизация ариновCl
MeO
NaNH2, t-BuONa
N
ТГФ, 0оС
20оС
MeO
N
H
75%
MeO
_
N
12.
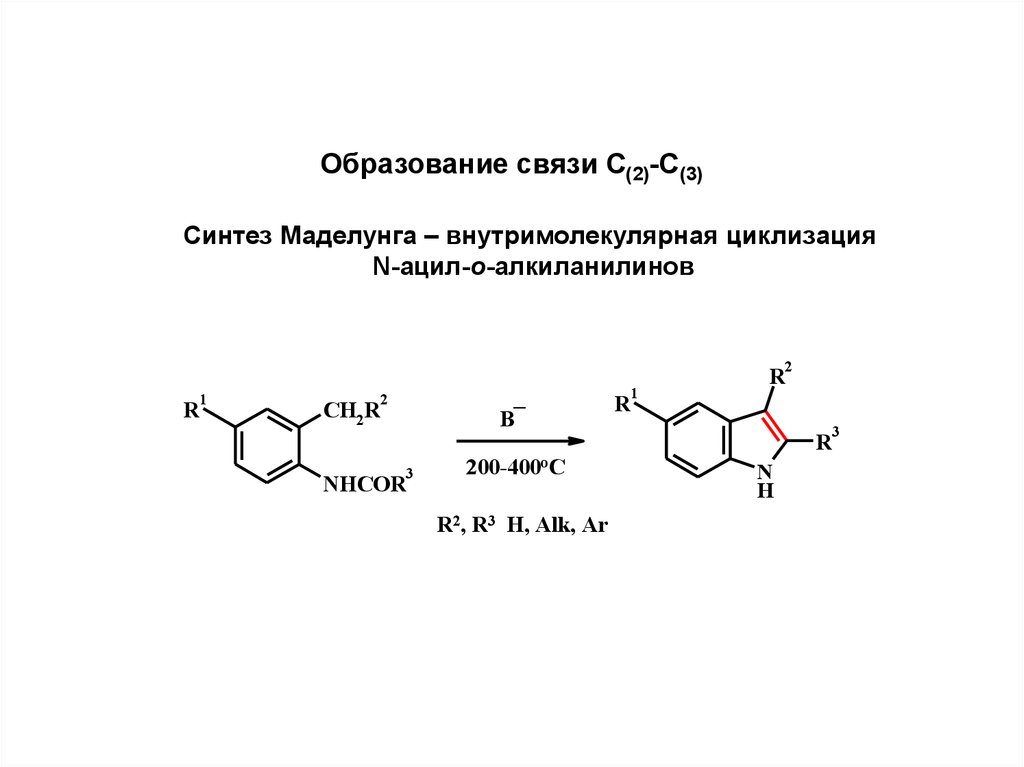
Образование связи С(2)-С(3)Синтез Маделунга – внутримолекулярная циклизация
N-ацил-о-алкиланилинов
2
1
R
_
B
2
CH2R
3
NHCOR
200-400oC
R2, R3 H, Alk, Ar
R
1
R
3
R
N
H
13.
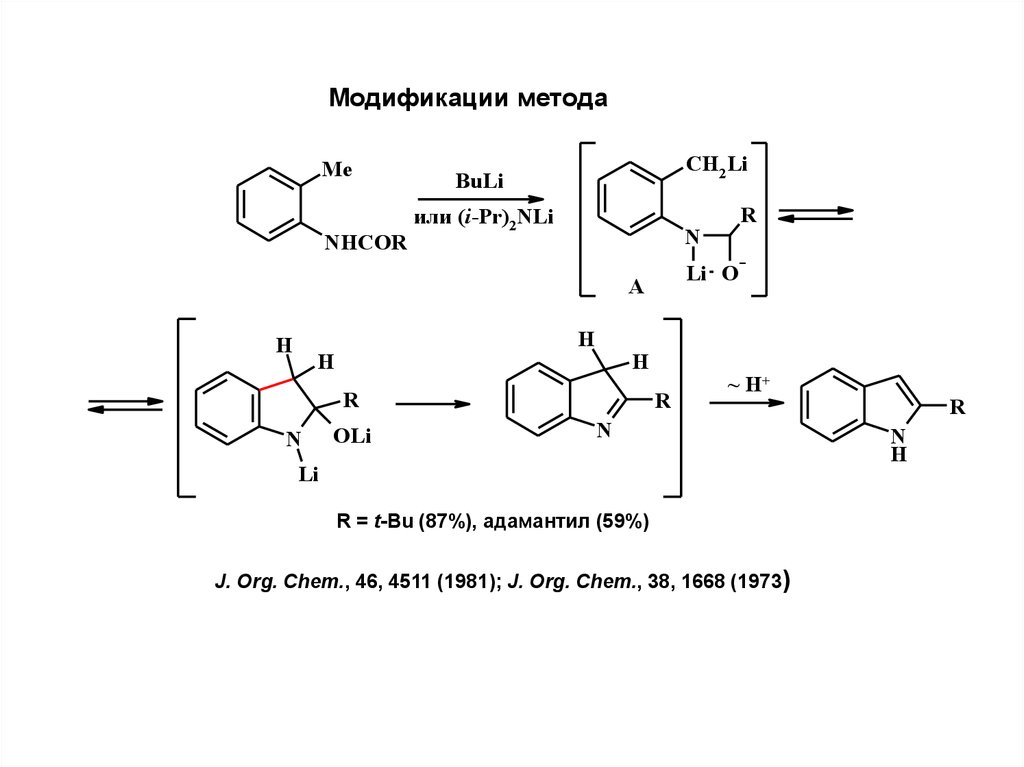
Модификации методаMe
NHCOR
CH2 Li
BuLi
или (i-Pr)2NLi
N
Li O
A
H
H
H
H
R
N
OLi
R
R
~ H+
N
Li
R = t-Bu (87%), адамантил (59%)
J. Org. Chem., 46, 4511 (1981); J. Org. Chem., 38, 1668 (1973)
R
N
H
14.
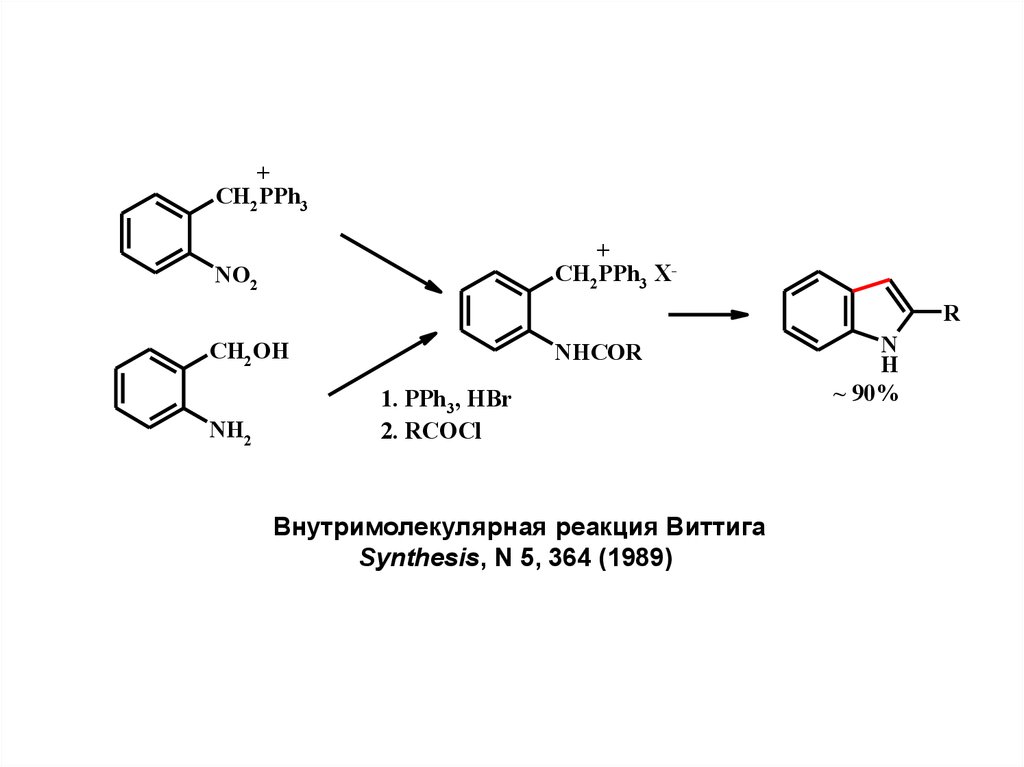
+CH2 PPh3
+
CH2 PPh3 X-
NO2
R
CH2OH
NH2
NHCOR
1. PPh3, HBr
2. RCOCl
Внутримолекулярная реакция Виттига
Synthesis, N 5, 364 (1989)
N
H
~ 90%
15.
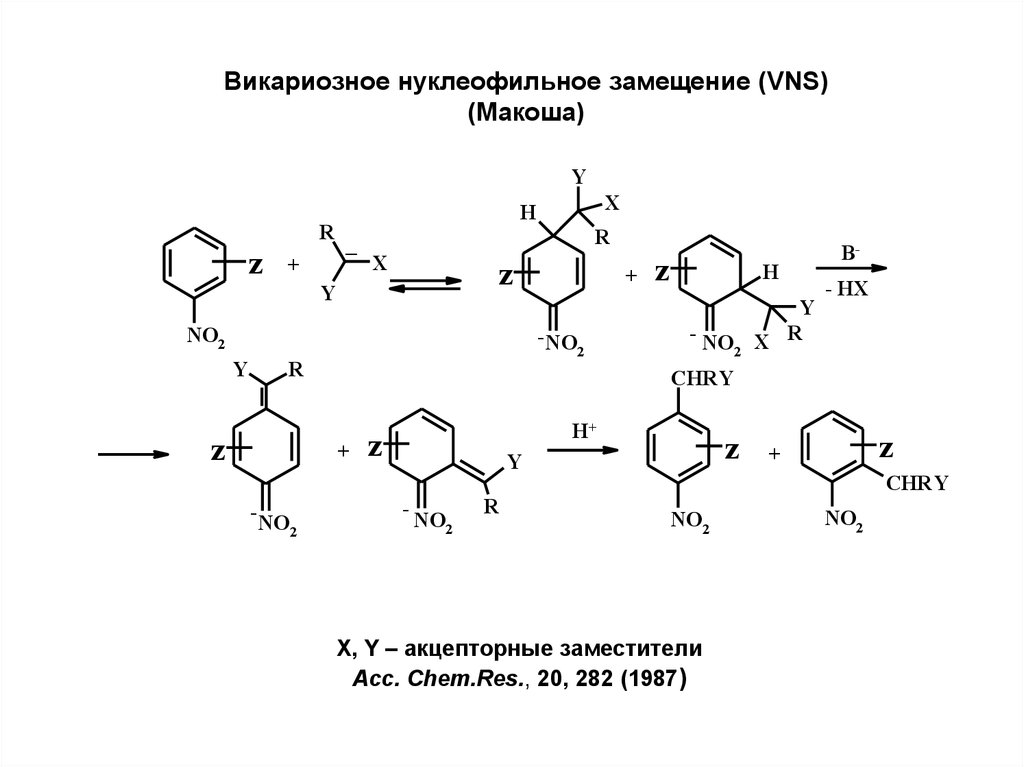
Викариозное нуклеофильное замещение (VNS)(Макоша)
Y
R
z
+
X
H
_
R
X
z
Y
NO2
+
-NO
Y
2
R
z
2
H
Y
- NO X R
2
- HX
CHRY
+
-NO
z
B-
H+
z
z
Y
-
NO2
R
z
+
CHRY
NO2
X, Y – акцепторные заместители
Acc. Chem.Res., 20, 282 (1987)
NO2
16.
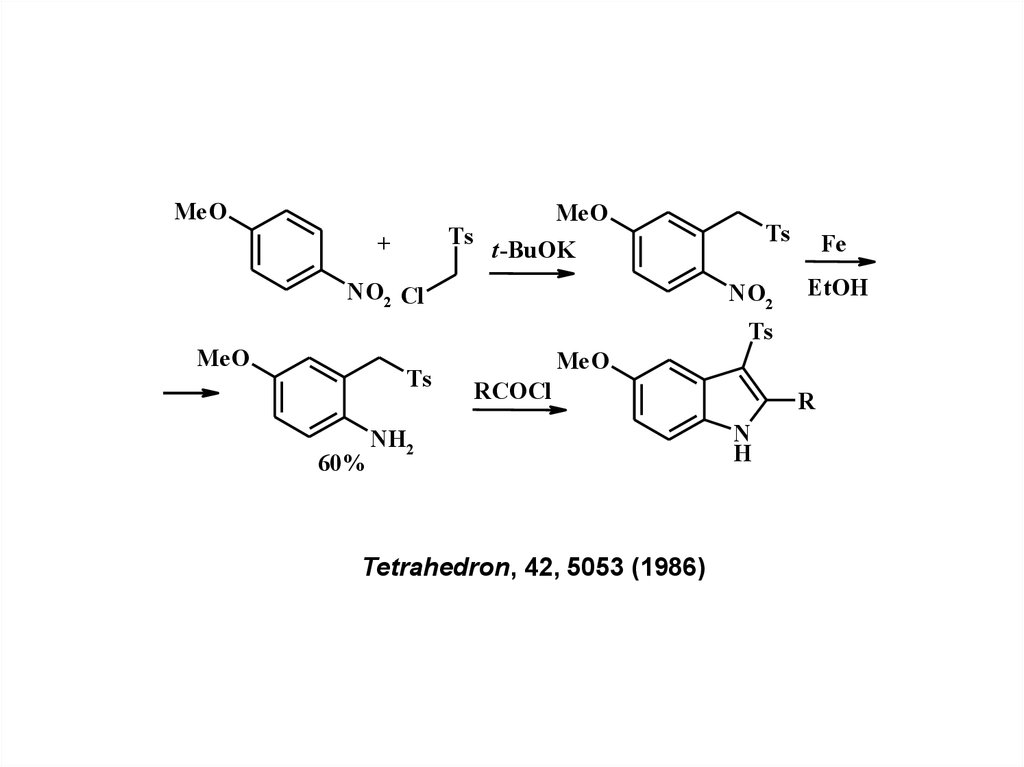
MeOTs
+
MeO
Ts
t-BuOK
NO2 Cl
NO2
Fe
EtOH
Ts
MeO
Ts
60%
MeO
RCOCl
NH2
Tetrahedron, 42, 5053 (1986)
R
N
H
17.
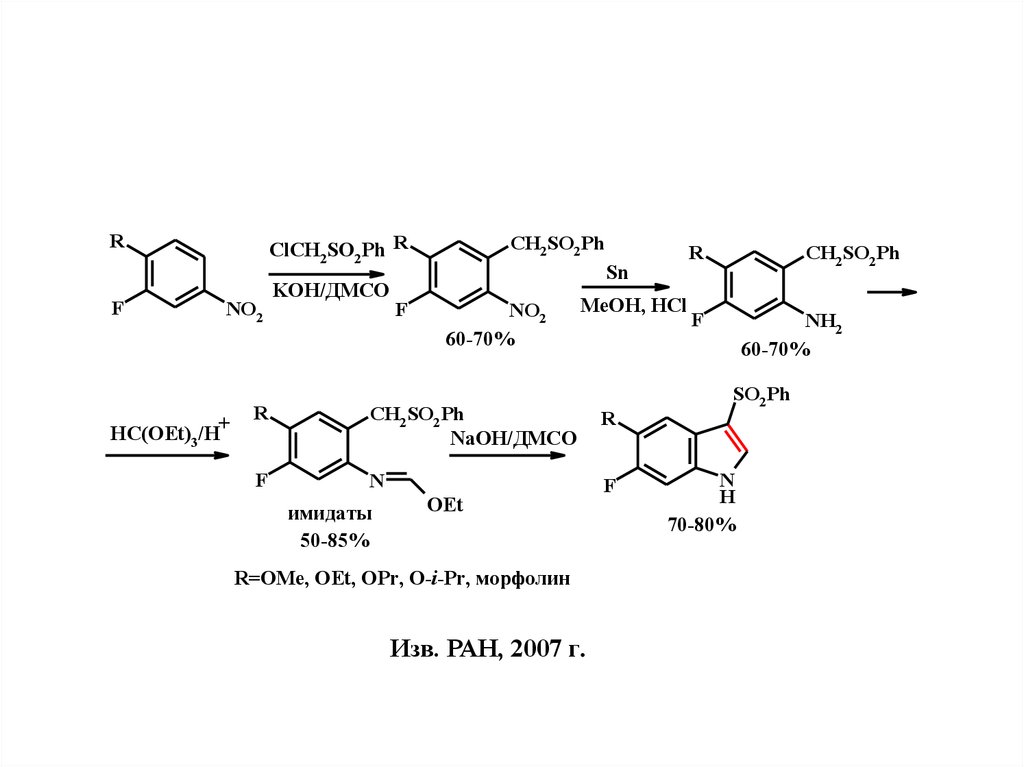
RF
ClCH2SO2 Ph R
NO2
+
HC(OEt)3 /H
KOH/ДМСО
F
CH2SO2 Ph
Sn
NO2
60-70%
MeOH, HCl
R
CH2SO2 Ph
NaOH/ДМСО
R
F
N
F
имидаты
50-85%
R
OEt
R=OMe, OEt, OPr, O-i-Pr, морфолин
Изв. РАН, 2007 г.
CH2SO2 Ph
F
NH2
60-70%
SO2 Ph
N
H
70-80%
18.
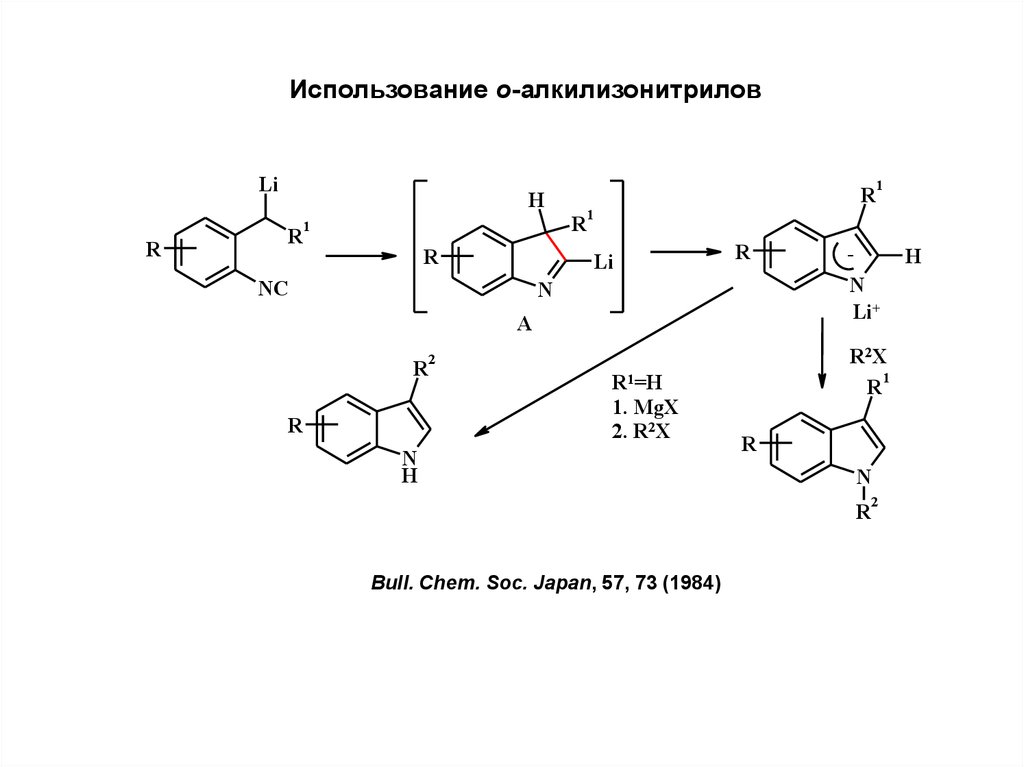
Использование о-алкилизонитриловLi
R
R
H
R
R
1
R
1
Li
NC
R
N
A
R
R
1
R2X
1
R
2
R1=H
1. MgX
2. R2X
N
H
N
Li+
R
N
R
Bull. Chem. Soc. Japan, 57, 73 (1984)
2
H
19.
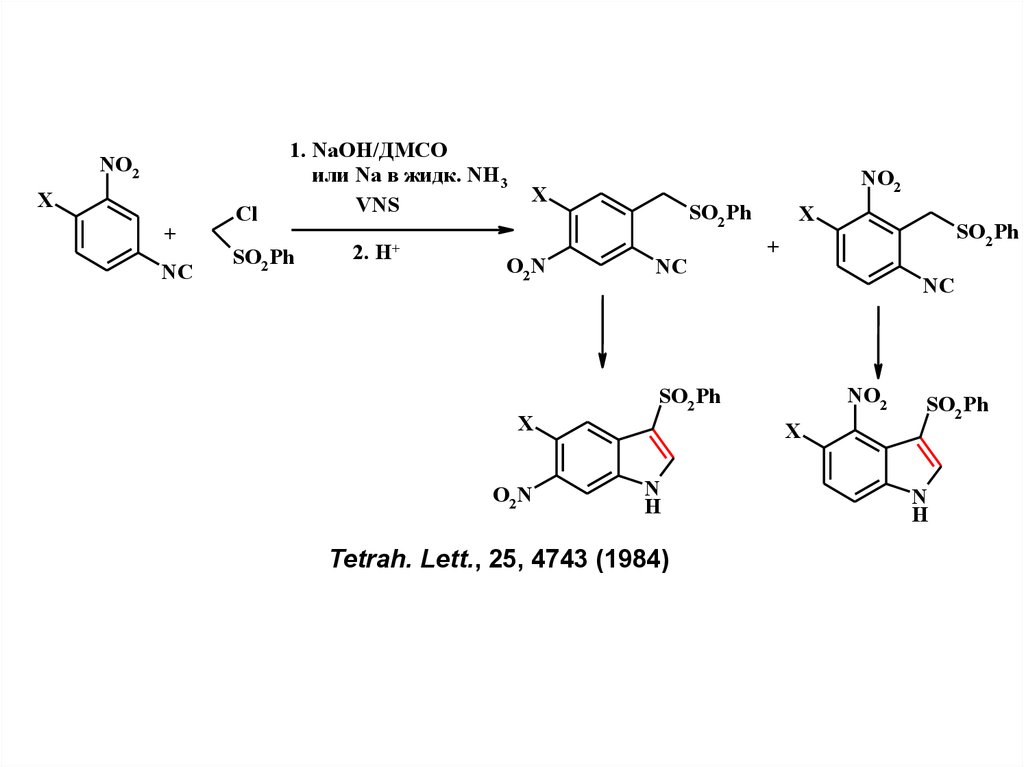
NO2X
+
NC
Cl
1. NaOH/ДМСО
или Na в жидк. NH3
VNS
SO2 Ph
2. H+
NO2
X
O2N
X
O2N
SO2 Ph
NC
X
NC
NO2
SO2 Ph
X
N
H
Tetrah. Lett., 25, 4743 (1984)
SO2 Ph
+
SO2 Ph
N
H
20.
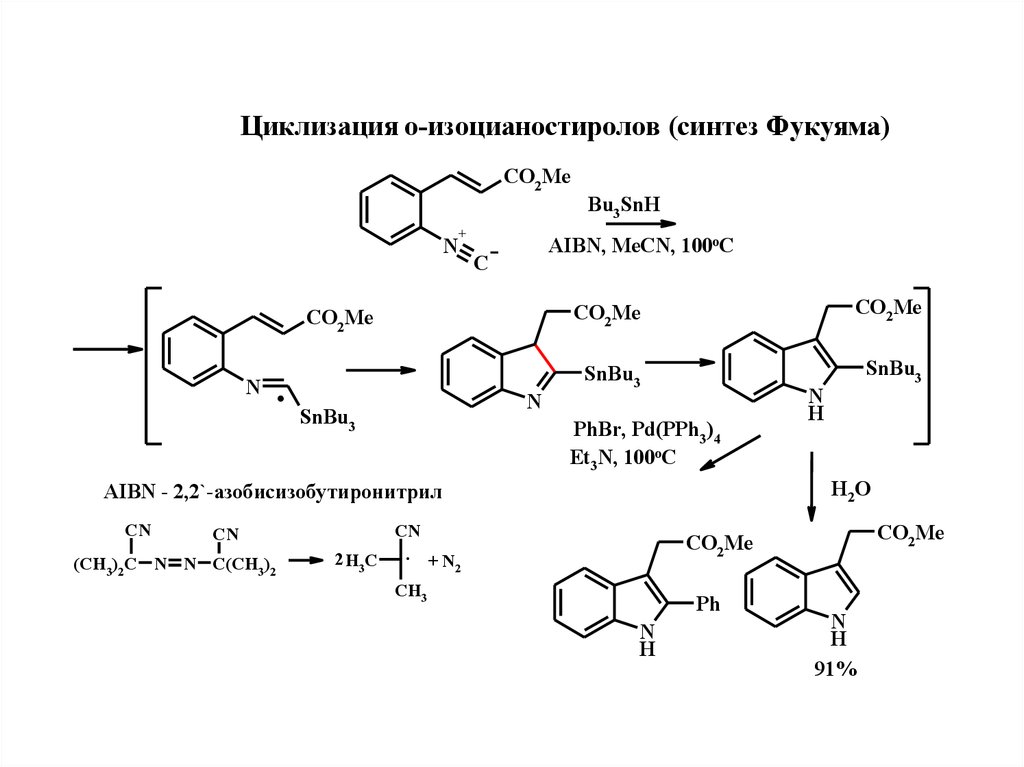
Циклизация о-изоцианостиролов (синтeз Фукуяма)CO2Me
N
+
AIBN, MeCN, 100oC
C
CO2Me
N
.
N
SnBu3
Bu3SnH
CO2Me
CO2Me
SnBu3
SnBu3
PhBr, Pd(PPh3)4
Et3N, 100oC
H2 O
AIBN - 2,2`-азобисизобутиронитрил
CN
CN
(CH3)2C N N C(CH3)2
N
H
CN
. +N
2 H3C
2
CO2Me
CO2Me
CH3
Ph
N
H
N
H
91%
21.
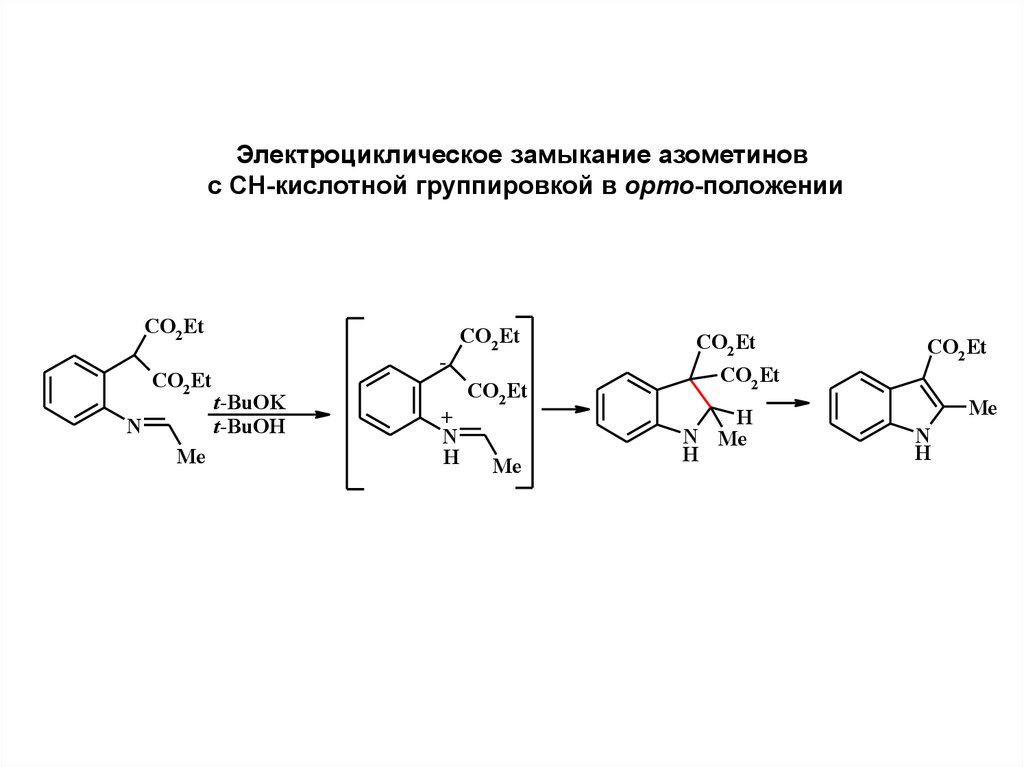
Электроциклическое замыкание азометиновс СН-кислотной группировкой в орто-положении
CO2 Et
CO2 Et
N
Me
t-BuOK
t-BuOH
+
N
H
CO2 Et
CO2 Et
Me
CO2 Et
CO2 Et
H
N Me
H
CO2 Et
Me
N
H
22.
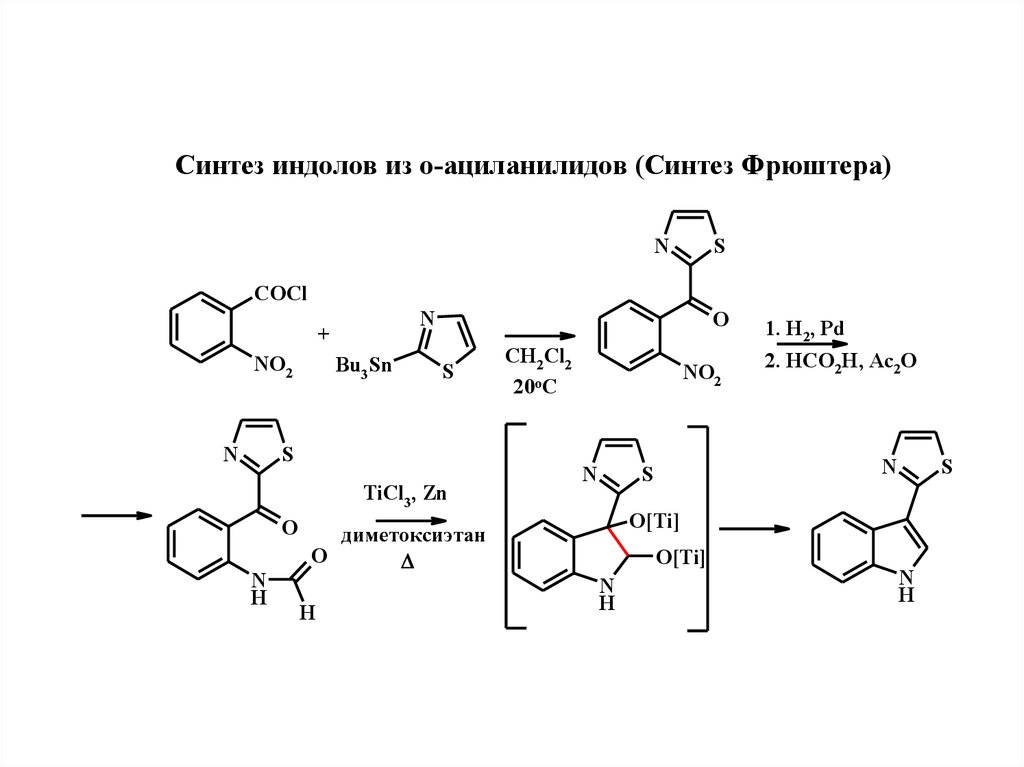
Синтeз индолов из о-ациланилидов (Синтeз Фрюштeра)N
S
COCl
N
+
NO2
N
Bu3Sn
O
S
S
TiCl3, Zn
O
N
H
CH2 Cl2
20oC
NO2
N
2. HCO2H, Ac2O
N
S
S
O[Ti]
димeтоксиэтан
O
H
1. H2, Pd
O[Ti]
N
H
N
H
23.
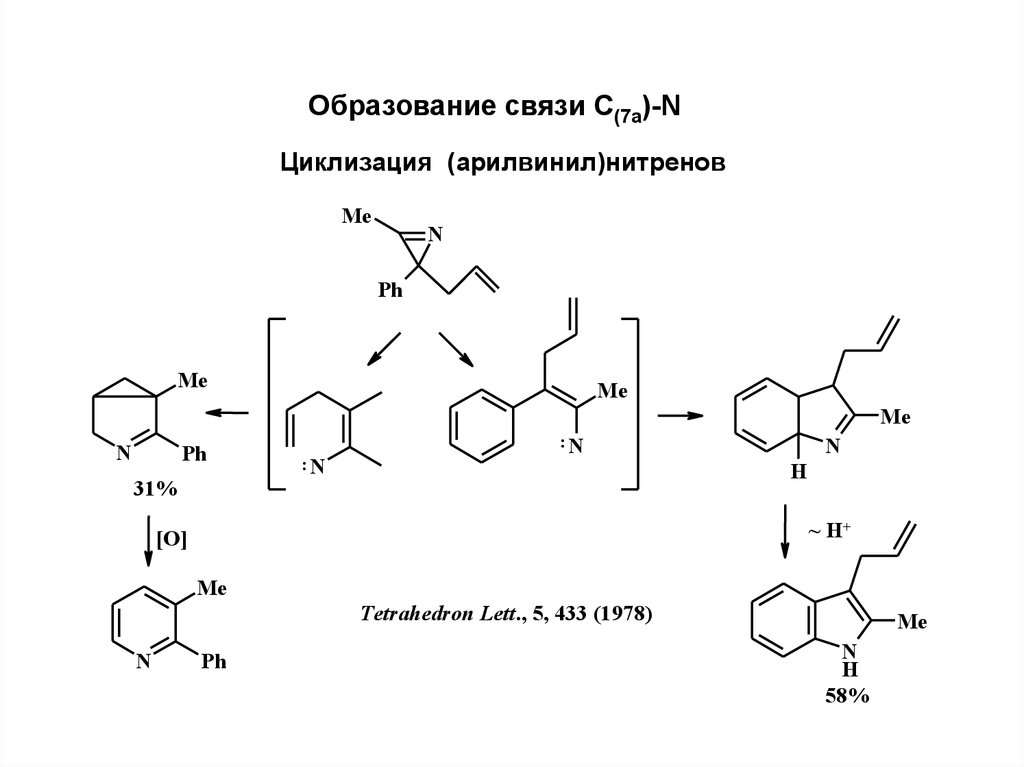
Образование связи С(7а)-NЦиклизация (арилвинил)нитренов
Me
N
Ph
Me
Me
Me
N
Ph
31%
:N
:N
N
H
~ H+
[O]
Me
Tetrahedron Lett., 5, 433 (1978)
N
Ph
Me
N
H
58%
24.
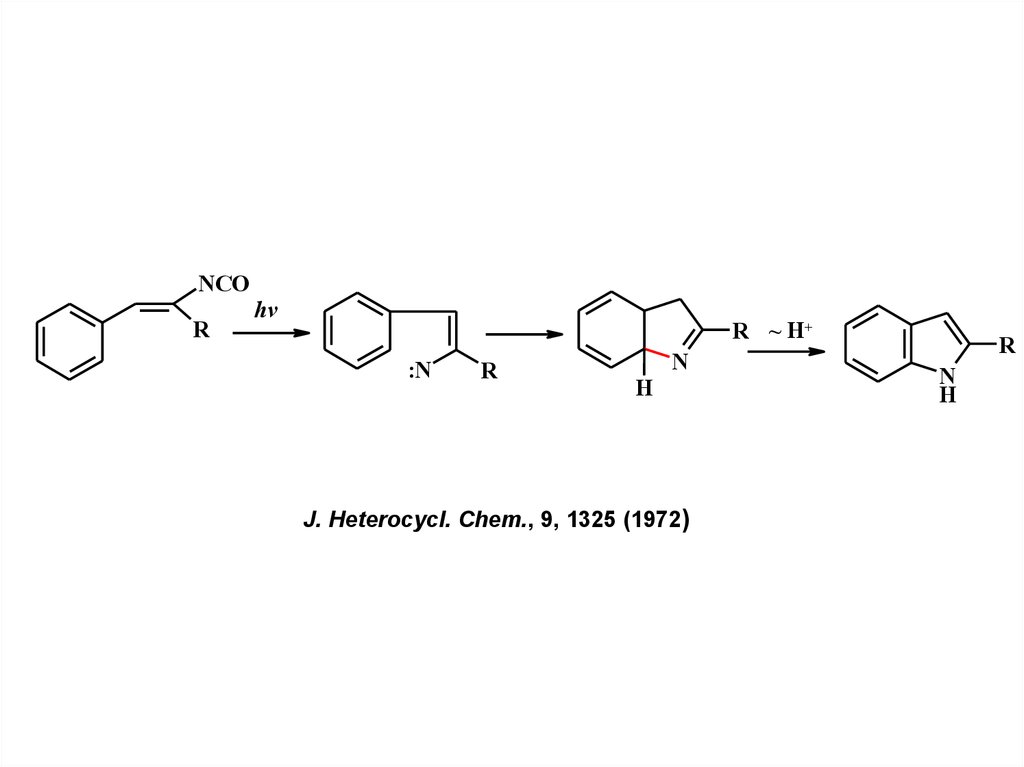
NCOR
hv
R ~ H+
:N
R
N
H
J. Heterocycl. Chem., 9, 1325 (1972)
R
N
H
25.
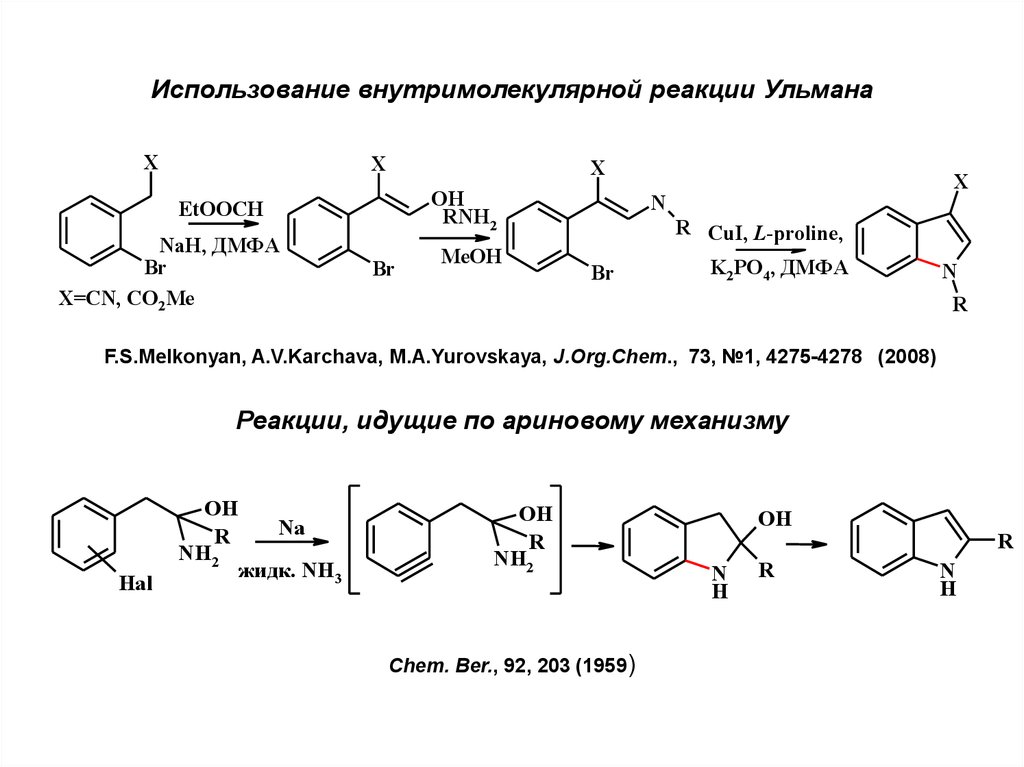
Использование внутримолекулярной реакции УльманаX
X
X
OH
RNH2
EtOOCH
NaH, ДМФА
Br
X=CN, CO2Me
Br
MeOH
X
N
R CuI, L-proline,
Br
K2PO4, ДМФА
N
R
F.S.Melkonyan, A.V.Karchava, M.A.Yurovskaya, J.Org.Chem., 73, №1, 4275-4278 (2008)
Реакции, идущие по ариновому механизму
OH
R
NH2
Hal
Na
жидк. NH3
OH
R
NH2
Chem. Ber., 92, 203 (1959)
OH
N
H
R
R
N
H
26.
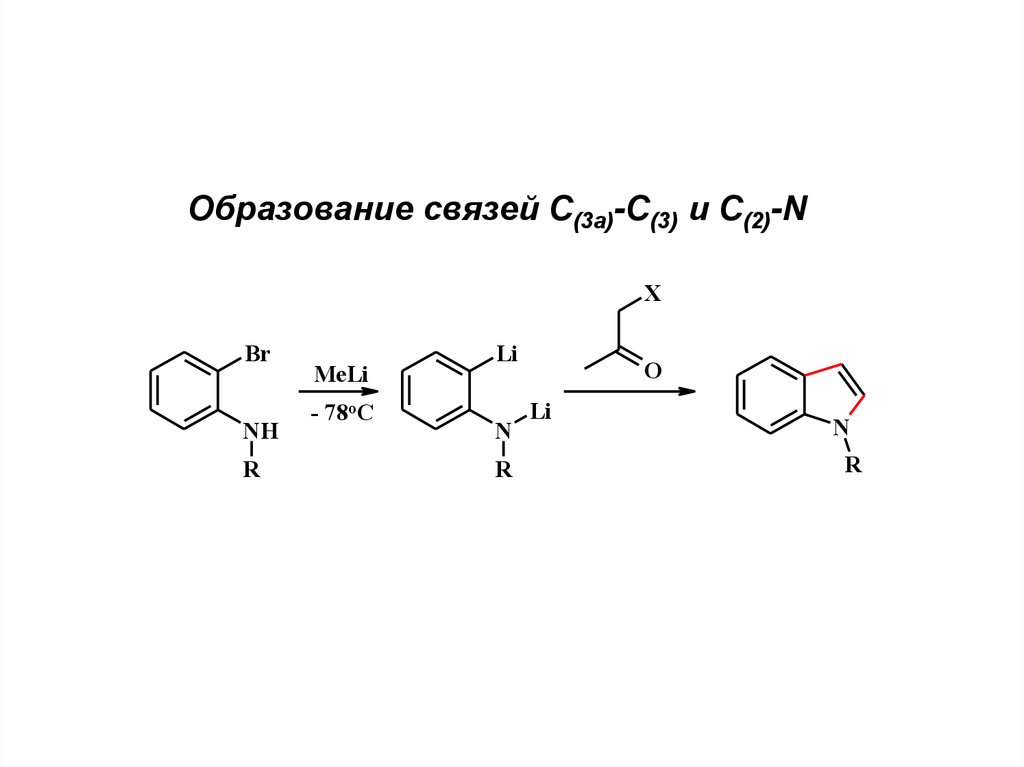
Образование связей С(3а)-С(3) и С(2)-NX
Br
NH
R
MeLi
- 78oC
Li
N
R
O
Li
N
R
 Химия
Химия