Похожие презентации:
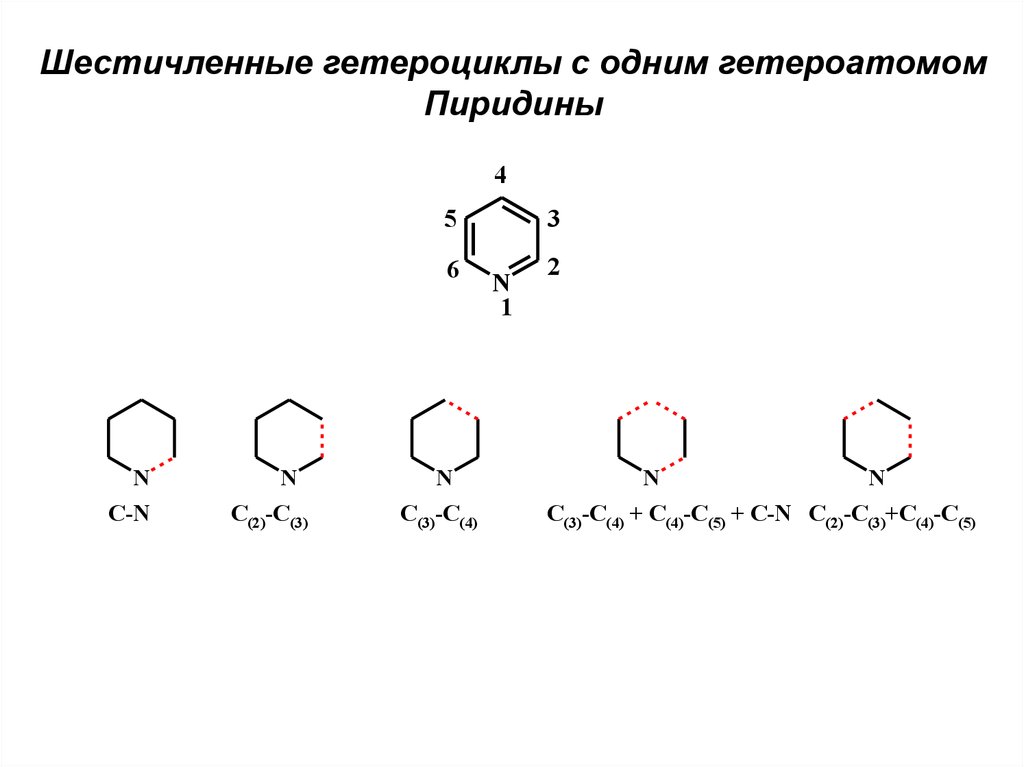
Шестичленные гетероциклы с одним гетероатомом. Пиридины
1.
Шестичленные гетероциклы с одним гетероатомомПиридины
4
5
6
N
C-N
N
C(2)-C(3)
N
C(3)-C(4)
3
N
1
2
N
N
C(3)-C(4) + C(4)-C(5) + C-N C(2)-C(3)+C(4)-C(5)
2.
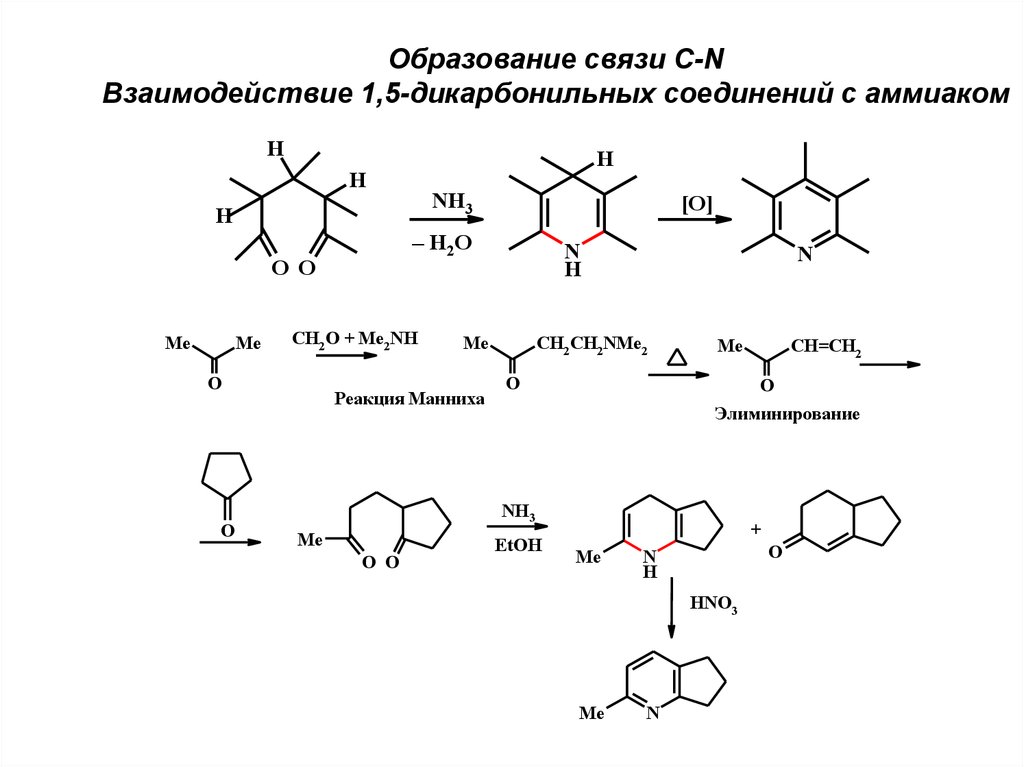
Образование связи C-NВзаимодействие 1,5-дикарбонильных соединений с аммиаком
H
H
H
NH3
H
– H2O
O O
Me
Me
CH2 O + Me2NH
O
O
[O]
N
H
Me
Реакция Манниха
N
CH2 CH2NMe2
Me
O
O
Элиминирование
NH3
Me
O O
CH=CH2
EtOH
+
Me
O
N
H
HNO3
Me
N
3.
NH2OH. HClMe
– H2 O
Me
N
O O
OH
Bu
OEt
O
Bu
Me
Гетеро-реакция
Дильса-Альдера
Bu
O
O
H
Bu
NH2OH·HCl
Me
AcOH/H2O
O
OEt
47%
EtOH,
Me
N
80%
гидрохинон
+
Me
Me
N
SeO2
HO2 C
Bu
N
фузариновая
кислота
4.
SMeSMe
SMe
O
N
+
O
t-BuOK
Me
N
ТГФ, 20°С
SMe
NH4 OAc, AcOH
N
N
79%
N
Org. Synth., 64, 189 (1986)
N
O O
79%
N
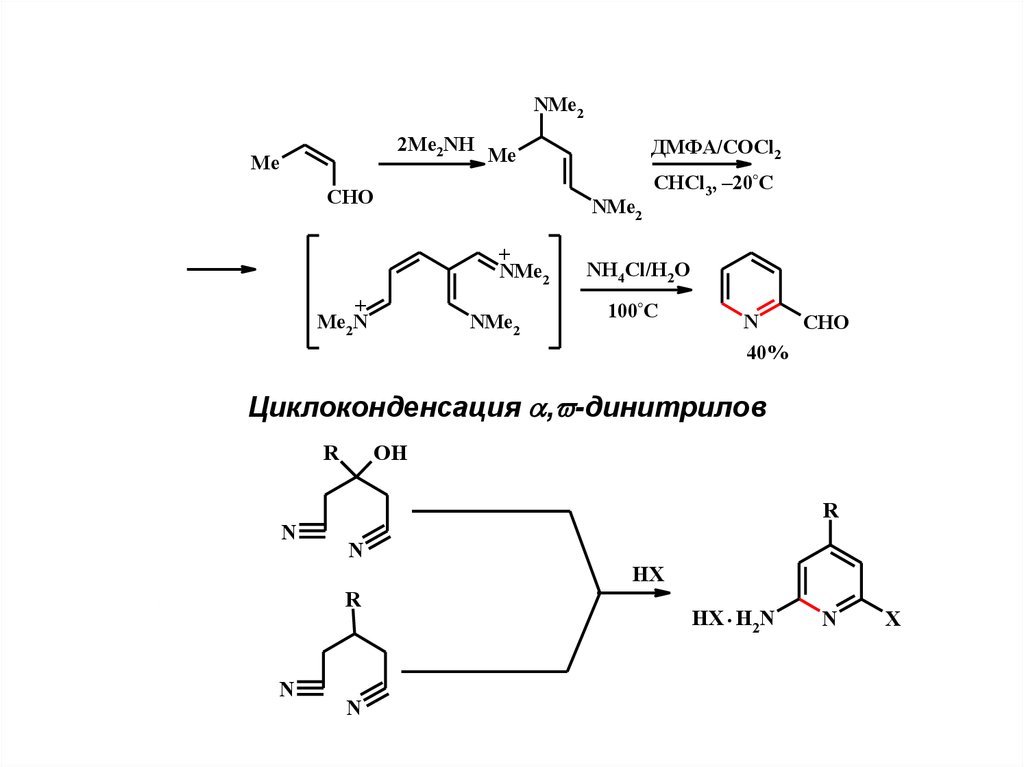
5.
NMe22Me2NH
Me
ДМФА/COCl2
Me
CHO
NMe2
+
NMe2
+
Me2N
NMe2
CHCl3, –20°C
NH4Cl/H2O
100°C
N
CHO
40%
Циклоконденсация , -динитрилов
R
N
OH
R
N
R
N
N
HX
HX . H2N
N
X
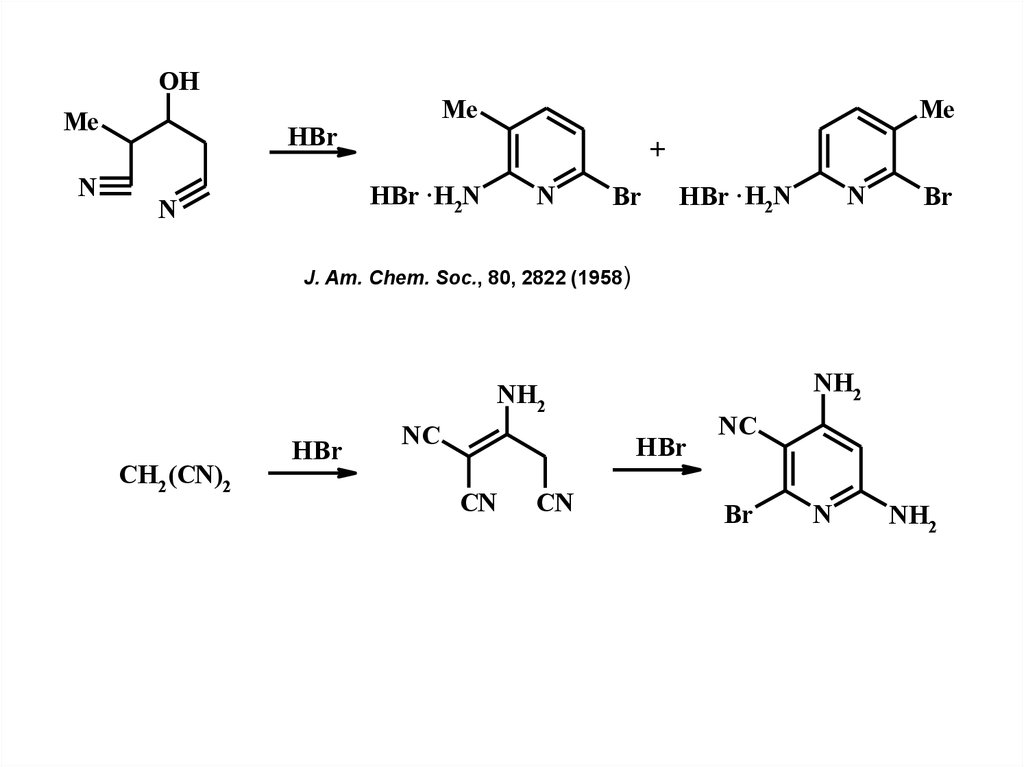
6.
OHMe
N
Me
HBr
Me
+
HBr ·H2N
N
N
Br
HBr · H2N
N
Br
J. Am. Chem. Soc., 80, 2822 (1958)
NH2
NH2
CH2(CN)2
HBr
NC
HBr
CN
CN
NC
Br
N
NH2
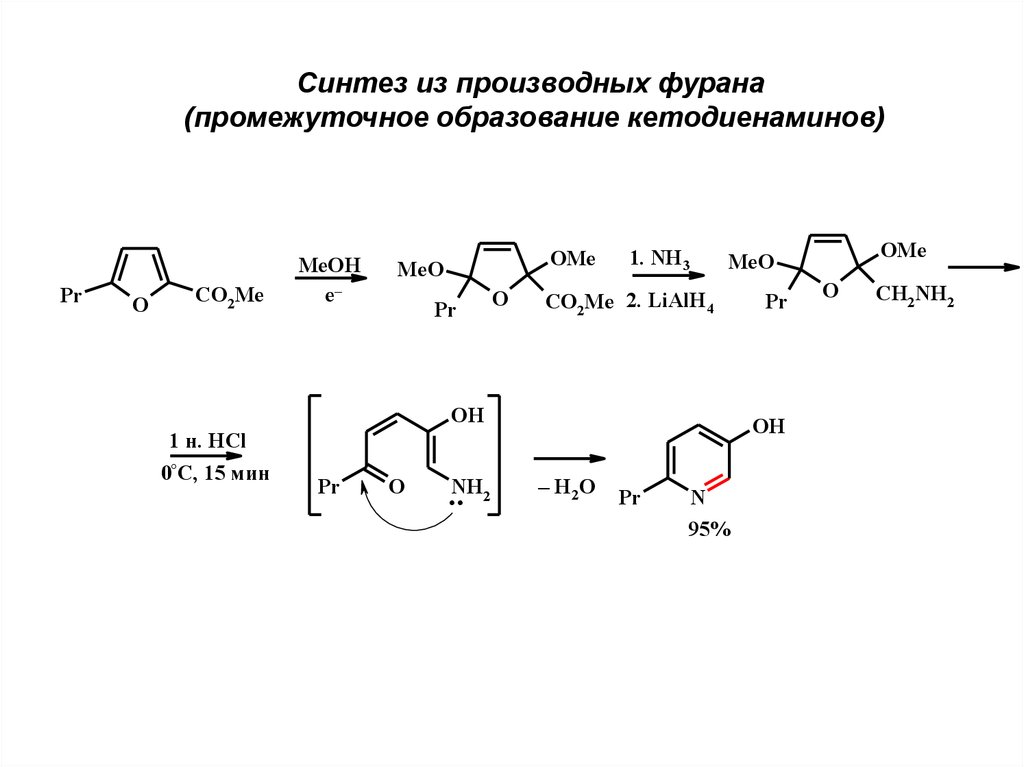
7.
Синтез из производных фурана(промежуточное образование кетодиенаминов)
Pr
O
CO2Me
MeOH
e–
OMe
MeO
Pr
O
1. NH3
CO2Me 2. LiAlH4
OH
1 н. HCl
0°C, 15 мин
Pr
O
..NH2
Pr
OH
– H2 O
Pr
OMe
MeO
N
95%
O
CH2NH2
8.
Реакция КрёнкеОригинальный метод получения кетодиенаминов из α-пиридинийметилкетона
с α,β-непредельными кетонами
O
1
R
2
1
R
R
O
+
N
NH4 OAc, AcOH
2
R
R
N
R
BrO
OH
R
R
1
1
R
BrR
2
+
N
Br-
O
R
2
+
N
O
NH3
1
R
H
-Py
Присоединение по Михаэлю
енольной формы (С-нуклеофил)
пиридинового кетона к непредельному кетону
1
R
1
R
R
2
NH2 O
R
R
N
R
2
R
R
O O
2
9.
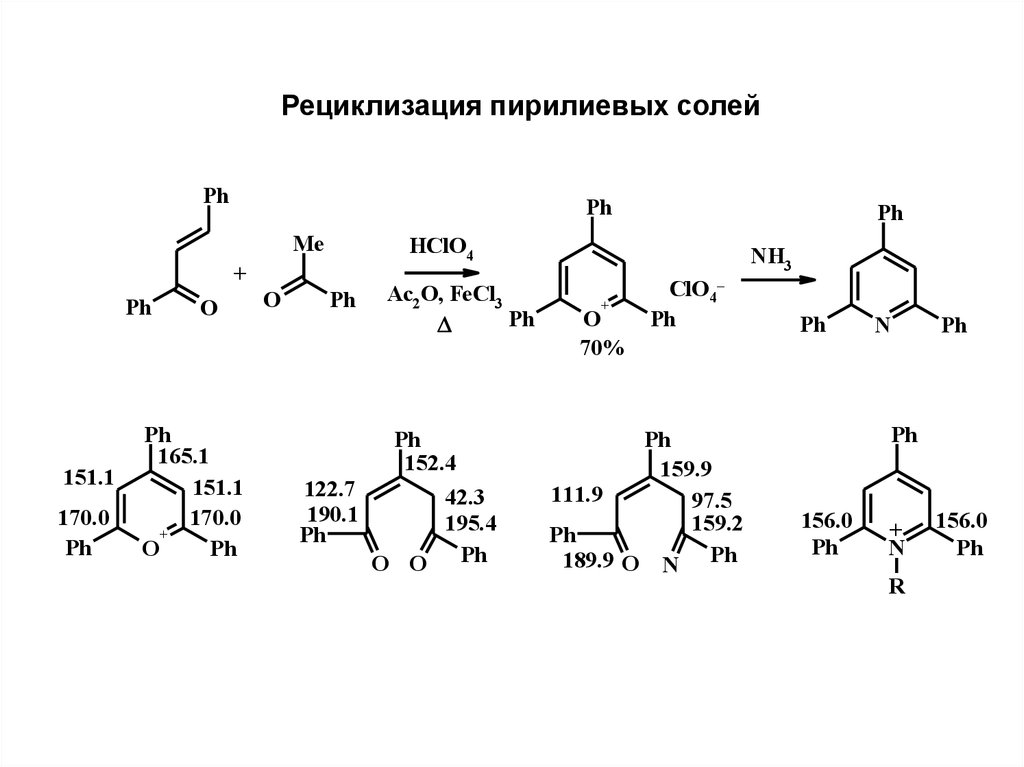
Рециклизация пирилиевых солейPh
Ph
Me
HClO4
+
Ph
151.1
170.0
Ph
O
Ph
165.1
151.1
170.0
+
O
Ph
O
Ph
Ph
Ac2 O, FeCl3
Ph
Ph
152.4
122.7
190.1
Ph
42.3
195.4
O O Ph
NH3
+
O
70%
ClO4–
Ph
Ph
159.9
111.9
97.5
159.2
Ph
189.9 O N Ph
Ph
N
Ph
Ph
156.0
Ph
+
N
R
156.0
Ph
10.
ANRORC-механизмPh
Ph
Ph
RNH2
Ph
O
+
Ph
– H+
быстро
Ph
быстро Ph
Ph
O
NHR
AN
Addition Nucleophtlic
O HN Ph
R
RO
Ring Oppening
медленно
RNH2
Ph
очень медленно
Ph
Ph
Ph
O O
быстро
Ph
Ph
+
N
– H 2O
Ph + H+
R
Tetrahedron, 43, 5171 (1987)
Ph
HO
N
Ph
R
RC
Ring Closure
11.
Образование связи С(2)-С(3)Синтез пиридинов по реакции Дильса-Альдера
1,3-бутадиенов с нитрилами
R
N
N
R
– H2
N
R
Синтез пиридонов электроциклической термической
циклизацией 1,3-диенацилазидов и изоцианатов
CH3 CH=CHCH=CHCO2 H
1. SOCl2
[CH3 CH=CHCH=CHCON3]
2. Me3SiN3
толуол, 20 ч
CH3 CH=CHCH=CHN=C=O
R
R
H
H
N C=O
N
R
~ H+
O
J. Org. Chem., 38, 2982 (1973)
N
H
O
12.
OHPhCH2CHC
C-t-Bu +
N CN
N
O
NH
C
PhCH2CH
t-Bu
Ph
NHC
N
O
J. Am. Chem. Soc., 102, 747 (1980)
Ph
t-Bu
_
Ph
HN
H
N
N
H
t-Bu
N
C
O
O
Ph
H
t-Bu
N
O
~
Ph
H+
t-Bu
N
H
79%
O
C-t-Bu
13.
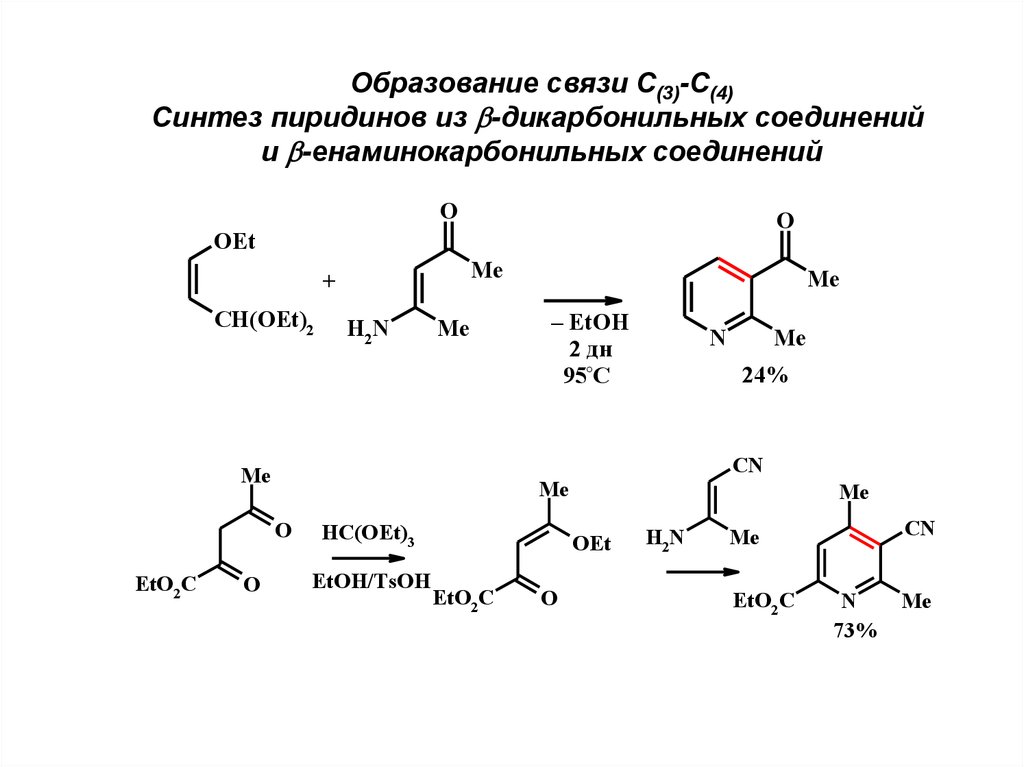
Образование связи С(3)-С(4)Синтез пиридинов из -дикарбонильных соединений
и -енаминокарбонильных соединений
O
O
OEt
Me
+
CH(OEt)2
H2N
Me
Me
O
– EtOH
2 дн
95°C
N
HC(OEt)3
EtOH/TsOH
CN
Me
OEt
EtO2 C
O
Me
24%
Me
O
EtO2 C
Me
H2N
CN
Me
EtO2 C
N
73%
Me
14.
CO2 Et+
Et
O
H2N
CO2 Et
AcOH
Me
Et
N
Me
Синтез пиридонов-2 из -дикарбонильных соединений
и цианацетамида (синтез Гуареши).
Синтез пиридоксина (виамина В6)
CO2Me
CO2Me
CN
O
Me
O
+
H2N
O
EtOH
пиперидин
Me
60°C
CO2Me
H2SO4
Me
CN
N
O
H
80%
CO2Me
H2, Pd/C
POCl3
N
O
H
85%
CO2Me
Me
N
Cl
70%
AcOK
Me
N
15.
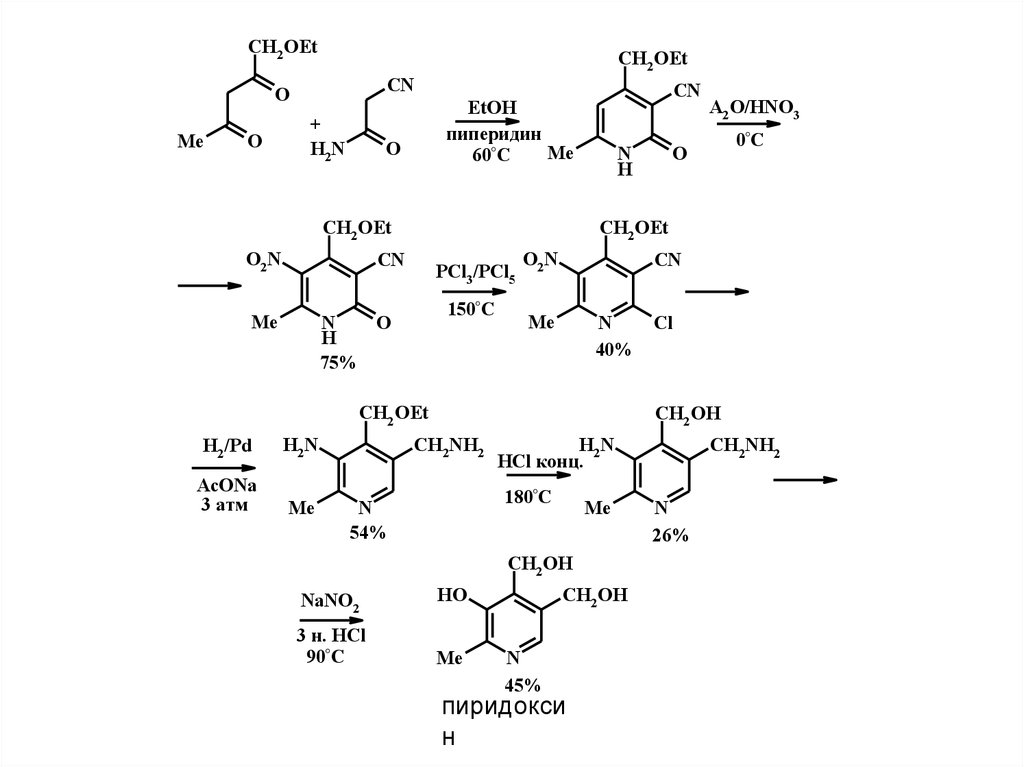
CH2 OEtCH2 OEt
CN
O
Me
O
+
H2N
O
CH2 OEt
O2N
N
H
PCl3 /PCl5
150°C
N
O
H
75%
O2N
H2N
AcONa
3 атм
Me
Me
N
40%
Cl
H2N
HCl конц.
180°C
N
54%
Me
CH2 OH
3 н. HCl
90°C
O
CH2 OH
CH2NH2
NaNO2
0°C
CN
CH2 OEt
H2 /Pd
A2 O/HNO3
CH2 OEt
CN
Me
CN
EtOH
пиперидин
Me
60°C
HO
Me
CH2 OH
N
45%
пиридокси
н
CH2NH2
N
26%
16.
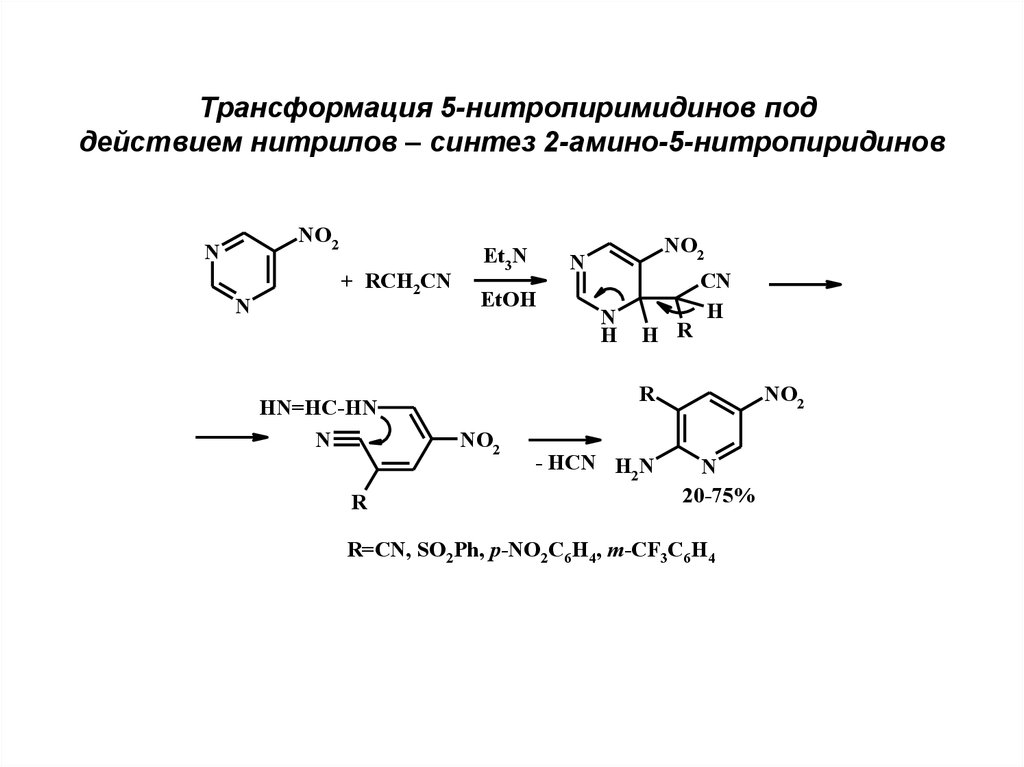
Трансформация 5-нитропиримидинов поддействием нитрилов – синтез 2-амино-5-нитропиридинов
NO2
N
N
+ RCH2CN
HN=HC-HN
N
R
Et3N
NO2
N
EtOH
N
H
H R
CN
H
R
NO2
- HCN H N
2
NO2
N
20-75%
R=CN, SO2Ph, p-NO2C6H4, m-CF3C6H4
17.
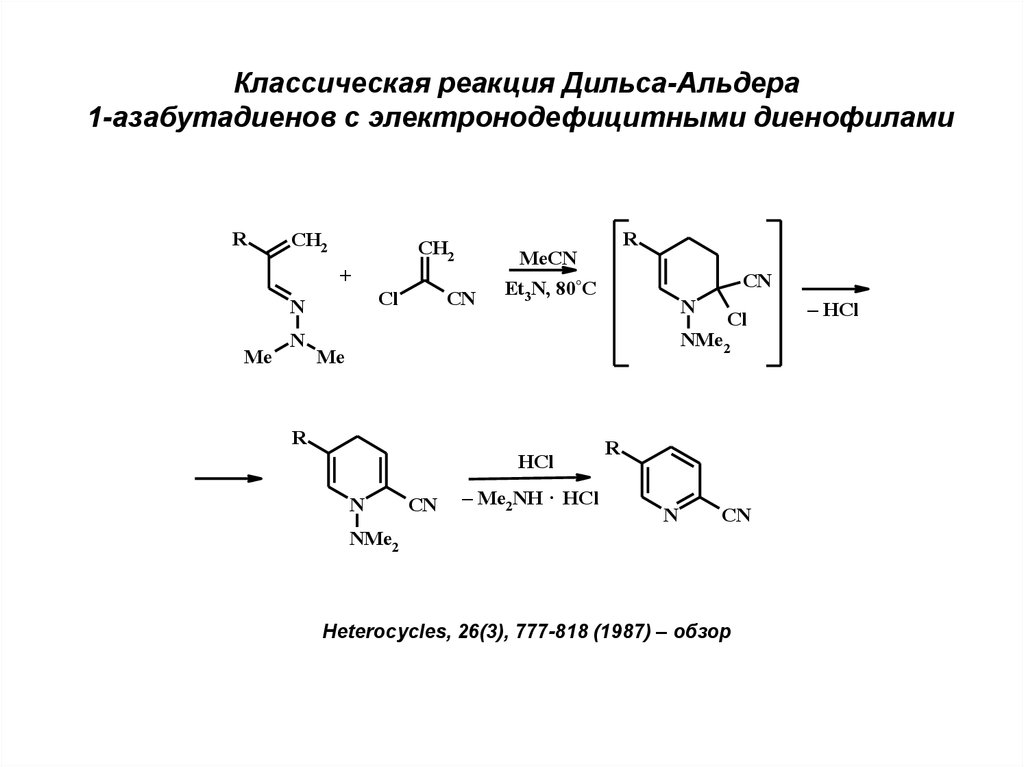
Классическая реакция Дильса-Альдера1-азабутадиенов с электронодефицитными диенофилами
R
CH2
CH2
+
Cl
N
Me
N
R
MeCN
CN
CN
Et3N, 80°C
N
Cl
NMe2
Me
R
HCl
N
CN
– Me2NH · HCl
R
N
CN
NMe2
Heterocycles, 26(3), 777-818 (1987) – обзор
– HCl
18.
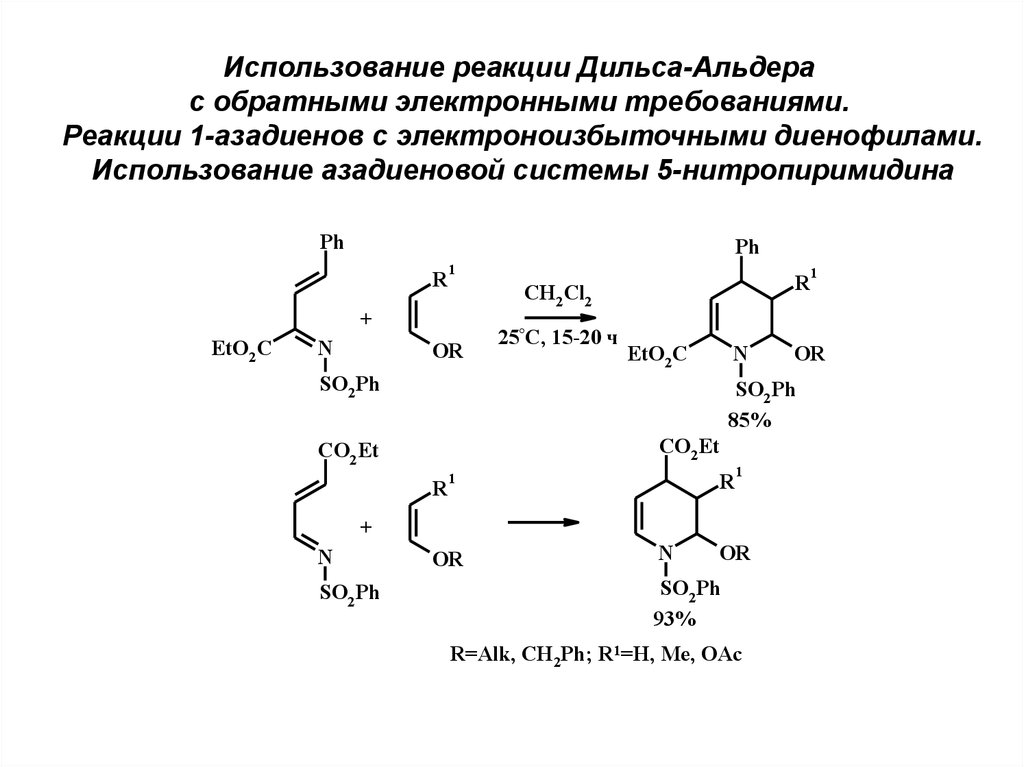
Использование реакции Дильса-Альдерас обратными электронными требованиями.
Реакции 1-азадиенов с электроноизбыточными диенофилами.
Использование азадиеновой системы 5-нитропиримидина
Ph
Ph
R
1
CH2 Cl2
+
EtO2 C
N
R
OR
25°C, 15-20 ч
EtO2 C
N
SO2 Ph
CO2 Et
R
R
1
1
+
N
SO2 Ph
OR
SO2 Ph
85%
CO2 Et
OR
N
OR
SO2 Ph
93%
R=Alk, CH2Ph; R1=H, Me, OAc
1
19.
PhPh
Ph
R
бензол
24-28 ч,
+
NC
R
N
Ac
+
NC
N
R = Ph
OEt
CO2Et
R
Ac
13%
69%
0%
NC
N
Ac
79%
0%
92%
Использование 1-азадиеновая системы 5-нитропиримидина
4
N
5
N
1
NO2
Ph
+
6
H2N
2
NH2
3
H2N
NH2
1
N
Ph
N 4
6
5
NO2
NH2
– NH3
N
N
Ph
NO2
– HCN
Ph
H2N
NO2
N
20.
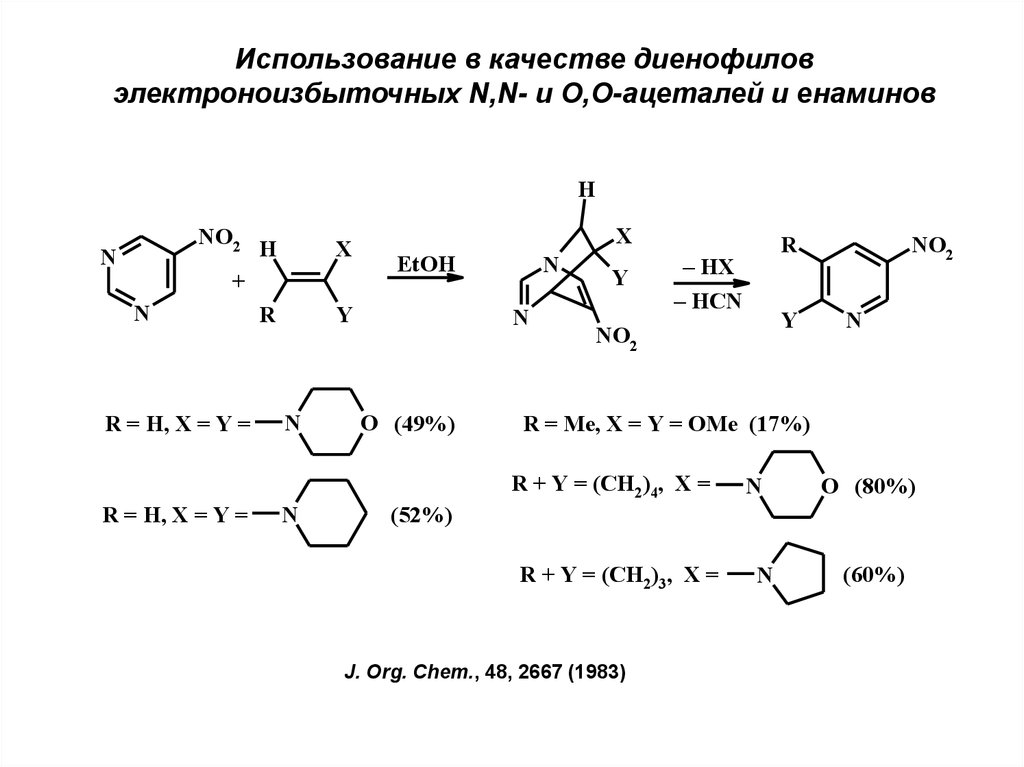
Использование в качестве диенофиловэлектроноизбыточных N,N- и О,О-ацеталей и енаминов
H
NO2
N
H
X
+
N
R = H, X = Y =
R
X
EtOH
Y
N
N
N
O (49%)
Y
– HX
– HCN
N
Y
NO2
NO2
N
R = Me, X = Y = OMe (17%)
R + Y = (CH2)4, X =
R = H, X = Y =
R
N
O (80%)
(52%)
R + Y = (CH2)3, X =
J. Org. Chem., 48, 2667 (1983)
N
(60%)
21.
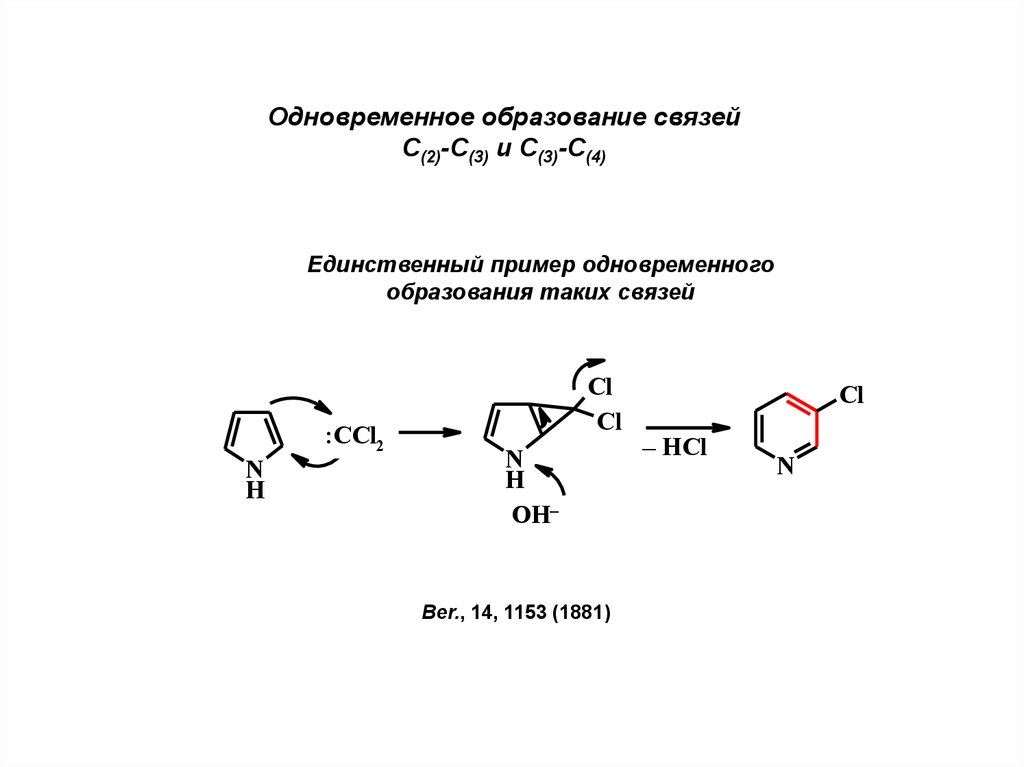
Одновременное образование связейС(2)-С(3) и С(3)-С(4)
Единственный пример одновременного
образования таких связей
:CCl2
N
H
Cl
Cl
N
H
OH–
Ber., 14, 1153 (1881)
Cl
– HCl
N
22.
Одновременное образование связей С(2)-С(3) и С(4)-С(5)Диеновый синтез с использованием 2-азабутадиенов
CO2Me
MeO2 C
CO2Me
CO2Me
Me
N
CO2Me
CO2Me
Me
– Me2NH
CO2Me
Me
N
CO2Me
N
NMe2
CO2Me
CO2Me
O
Me
N
H
O
Me
O
NH
O
23.
Использование 2-азадиеновой системы 1,2,4-триазинаN
CO2Me
N
+
NR2
SO2Me
N
Ar
CO2Me
ТГФ, 66°С, 24 ч
– N2, – R2NH
Ar
N
~ 50%
SO2Me
Использование 2-азадиеновой системы 1,3-оксазин-6-она
Ph
N
R
O
Y
X
X
– CO2
+
O
Y
X
Y
+
Ph
N
R = H, Me, Ph, CO2Et
R
Ph
N
R
24.
Использование 2-азадиеновой системы 2-(1Н)-пиразинонаR
R
2
N
R
R
R
N
4
R
O 3
R
R
R
1
4
R
– RNCO
4
N
O
R
2
N
R
R
2
N
3
R
1
R
4
R
3
1
3
R
1
– R2CN
R
R
R
R
2
4
3
N
O
R
R
N
3
N
R
R
2
N
4
R
1
R
3
R
1
4
R
N
R
1
O
R
O
25.
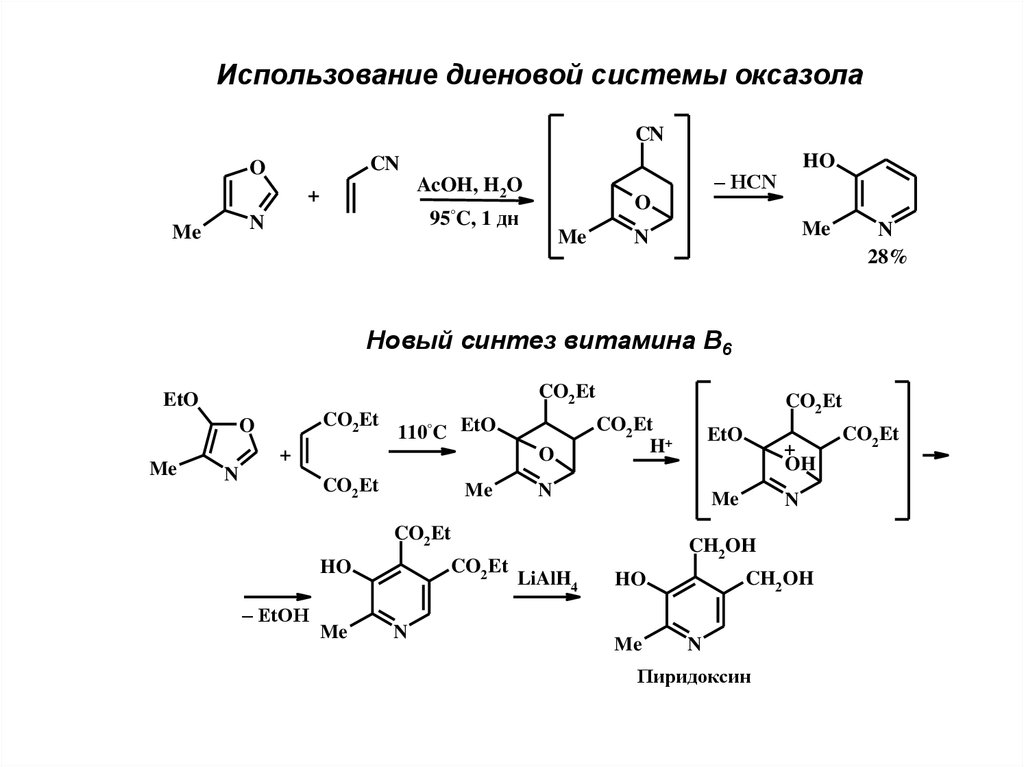
Использование диеновой системы оксазолаCN
CN
O
O
95°C, 1 дн
N
Me
– HCN
AcOH, H2O
+
HO
Me
Me
N
N
28%
Новый синтез витамина В6
CO2 Et
EtO
CO2 Et
O
Me
110°C EtO
O
+
N
CO2 Et
Me
CO2 Et
CO2 Et
H+
N
CO2 Et
– EtOH
Me
N
+
OH
Me
CO2 Et
HO
EtO
N
CH2 OH
LiAlH4
CH2 OH
HO
Me
N
Пиридоксин
CO2 Et
26.
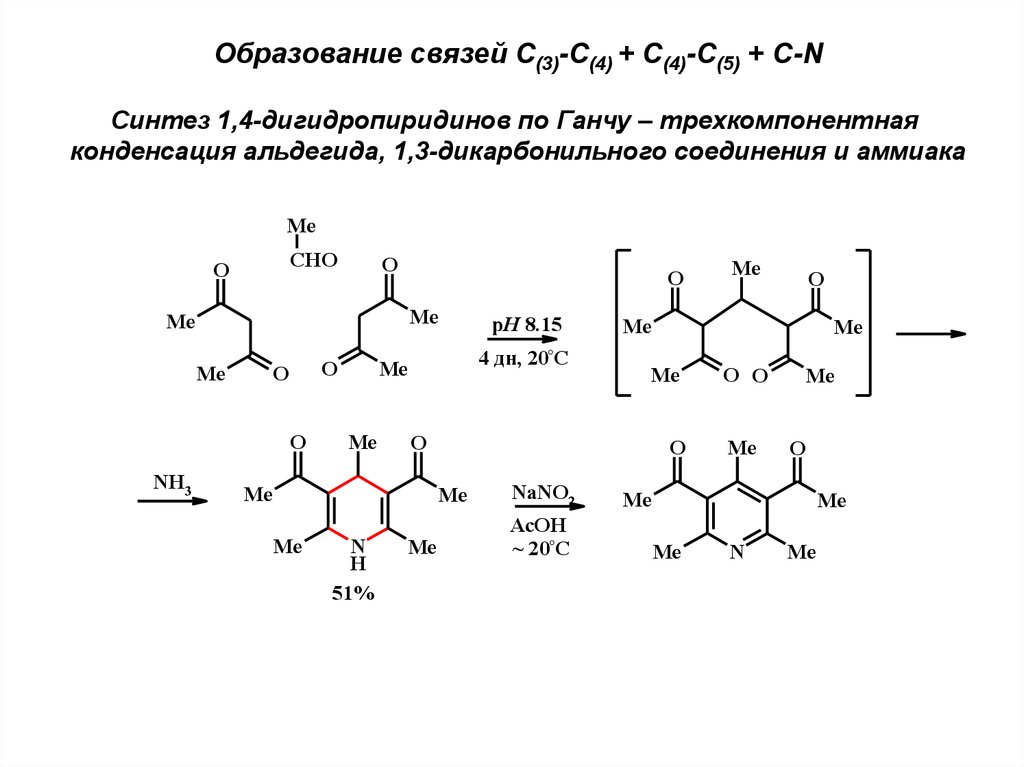
Образование связей С(3)-С(4) + С(4)-С(5) + С-NСинтез 1,4-дигидропиридинов по Ганчу – трехкомпонентная
конденсация альдегида, 1,3-дикарбонильного соединения и аммиака
Me
CHO
O
O
O
Me
Me
Me
O
O
NH3
4 дн, 20°C
Me
O
Me
N
H
51%
Me
Me
Me
O
Me
NaNO2
AcOH
~ 20°C
O
Me
O
Me
Me
pH 8.15
Me
O O
Me
Me
O
Me
Me
Me
N
Me
27.
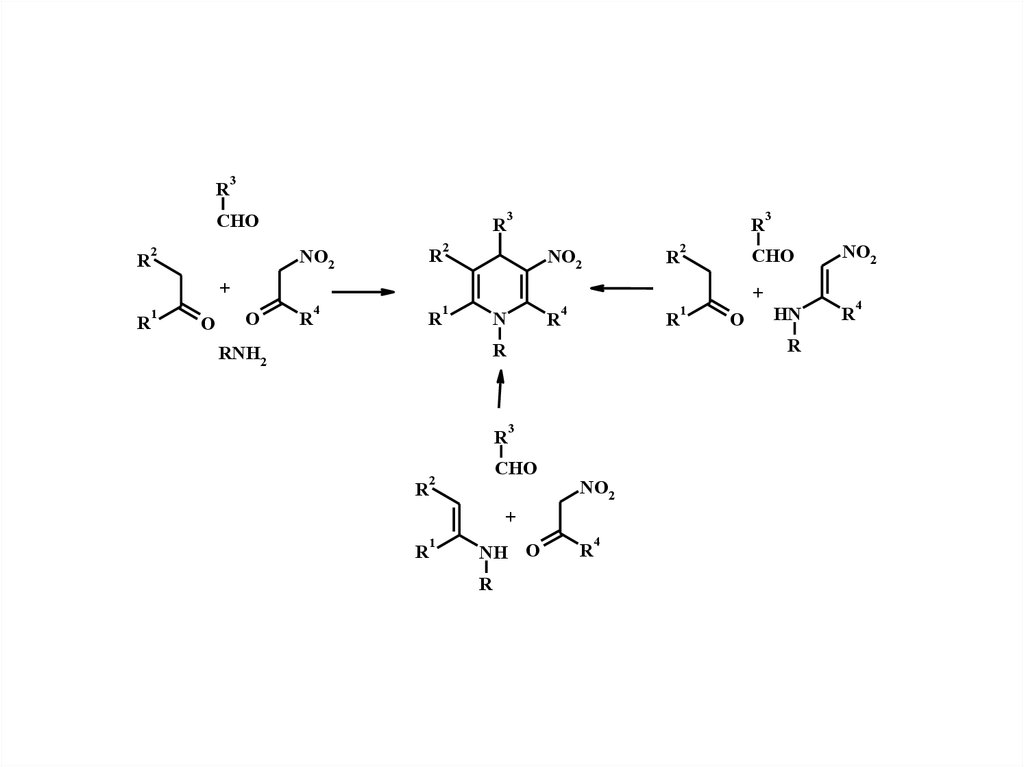
R3
CHO
R
2
R
NO2
3
R
2
NO2
1
4
R
R
2
R
1
CHO
+
R
1
O
3
NO2
+
O
R
4
R
N
R
R
R
3
CHO
2
NO2
+
R
1
NH O
R
HN
R
R
RNH2
O
R
4
R
4
28.
OO
Me
H2N
NH3
Ph
CO2Me
MeO2 C
Me
Me
Me
O
Ph
медленно
Ph
CO2Me
MeO2 C
CO2Me
Me
Me
N
H
NH2 O
CO2Me
Ph
MeO2 C
Me
CO2Me
OH
Me
Tetrahedron, 43, 5171 (1987)
N
H
Me
Me
29.
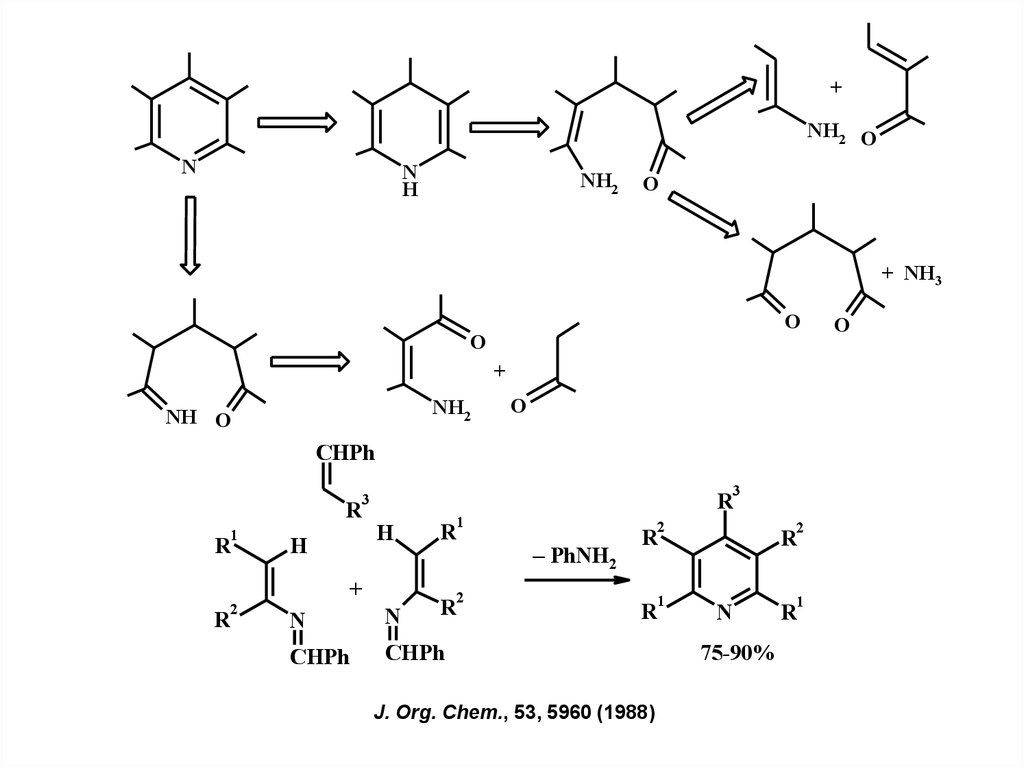
+NH2 O
N
N
H
NH2
O
+ NH3
O
O
+
NH2
NH O
O
CHPh
3
R
3
R
R
1
2
R
H
H
+
1
R
2
R
N
N
CHPh
CHPh
2
– PhNH2
R
R
J. Org. Chem., 53, 5960 (1988)
1
R
N
75-90%
R
2
1
O












 Химия
Химия