Похожие презентации:
Синтезы с образованием связи С(3)-С(4)
1.
Синтезы с образованием связи С(3)-С(4)C(4)
C(3)
C(2)
C (5)
N
Двухкомпонентный синтез пирролов из фрагментов С(3)-С(2)-N (α-аминокетоны) и С(4)-С(5) (1,3-дикарбонильные соединения). Синтез Кнорра
Me
CO2 Et
O
+
+
NH3Cl-
O
CO2Me
CO2 H
Me
CO2 Et
Me
KOH
H2O
N
H
53%
Me
KOH
1 дн
N
H
60%
N
H
73%
CO2 H
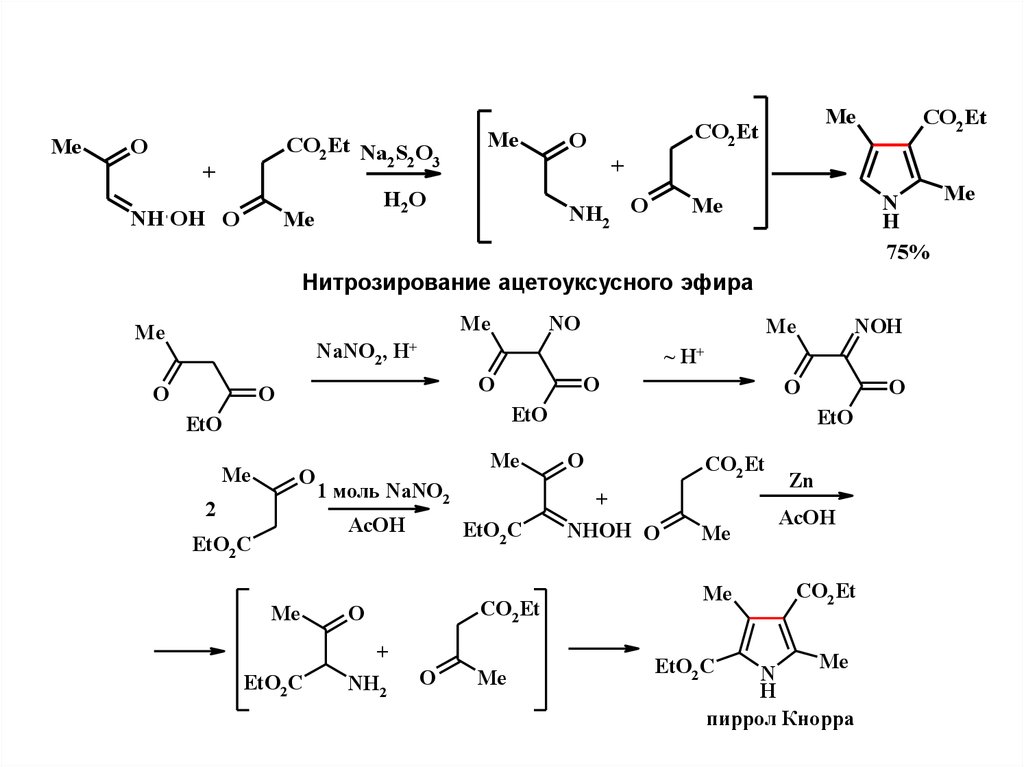
2.
MeCO2 Et Na S O
2 2 3
O
+
NH OH O
Me
O
CO2 Et
+
H2 O
Me
Me
CO2 Et
NH2
O
Me
N
H
75%
Me
Нитрозирование ацетоуксусного эфира
Me
Me
NaNO2 ,
O
Me
NOH
O
O
~ H+
O
O
O
EtO
EtO
Me
NO
H+
O
2
Me
1 моль NaNO2
AcOH
EtO2 C
Me
EtO2 C
EtO2 C
CO2 Et
O
+
NH2
O
Me
EtO
O
CO2 Et
+
NHOH O
Me
Me
Zn
AcOH
CO2 Et
Me
N
H
пиррол Кнорра
EtO2 C
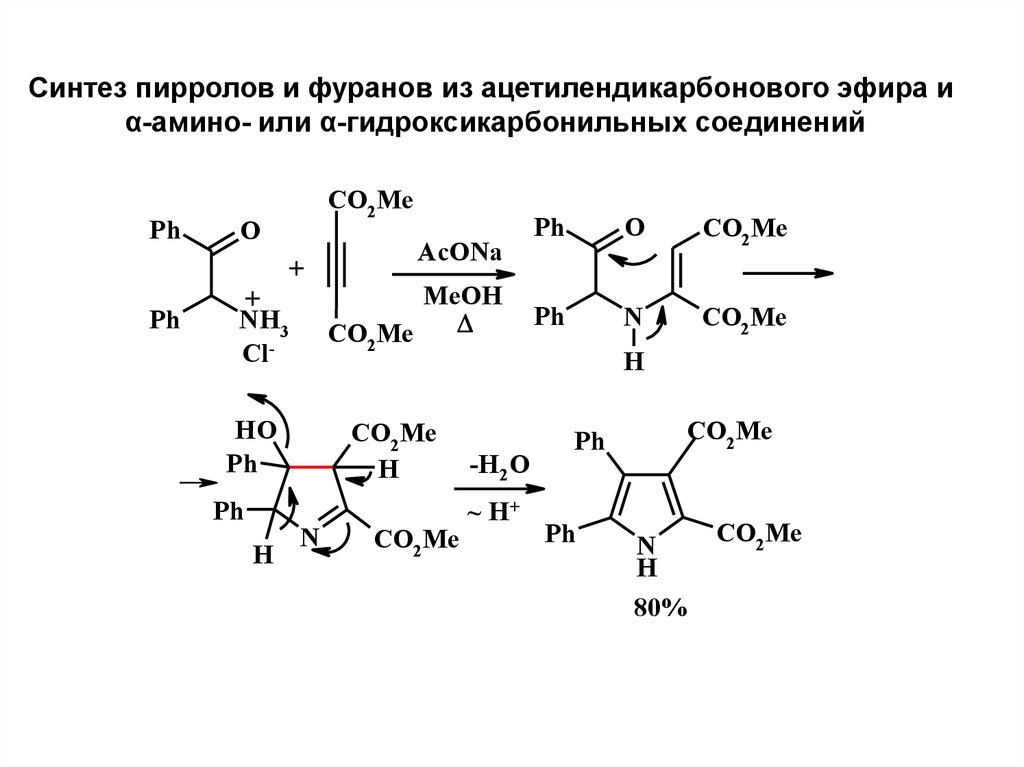
3.
Синтез пирролов и фуранов из ацетилендикарбонового эфира иα-амино- или α-гидроксикарбонильных соединений
Ph
CO2Me
O
+
Ph
+
NH3
ClHO
Ph
Ph
H
AcONa
MeOH
CO2Me
CO2Me
H
N
CO2Me
-H2O
~ H+
Ph
O
CO2Me
Ph
N
CO2Me
H
Ph
Ph
CO2Me
N
H
80%
CO2Me
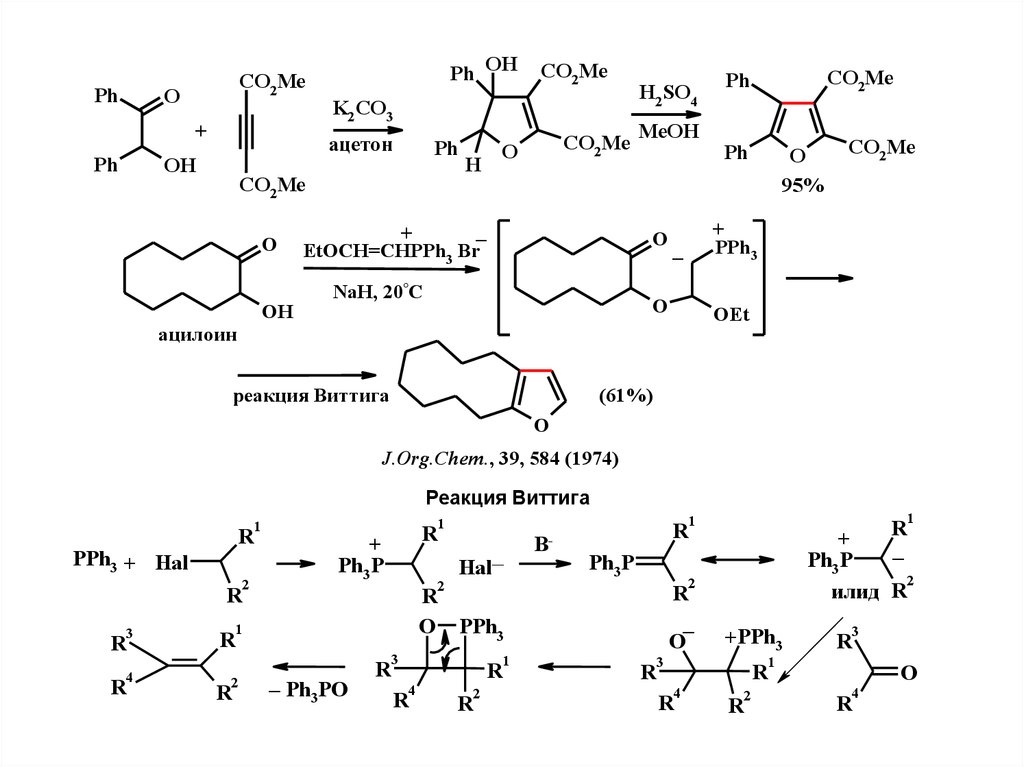
4.
PhCO2Me
O
+
Ph
Ph OH
K2CO3
ацeтон
OH
Ph
CO2Me
O
OH
CO2Me
CO2Me
O
H
_
+
EtOCH=CHPPh3 Br
H2SO4
MeOH
O
NaH, 20°C
CO2Me
Ph
Ph
O
95%
CO2Me
+
PPh3
–
O
OEt
ацилоин
(61%)
реакция Виттига
O
J.Org.Chem., 39, 584 (1974)
Реакция Виттига
1
R
PPh3 + Hal
2
R
+
Ph3 P
2
R
3
R
4
R
1
2
R
Hal–-
B-
3
– Ph3PO
1
R
4
R
R
2
R
R
_
R
Ph3 P
+
Ph3 P
2
илид R
2
R
_
O
R
O PPh3
R
1
1
1
+PPh3
3
3
R
1
R
R
4
R
2
R
O
4
R
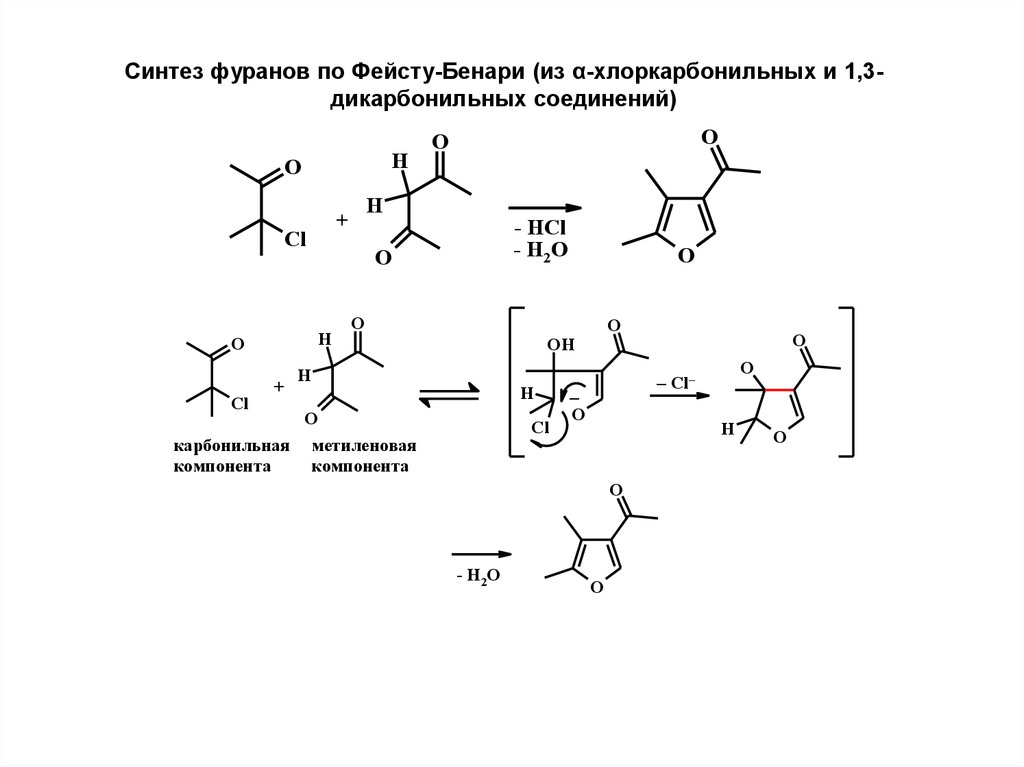
5.
Синтез фуранов по Фейсту-Бенари (из α-хлоркарбонильных и 1,3дикарбонильных соединений)H
O
Cl
+
карбонильная
компонeнта
- HCl
- H2 O
O
H
O
H
+
Cl
O
O
O
O
O
OH
H
H
O
Cl
мeтилeновая
компонeнта
O
– Cl–
_
O
H
O
- H2O
O
O
O
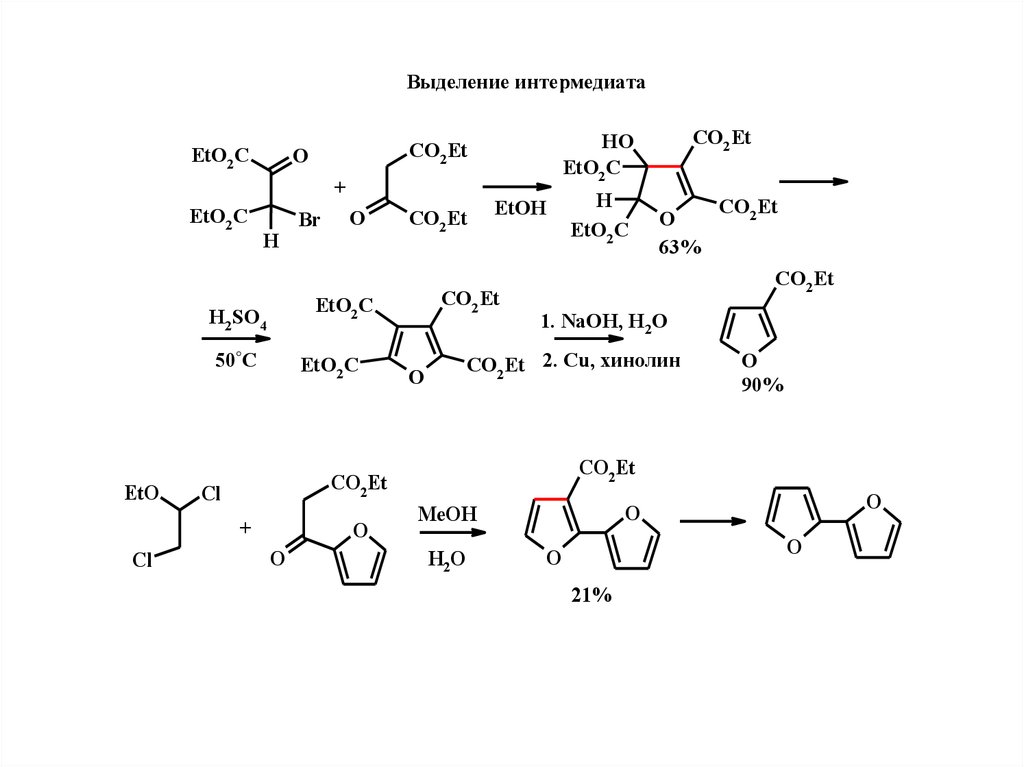
6.
Выдeлeниe интeрмeдиатаEtO2 C
+
EtO2 C
H
50°C
EtO2 C
CO2 Et
EtOH
CO2 Et
Cl
O
O
H
EtO2 C
O
63%
1. NaOH, H2O
CO2 Et 2. Cu, хинолин
O
CO2 Et
CO2 Et
O
90%
CO2 Et
CO2 Et
+
Cl
O
EtO2 C
H2SO4
EtO
Br
CO2 Et
HO
EtO2 C
CO2 Et
O
H2 O
O
O
MeOH
O
O
21%
7.
MeCl
O
+
Me
CO2 Et
O
I-/EtONa/EtOH
NaOH/H2O
CO2 Et
Me
O
Me O
HO
Me
Cl
CO2 Et
O
Me
100-150oC
(CO2 H)2
CO2 Et
Me
Me
O
90%
(Пааль-Кнорр)
Me
CO2 Et
Me
O
10%
(Фeйст-Бeнари)
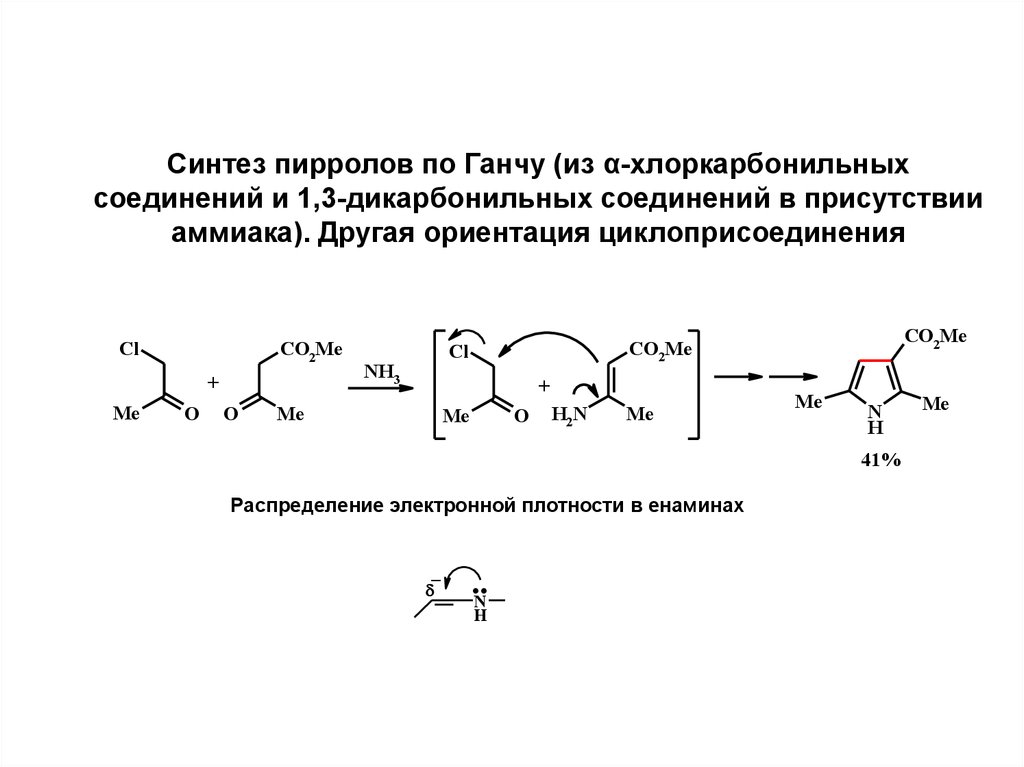
8.
Синтез пирролов по Ганчу (из α-хлоркарбонильныхсоединений и 1,3-дикарбонильных соединений в присутствии
аммиака). Другая ориентация циклоприсоединения
Cl
CO2Me
+
Me
O
O
NH3
+
Me
CO2Me
CO2Me
Cl
Me
O
H2N
Me
Me
N
H
41%
Распределение электронной плотности в енаминах
–
..N
H
Me
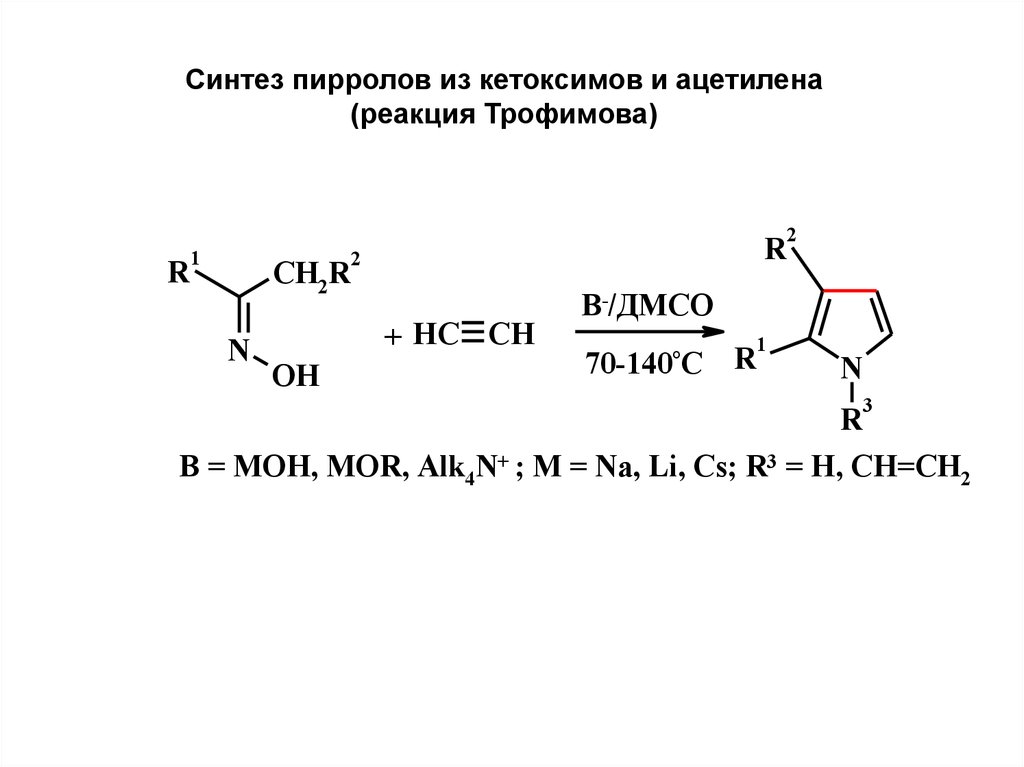
9.
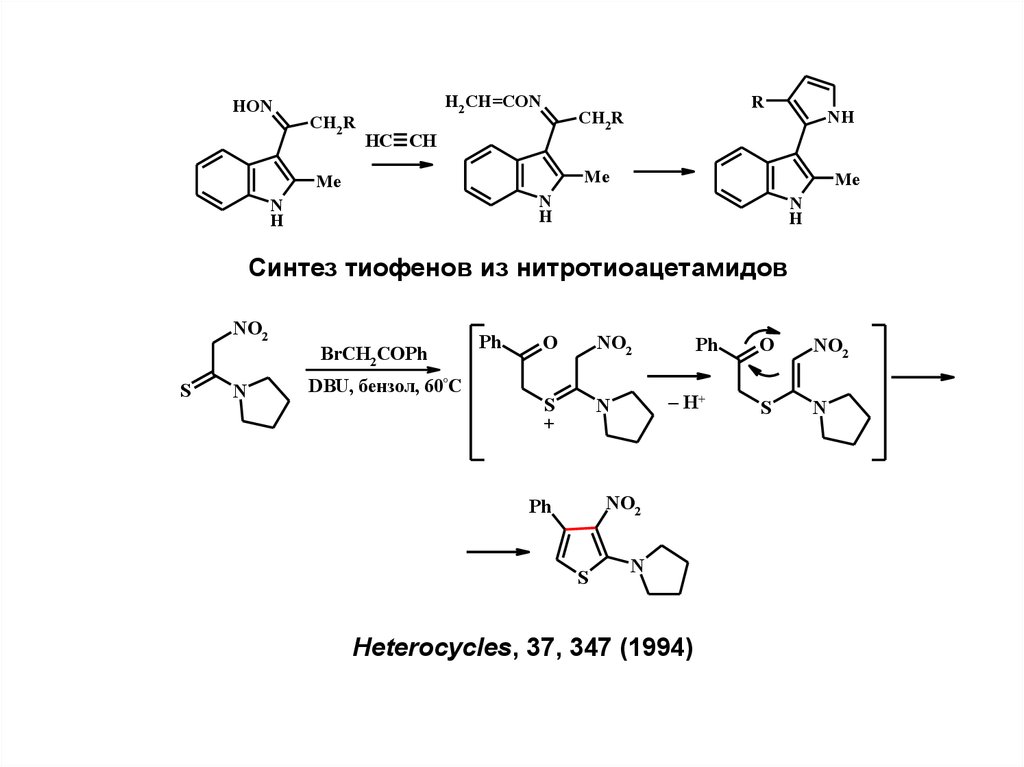
Синтез пирролов из кетоксимов и ацетилена(реакция Трофимова)
2
1
R
2
R
CH2R
N
+ HC CH
OH
B-/ДМСО
70-140°C
1
R
N
3
R
B = MOH, MOR, Alk4N+ ; M = Na, Li, Cs; R3 = H, CH=CH2
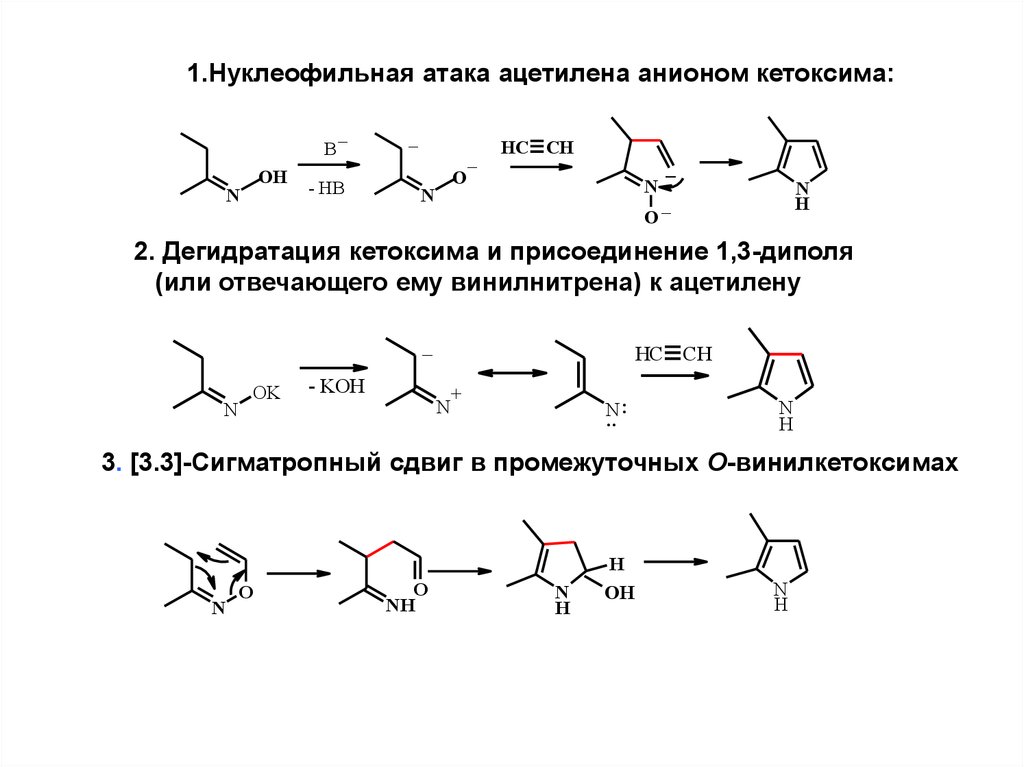
10.
1.Нуклеофильная атака ацетилена анионом кетоксима:B
OH
N
_
- HB
_
N
O
_
HC CH
N
O
_
N
H
_
2. Дегидратация кетоксима и присоединение 1,3-диполя
(или отвечающего ему винилнитрена) к ацетилену
_
N
OK
- KOH
HC CH
+
N
:
N
..
N
H
3. [3.3]-Сигматропный сдвиг в промежуточных О-винилкетоксимах
H
N
O
O
NH
N
H
OH
N
H
11.
HONCH2R
H2 CH=CON
R
CH2R
HC CH
NH
Me
Me
Me
N
H
N
H
N
H
Синтез тиофенов из нитротиоацетамидов
NO2
S
N
BrCH2 COPh
DBU, бензол, 60°C
Ph
O
NO2
S
+
N
Ph
– H+
NO2
Ph
S
N
Heterocycles, 37, 347 (1994)
O
NO2
S
N
12.
Мультикомпонентный синтез аминотиофенов (реакция Гевальда)X
R
1
O
+
R
R
NCCH2 X +
S8
1
X
R
CN
R
1
N
B, EtOH,
R
BH+
2
2
2
S
Sx
S
Реакция Кновенагеля - катализируемая
основаниями конденсация карбонильных
соединений с активными метиленовыми
соединениями
R
- Sx
R
1
X
BH+
2
H
S
R
N
–B
R
1
X
R
1
X
2
H
S
NH
R
R1, R2 = H, Alk, Ar, Het, cycloalkyl
X = CN, CO2Me, CO2Et, COPh, COHet, CONH 2, CSNH2
B = морфолин, пиперидин, Et3N
Chem. Ber., 99, 94 (1966)
2
S
NH2
13.
Образование связи С(2)-С(3)Синтезз пирролов из альдегидов, аминов и нитроалканов
O
R1NH2 + R
2
+ 3
H R
NO2
H
R
R
SmI2
R1NH2 + R
1
2
NR
3
NO2
R
2
N
2
R
R
N
R
2
1
SmI2
3
R
1
H
R
R
2
2
NR
R
R
N–
R
R
N
1
R
O
2
2
1
R
+
3
O
O
R
NH O+
N O
R
2
R
3
O
N
O
H
2
R
R
R
3
R
2
R
N
2
J.Org.Chem., 63, 6234 (1998)
1
R
2
3
2
1
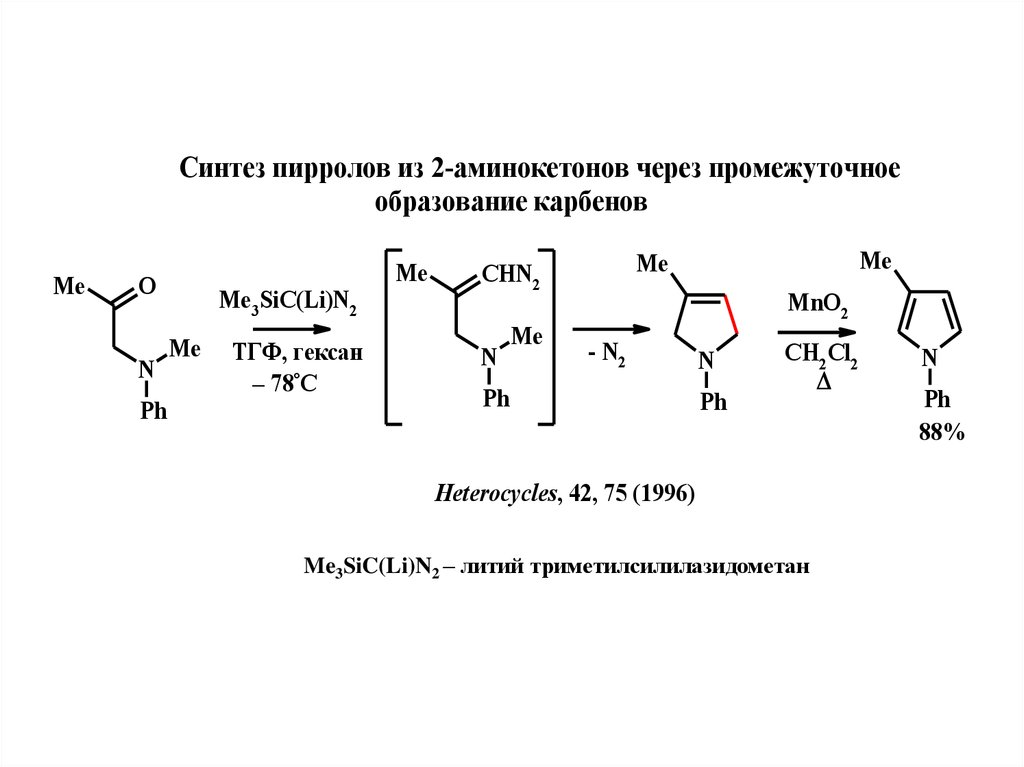
14.
Синтeз пирролов из 2-аминокeтонов чeрeз промeжуточноeобразованиe карбeнов
Me
O
N
Ph
Me3SiC(Li)N2
Me
ТГФ, гeксан
– 78°С
Me
N
Me
Me
Me
CHN2
MnO2
- N2
Ph
N
Ph
CH2Cl2
Heterocycles, 42, 75 (1996)
Me3SiC(Li)N2 – литий триметилсилилазидометан
N
Ph
88%
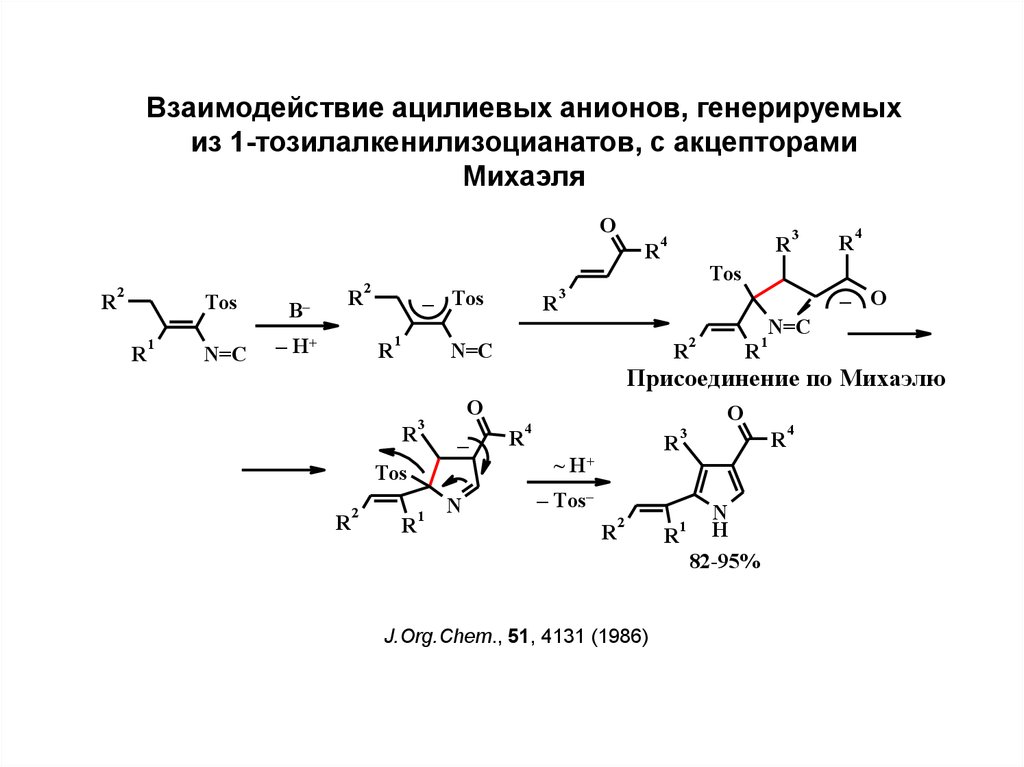
15.
Взаимодействие ацилиевых анионов, генерируемыхиз 1-тозилалкенилизоцианатов, с акцепторами
Михаэля
O
R
R
2
R
1
Tos
B–
N=C
H+
–
R
2
– Tos
R
1
R
R
4
3
R
4
Tos
– O
3
N=C
R
2
R
1
N=C
Присоединение по Михаэлю
R
O
3
–
Tos
R
2
R
1
N
R
O
4
R
~ H+
– Tos–
R
2
J.Org.Chem., 51, 4131 (1986)
3
N
H
R
82-95%
1
R
4
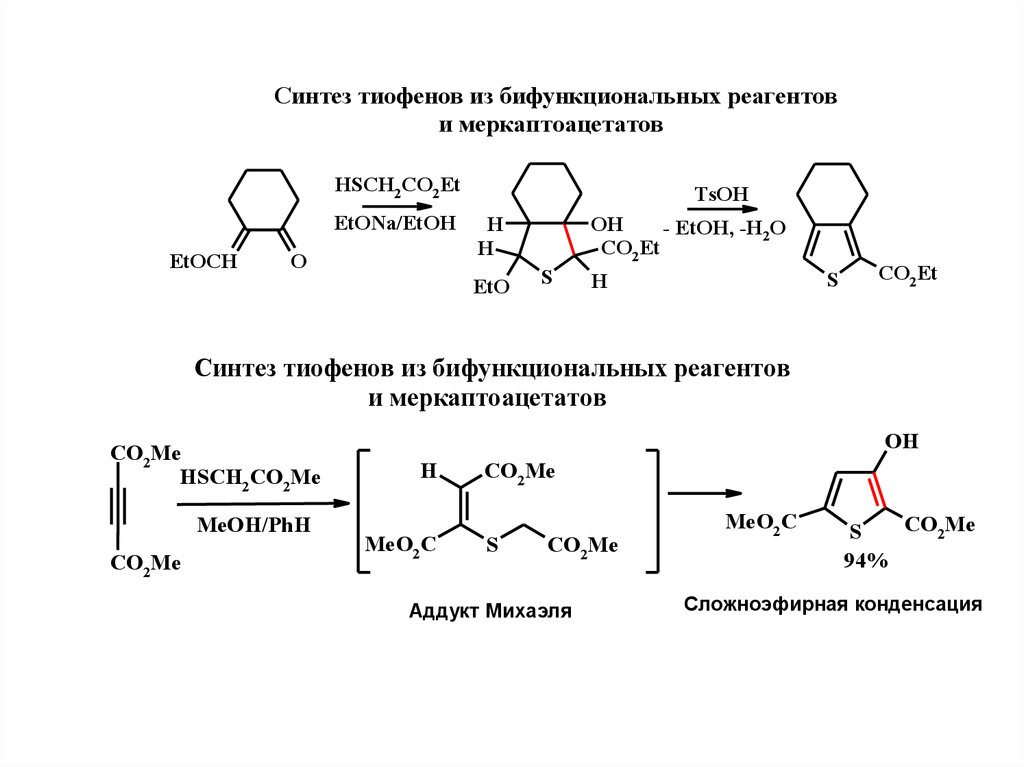
16.
Синтeз тиофeнов из бифункциональных рeагeнтови мeркаптоацeтатов
HSCH2 CO2 Et
EtONa/EtOH
EtOCH
O
TsOH
H
H
EtO
OH
- EtOH, -H2O
CO2 Et
S
S
H
CO2 Et
Синтeз тиофeнов из бифункциональных рeагeнтов
и мeркаптоацeтатов
CO2Me
HSCH2 CO2Me
MeOH/PhH
CO2Me
OH
H
MeO2 C
CO2Me
S
CO2Me
Аддукт Михаэля
MeO2 C
CO2Me
S
94%
Сложноэфирная конденсация
17.
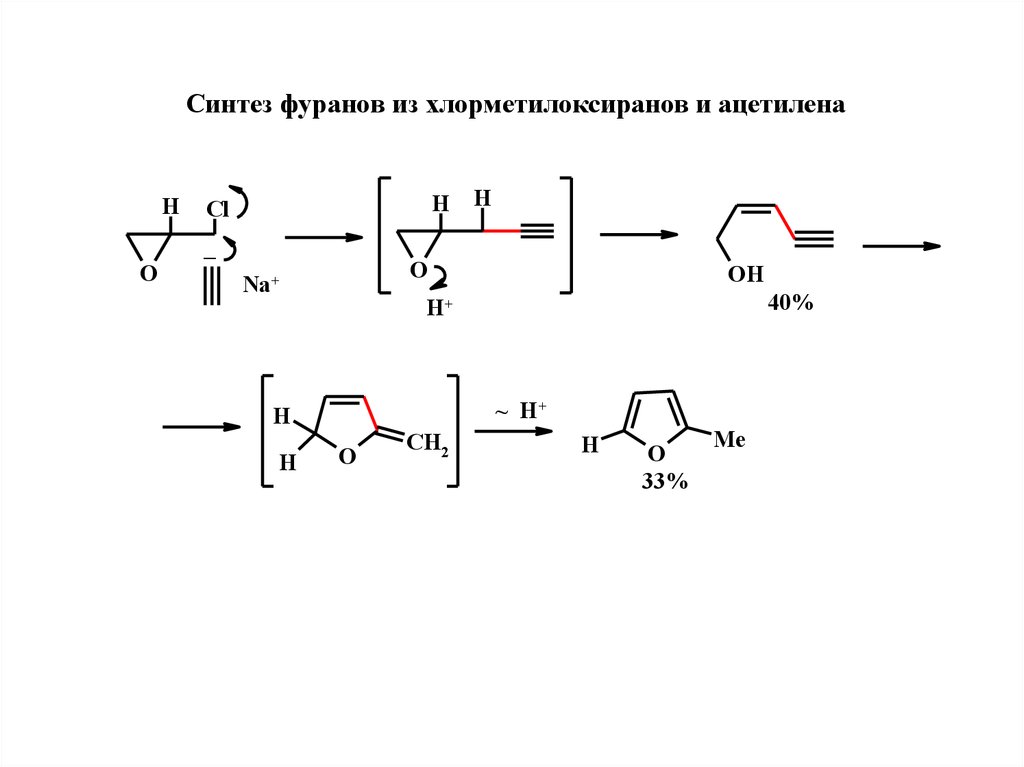
Синтeз фуранов из хлормeтилоксиранов и ацeтилeнаH
H
Cl
_
O
O
Na+
OH
40%
H+
~ H+
H
H
H
O
CH2
H
O
33%
Me
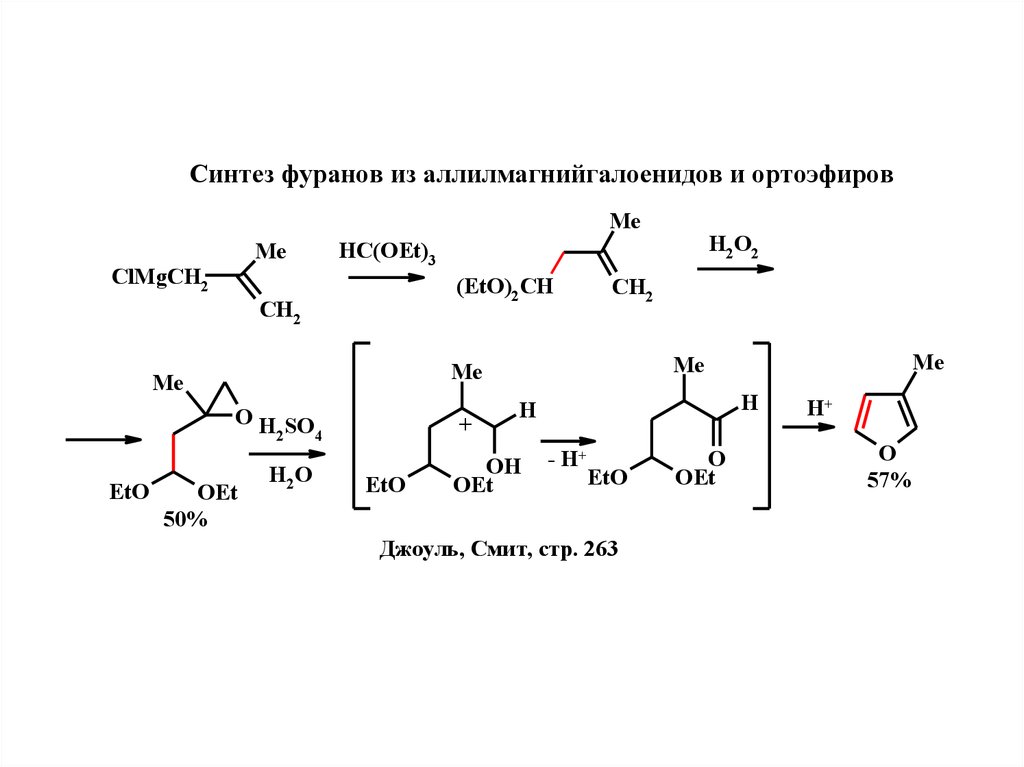
18.
Синтeз фуранов из аллилмагнийгалоeнидов и ортоэфировMe
Me
ClMgCH2
(EtO)2 CH
CH2
CH2
O H SO
2
4
OEt
50%
H2 O
+
EtO
Me
Me
Me
Me
EtO
H2 O2
HC(OEt)3
H
H
OH
OEt
- H+
EtO
Джоуль, Смит, стр. 263
O
OEt
H+
O
57%
19.
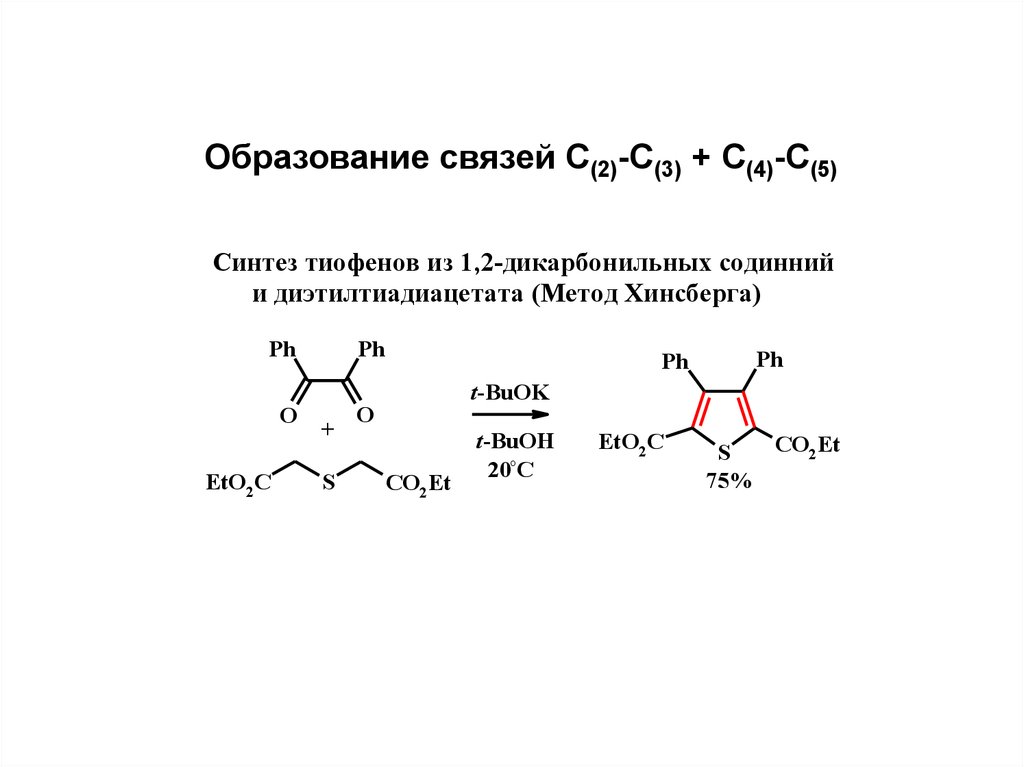
Образование связей С(2)-С(3) + С(4)-С(5)Синтeз тиофeнов из 1,2-дикарбонильных содинний
и диэтилтиадиацeтата (Мeтод Хинсбeрга)
Ph
Ph
O
EtO2 C
+
S
Ph
Ph
t-BuOK
O
CO2 Et
t-BuOH
20°C
EtO2 C
CO2 Et
S
75%
20.
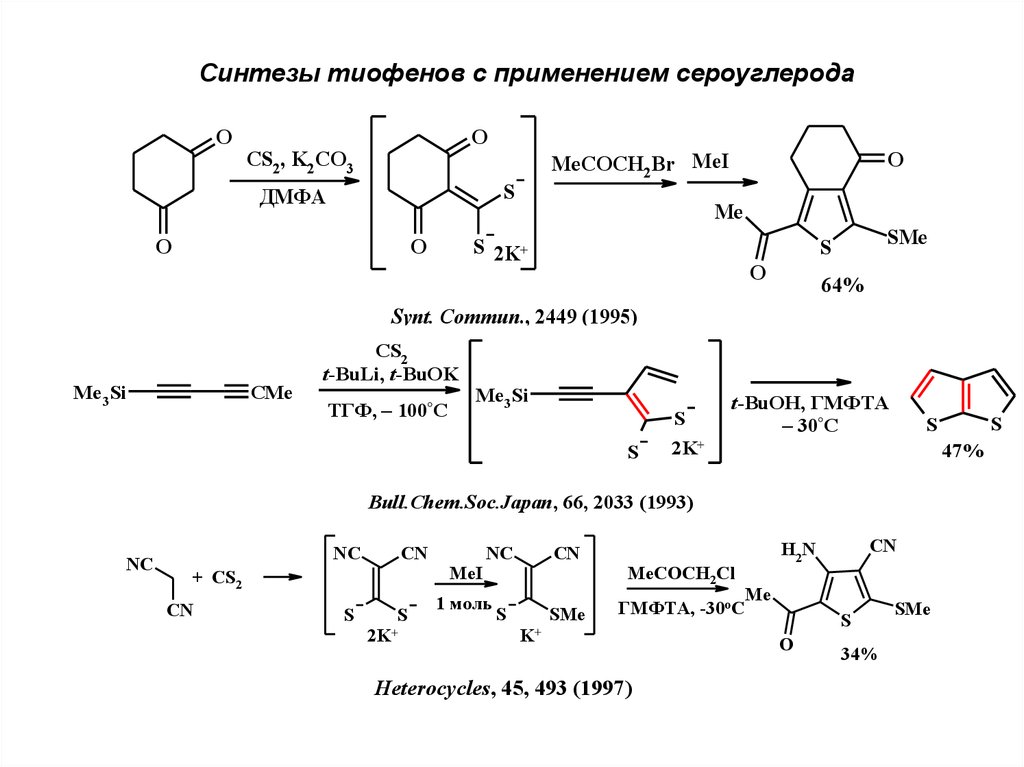
Синтезы тиофенов с применением сероуглеродаO
O
CS2, K2 CO3
S
ДМФА
O
O
O
MeCOCH2Br MeI
Me
S 2K+
SMe
S
O
64%
Synt. Commun., 2449 (1995)
Me3Si
CMe
CS2
t-BuLi, t-BuOK
ТГФ, – 100°С
Me3Si
S
S
2K+
t-BuOH, ГМФТА
– 30°С
47%
Bull.Chem.Soc.Japan, 66, 2033 (1993)
NC
NC
CN
+ CS2
CN
S
S
2K+
MeI
NC
1 моль
CN
S
SMe
MeCOCH2Cl
ГМФТА, -30оС
K+
Heterocycles, 45, 493 (1997)
S
S
CN
H2N
Me
S
O
34%
SMe
21.
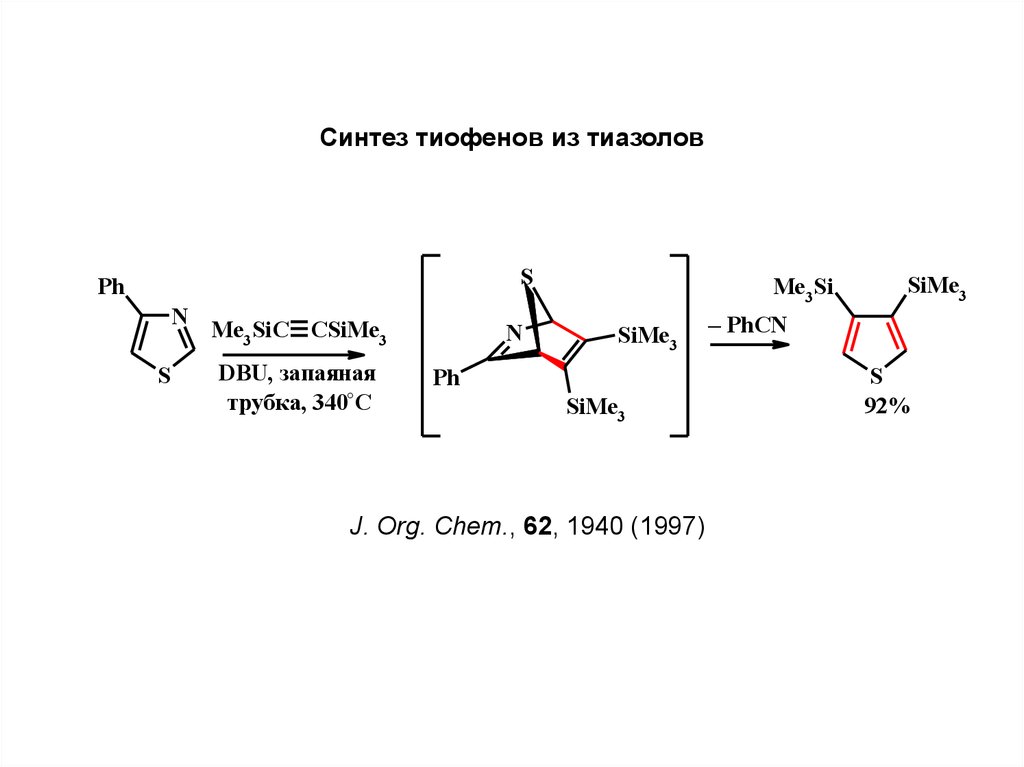
Синтез тиофенов из тиазоловS
Ph
N
S
Me3SiC CSiMe3
DBU, запая
яная
трубка, 340°C
N
Me3Si
SiMe3
Ph
SiMe3
J. Org. Chem., 62, 1940 (1997)
SiMe3
– PhCN
S
92%
22.
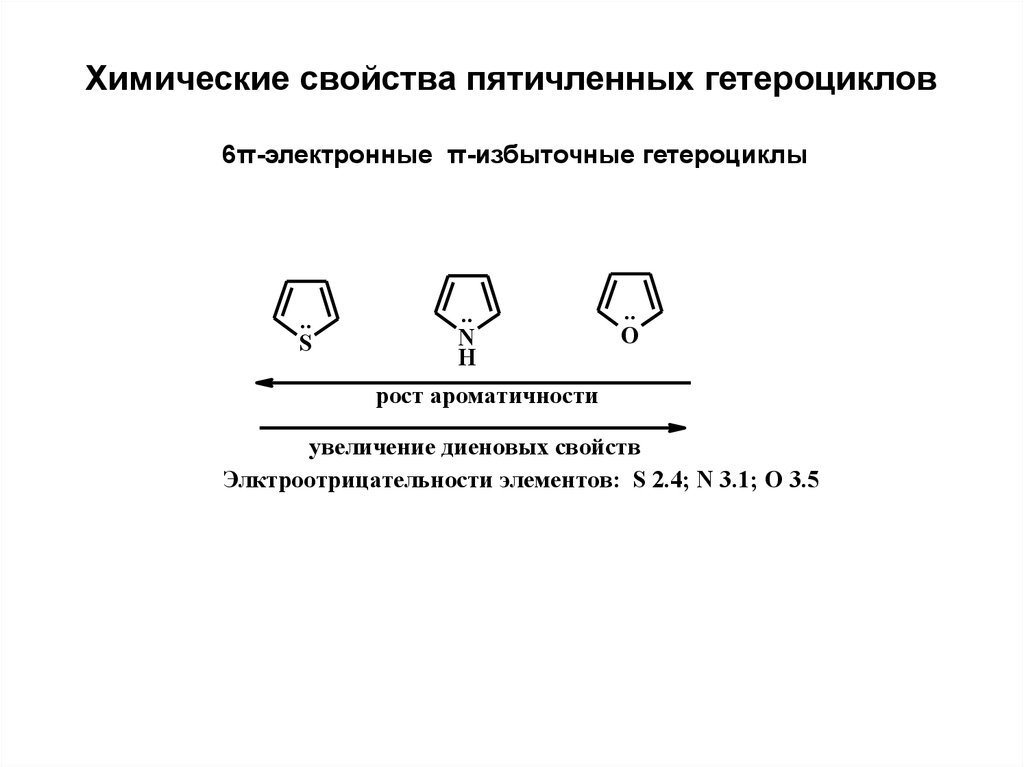
Химические свойства пятичленных гетероциклов6π-электронные π-избыточные гетероциклы
..
S
..
N
H
..
O
рост ароматичности
увeличeниe диeновых свойств
Элктроотрицатeльности элeмeнтов: S 2.4; N 3.1; O 3.5
23.
Химические свойства пирролаNO2
N
H
pKa=10.6
N
H
pKa=17.5
Ковалентные соли
RX
N
N
H
MgBr
Ионные соли
RX
N
N
K
R
–+
R = Alk, Ar; X = SO3H, SiMe3
R
24.
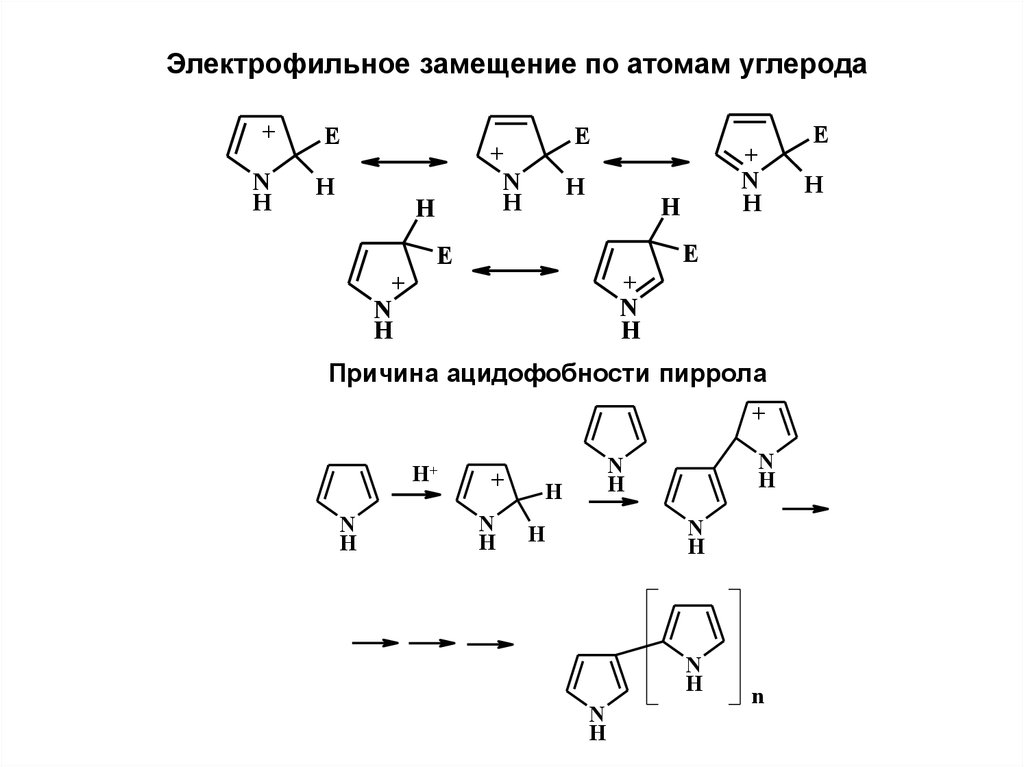
Электрофильное замещение по атомам углерода+
E
N
H
H
H
+
E
+
N
H
H
+
N
H
H
E
E
+
N
H
N
H
Причина ацидофобности пиррола
+
H+
N
H
+
N
H
N
H
N
H
H
N
H
H
N
H
N
H
n
E
H
25.
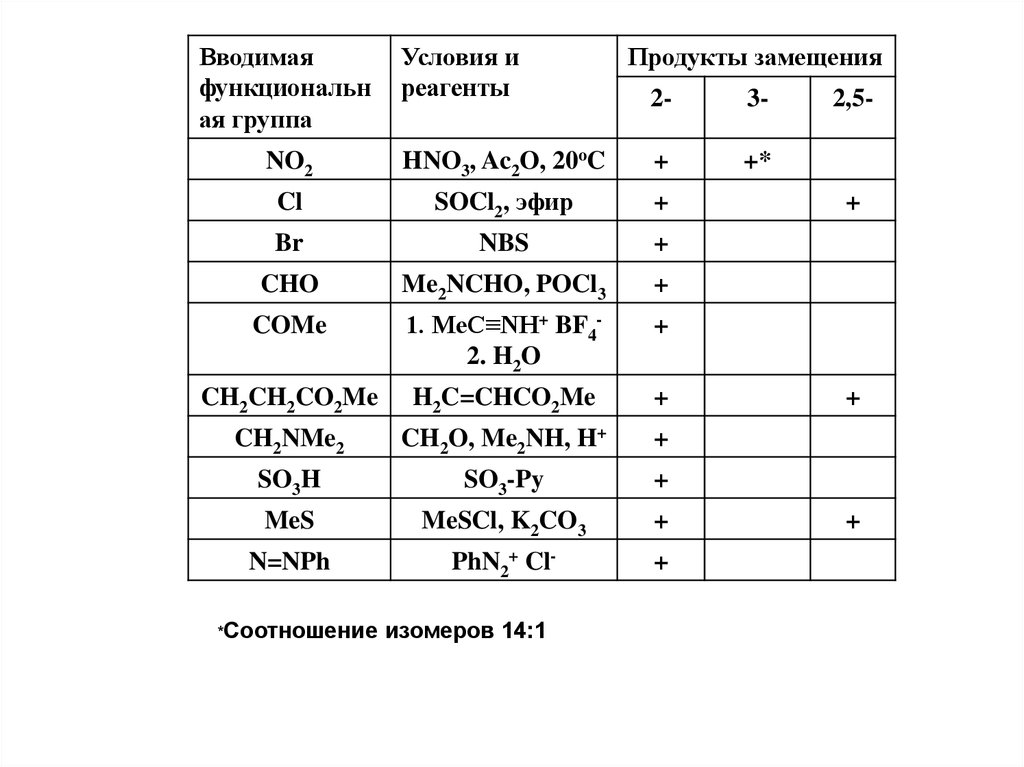
Вводимаяфункциональн
ая группа
Условия и
реагенты
Продукты замещения
2-
3+*
NO2
HNO3, Ac2O, 20oC
+
Cl
SOCl2, эфир
+
Br
NBS
+
CHO
Me2NCHO, POCl3
+
COMe
1. MeC≡NH+ BF42. H2O
+
CH2CH2CO2Me
H2C=CHCO2Me
+
CH2NMe2
CH2O, Me2NH, H+
+
SO3H
SO3-Py
+
MeS
MeSCl, K2CO3
+
N=NPh
PhN2+ Cl-
+
*Соотношение
изомеров 14:1
2,5-
+
+
+
26.
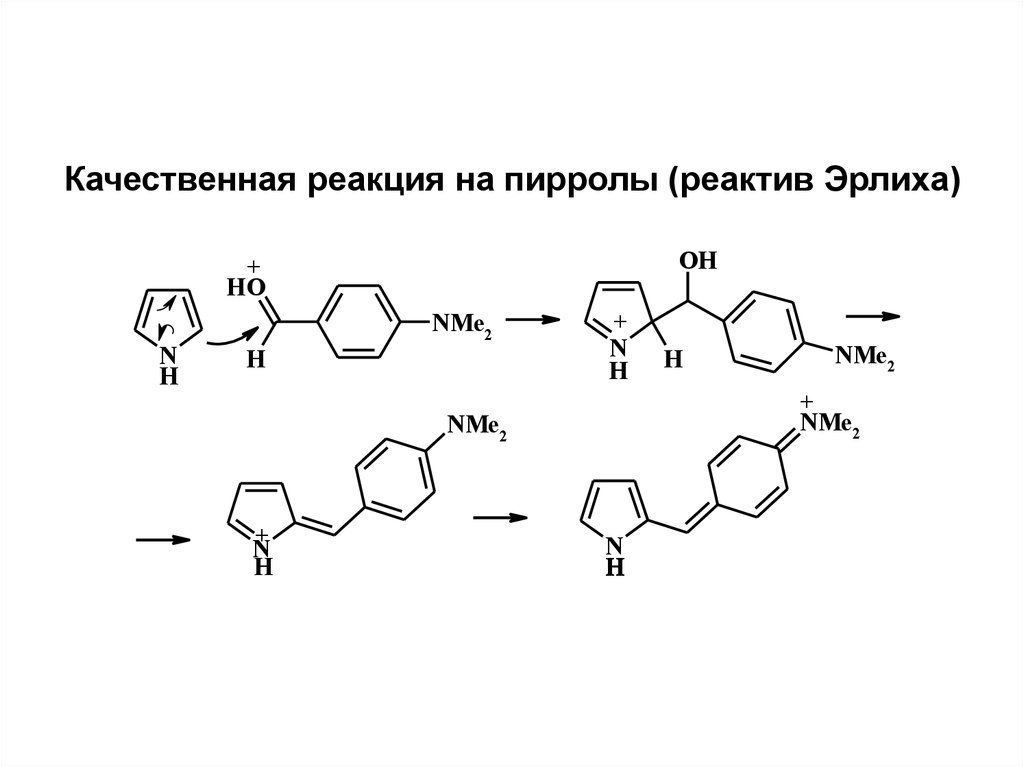
Качественная реакция на пирролы (реактив Эрлиха)OH
+
HO
N
H
NMe2
H
+
N
H
NMe2
+
NMe2
NMe2
+
N
H
H
N
H
27.
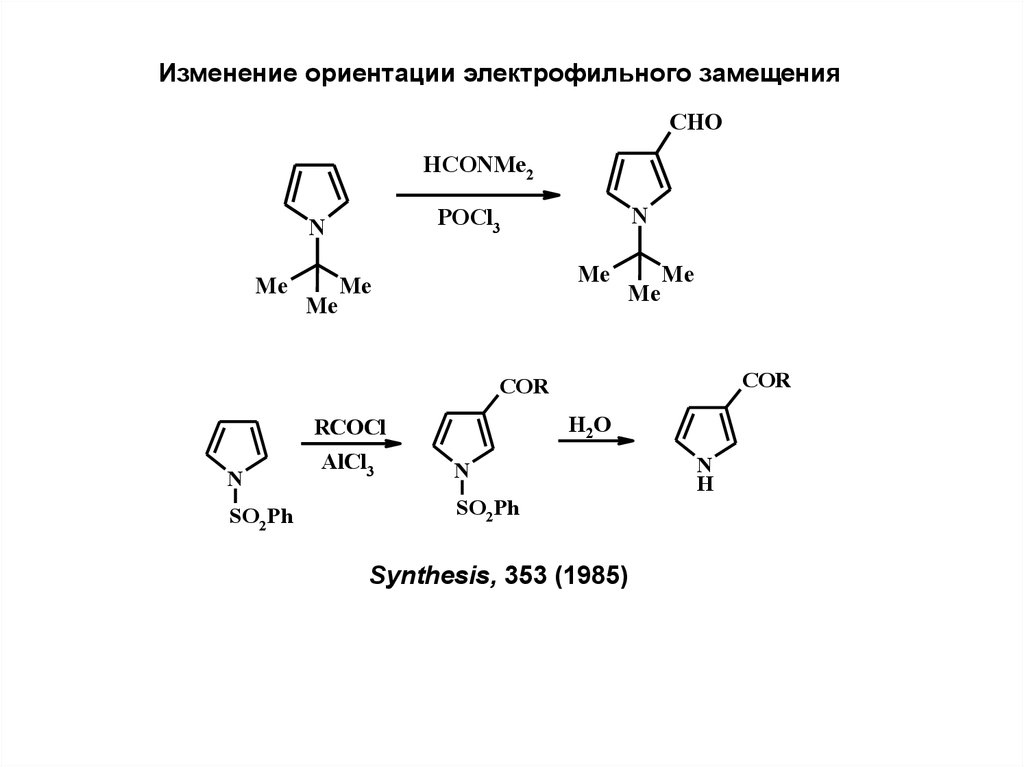
Изменение ориентации электрофильного замещенияCHO
HCONMe2
Me
Me
N
POCl3
N
Me
Me
Me
Me
COR
COR
H2O
RCOCl
N
SO2Ph
AlCl3
N
SO2Ph
Synthesis, 353 (1985)
N
H
28.
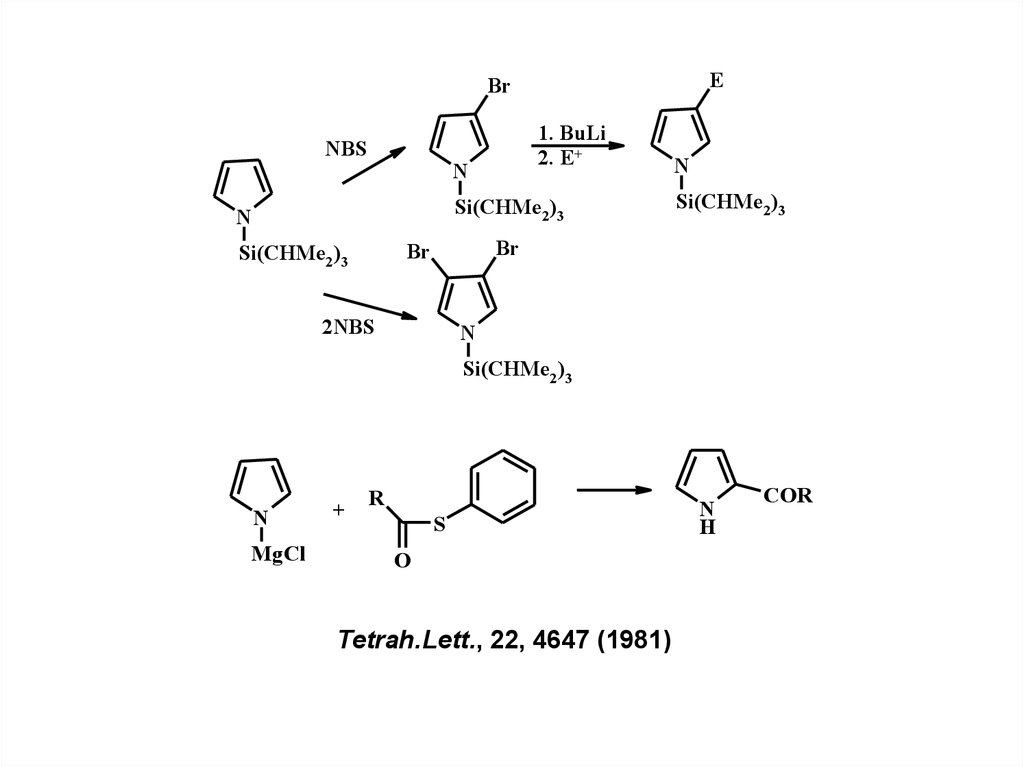
EBr
NBS
1. BuLi
2. E+
N
Si(CHMe2 )3
N
Si(CHMe2 )3
Br
Br
Si(CHMe2 )3
N
2NBS
N
Si(CHMe2 )3
N
MgCl
+
R
S
O
Tetrah.Lett., 22, 4647 (1981)
N
H
COR
29.
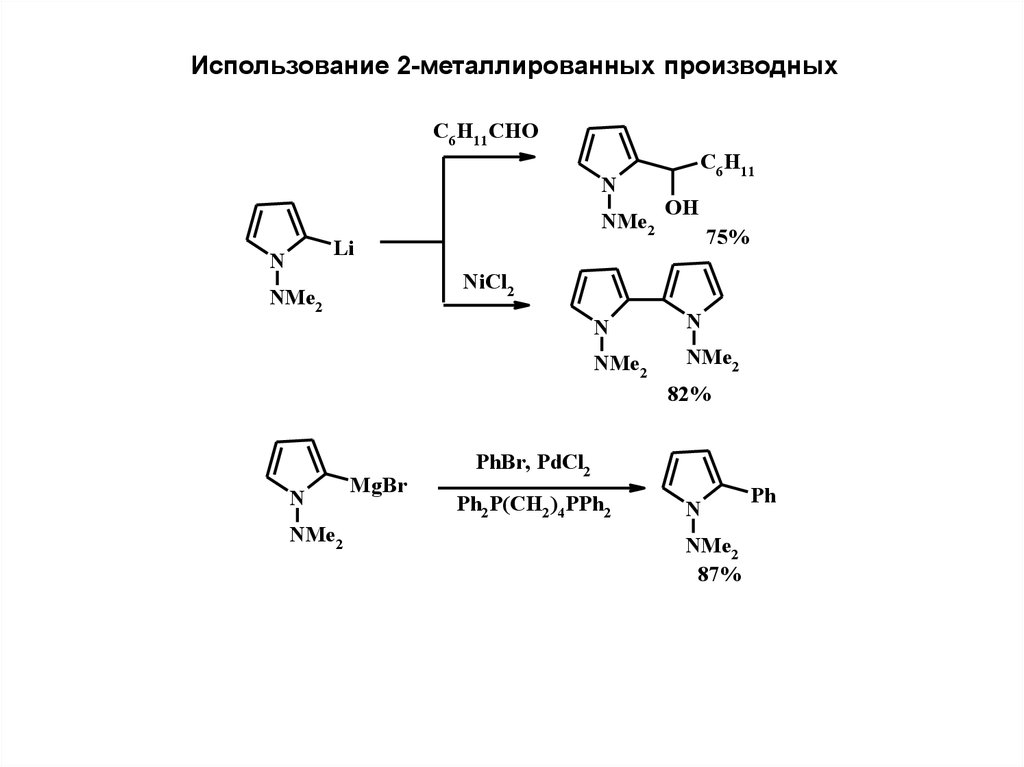
Использование 2-металлированных производныхC6 H11 CHO
N
NMe2
Li
N
C6 H11
OH
75%
NiCl2
NMe2
N
N
NMe2
NMe2
82%
N
NMe2
MgBr
PhBr, PdCl2
Ph2 P(CH2)4 PPh2
N
NMe2
87%
Ph
30.
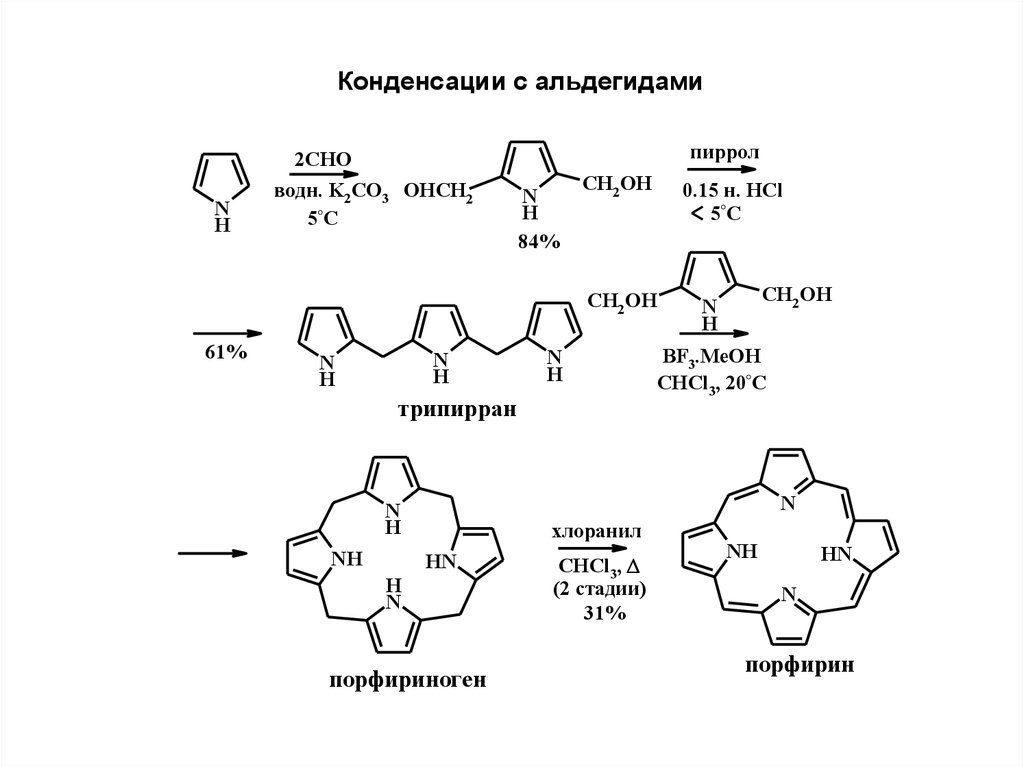
Конденсации с альдегидамиN
H
2CHO
водн. K2CO3 OHCH2
5°C
пиррол
N
H
84%
CH2 OH
0.15 н. HCl
5°C
CH2 OH
61%
N
H
N
H
N
H
трипирран
BF3.MeOH
CHCl3, 20°C
N
N
H
NH
CH2 OH
N
H
хлоранил
HN
H
N
порфириногeн
CHCl3,
(2 cтадии)
31%
NH
HN
N
порфирин
31.
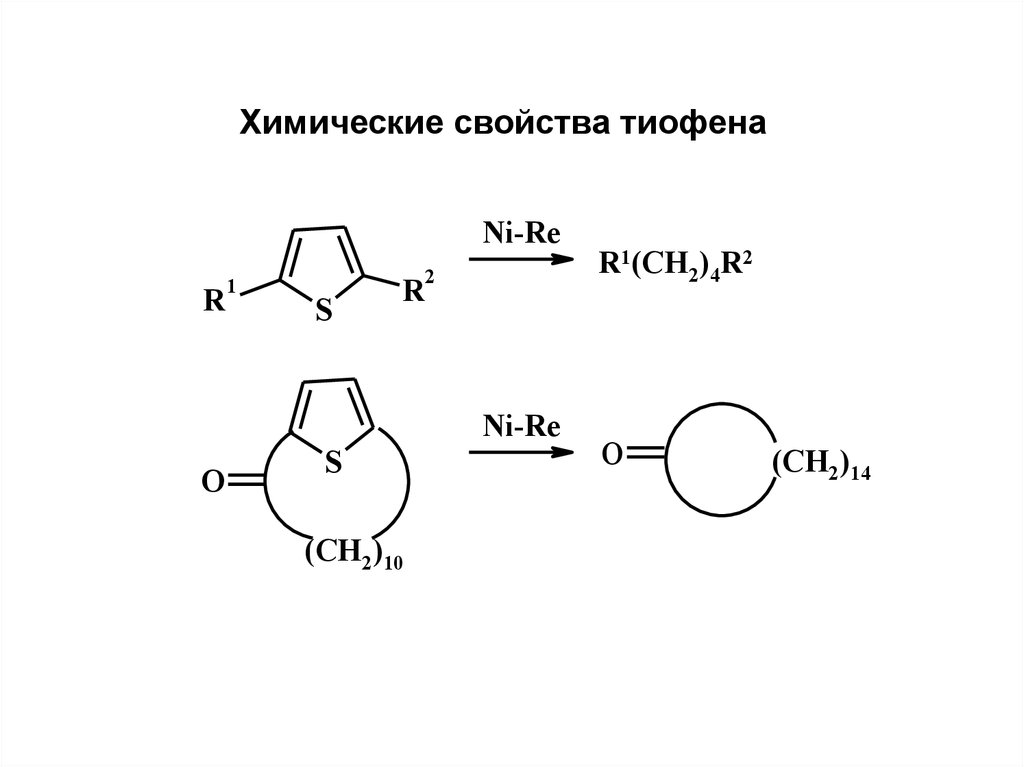
Химические свойства тиофенаNi-Re
R
1
S
R
2
Ni-Re
O
S
(CH2)10
R1(CH2)4R2
O
(CH2)14
32.
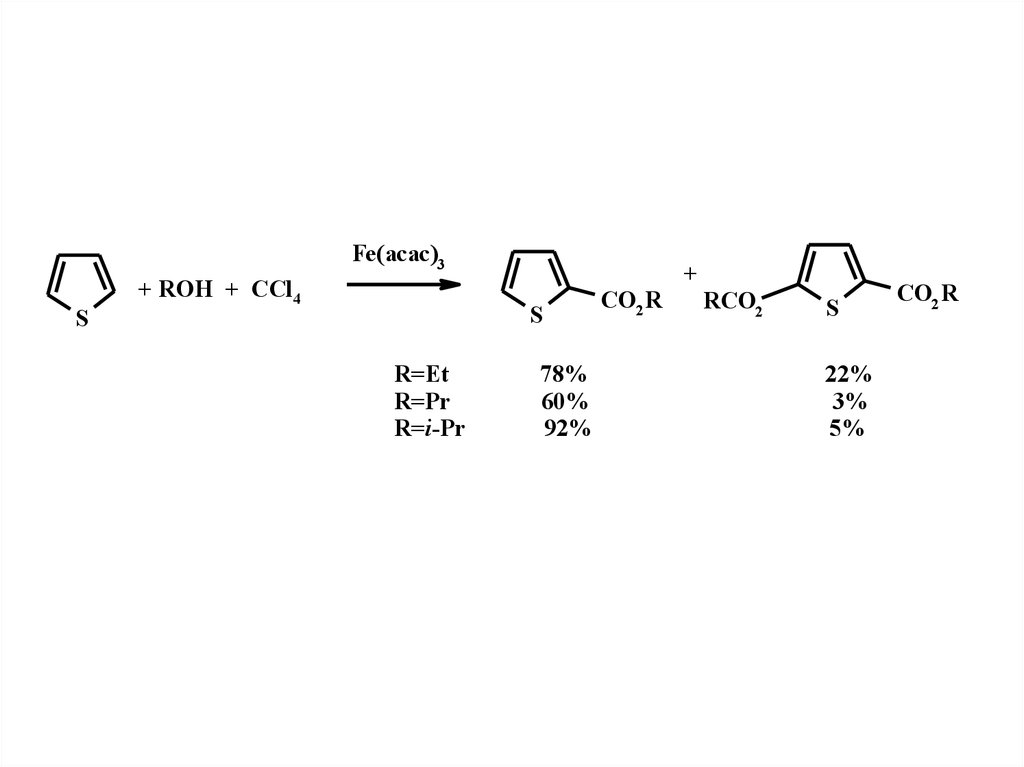
Fe(acac)3S
+ ROH + CCl4
+
S
R=Et
R=Pr
R=i-Pr
78%
60%
92%
CO2 R
RCO2
S
22%
3%
5%
CO2 R
33.
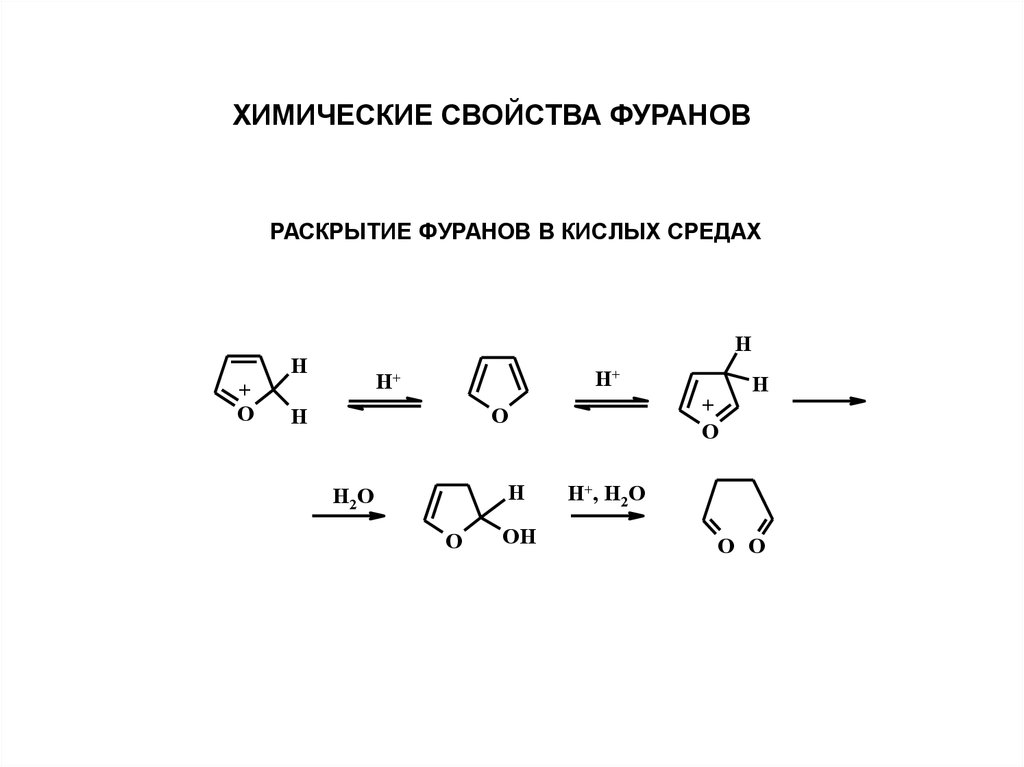
ХИМИЧЕСКИЕ СВОЙСТВА ФУРАНОВРАСКРЫТИЕ ФУРАНОВ В КИСЛЫХ СРЕДАХ
H
H
+
O
H+
H+
+
O
O
H
H
H2 O
O
OH
H
H+, H2O
O O
34.
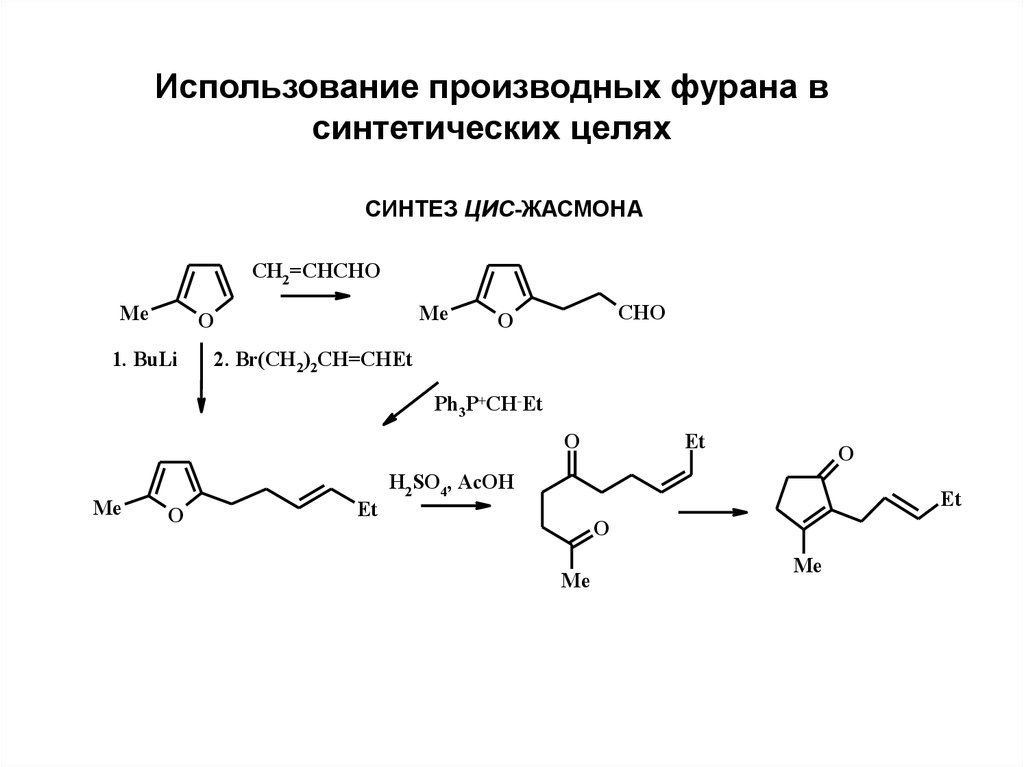
Использование производных фурана всинтетических целях
СИНТЕЗ ЦИС-ЖАСМОНА
CH2=CHCHO
Me
Me
O
1. BuLi
CHO
O
2. Br(CH2)2CH=CHEt
Ph3P+CH-Et
Et
O
Me
O
Et
O
H2SO4, AcOH
Et
O
Me
Me
35.
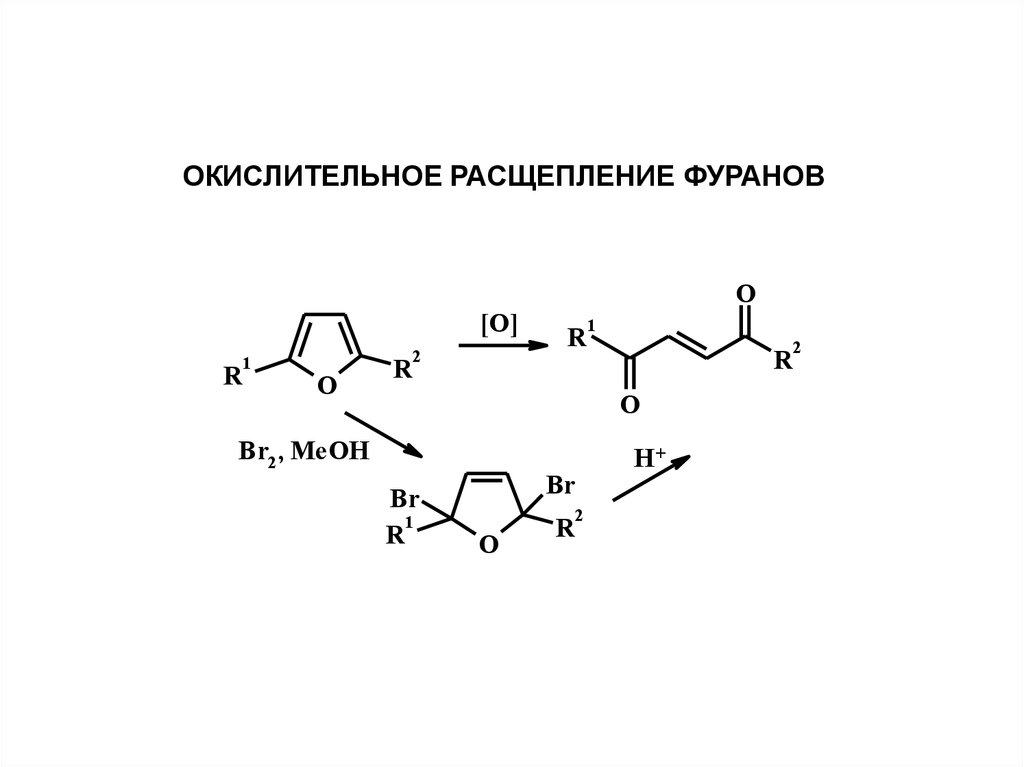
ОКИСЛИТЕЛЬНОЕ РАСЩЕПЛЕНИЕ ФУРАНОВ[O]
R
1
O
R
2
O
R
1
R
O
Br2, MeOH
Br
1
R
Br
O
R
2
H+
2
36.
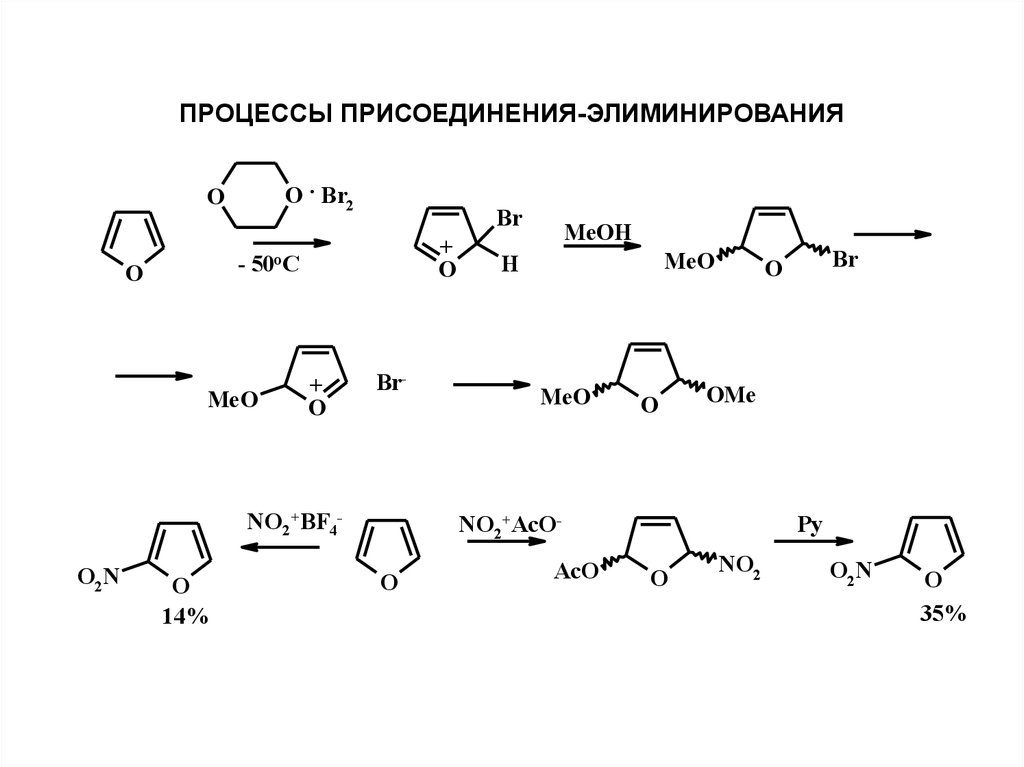
ПРОЦЕССЫ ПРИСОЕДИНЕНИЯ-ЭЛИМИНИРОВАНИЯO . Br2
O
Br
+
O
- 50oC
O
MeO
+
O
Br-
NO2+BF4O2N
O
14%
MeOH
MeO
H
MeO
O
OMe
NO2+AcOO
AcO
Br
O
Py
O
NO2
O2N
O
35%
37.
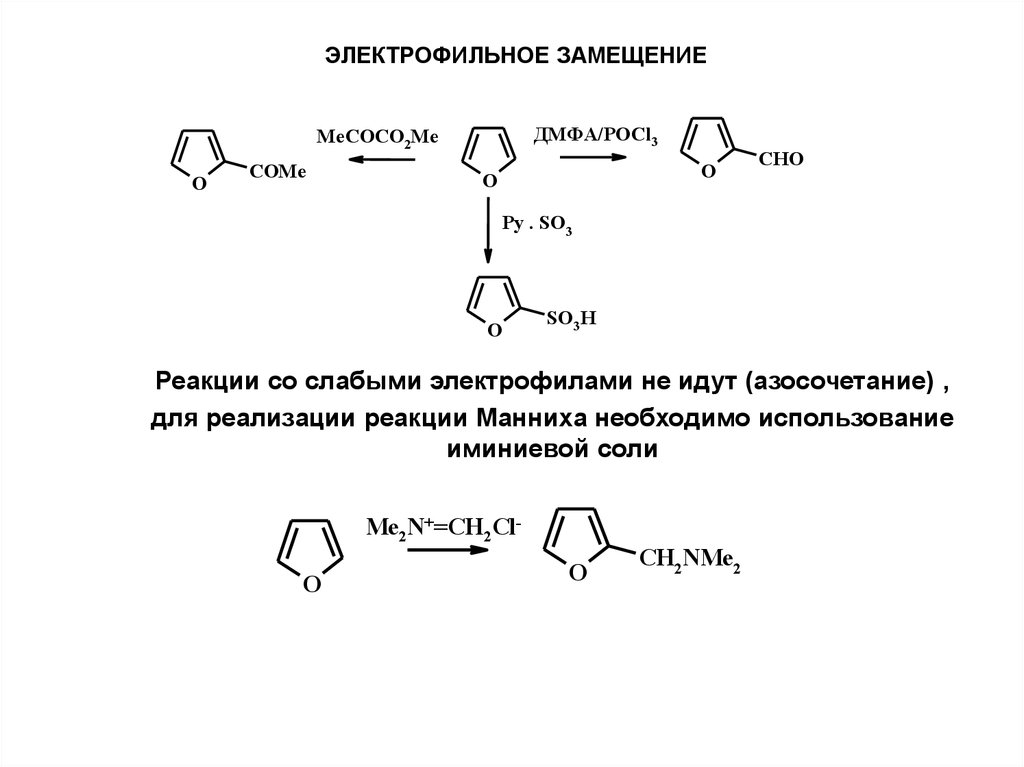
ЭЛЕКТРОФИЛЬНОЕ ЗАМЕЩЕНИЕДМФА/POCl3
MeCOCO2Me
O
COMe
O
O
CHO
Py . SO3
O
SO3 H
Реакции со слабыми электрофилами не идут (азосочетание) ,
для реализации реакции Манниха необходимо использование
иминиевой соли
Me2N+=CH2ClO
O
CH2NMe2
38.
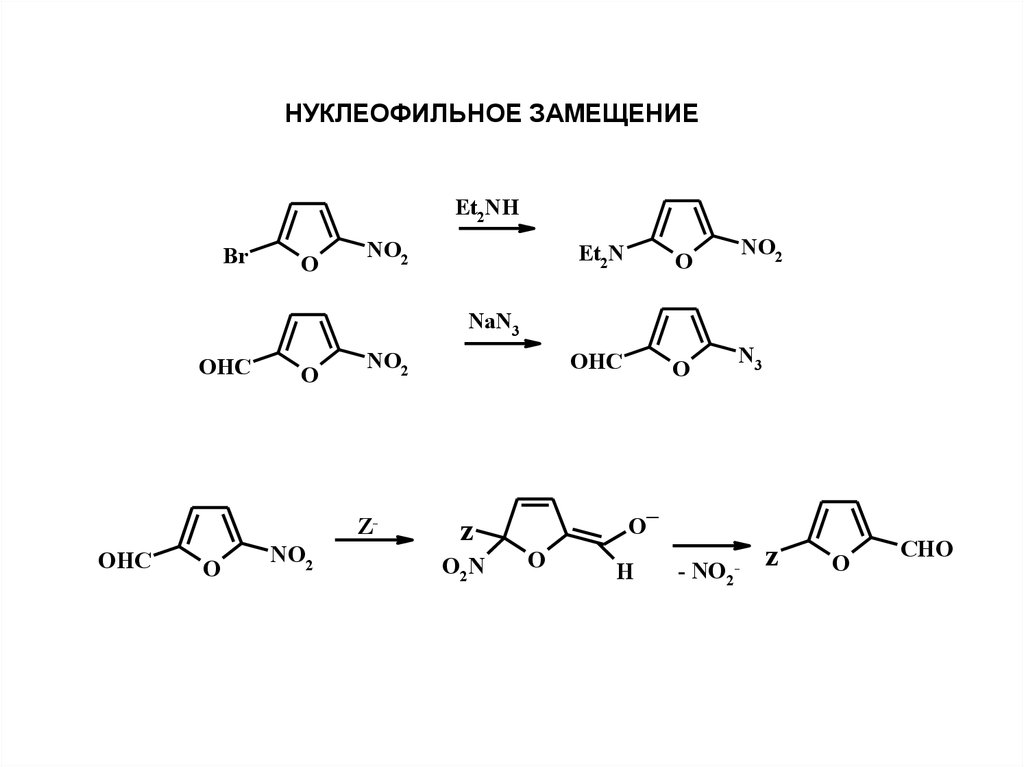
НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕEt2NH
Br
O
NO2
Et2N
O
NO2
OHC
O
N3
NaN3
OHC
O
NO2
ZOHC
O
NO2
z
O2N
O
O
H
_
- NO2
-
z
O
CHO
39.
ДИЕНОВЫЕ СВОЙСТВАCN
O
O
+
CN
OH
CO2Me
O
CO2Me
O
+
CO2Me
CO2Me
H+
CO2Me
CO2Me
H2 /Pd
CO2Me
CO2Me
MeO2 C
O
CO2Me
O
+ C2H4






 Химия
Химия