Похожие презентации:
Аннелирование бензольного кольца
1.
Аннелирование бензольного кольца+
N
R
O
N
N
CO2 Et
R
O
N
CO2 Et
Диполя
рное циклоприсоединение
R
O
R
Zn(OTf)2
OH – 2H2O
N
CO2 Et
Tetrahedron Lett., 26, 4047 (1985)
N
H
H2
2.
O2SnCl2
N
CO2 Et
O
N
CO2 Et
OSiMe3
N
CO2 Et
O
O
O
Sn
CHO
O
CO2 Et
[O]
CO2 Et
CHO
N
Cl
RMgX
R
N
Cl
O Sn Cl
N
R
Cl
_
C OH
H
N
CO2 Et
SnCl4
CO2 Et
-OH
N
CO2 Et
3.
Синтез индолов электроциклическим замыканиембезольного кольца диалкенилпирролов
R
O
R
R
2
Tos
R
1
R
B–
–
N=C
2
H+
R
_
R
R
R
R
1
2
1
R
N=C
O
R
2
R
1
R
O
4
R
DDQ
N
H
R
1
4
или hv
N
H
1
4
_ O
R
R
R
2
R
2
H+
– Tos–
N
O
R
O
R
4
~
Tos
2
N=C
O
R
Tos
R
_ Tos
1
R
4
R
2
R
1
N
H
R
80-98%
J.Org.Chem., 51, 4131 (1986)
4
R
N
H
4
R
4.
Циклокарбонилирование 2-(ацетоксиаллил)пирроловOAc
CO, Ac2O, NEt3
N
PdCl2(PPh3)2, 130°C
CH2 OMe OAc
J.Org.Chem., 56, 1922 (1991)
N
CH2 OMe
~ 50%
5.
Взаимодействие бензотриазолильных производныхпирролов с 1,3-дикарбонильными соединениями
O
Me
MeCOCl
Me
N
SO2 Ph
1
N
спирт
N
SO2 Ph
2
Bt
Bt
TsOH, толуол,
2
Me
Bt
Me
Me
Li
BuLi
+
N
SO2 Ph
N
NaBH4
AlCl3
N
SO2 Ph
H
N
HO
N
SO2 Ph
R
1
R
O
N
SO2 Ph
200°C
2
Bt
R
R
N
SO2 Ph
1
Me
Me
Me
O
R
2
+
R
N
SO2 Ph
1
2
R
O
10% H2SO4
i-PrOH
J.Org.Chem., 68, 5728 (2003)
1
N
2
SO2 Ph
R
43-60%
2
6.
Общий метод синтеза 4-замещённых индоловO
SC6 H4 Cl-p
+
Cl
N
SO2 Ph
TiCl4
CO2 Et
Me
EtO
CH2Cl2, -78oC
p-ClC6 H4S
O
HO Me
MeMgI
TsOH
N
SO2 Ph
86%
N
SO2 Ph
SC6H4Cl-p
O
1. LiOH, H2O
Cl
ТГФ, ~ 20oC
2. (COCl)2, Py
N
бензол, ~ 20oC
SO2 Ph
p-ClC6 H4S
Me3SiO CN
Me3SiCN
SnCl4
o
N CH2Cl2, 0 C
SO2 Ph
CN
POCl3, Py
N
SO2 Ph
SC6H4Cl-p
N
SO2 Ph
SC6H4Cl-p
63%
N
SO2 Ph
TsOH, MeOH
OMe
87%
O
+ HO
p-ClC6H4
N
SO2 Ph
Cl
OH
N
SO2 Ph
O
0.2 экв. TsOH
0.5 экв. CuCl2
бензол,
OH
Cl
i-PrNH2, NaOH
O
OH
NHPr-i
H2O, EtOH
N
N
H
SO2 Ph
S-(-)-пиндолол
Tetrahedron Lett., 34, 489 (1993)
7.
Синтез метилового эфира 4-гидроксииндол-6карбоновой кислоты из пиррол-2-альдегидаCO2Me
O
HO2 C
CO2Me
OHC
MeO2 C
t-BuOK, t-BuOH
N
H
C
Ac2 O
N
H
MeO2 C
Et3N
20°C, 1 ч
Ac2O, 10 экв
AcOH, 1 экв
толуол,
OAc
OH
N
N
MeO2 C
N
H
OAc
MeO2 C
OH
MeO2 C
95%
J.Org.Chem., 69, 6945 (2004)
N
H
MeO2 C
N
H
8.
Катализируемое кислотами Льюиса [4+2]бензаннелирование между енинальной единицей иенолами или эфирами енолов
Ph
Ph
2
3
R
OR
+
N
Ts
CHO R1
2
или AuBr3
N
Ts
CHO
Ph
O
N
Ts
1
R
N
88-90% Ts
+
+
M
R
Cu(OTf)2
Ph
M-
O
2
R
3
OR
Ph
O
2
Ph
R
+
1
R
N
Ts
M-
J.Org.Chem., 71, 5249 (2006)
1
R
O
2
-M-
R
1
R
N
Ts
9.
Синтез кетонов индольного ряда с использованиемкатализируемых переходными металлами
последовательности тандемных превращений
Bu
Bu
Me
Me
5% t-Bu3PAuCl, 5% AgSbF6
N
Ts
OAc
CH2ClCH2CN, ~ 20°C, 10 ч
Bu
OAc
N
Ts
J.Am.Chem.Soc., 128, 7436 (2006)
Me
O
57%
N
Ts
10.
Синтез индолов по реакции Дильса-Альдера из 2- или 3нитропирролов с активированными диенамиR
CO2Me
NPr
R
Me
N
Ts
Me
R
NO2
N
Ts
OMe
(диен Данишевского)
HO
R
OSiMe3
N
Ts
Tetrahedron Lett., 48, 1435 (2007)
N
Ts
11.
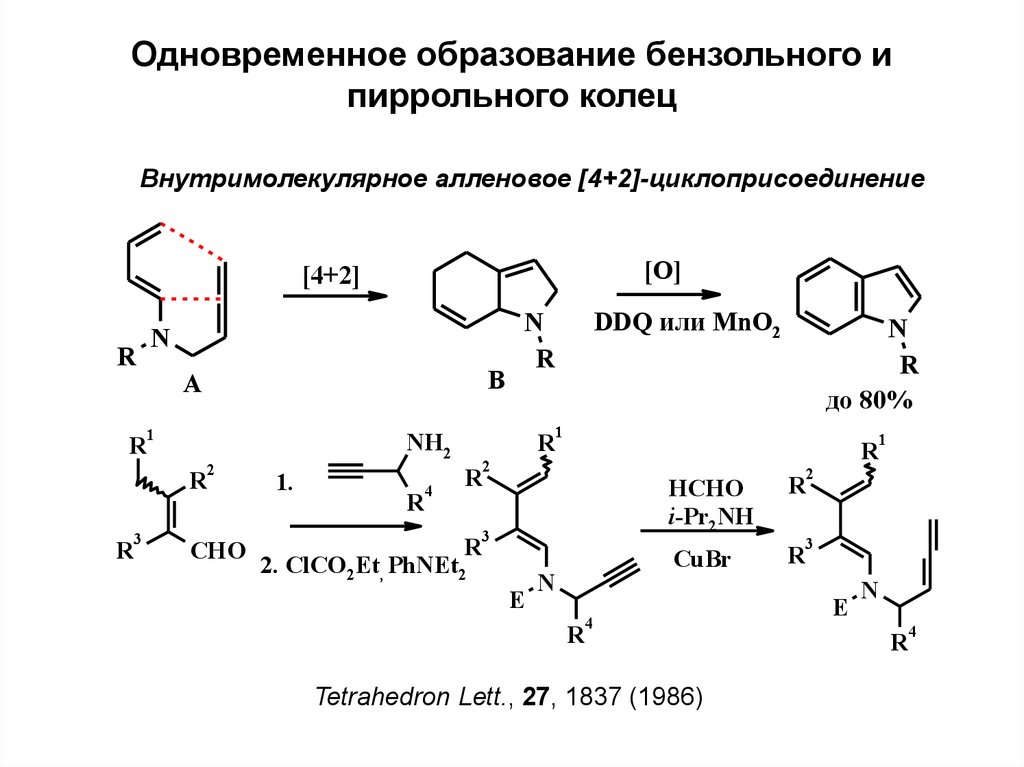
Одновременное образование бензольного ипиррольного колец
Внутримолекулярное алленовое [4+2]-циклоприсоединение
[O]
[4+2]
R
R
N
1
R
3
R
B
A
2
CHO
R
4
N
R
до 80%
1
NH2
1.
DDQ или MnO2
N
R
R
R
2
R
3
R
2. ClCO2Et, PhNEt2
E
N
HCHO
i-Pr2NH
R
CuBr
R
4
R
Tetrahedron Lett., 27, 1837 (1986)
1
2
3
E
N
4
R
12.
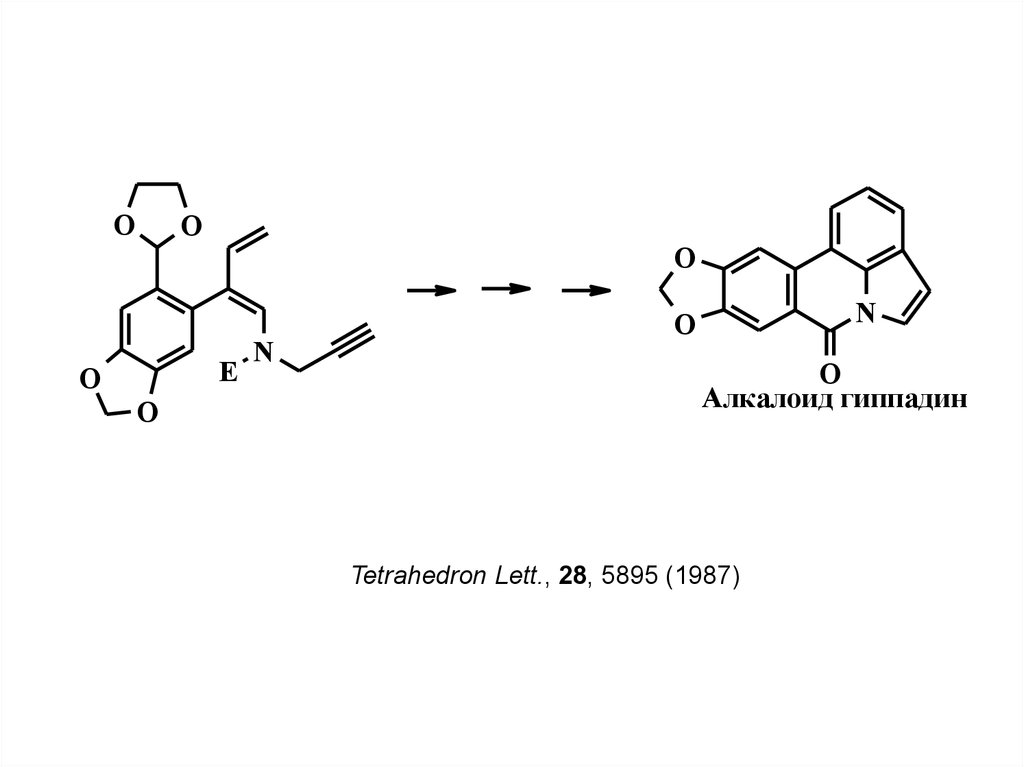
OO
O
E
O
O
N
N
O
O
Алкалоид гиппадин
Tetrahedron Lett., 28, 5895 (1987)
13.
Простой и общий метод синтеза 4-оксо-4,5,6,7тетрагидроиндолов с использованием нового методавнутримолекулярного 1,3-диполярного циклоприсоединения
R
O
O
R
O
3
CO2 H
N
1
R
3
R
2
H2 O
R
O
O
+
N
1
R
–
R
2
R
O
3
N
1
O
R
O
Tetrahedron Lett., 37, 2887 (1996)
R
3
2
O
– CO2
R
N
1
R
2
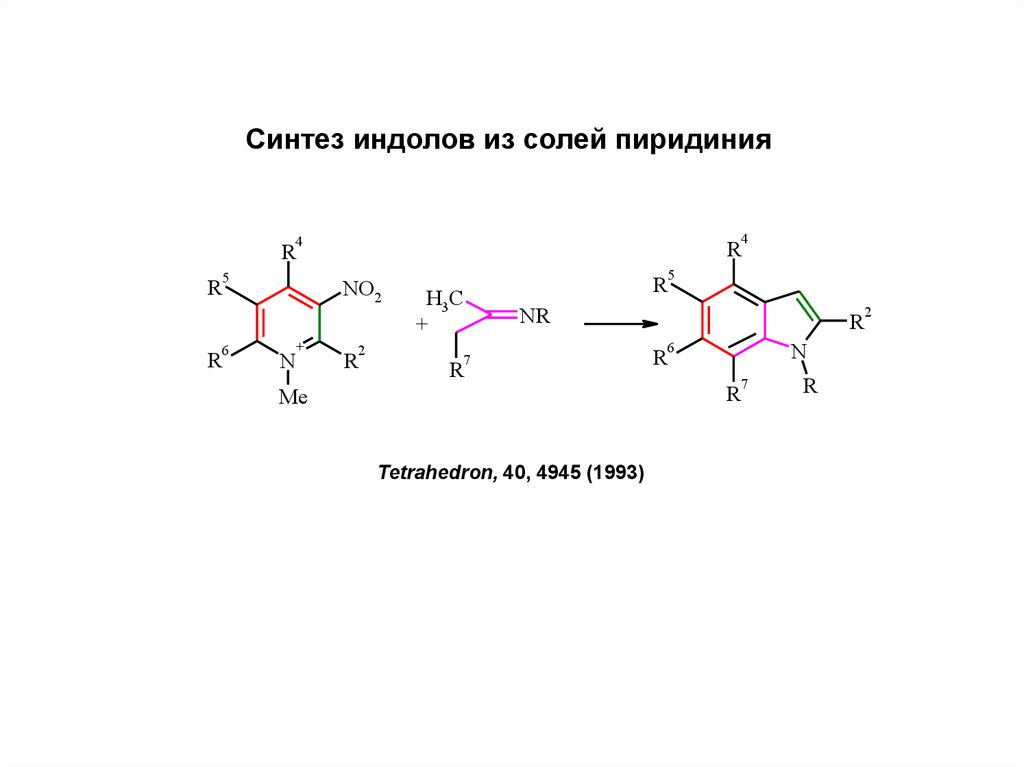
14.
Синтез индолов из солей пиридиния4
4
R
R
5
R
6
R
NO2
N
+
2
R
5
H3C
+
R
NR
7
R
Me
Tetrahedron, 40, 4945 (1993)
2
R
N
6
R
7
R
R
15.
HN Me
4
4
NO2
5
6
2
RHN
N
5
+
+
RN
2
N
6
Me
5
N
H
2
6
NR
5
– HNO2
6
Me _
HO + O
N
N
4
NO2
5
~ H+
H
2
6
NHR
4
6
4
5
2
N Me
NHR
– MeNH2
2
6
5
H
2
~ H+
5
NO2
NO2
NHR
4
4
N
R
4
H
N Me
H
2
6
NHR
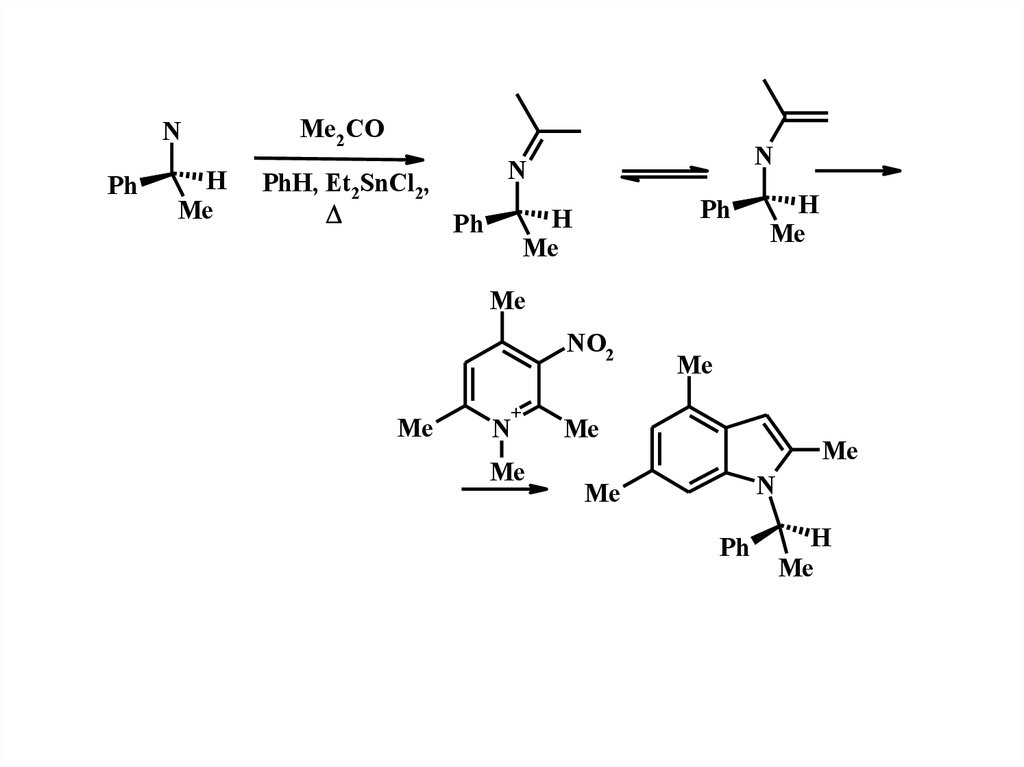
16.
NPh
H
Me
Me2 CO
PhH, Et2SnCl2,
Ph
N
N
Ph
H
Me
H
Me
Me
NO2
Me
N
+
Me
Me
Me
Me
N
Me
Ph
H
Me
17.
MeMe
H+
Me
N
Me
Ph
Me
+
N
Me
H
Me
Ph
H
Me
NaBH3 CN
MeOH/HCl
- 80oC
Me
H
Me
N
Me
H
Me
88%, de 80%
Ph
A.V.Karchava, M.A.Yurovskaya, T.R.Wagner, B.L.Zybailov, Yu.G.Bundel, Tetrahedron:
Asimmetry, 6, 2895 (1995)
18.
ArX
Ar
N
Me
X
CF3SO3Me X
+
N
N
Ar
AcOH
N
Me
Me
X
Ar
Выход индола,
%
Cl
Ph
51
SPh
Ph
64
CN
Ph
42
Ac
3-NO2C6H4
15
COOEt
2-CF3C6H4
10
COOEt
4-BrC6H4
88
COOEt
3,4-(MeO)2C6H3
92
COOEt
2-Furyl
61
COOEt
2-Thienyl
68
19.
Химические свойства индоловИндол - 10π электронная π-избыточная система
NH-кислота
NaNH2, жидк. NH3
_
N
Na+
или NaH в орг. раств.
N
H
pKa = 16.97
OH
O
N
MgBr
N
H
20.
t-BuLiE+
Li
E
N
N
SO2 Ar
SO2 Ar
Li
CH2NMe2
SO2 Ar
E+
t-BuLi
N
N
N
CH2NMe2
E
NaBH4
N
CH2NMe2
J. Org. Chem., 55, 3688 (1990)
E
N
H
21.
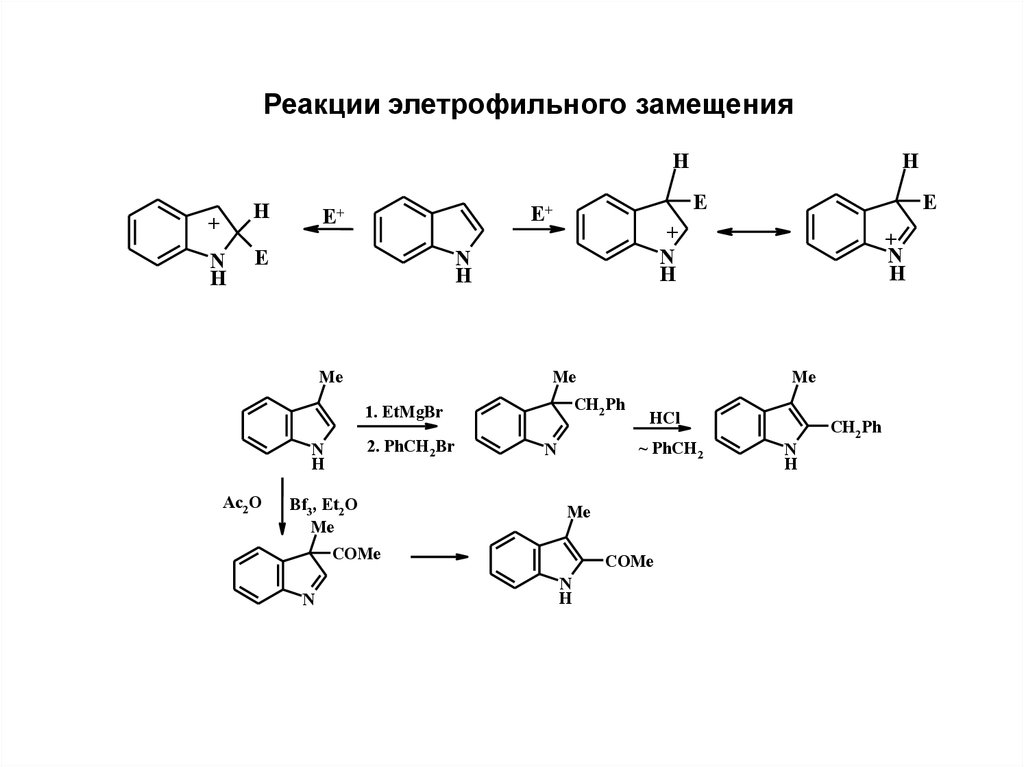
Реакции элетрофильного замещенияH
H
+
N
H
E
E+
E+
E
Me
N
H
Ac2 O
Bf3, Et2 O
Me
Me
COMe
N
HCl
~ PhCH2
N
COMe
N
H
+
N
H
Me
CH2 Ph
1. EtMgBr
2. PhCH2Br
E
+
N
H
N
H
Me
H
N
H
CH2 Ph
22.
Вступающая группаРеагенты и условия
NO2
PhCONO2
Br
NBS, CCl4, 80oC
Cl
N-хлорсукцинимид, MeOH, 20oC
CHO
Me2NCHO, POCl3, 25-30oC
COMe
Ac2O, нагревание
CH2CH2NO2
CH2=CHNO2, 0-20oC
CH2CH2COMe
CH2=CHCOMe, AcOH, Ac2O, 100oC
CH2NMe2
CH2O, Me2NH, AcOH, 20oC
N=NPh
PhN2+ Cl-, водн. KOH, 0oC
SO3H
Py•SO3, нагревание
23.
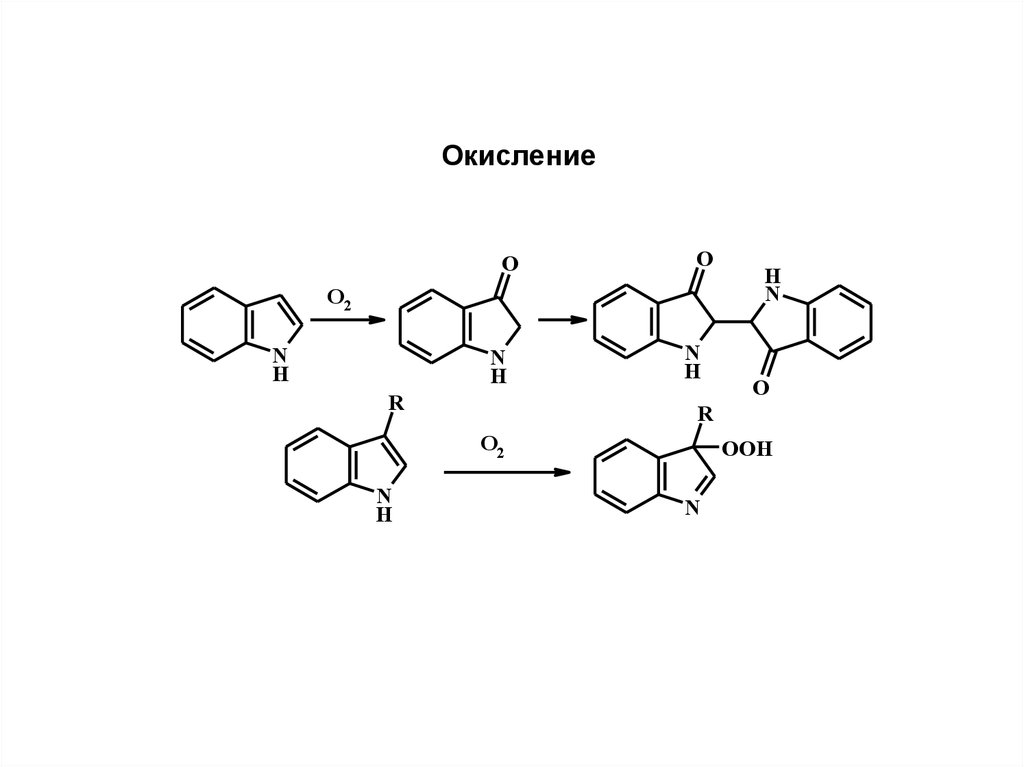
ОкислениеO
O
O2
N
H
N
H
R
N
H
O
R
O2
N
H
H
N
OOH
N
24.
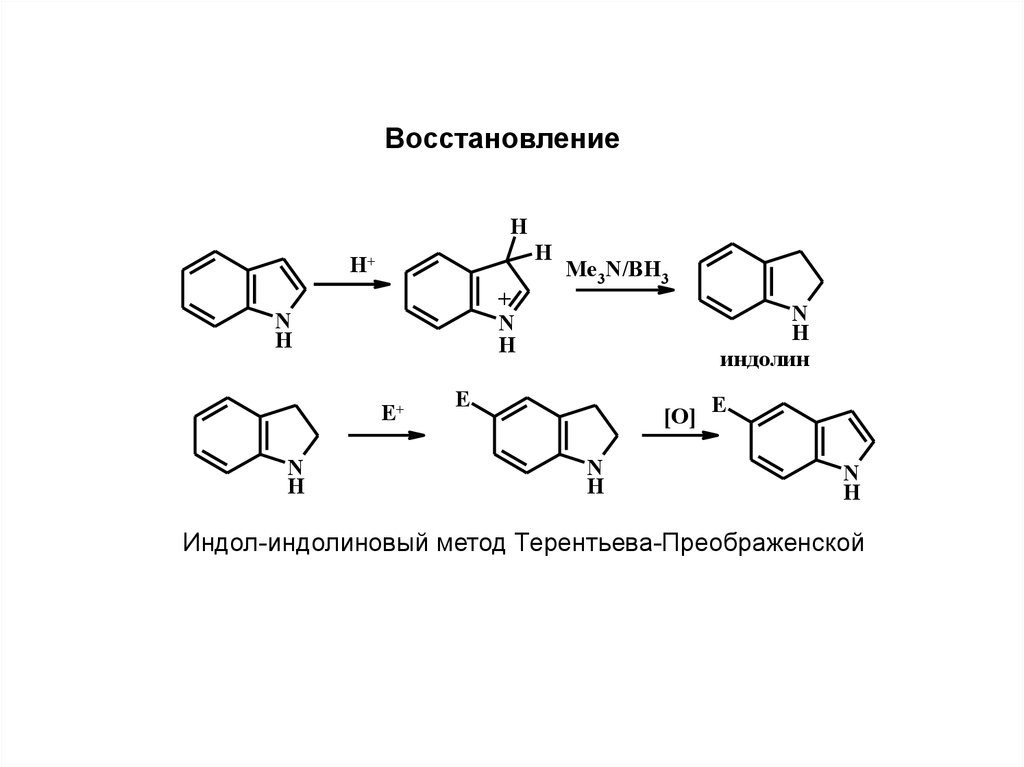
ВосстановлениеH
H
H+
+
N
H
N
H
E+
N
H
Me3N/BH3
N
H
индолин
E
[O] E
N
H
N
H
Индол-индолиновый метод Терентьева-Преображенской
25.
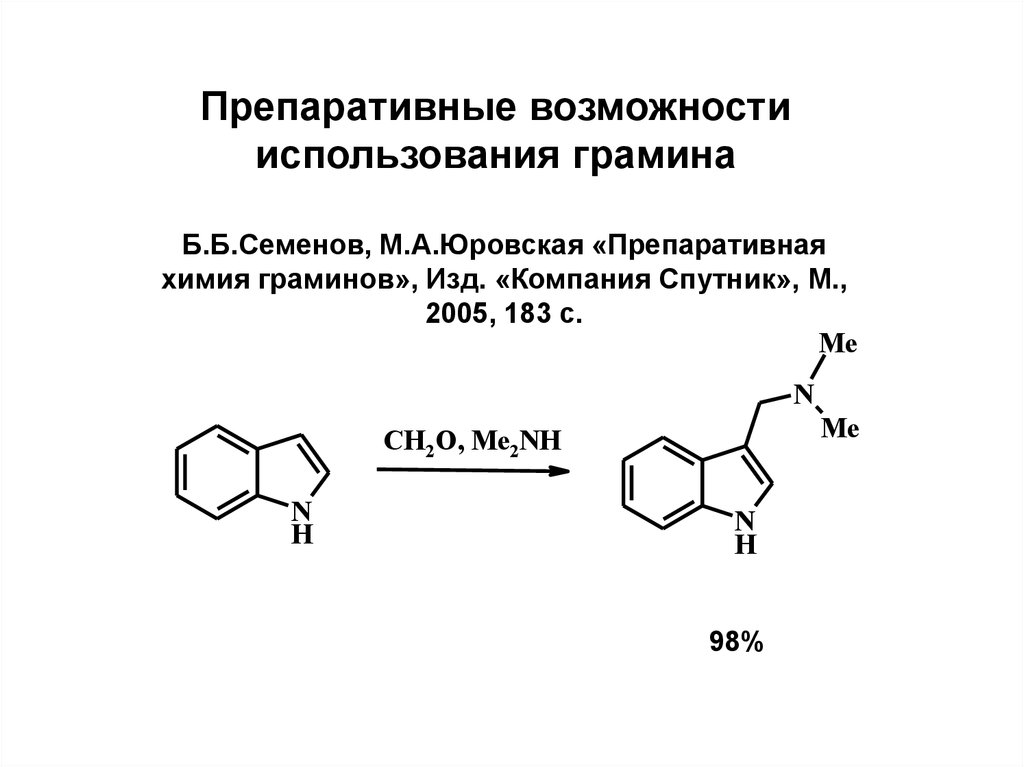
Препаративные возможностииспользования грамина
Б.Б.Семенов, М.А.Юровская «Препаративная
химия граминов», Изд. «Компания Спутник», М.,
2005, 183 с.
Me
N
Me
CH2O, Me2NH
N
H
N
H
98%
26.
Me+ Me
N
Me
N
Me
R
MeI
1
абс. этанол
N
Me
R
I-
1
N
R
~ 100%
R
Nu
R
Me
+ Me
N
Me
Nu
I-
1
N
- Me3N
R
1
R
N
R
C-, N-, S- и др. нуклофилы
27.
Реакции с С-нуклеофиламиMe
+ Me
N
CN
Me
MeSO4
N
H
-
NaCN
H2 O
N
H
100%
NO2
Me
N
N
H
Me
MeNO2
B–
N
H
98.5%
B– = раствор Mg(OMe)2, насыщнный СО2
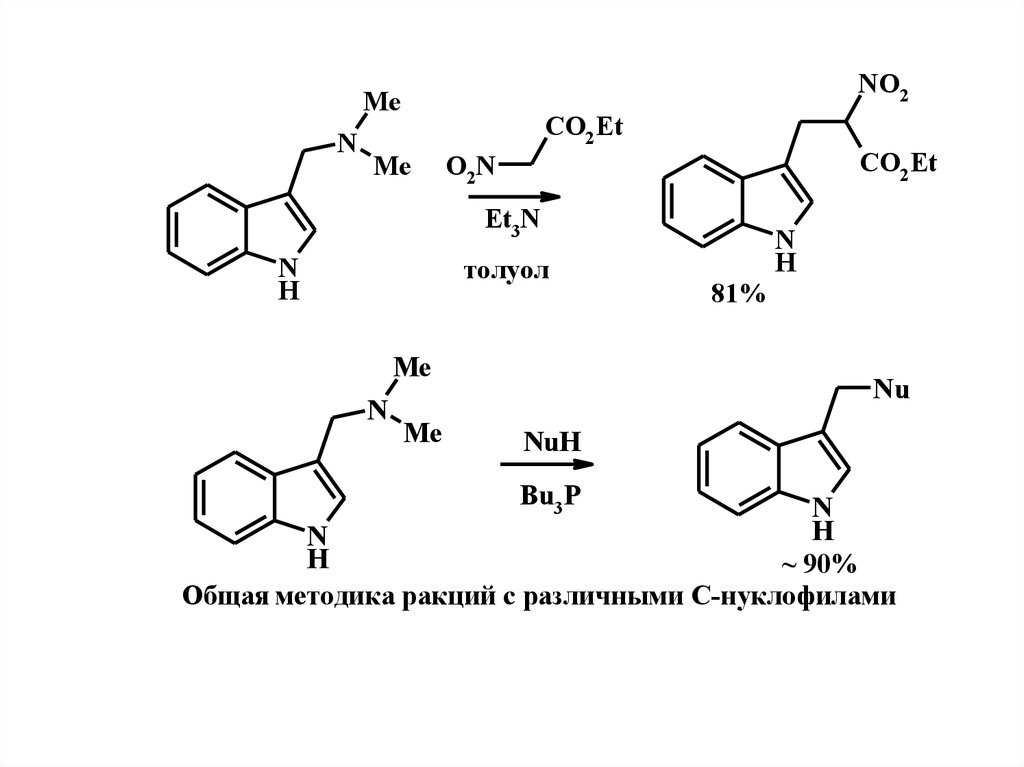
28.
NO2Me
N
CO2 Et
Me
CO2 Et
O2N
Et3N
N
H
толуол
Me
N
Me
N
H
81%
Nu
NuH
Bu3 P
N
H
N
H
~ 90%
Общая мeтодика ракций с различными С-нуклофилами
29.
AcNHMe
N
CO2 Et
CO2 Et
Me
AcNHCH(CO2 Et)2
N
H
90%
NaOH
толуол или ксилол
N
H
AcNH
Me
N
N
N
N
H
CO2 Et
Me
AcNHCH(CO2 Et)2
NaOH
толуол или ксилол
CO2 Et
N
N
N
H
46%
30.
MeH
N
Me
N
H
CO2 Et
Me
Me
OH
AcOCH(CO2 Et)2
Na, ксилол
N
N
H
CH2 Ph
Me
Me
Me
CO2 Et
OH
NaOH
спирт-вода
80%
Me
CO2 Et
CO2 Et
EtONa, EtOH
N
H
Ph
O
N
H
CO2 H
Me
Me
N
H
80%
O
CO2 H
31.
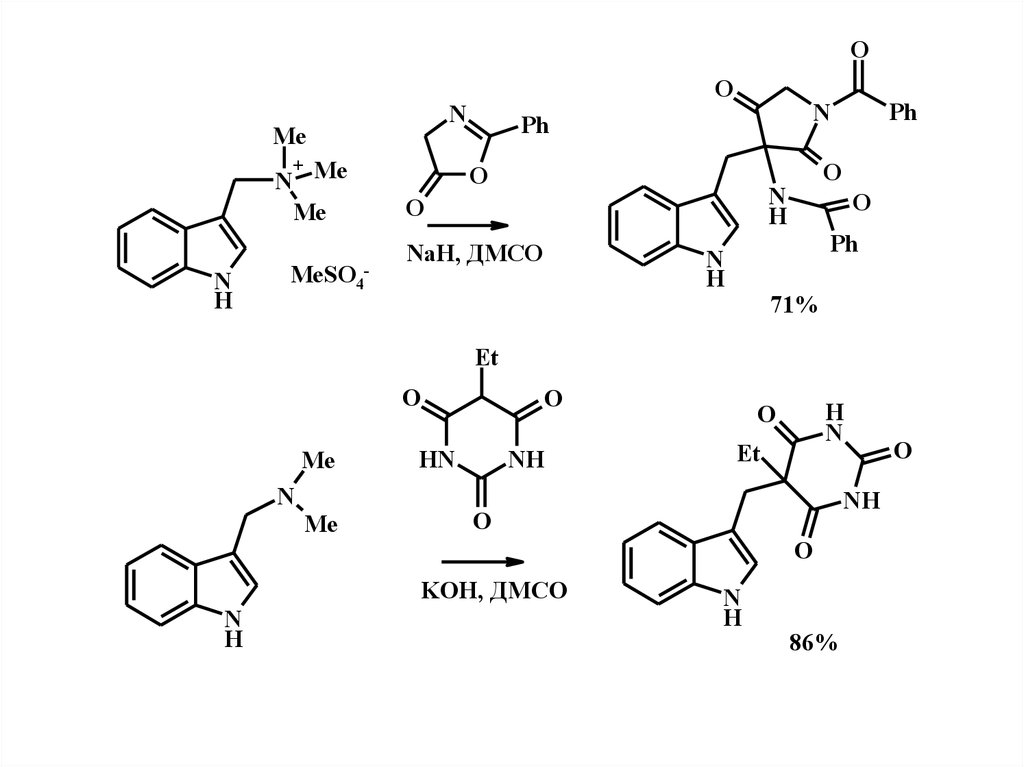
ON
Me
N Me
Me
+
N
H
MeSO4-
O
O
O
N
H
O
NaH, ДМСО
Ph
N
Ph
O
Ph
N
H
71%
Et
O
Me
N
Me
O
HN
NH
Et
NH
O
O
KOH, ДМСО
N
H
H
N
O
N
H
86%
O
32.
MeMe
N
Me
MeO2 C
N
N
MeO2 C
N Me
O
диоксан
N
H
N
H
34%
Реакции с S-нуклеофилами
Me
N
Me
SCH2 CO2 H
HSCH2 CO2 H
NaOH
N
H
N
H
90 %
33.
Реакции с N-нуклеофиламиMe
N
Me
RNH2
избыток амина
- Me2NH
N
H
N
NHR
Me
CO2 H
Me
NH2
+
N
H
N
H
H2 O
N
H
50-90 %
H
N
N
H
CO2 H
N
H
23 %
34.
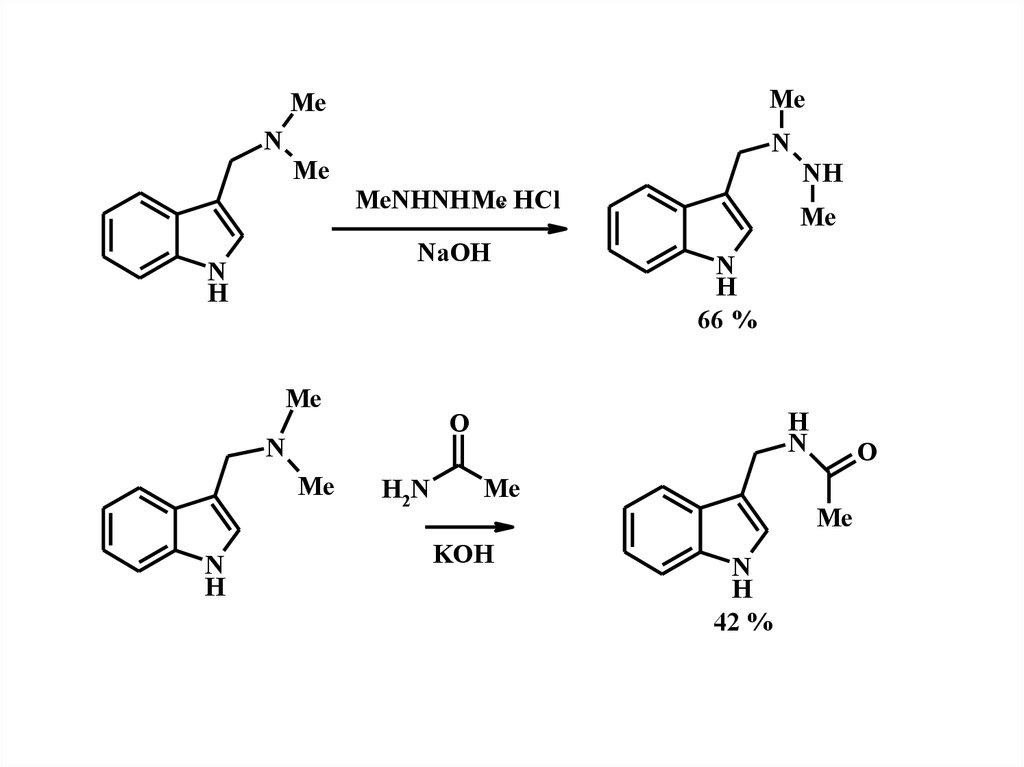
MeMe
N
Me
N
MeNHNHMe. HCl
NaOH
N
H
Me
N
H
Me
N
H
66 %
H
N
O
N
Me
NH
H2N
O
Me
Me
KOH
N
H
42 %
35.
MeH
N
N
Me
вода
N
H
Me
N
N
Me
N
H
O
PhSO2NH2
O
Ph
N
H
N
N
N
H
ксилол
S
N
H
65 %
36.
Реакции с О-нуклеофиламиMe
+
N Me
Me
I-
N
H
OH
NaOH
эфир
N
H
66 %
Me
Me
O
N
Me
N
H
AcONa
Ac2 O
N
Me
O
88 %
O
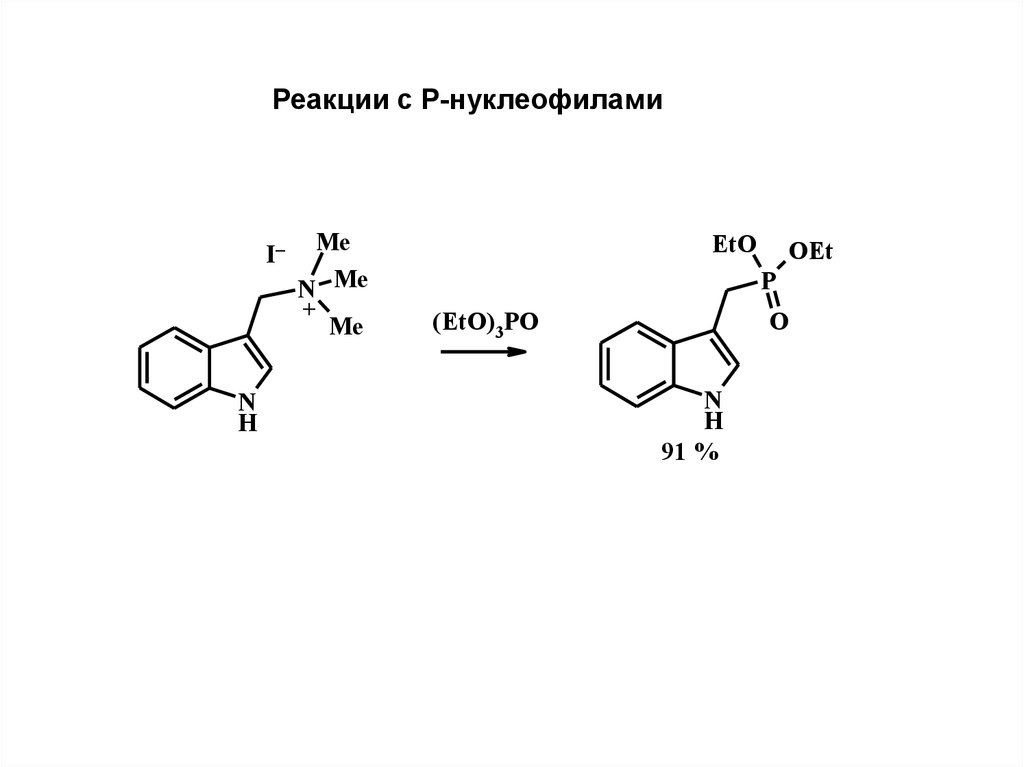
37.
Реакции с Р-нуклеофиламиI–
N
H
Me
N Me
+
Me
EtO
OEt
P
(EtO)3 PO
O
N
H
91 %























 Химия
Химия