Похожие презентации:
Электронное и пространственное строение молекул органических соединений – основа биологической активности
1. Электронное и пространственное строение молекул органических соединений – основа биологической активности
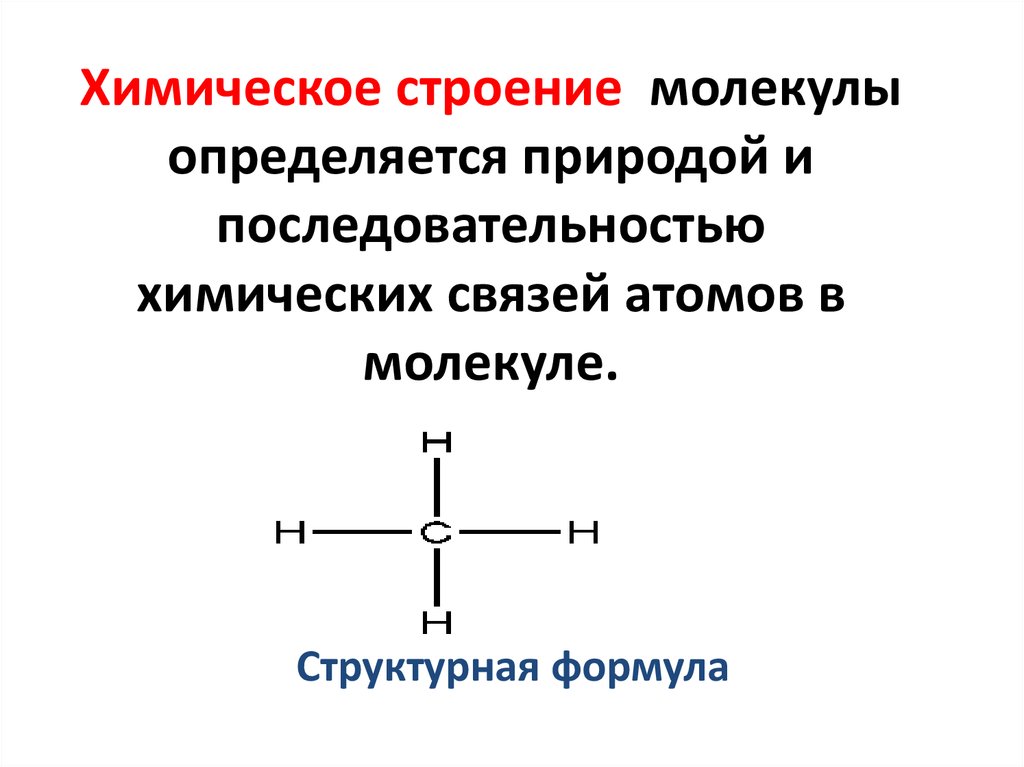
2. Химическое строение молекулы определяется природой и последовательностью химических связей атомов в молекуле.
НН-С–Н
Н
Структурная формула
3.
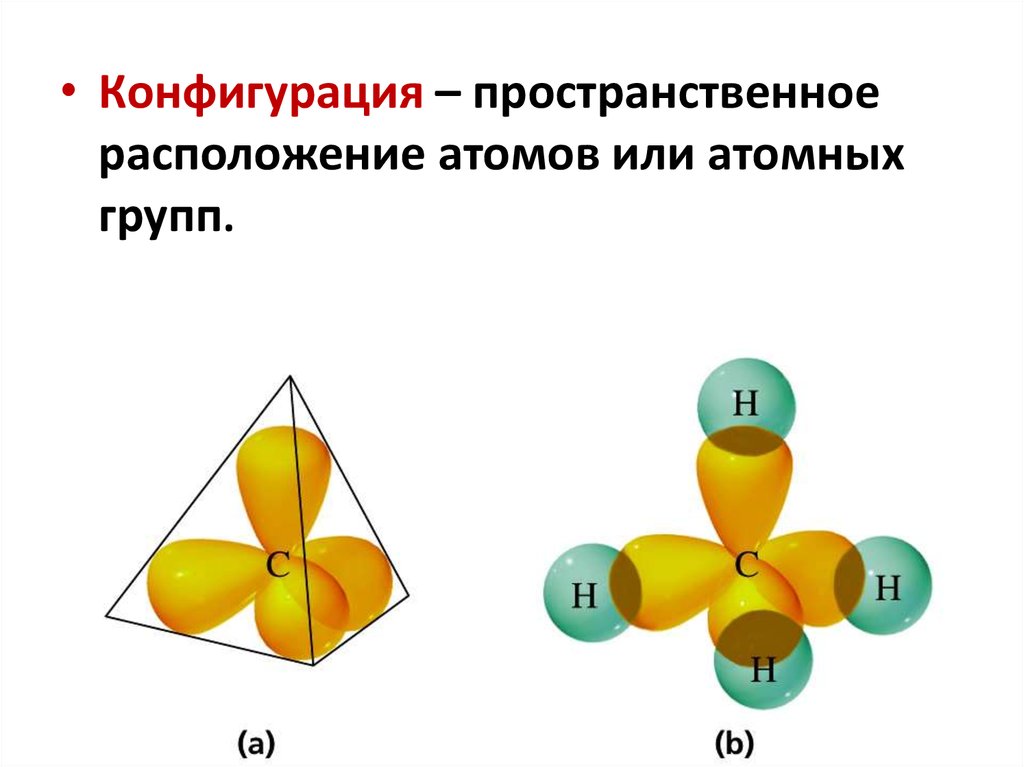
• Конфигурация – пространственноерасположение атомов или атомных
групп.
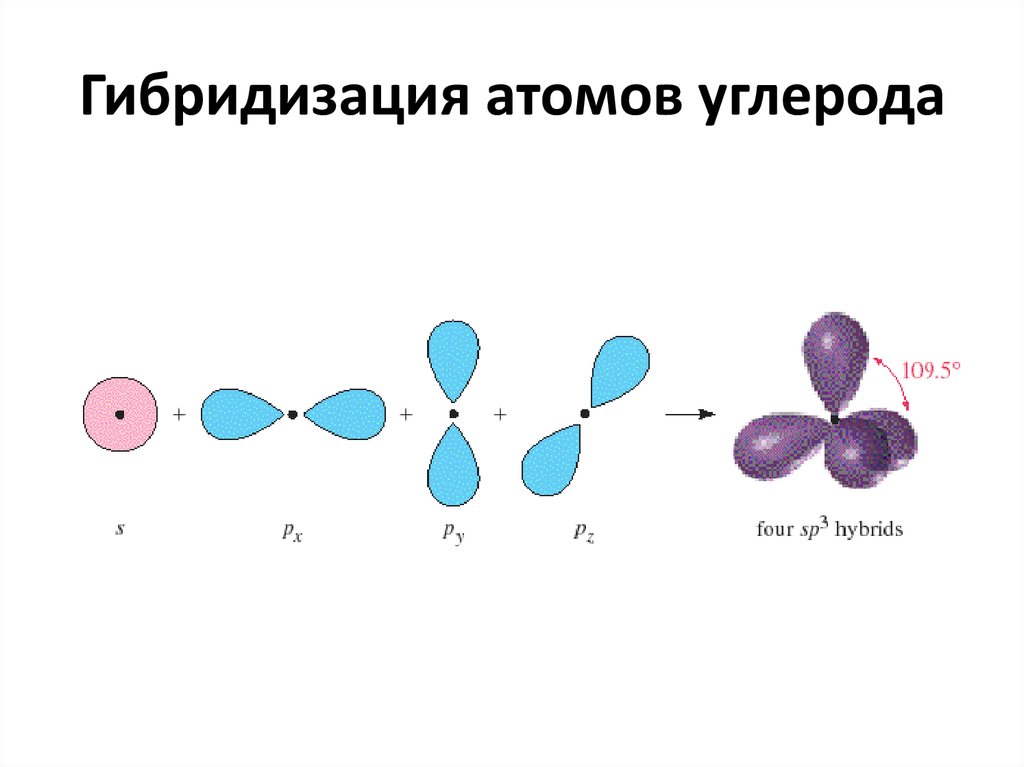
4. Гибридизация атомов углерода
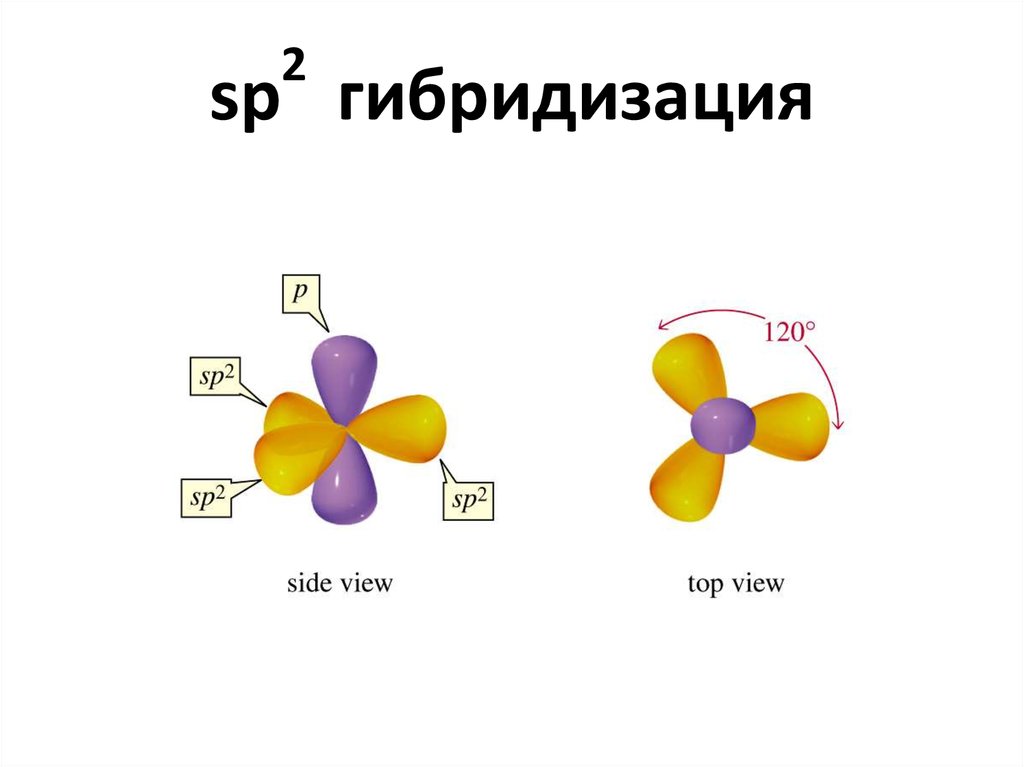
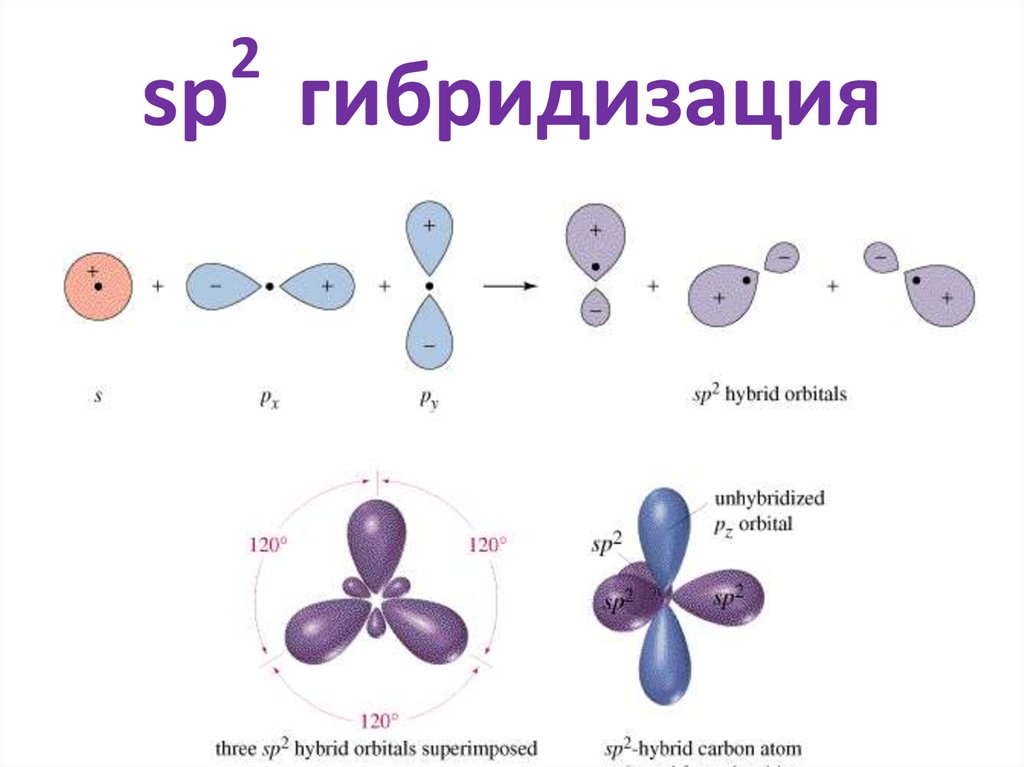
5. sp2 гибридизация
2sp гибридизация
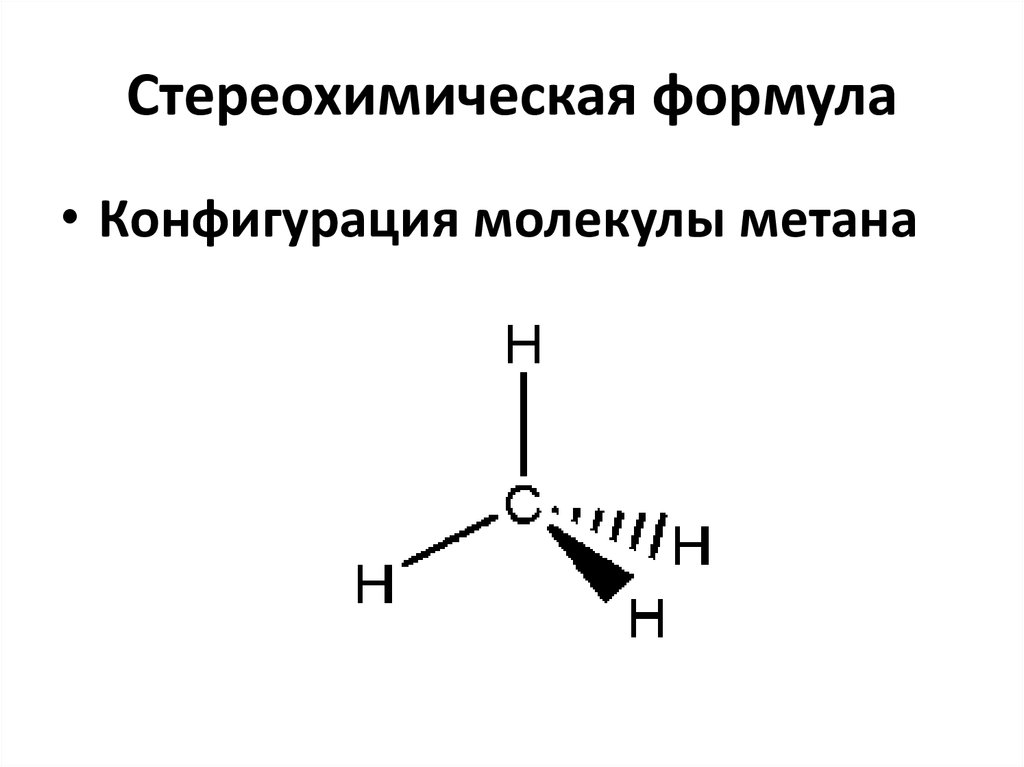
6. Стереохимическая формула
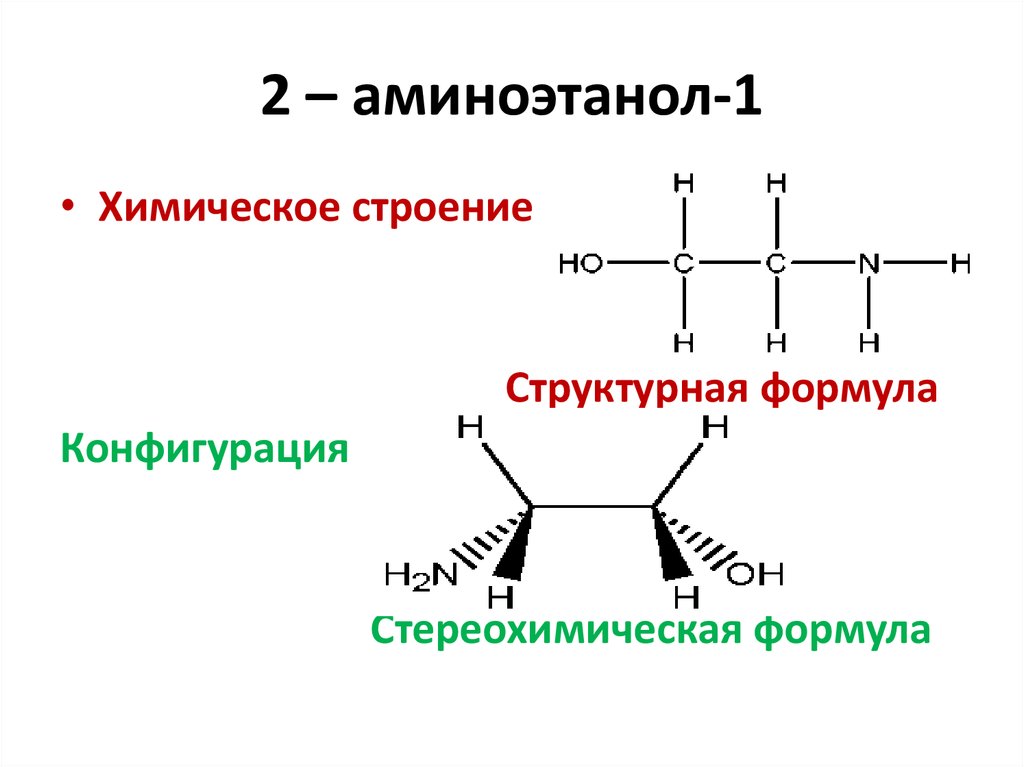
• Конфигурация молекулы метана7. 2 – аминоэтанол-1
• Химическое строениеСтруктурная формула
Конфигурация
Стереохимическая формула
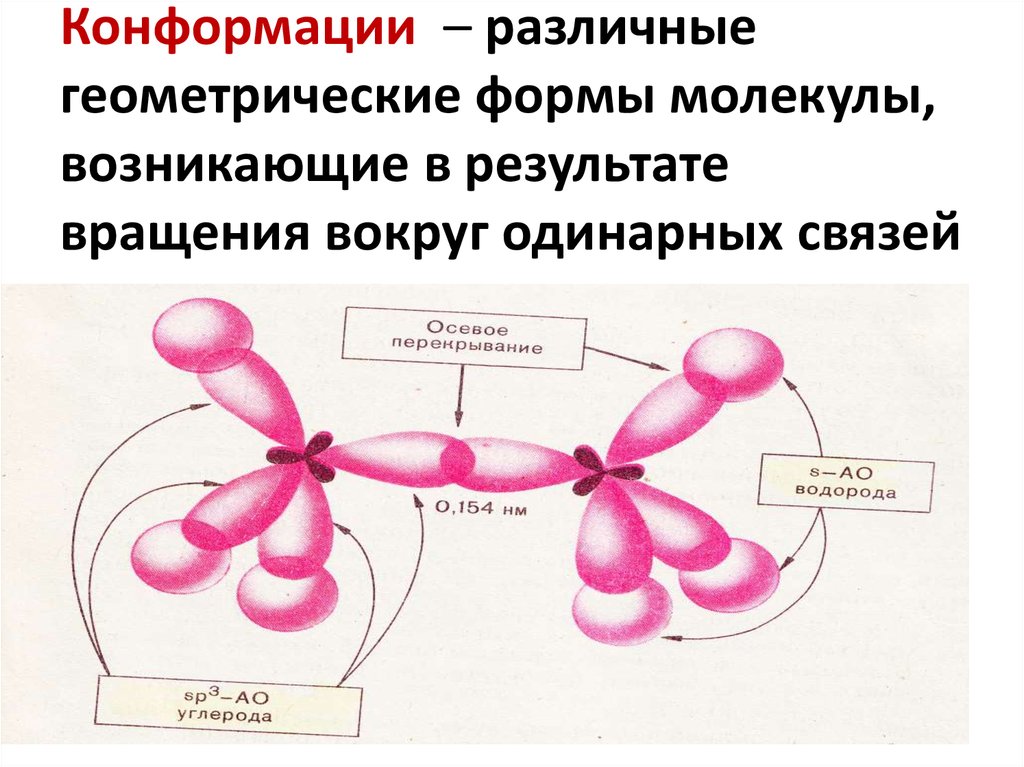
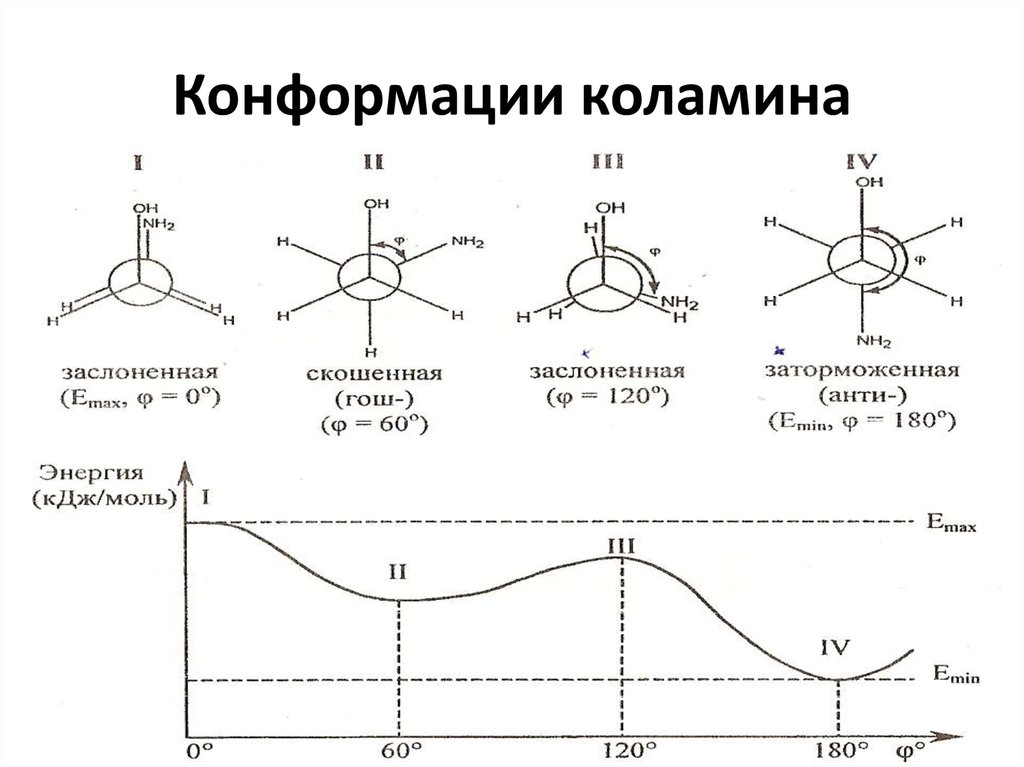
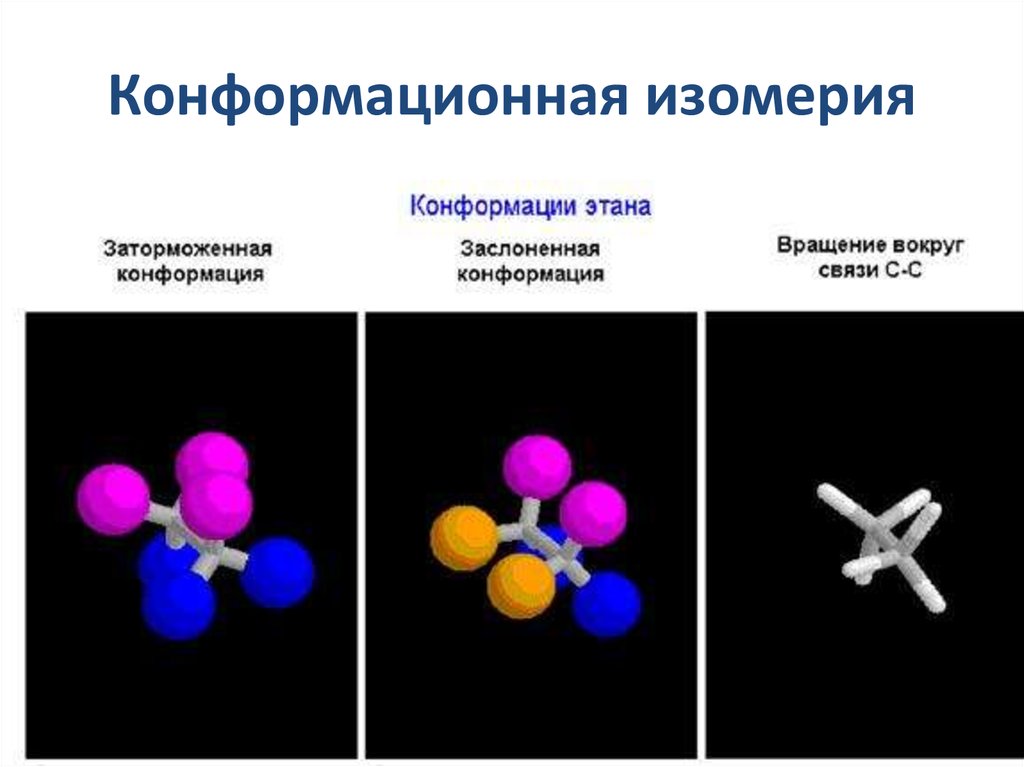
8. Конформации – различные геометрические формы молекулы, возникающие в результате вращения вокруг одинарных связей
9.
10. Проекции Ньюмена
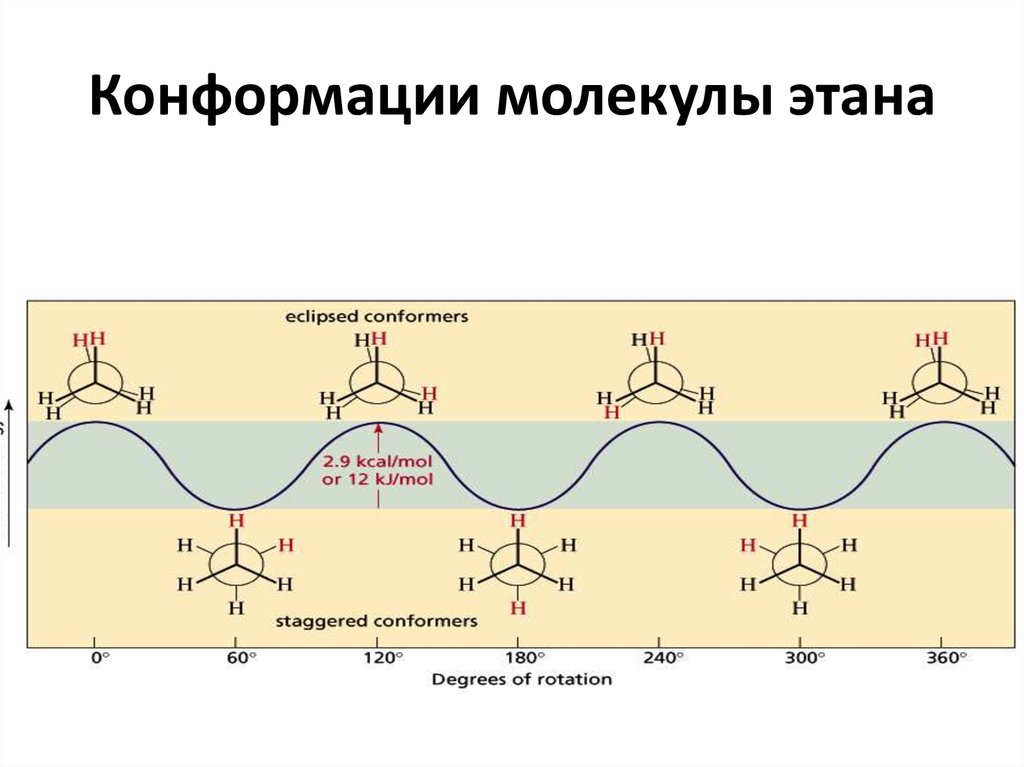
11. Конформации молекулы этана
12. Конформации коламина
13.
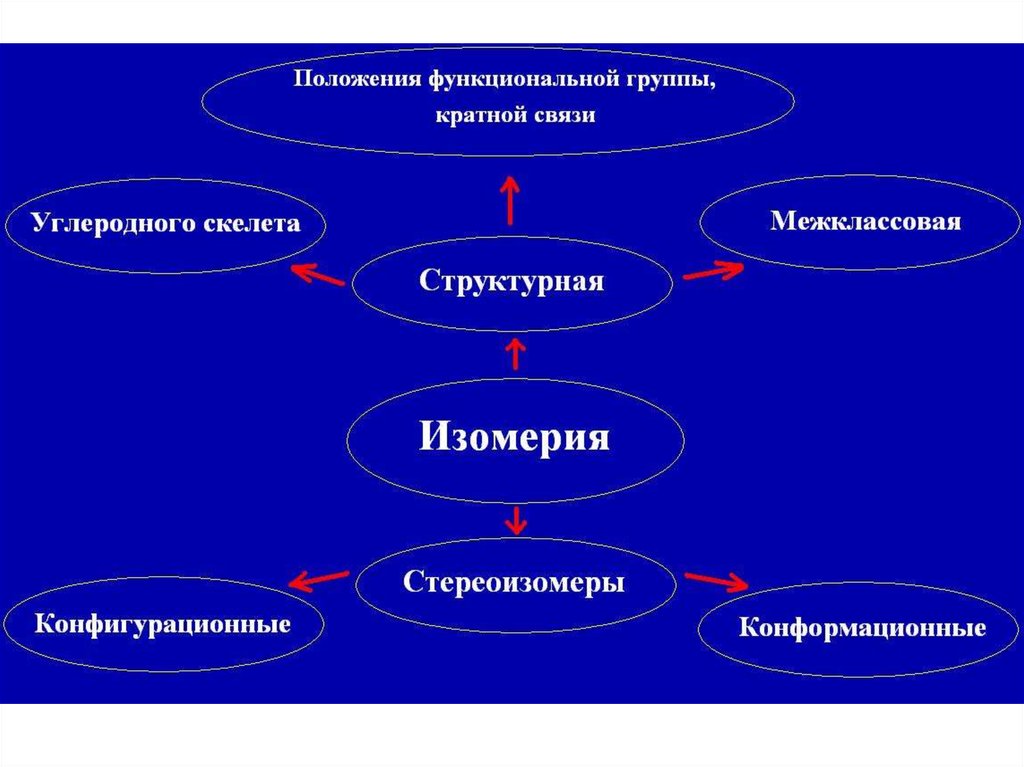
14. Структурная изомерия
- углероднойцепи
( бутан , изобутан)
- положения кратных связей
(бутен-1,бутен- 2)
- положения функциональных групп
(пропанол-1, пропанол-2)
- межклассовая изомерия
(гексан, циклогексан)
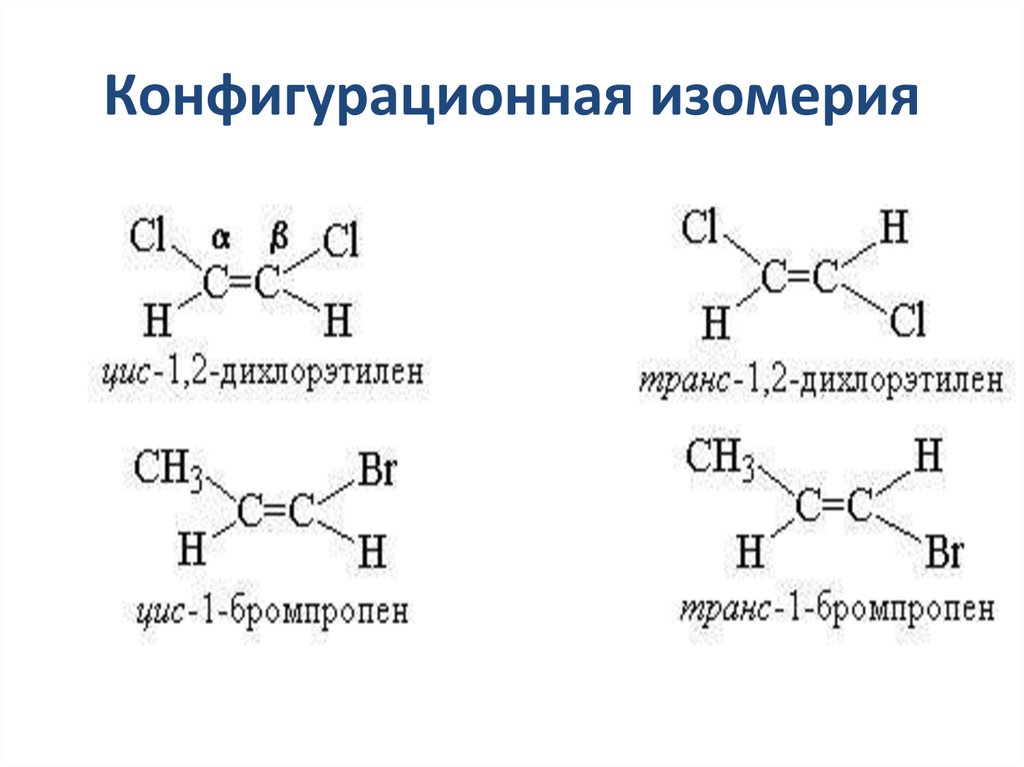
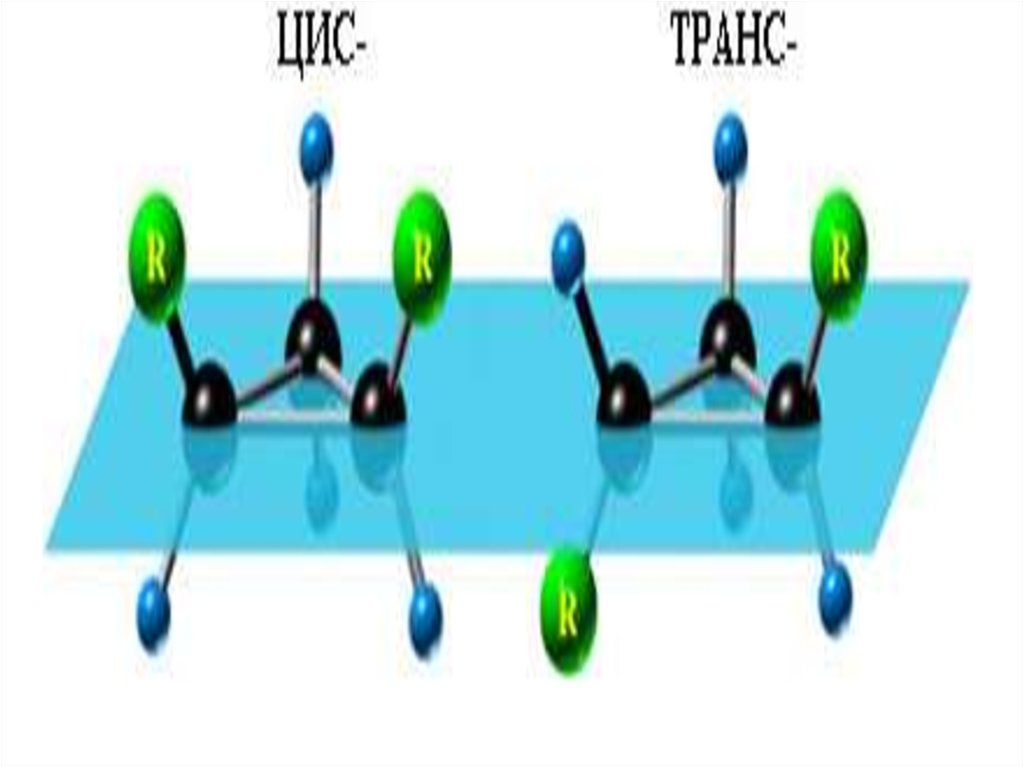
15. Конфигурационная изомерия
16.
17. Конформационная изомерия
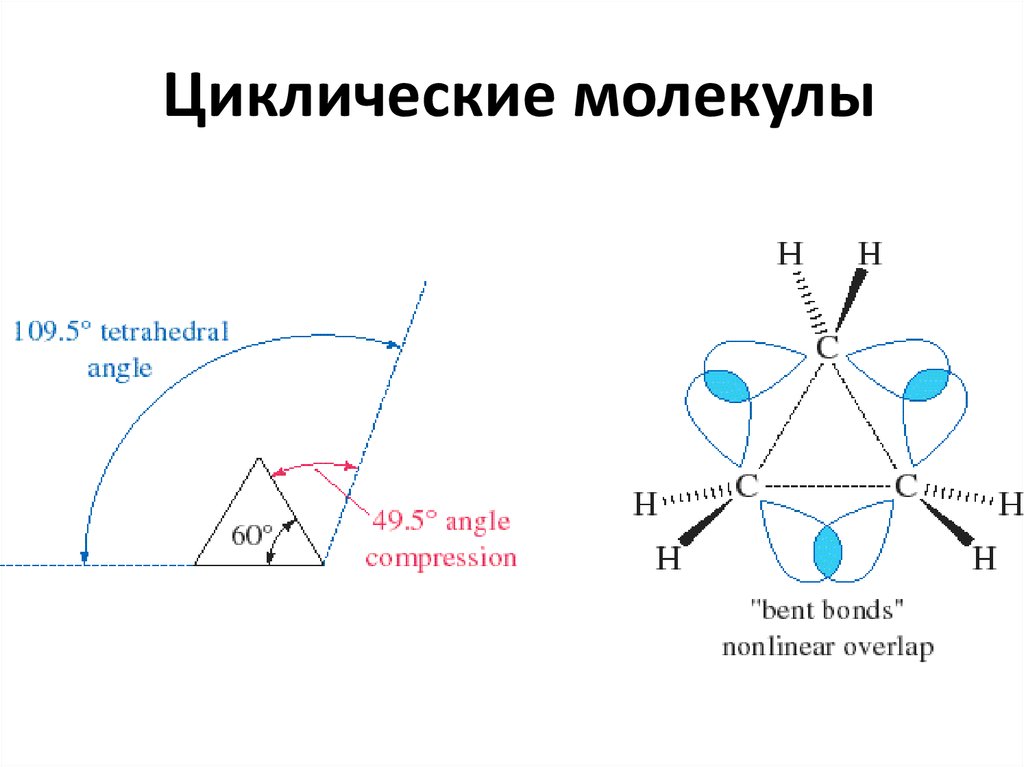
18. Циклические молекулы
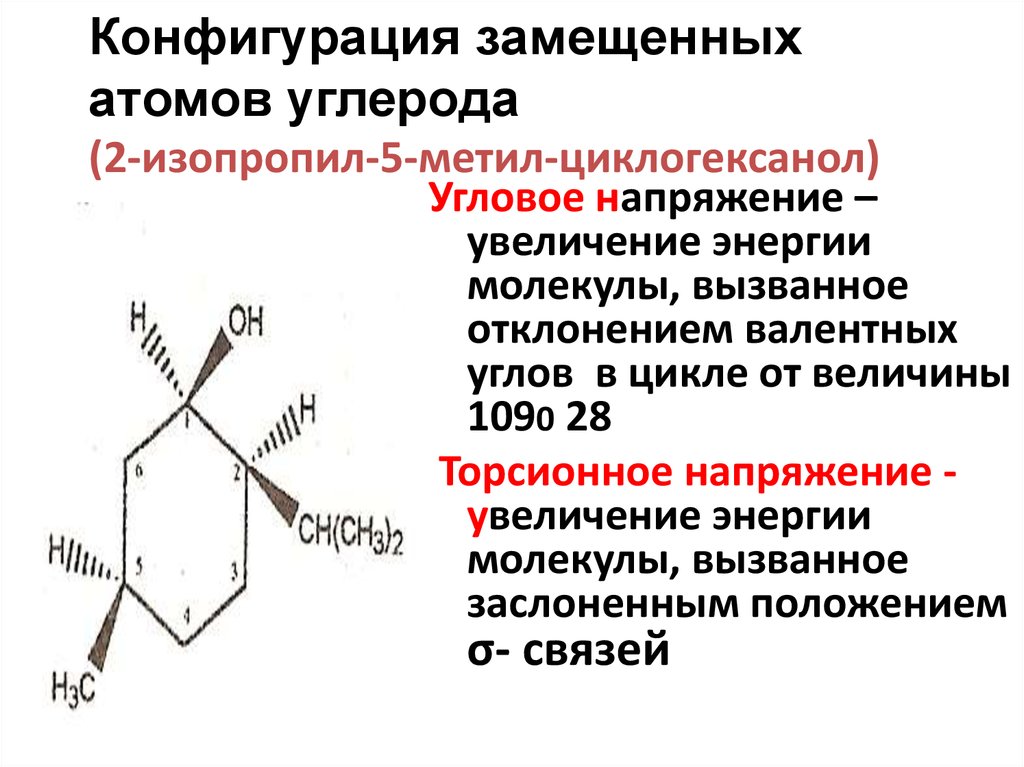
19. Конфигурация замещенных атомов углерода (2-изопропил-5-метил-циклогексанол)
Угловое напряжение –увеличение энергии
молекулы, вызванное
отклонением валентных
углов в цикле от величины
1090 28
Торсионное напряжение увеличение энергии
молекулы, вызванное
заслоненным положением
σ- связей
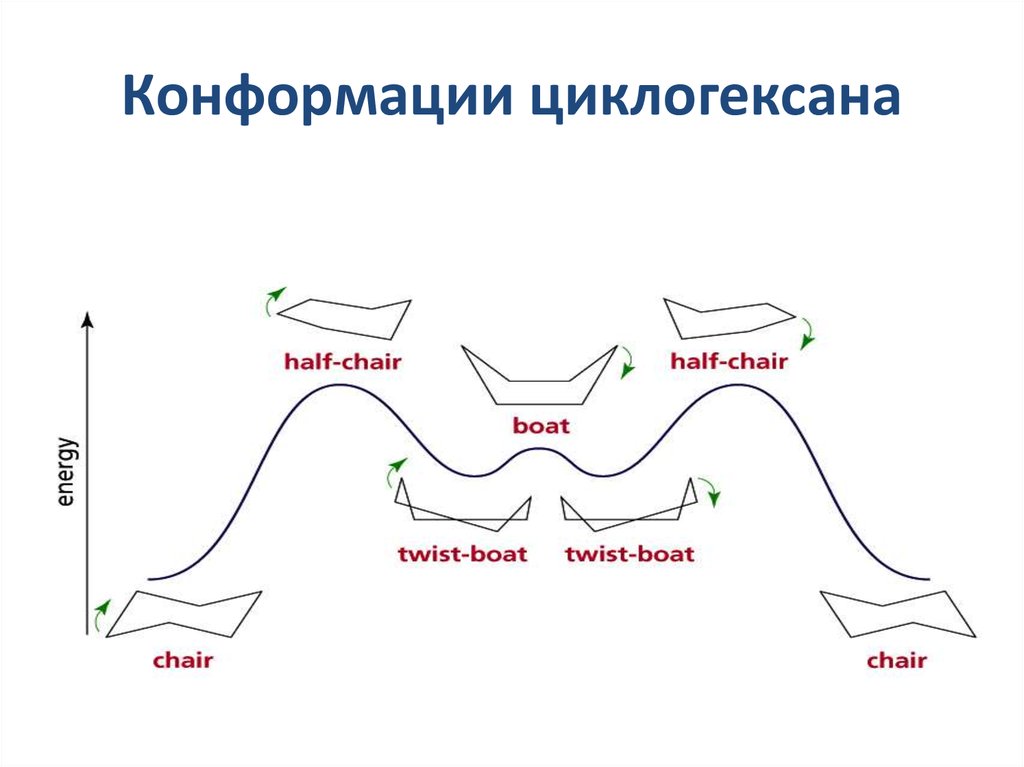
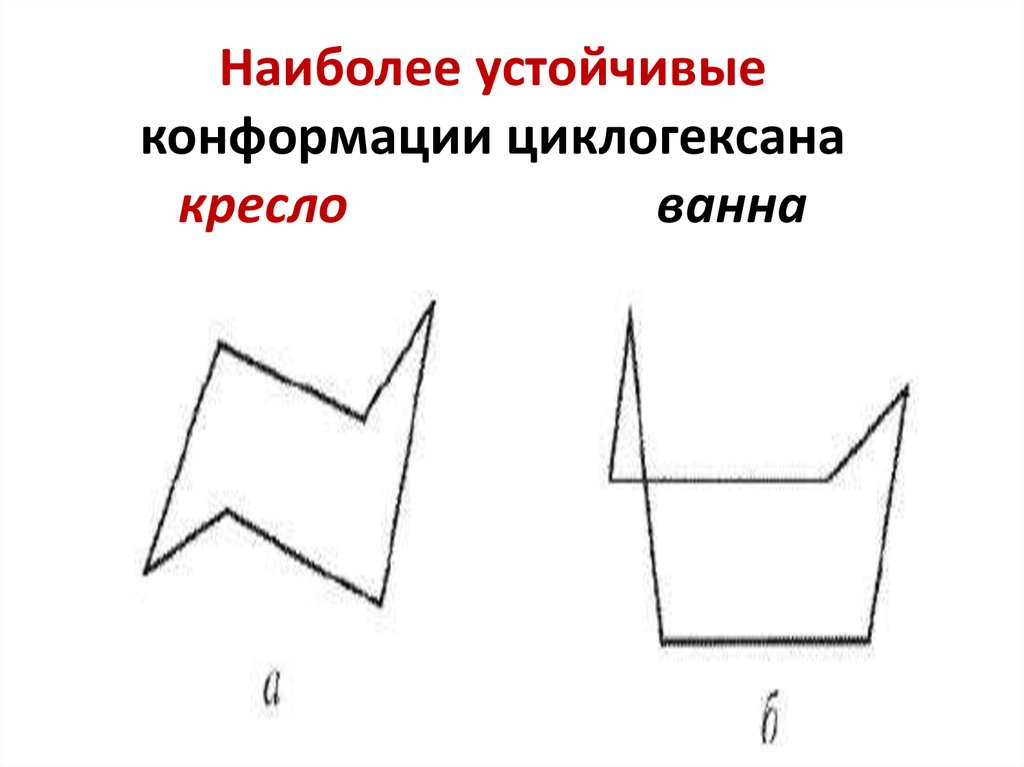
20. Конформации циклогексана
21. Наиболее устойчивые конформации циклогексана кресло ванна
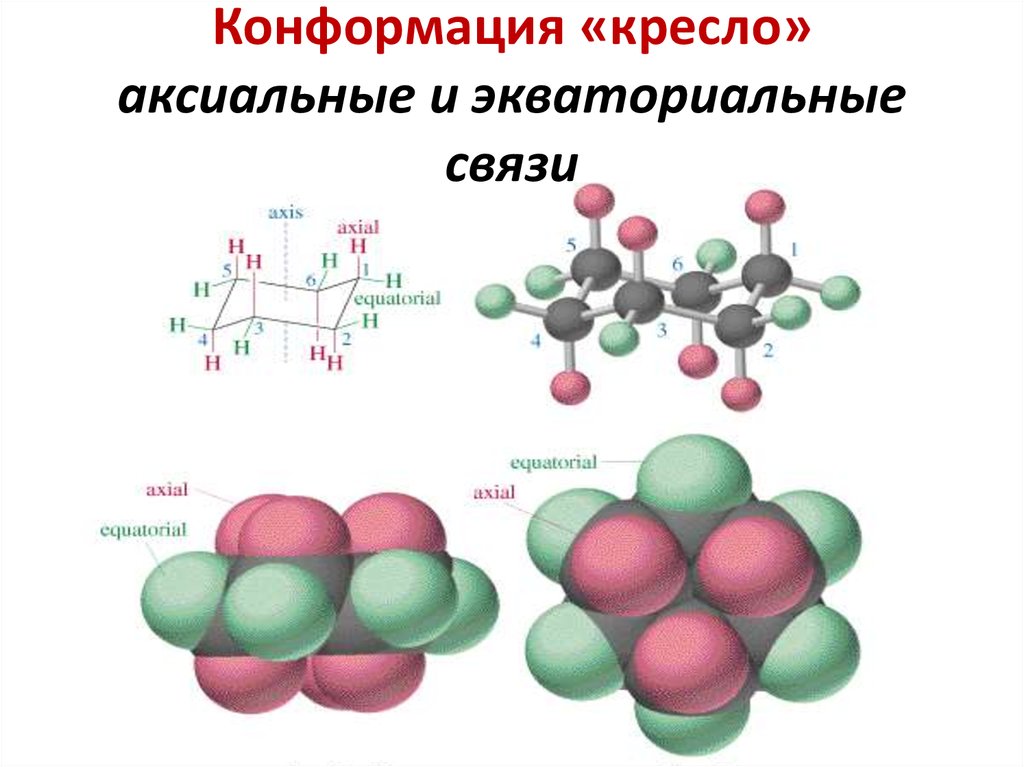
22. Конформация «кресло» аксиальные и экваториальные связи
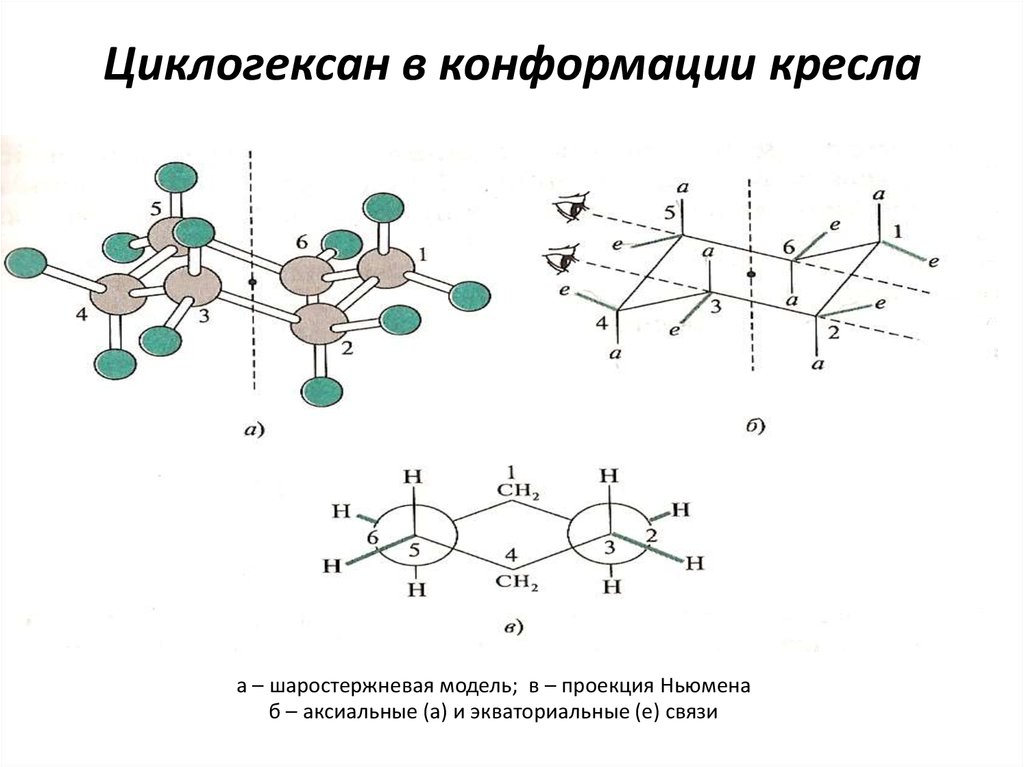
23. Циклогексан в конформации кресла
а – шаростержневая модель; в – проекция Ньюменаб – аксиальные (а) и экваториальные (е) связи
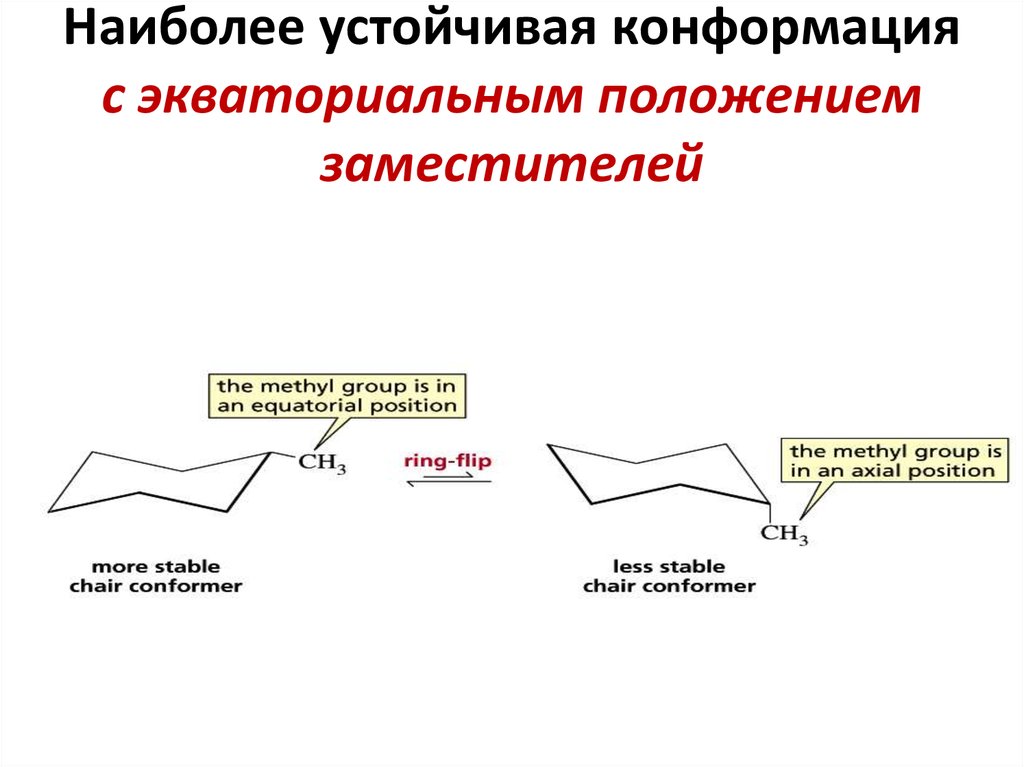
24. Наиболее устойчивая конформация с экваториальным положением заместителей
25.
Сопряжение и ароматичность –энергетический фактор стабилизации
молекул биологически активных
соединений
26.
Классификация двойных связей порасположению в молекуле
СН2=СН-(СН2)-СН=СН2
Изолированные двойные связи
СН2=С=СН2
Кумулированные двойные связи
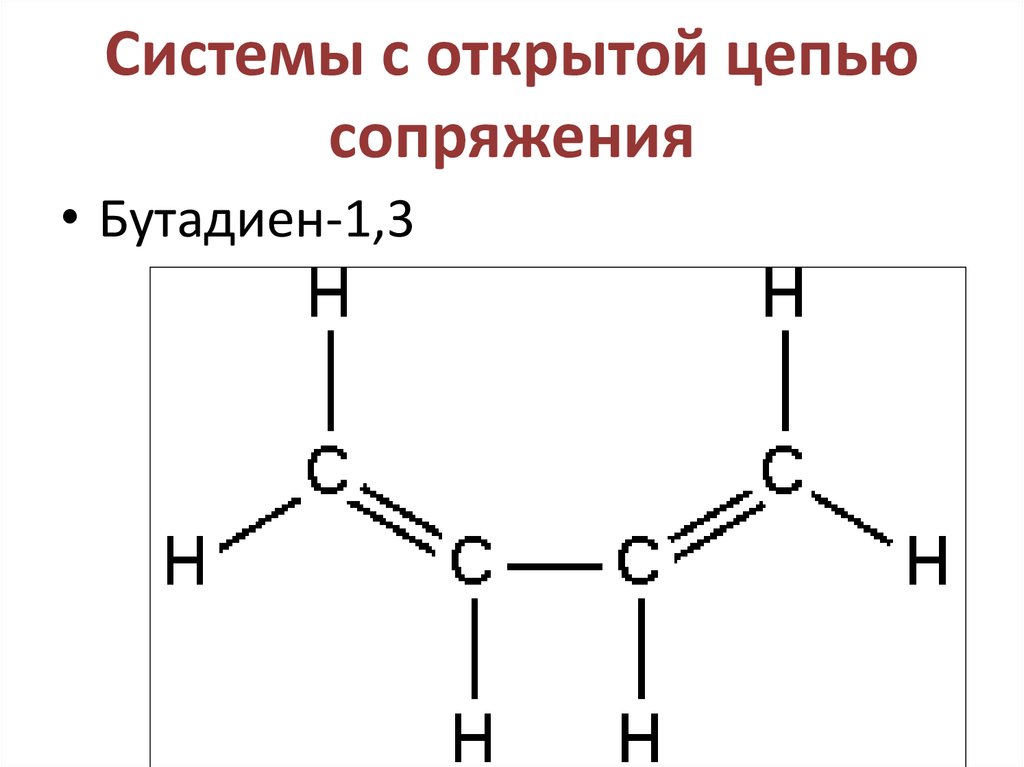
СН2=СН-СН=СН2
Сопряженные двойные связи
27. sp2 гибридизация
2sp гибридизация
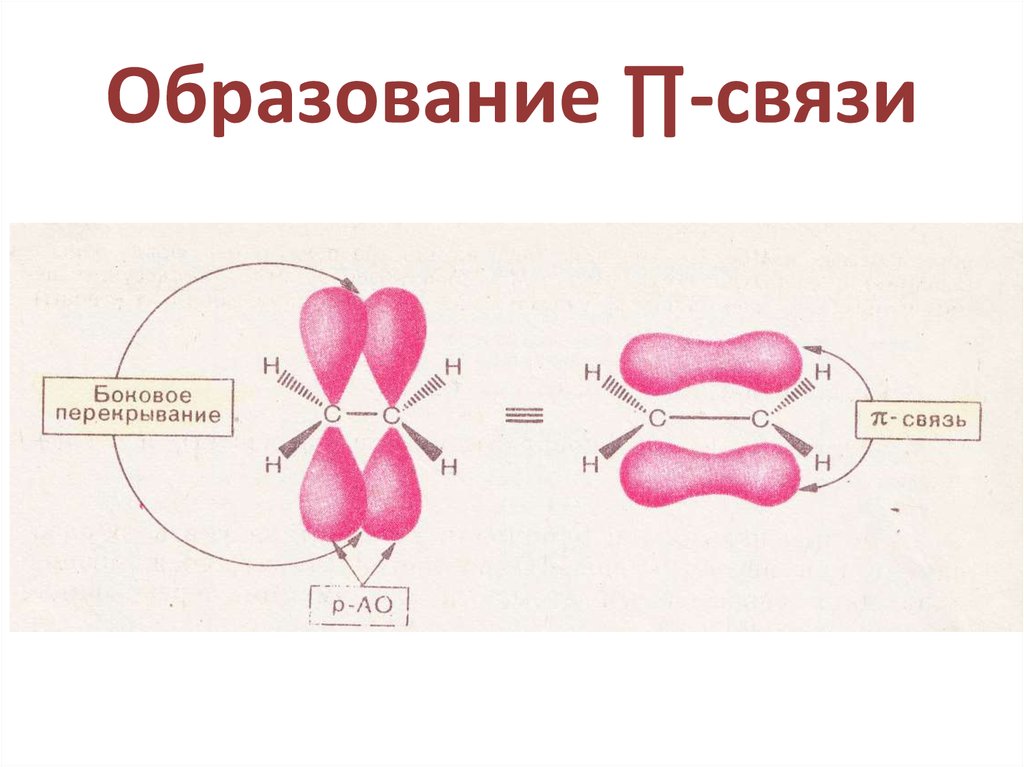
28. Образование ∏-связи
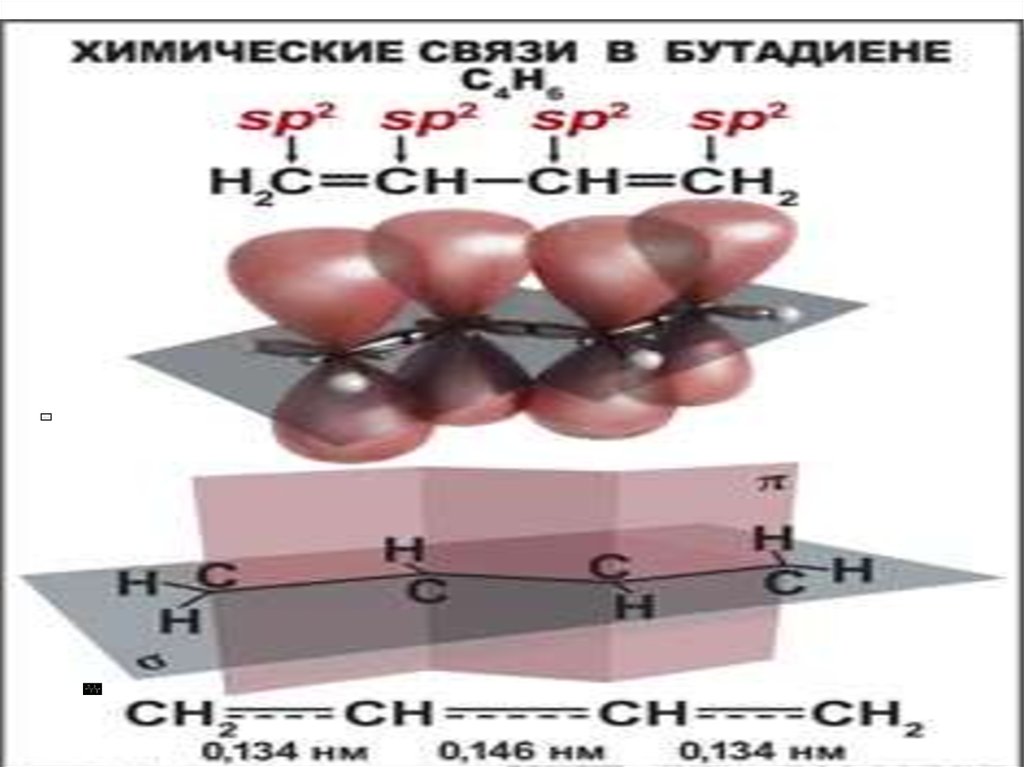
29. Сопряжение – перераспределение электронной плотности в молекуле, приводящее к выравниванию связей по длине и энергии
• Энергия сопряжения –уменьшение энергии молекулы
вследствие сопряжения.
30. Системы с открытой цепью сопряжения
• Бутадиен-1,331.
Алифатические системы32. Типы сопряжения
• π-π – сопряжениеСН2=СН-СН=0
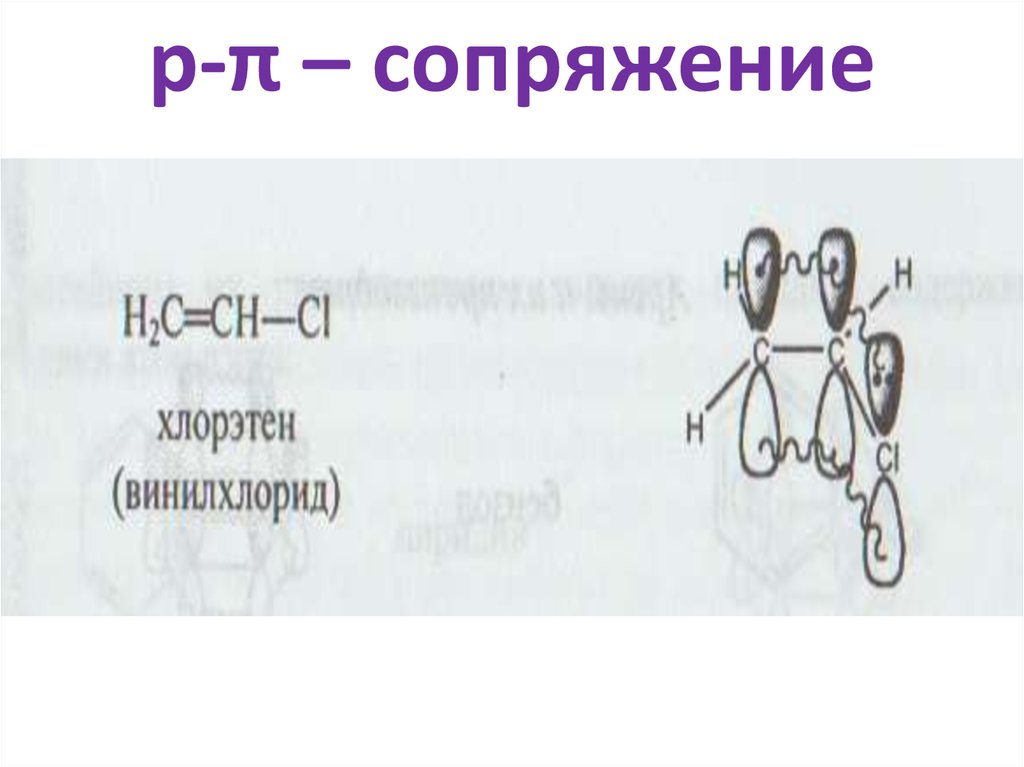
• р-π – сопряжение
СН2=СН-ОН
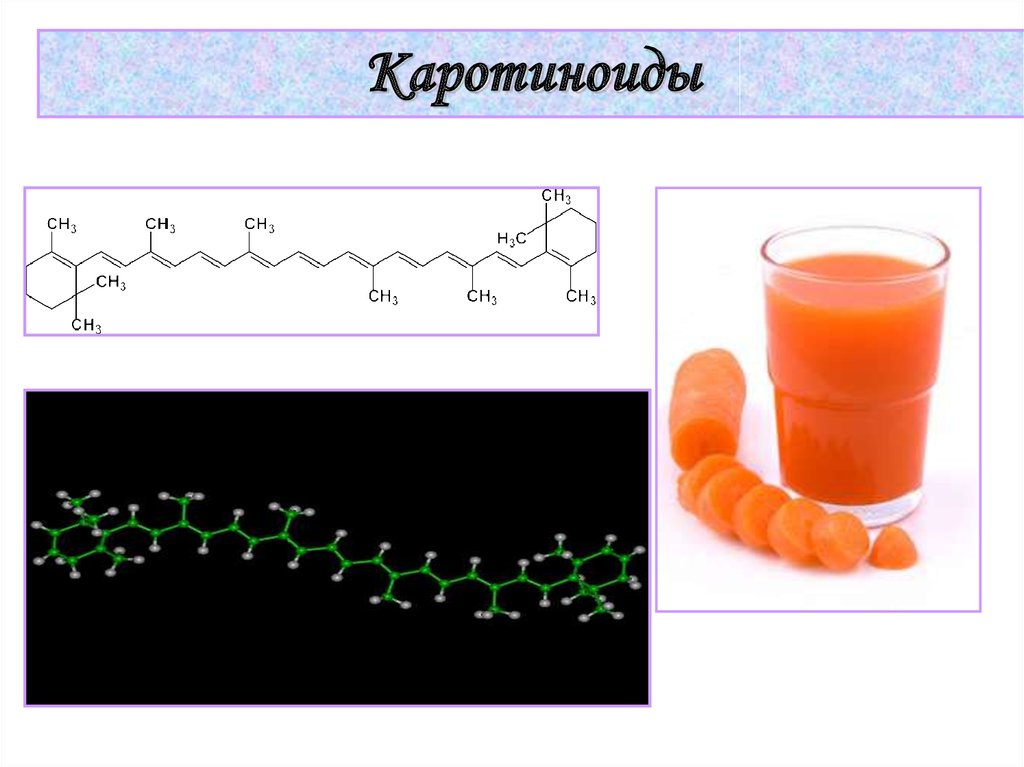
33.
Каротиноиды34.
Химические основы процессазрительного восприятия
35. р-π – сопряжение
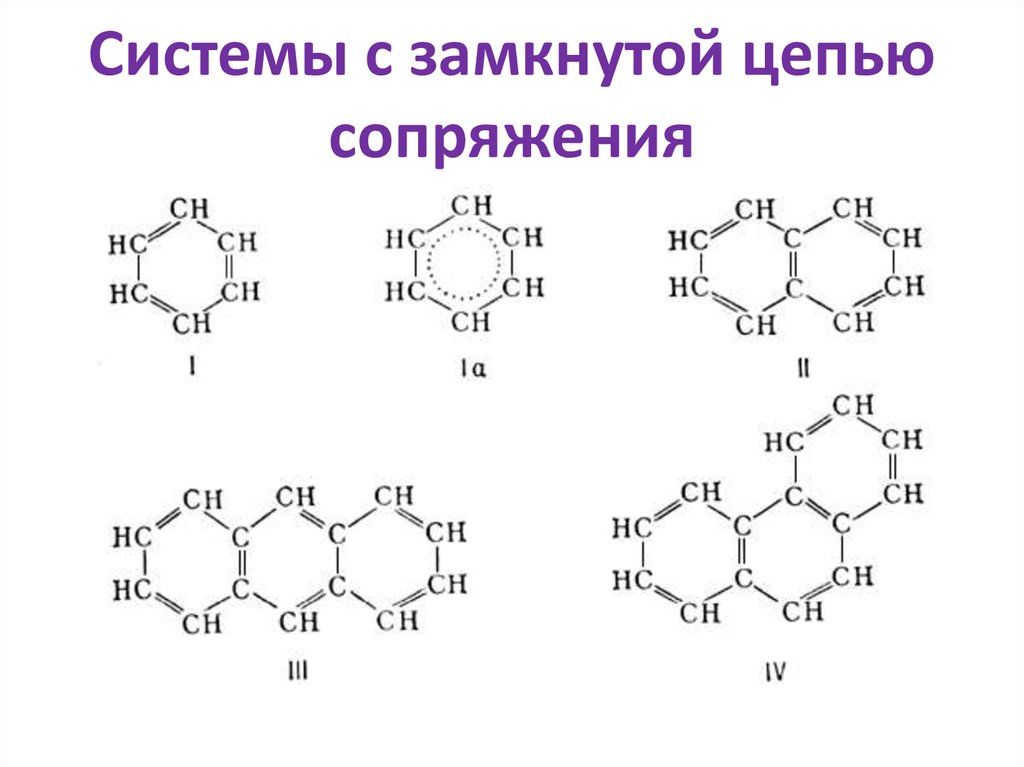
36. Системы с замкнутой цепью сопряжения
37. Есопр. Замкнутых ˃ Есопр.открытых
Критерии ароматичности• Плоский замкнутый цикл
• Замкнутая сопряженная система
• Число электронов в сопряженной
системе = 4n + 2, где n – простое целое
число (правило Хюккеля)
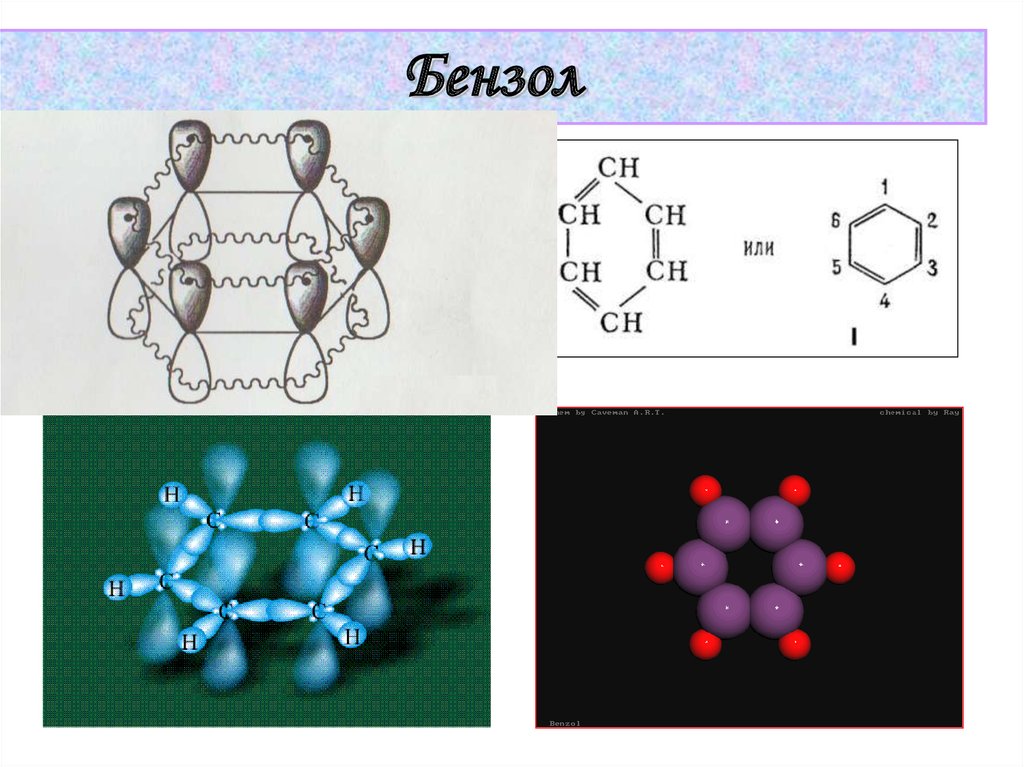
38.
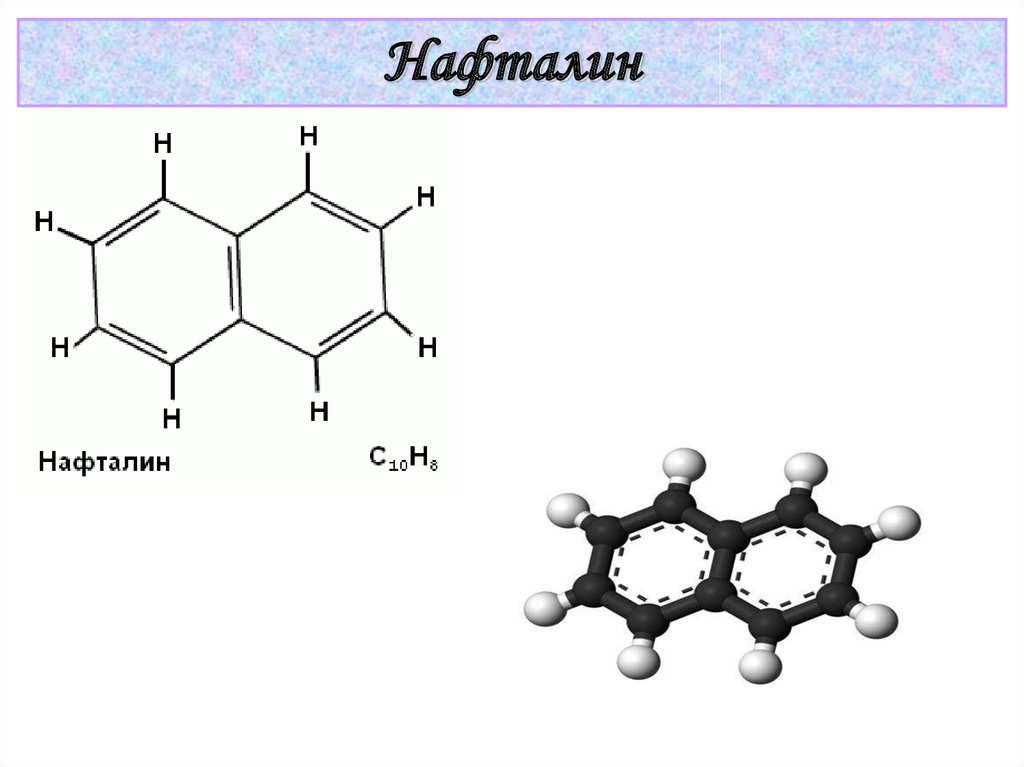
Бензол39.
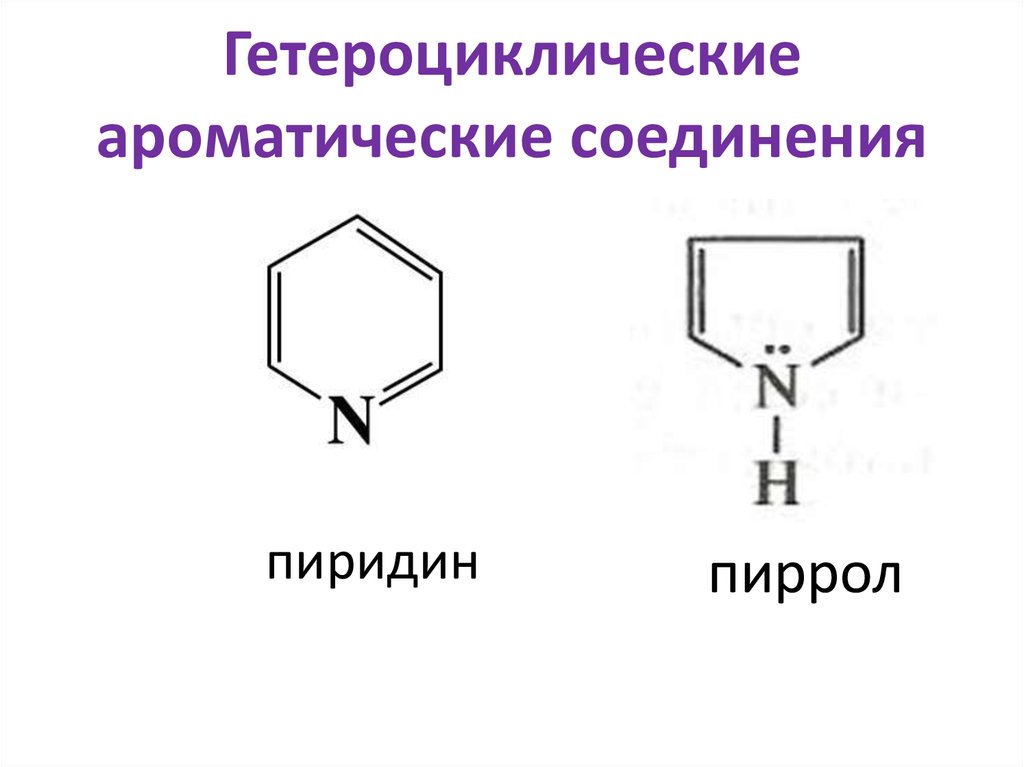
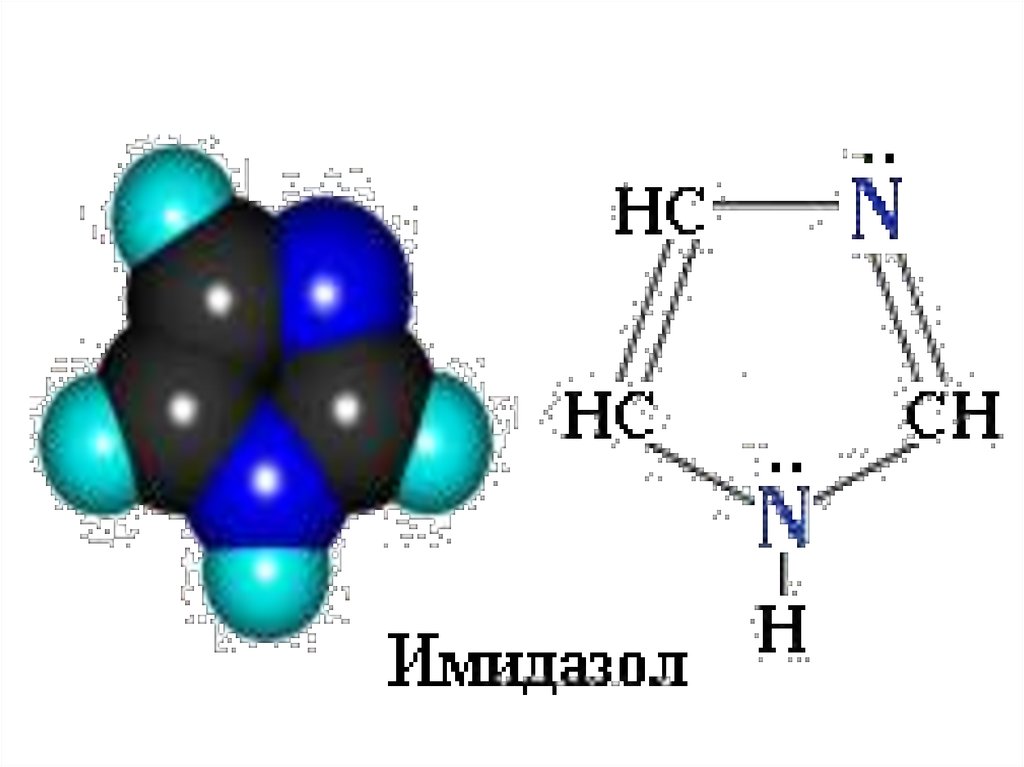
Нафталин40. Гетероциклические ароматические соединения
пиридинпиррол
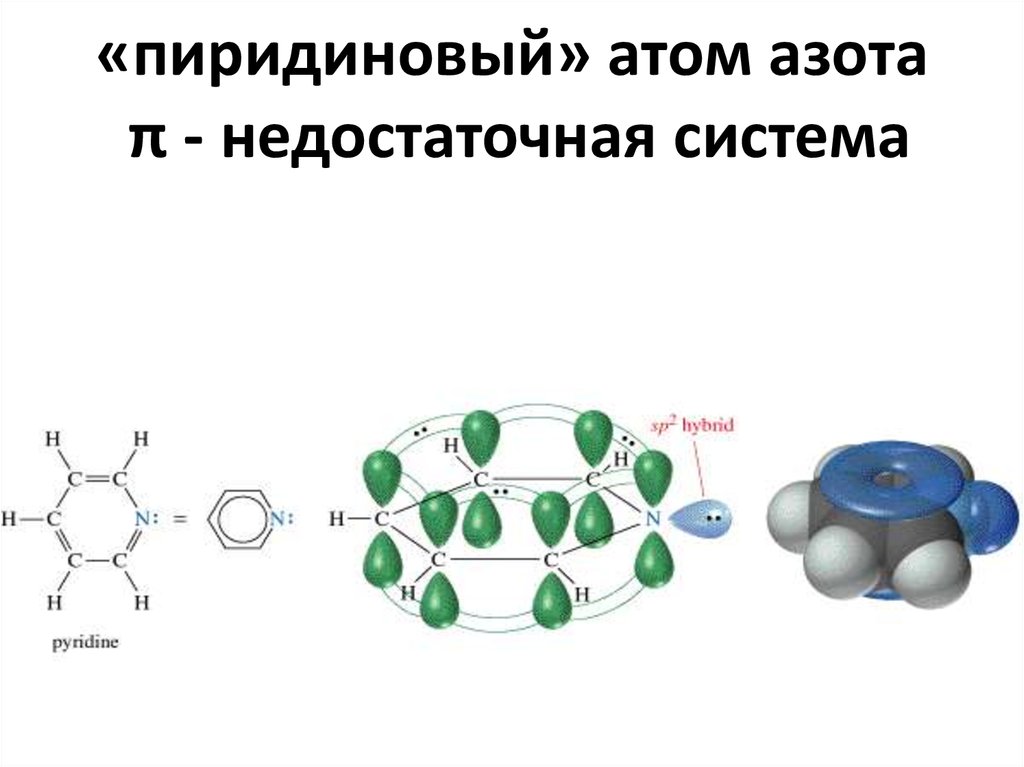
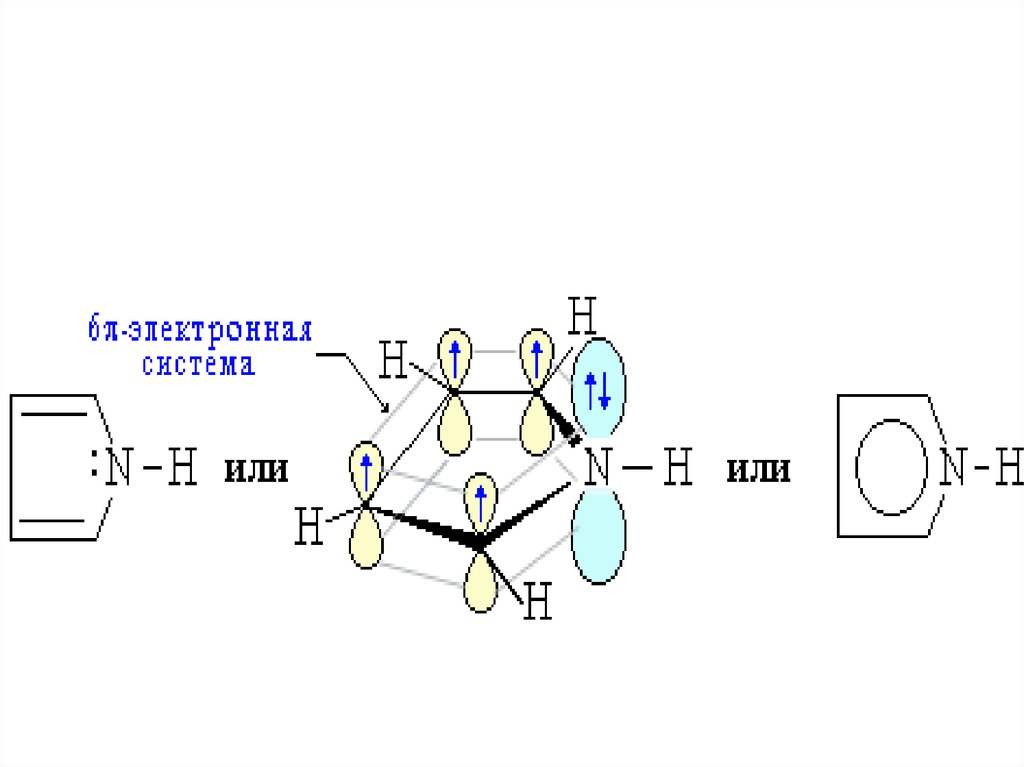
41. «пиридиновый» атом азота π - недостаточная система
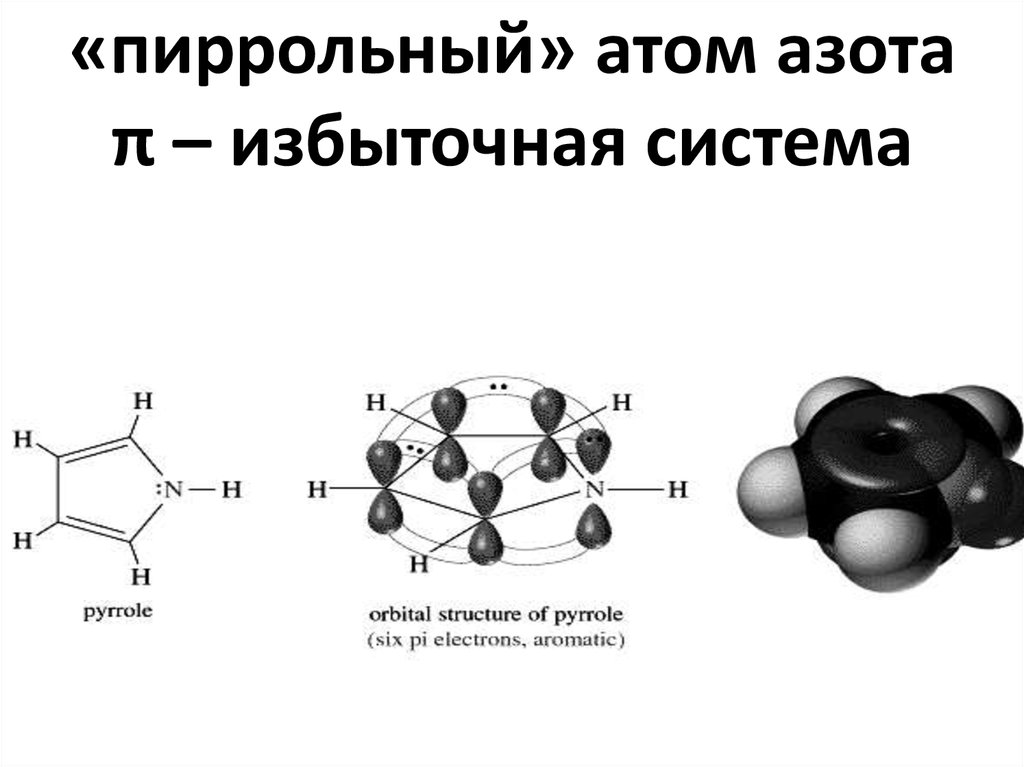
42. «пиррольный» атом азота π – избыточная система
43.
44.
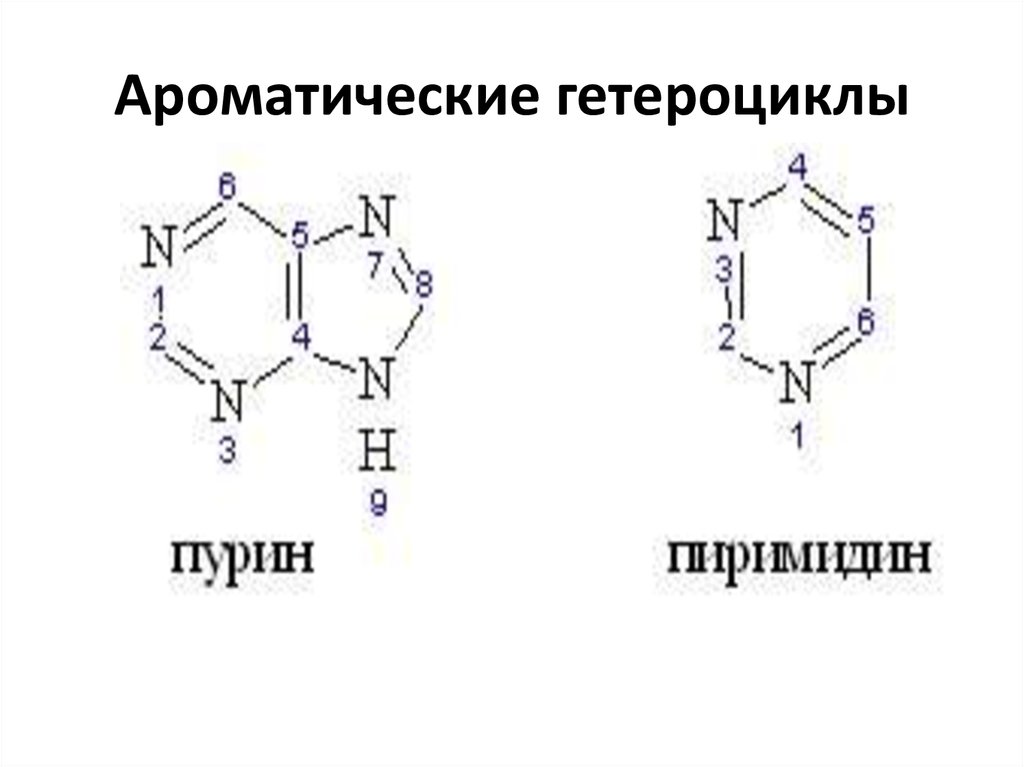
45. Ароматические гетероциклы
46. Ароматические гетероциклы
фуранпиррол
тиофен
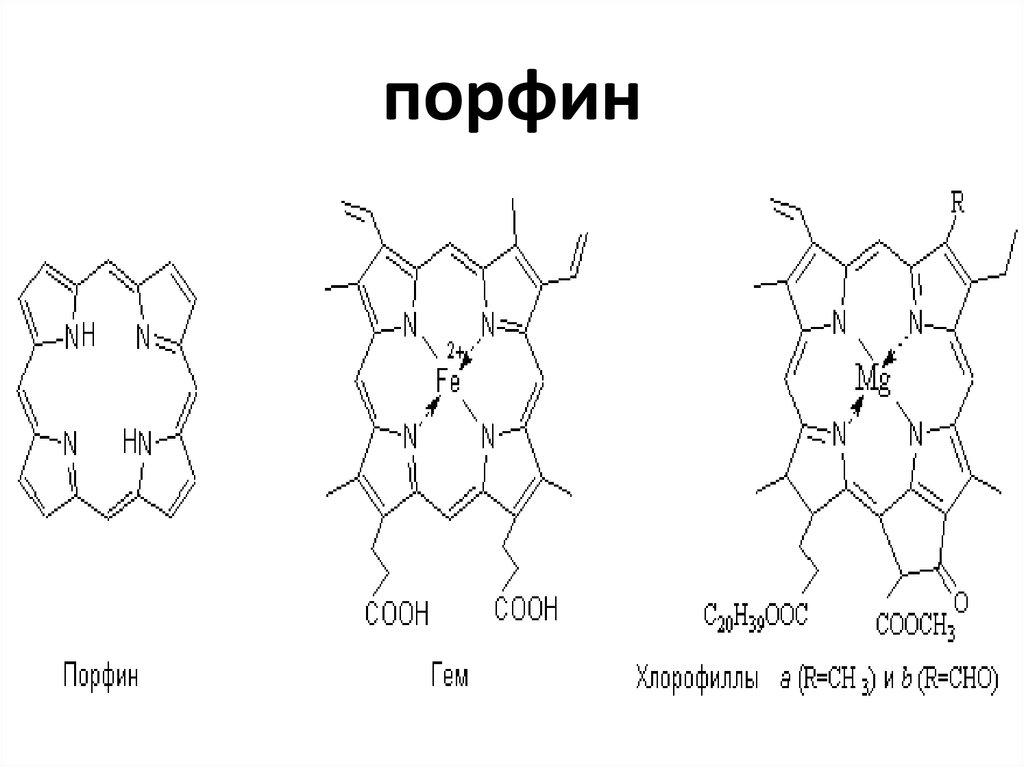
47. порфин
48.
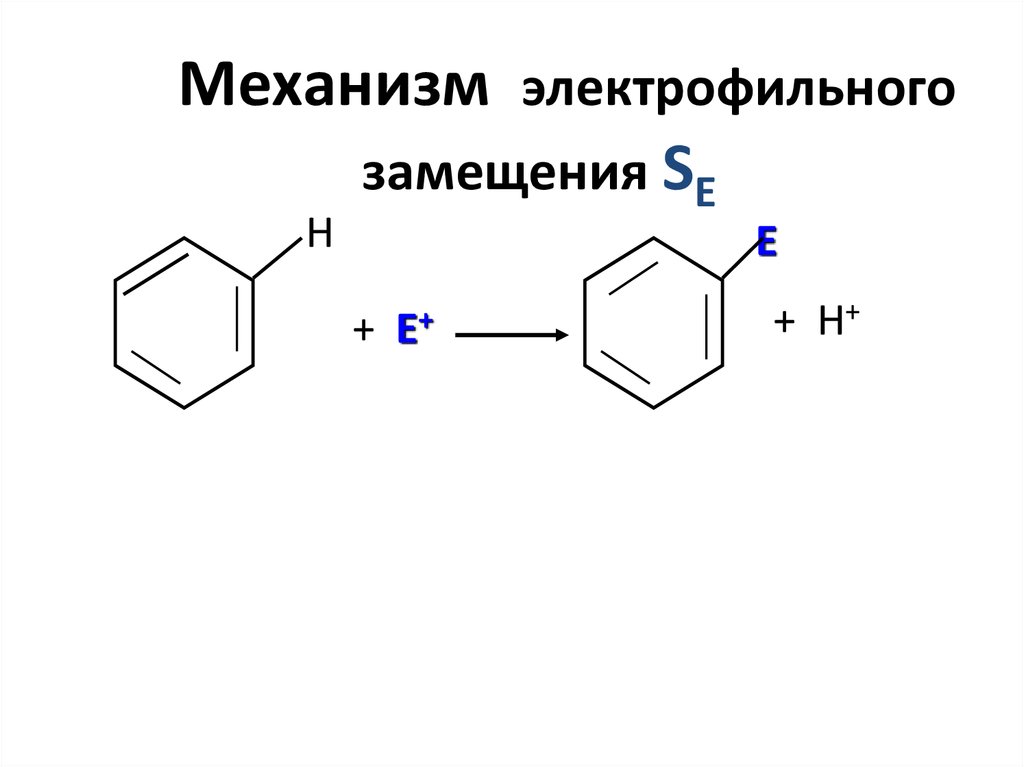
Механизм электрофильногозамещения SE
Н
Е
+
Е+
+ Н+
49.
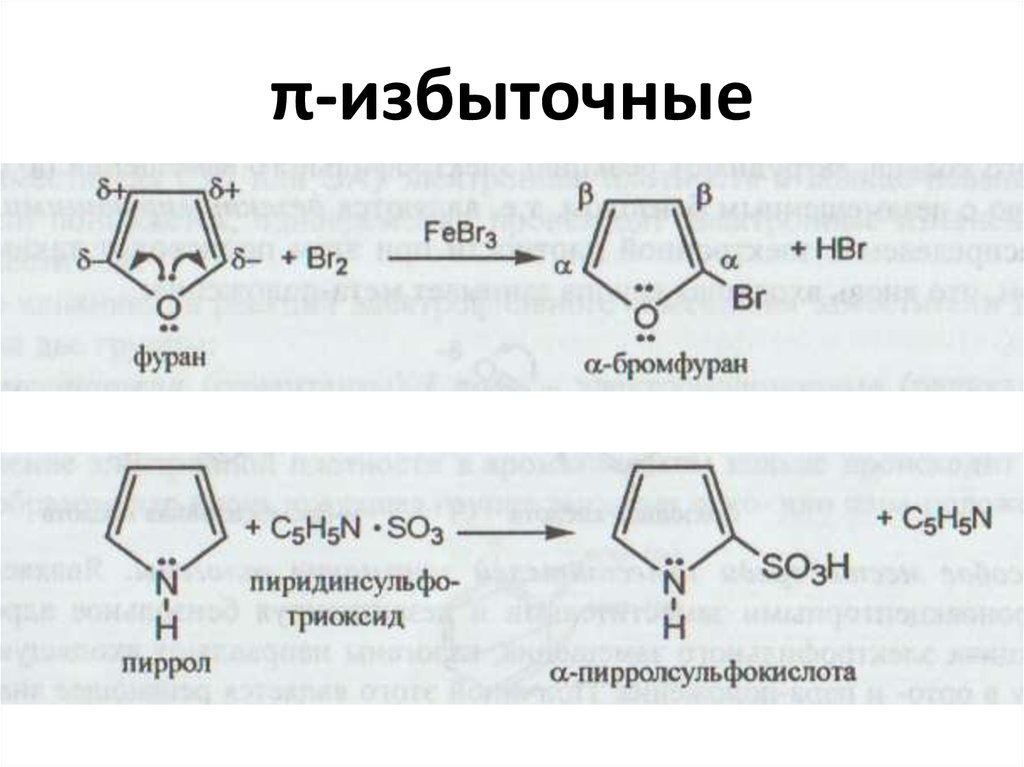
Реакции электрофильного замещения50. Реакционная способность ароматических гетероциклических соединений
• π-избыточные(пиррол)
π-недостаточные
(пиридин)
Реакции SЕ легче
Реакции SЕ труднее
Е+ в α -положение
+
Е в β –положение
кислотные свойства
основные свойства
51.
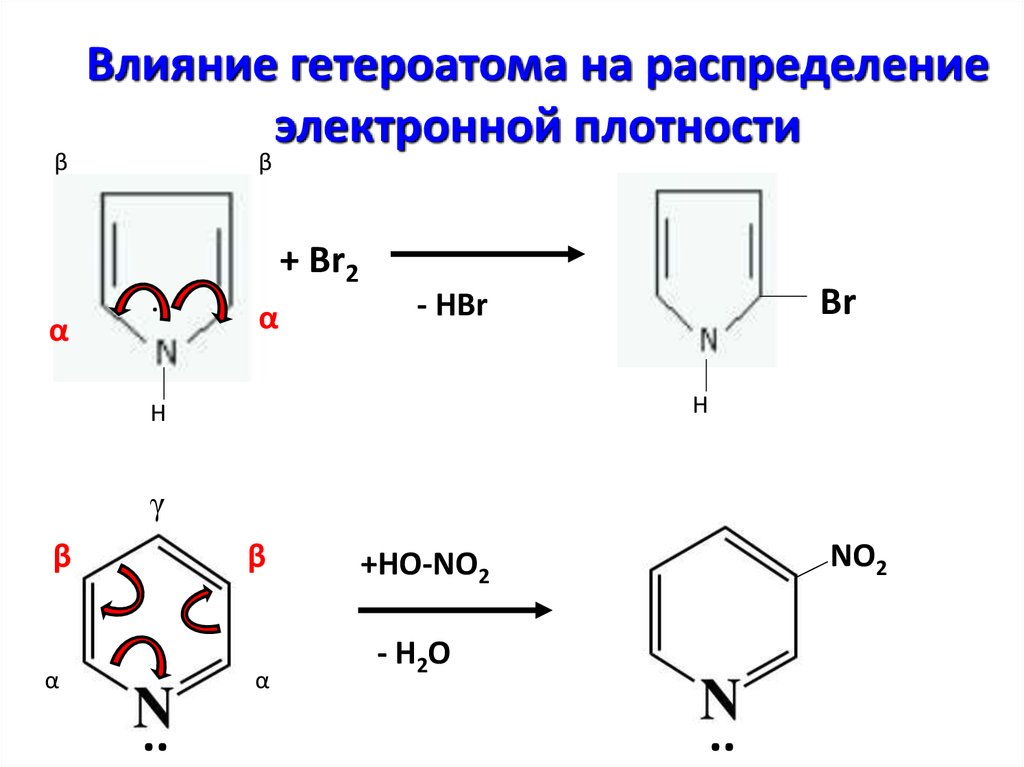
βВлияние гетероатома на распределение
электронной плотности
β
+ Br2
α
..
α
Br
- HBr
H
H
γ
β
β
α
α
..
NO2
+HO-NO2
- H2O
..















 Химия
Химия








