Похожие презентации:
Окисно-відновні реакції. Хімія. 9 клас
1.
Окисно-відновні реакції.Розглянемо такі питання:
Згадаємо: як класифікувати реакції, які з них є окисновідновними. Як визначати ступінь окислення елементів.
1
Складання найпростіших ОВР, добір
коефіцієнтів.
2
3
Навколишній світ – хімічна лабораторія, в якій
щосекундно відбуваються окисно-відновні реакції.
Значення ОВР.
2.
АКТУАЛІЗАЦІЯ ОПОРНИХЗНАНЬ
• Хімічний диктант
Записати рівняння реакцій, вказати їх типи.
1 варіант
1. SO3 + H2O
2. Fe + HCl
3. N2O5 + H2O
4. CaO + HCl
5. FeO + H2SO4
6. Cu + H2SO4
7. CO2 + H2O
8. KOH + H2SO4
9. Fe(OH)3
10. Fe + CuSO4
2 варіант
1. SO2 + H2O
2. Al + HCl
3. P2O5 + H2O
4. MgO + HCl
5. CaO + H2O
6. Na2O + H2SO4
7. Hg + H2SO4
8. Cu(OH)2 + HCl
9. H2CO3
10. Zn + HgCl2
3.
1.1CaCO3 + 2CH3COOH = Ca(CH3COO)2 + H2O + CO2
розчинення перлини в виноградному оцеті
C+O2 =CO2 згоряння алмазу на повітрі під
дією сонячних променів
Fe + 2HCI = FeCI2 + H2
4.
1.3Слід пам’ятати, що …
Ступінь окиснення атома Флуора в будьяких сполуках завжди -1.
Ступені окиснення атомів лужних металів в
сполуках завжди +1.
Ступінь окиснення атома Гідрогена в
сполуках +1, а в гідрідах металів -1,
наприклад: LiH, CaH2.
Ступінь окислення атома Оксигена зазвичай
дорівнює -2, крім пероксидів (Na2O2) і
сполуки Оксигена з Флуором (OF2).
Алгебрагічна сума ступенів окислення всіх
атомів в молекулі дорівнює 0.
5.
1.2Дайте відповіді на запитання:
Що ми називаємо хімічними реакціями?
За якими ознаками класифікують хімічні
реакції?
Які реакції вважають окисно-відновними?
Дайте визначення ступеня окиснення.
Яку ступінь окиснення мають елементи в
простих сполуках?
Визначте ступінь окиснення елементів у
речовинах:
N2,
NaCl,
H2SO4, КMnO4.
6.
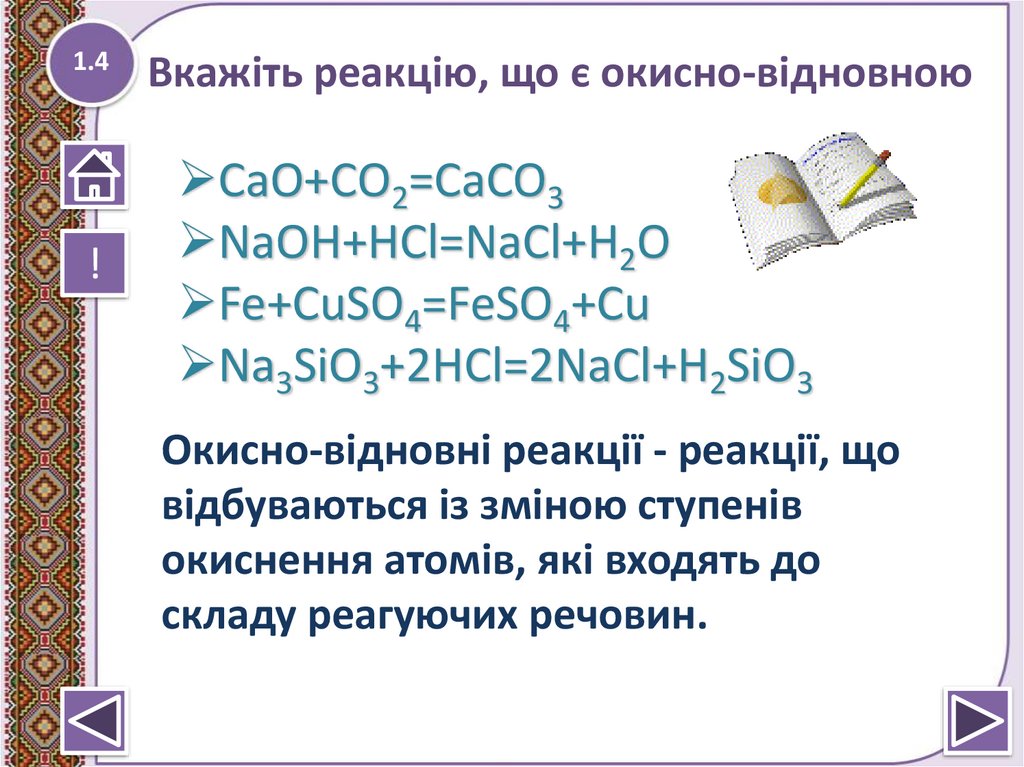
1.4!
Вкажіть реакцію, що є окисно-відновною
CaO+CО2=CaCO3
NaOH+HCl=NaCl+H2O
Fe+CuSO4=FeSO4+Cu
Na3SiO3+2HCl=2NaCl+H2SiO3
Окисно-відновні реакції - реакції, що
відбуваються із зміною ступенів
окиснення атомів, які входять до
складу реагуючих речовин.
7.
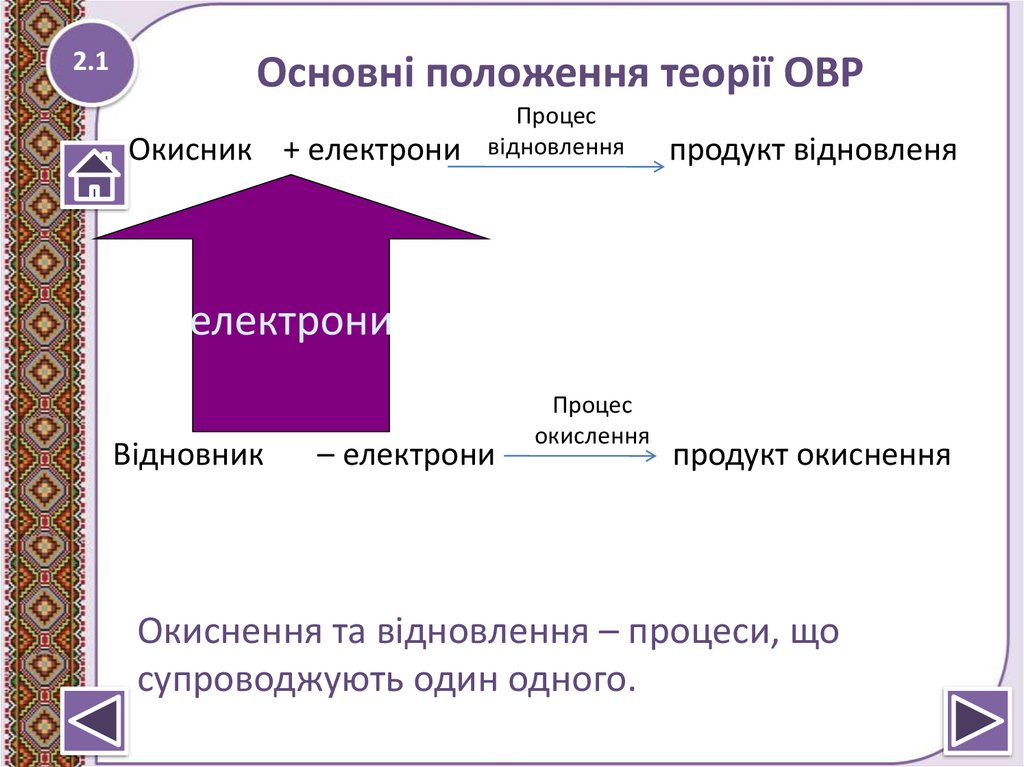
2.1Основні положення теорії ОВР
Окисник + електрони
Процес
відновлення
продукт відновленя
електрони
Відновник
– електрони
Процес
окислення
продукт окиснення
Окиснення та відновлення – процеси, що
супроводжують один одного.
8.
2.2Окисники -- відновники
Відновник підвищує
ступінь окиснення, -е,
процес окиснення
Окисник знижує
ступінь окиснення, +е,
процес відновлення
9.
2.3Алгоритм складання окисно – відновних
реакцій методом електронного балансу
1. Записати схему хімічної реакції.
2. Визначити і записати ступені окиснення атомів у лівій
і правій частинах складеної схеми, підкреслити
символи елементів, що змінили ступені окиснення.
3. Виписати елементи, що змінюють ступені окиснення.
4. Скласти електронні рівняння, визначаючи число
відданих і прийнятих електронів.
5. Зрівняти число відданих і прийнятих електронів,
підібравши найменше спільне кратне й додаткові
множники.
6. Отримані числа є коефіціентами в рівнянні реакції
перед формулами речовин, що містять елементи, які
змінили свої ступені окиснення.
7. Всі інші коефіціенти отримуємо простим підбором.
8. Визначаємо окисник і відновник, процеси окиснення
та відновлення.
10.
Доберіть коефіцієнти у схемах окисно –відновних реакцій методом електронного
балансу, вкажіть окисник і відновник, процеси
окиснення та відновлення.
2.4
1.
Na + H2O → NaOH + H2
2.
P + O2 → P2O5
3.
H2S + O2→ SO2 + H2O
4. Ag + HNO3 → AgNO3 + NO2 +H2O
11.
3.1Навколишній світ – хімічна лабораторія, в якій
щосекундно відбуваються окисно-відновні реакції.
Лісові пожежі
C + O2 → CO2
12.
3.2Навколишній світ – хімічна лабораторія, в якій
щосекундно відбуваються окисно-відновні реакції.
Фотосинтез
CO2 + H2O → C6H12O6 + O2
13.
3.3Навколишній світ – хімічна лабораторія, в якій
щосекундно відбуваються окисно-відновні реакції.
Корозія металів
Fe +H2O +O2 → Fe(OH)3
14.
3.4Навколишній світ – хімічна лабораторія, в якій
щосекундно відбуваються окисно-відновні реакції.
Виверження вулканів
S + O2 → SO2
15.
3.5Навколишній світ – хімічна лабораторія, в якій
щосекундно відбуваються окисно-відновні реакції.
Згоряння палива
16.
3.6Навколишній світ – хімічна лабораторія, в якій
щосекундно відбуваються окисно-відновні реакції.
Бродіння глюкози
C6H12O6 → C2H5OH + CO2
17.
3.7Навколишній світ – хімічна лабораторія, в якій
щосекундно відбуваються окисно-відновні реакції.
Грозові розряди
N2 + O2
NO
NO + O2
NO2
18.
3.8Окисно-відновні реакції в хімічних виробництвах
*
!
Виробництво
Виготовлення
кисломолочних
продуктів
19.
3.9Окисно-відновні реакції в побуті
Почорніння срібних
виробів
Ржавіння металів
Відбілювання і дезінфекція
Хімічна завивка волосся
*
!
20.
УЗАГАЛЬНЕННЯ ТАСИСТЕМАТИЗАЦІЯ ЗНАНЬ
• 3і списку рівнянь реакцій учні повинні вибрати окисновідновні та скласти електронний баланс.
• 1 варіант:
• KBr + Сl2 → КСl + Вr2;
• Zn + HCl → ZnCl2 + H2;
• Al(OH)3 + H2SO4 → Al2(SO4)3 + H2O;
• Al + S → Al2S3;
• NaOH + P2O5 → Na3PO4 + H2O;
21.
УЗАГАЛЬНЕННЯ ТАСИСТЕМАТИЗАЦІЯ ЗНАНЬ
3і списку рівнянь реакцій учні
повинні вибрати окисно-відновні та
скласти електронний баланс.
2 варіант:
Fe + Cl2 → FeCl3;
NaOH + HCl → NaCl + H2O;
KClO3 + P → KCl + P2O5;
CaO + CO2 → CaCO3;
KCl + F2 → KF + Cl2;



















 Химия
Химия








