Похожие презентации:
Окисно-відновні реакції, їх значення. Процеси окиснення, відновлення. Окисники, відновники
1. Тема: Окисно-відновні реакції., їх значення. Процеси окиснення, відновлення; окисники, відновники
Підготувала: вчитель хіміїВеликокучурівського ЗЗСО І-ІІІ ст.
ім. В. Бузенка
Ракочий Вєліна Костянтинівна
ProPowerPoint.Ru
2. Мета:
сформувати поняття: «окисно-відновнареакція», «процес окиснення», «процес
відновлення»,
«окисник»,
«відновник»;
навчити визначати окисно-відновні реакції за
рівняннями; сформувати вміння визначати
процеси окиснення та відновлення, окисник та
відновник за електронними рівняннями;
розвивати
логічне
мислення,
вміння
порівнювати, аналізувати, робити висновки.
ProPowerPoint.Ru
3.
• Що таке ступінь окиснення?• Чому дорівнює ступінь окиснення
простих речовин?
• Яке значення мають ступені окиснення
металів у складних речовинах?
• Назвіть метали, які мають стале значення
ступенів окиснення.
• Укажіть ступінь окиснення Оксигену в
складних сполуках.
• Укажіть ступінь окиснення Гідрогену в
складних сполуках.
ProPowerPoint.Ru
4.
+1+4
+5
0
•N2O, NO2, НNO3, N2
+3
+6
+2
0
•Cr2O3, K2Cr2O7, CrCl2, Cr
+5
+1
+7
+4
+7
0
•NaClO3, Cl2O, Cl2O7, Cl2
+2
+5
•KMnO4, MnO2, MnO, Mn2O5
ProPowerPoint.Ru
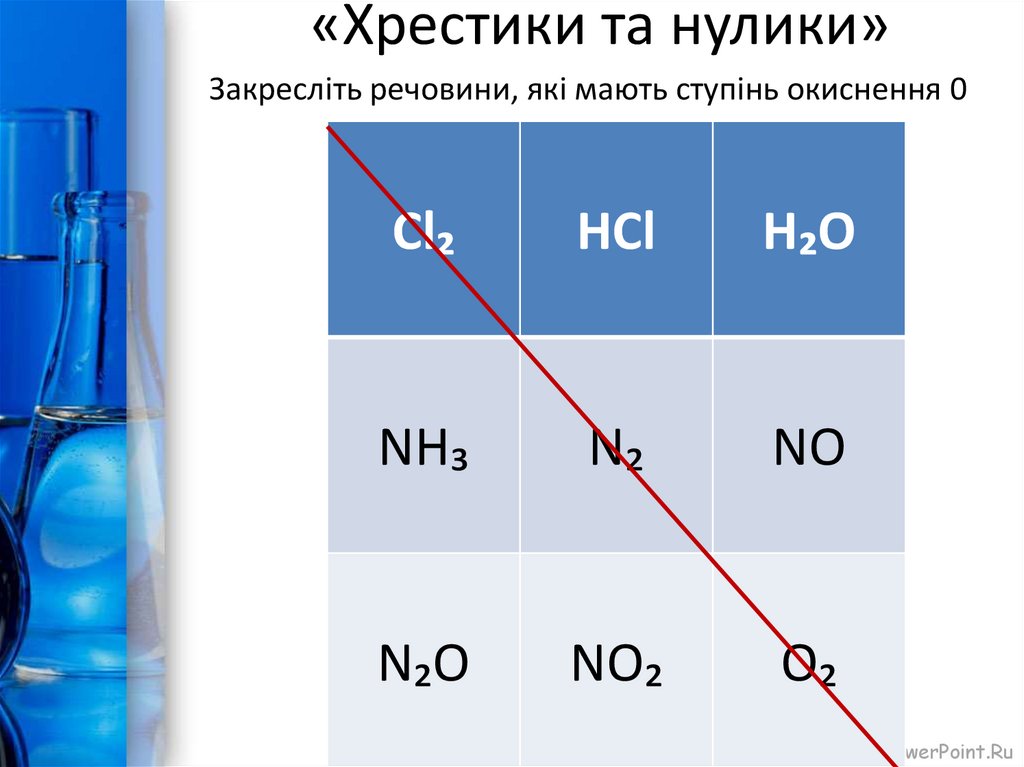
5. «Хрестики та нулики»
Закресліть речовини, які мають ступінь окиснення 0Cl₂
HCl
H₂O
NH₃
N₂
NO
N₂O
NO₂
O₂
ProPowerPoint.Ru
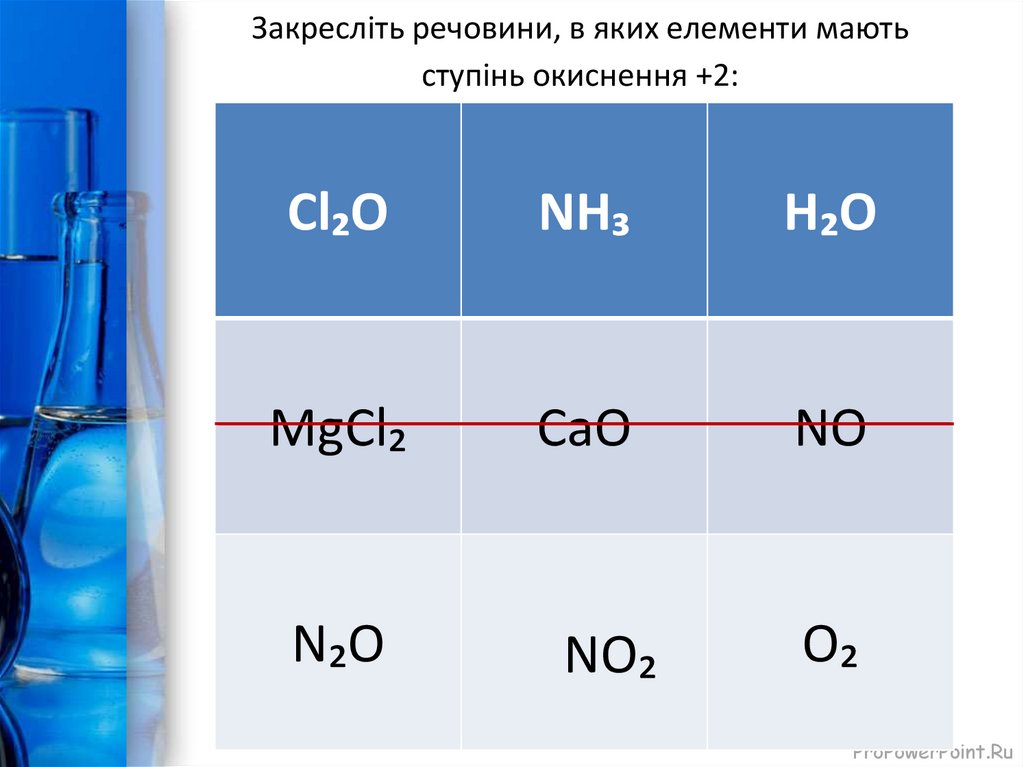
6. Закресліть речовини, в яких елементи мають ступінь окиснення +2:
Cl₂ОNH₃
H₂O
MgCl₂
СаО
NO
N₂O
NO₂
O₂
ProPowerPoint.Ru
7. Закресліть речовини, в яких елементи мають ступінь окиснення +5:
HClO₂HClО₃
H₂SO₄
Al(OH)₃
H₃PO₄
HNO₂
H₂CO₃
N₂O₅
H₂SO₃
ProPowerPoint.Ru
8.
+5 -2+1 -2
+1+5 -2
• 1. N2O5 + H2O → 2HNO3
0
0
+2 -2
• 2. N2 + O2 → 2NO
ProPowerPoint.Ru
9.
Окисно-відновніреакції
(ОВР) – це реакції, у яких хоча б
один хімічний елемент змінює
свій ступінь окиснення.
0
0
+2 -2
N2 + O2 → 2NO
ProPowerPoint.Ru
10.
Окиснення – це процес віддачіелектронів атомом (йоном) з
підвищенням
ступеня
окиснення.
0
+2
N – 2 e- → N
ProPowerPoint.Ru
11.
Відновлення – це процесприєднання
електронів
атомом
(йоном)
зі
зниженням
ступеня
окиснення.
0
-2
O + 2 e- → O
ProPowerPoint.Ru
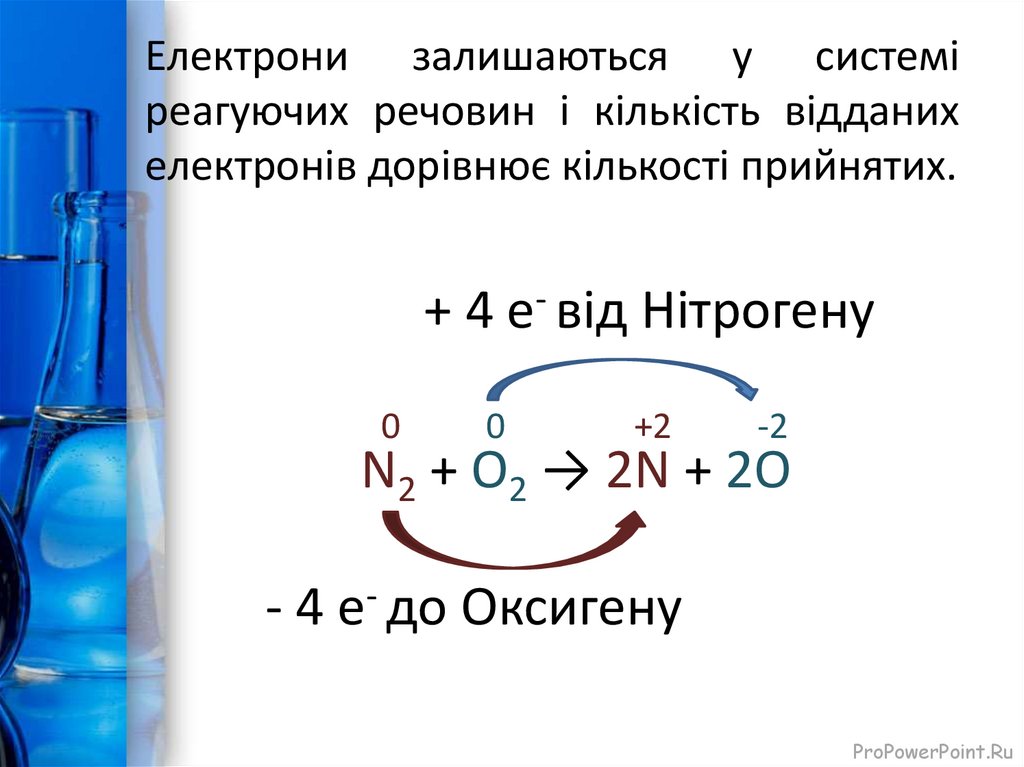
12.
Електрони залишаються у системіреагуючих речовин і кількість відданих
електронів дорівнює кількості прийнятих.
+ 4 е- від Нітрогену
0
0
+2
-2
N2 + O2 → 2N + 2O
- 4 е- до Оксигену
ProPowerPoint.Ru
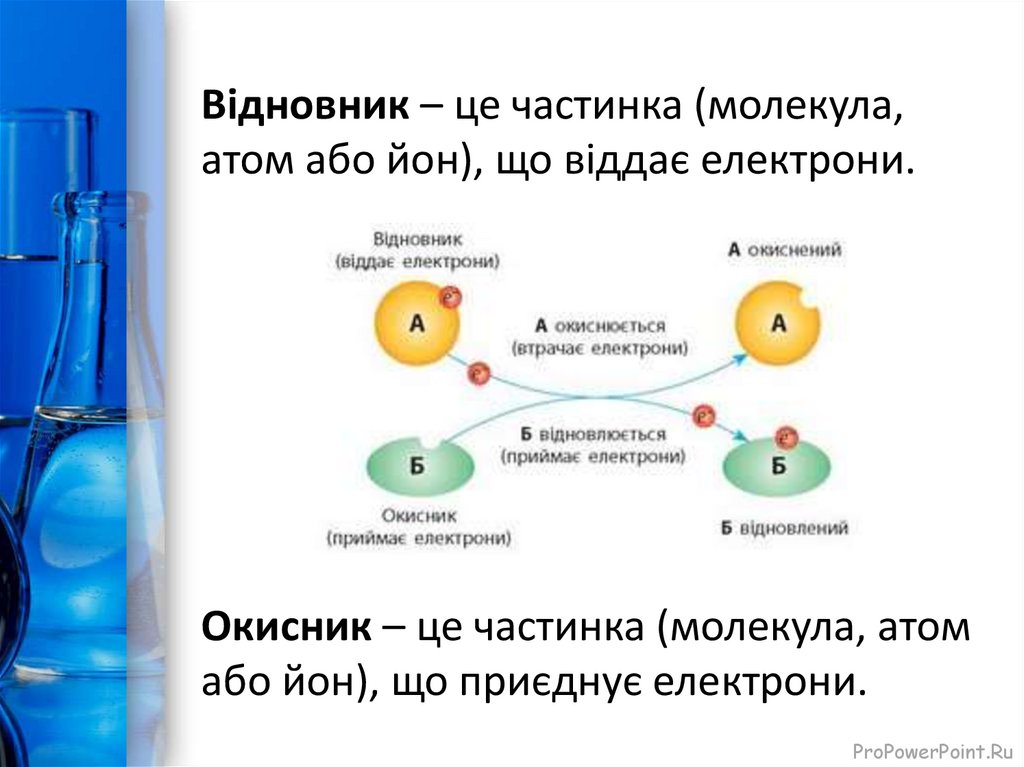
13.
Відновник – це частинка (молекула,атом або йон), що віддає електрони.
Окисник – це частинка (молекула, атом
або йон), що приєднує електрони.
ProPowerPoint.Ru
14.
У підручнику «Вступдо хімії» (1926 року)
вперше виклав весь
матеріал хімії з позиції
електронної
теорії
будови
атомів
та
молекул.
Вчений
створив
основи
електронної
теорії
окисновідновних реакцій.
Лев Володимирович
Писаржевський
ProPowerPoint.Ru
15.
ProPowerPoint.Ru16.
ProPowerPoint.Ru17.
ProPowerPoint.Ru18.
ProPowerPoint.Ru19.
ProPowerPoint.Ru20.
ProPowerPoint.Ru21.
Вставити кількість приєднаних абовідданих
електронів,
визначити
процеси окиснення та відновлення,
окисник та відновник.
а) N+⁵
б) Mg0
в) N₂
г) H+1
→ N⁻
→ Mg+2
→ 2N→ H₂
ProPowerPoint.Ru
22. Закінчити схеми, вказати окисник і відновник, процеси окиснення і відновлення:
0• а) N + 3e →
+6
•б) S + 6e →
0
• в) Ca – 2e →
-2
• г) S – 2e →
ProPowerPoint.Ru
23.
Висновки:1. ОВР – це реакції, під час яких
відбувається перехід електронів.
2. ОВР так називаються тому, що
перехід електронів від відновника
до окисника можливий тільки під
час
двох
взаємопов’язаних
процесів окиснення і відновлення.
ProPowerPoint.Ru
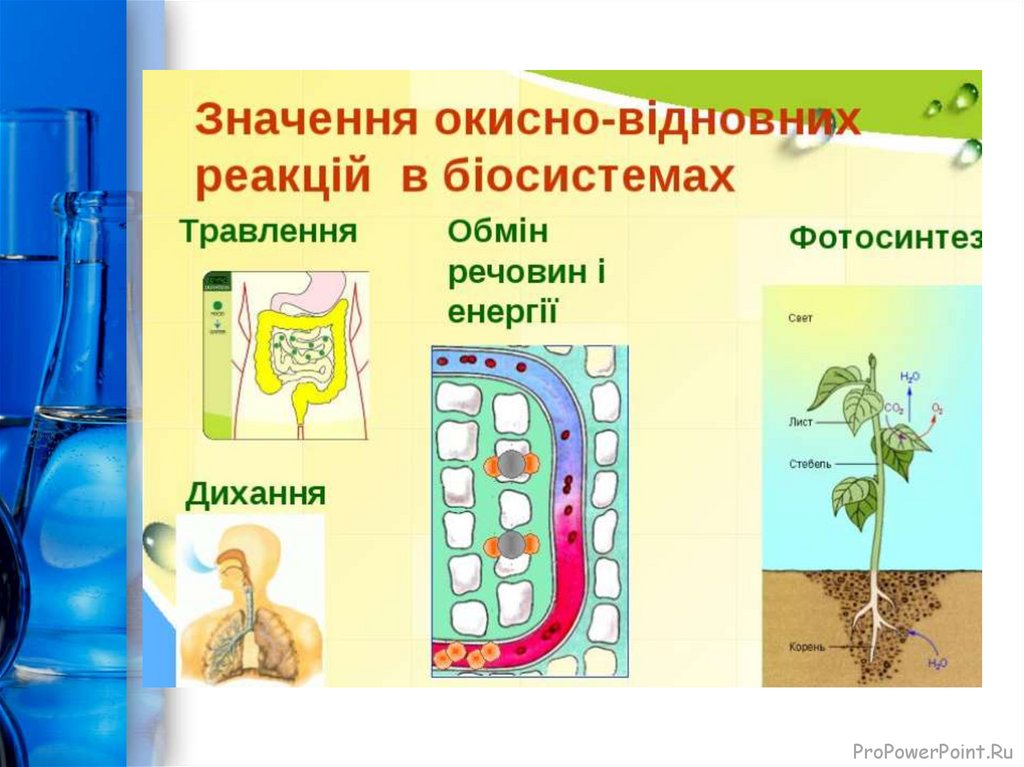
24.
Значення окисно-відновних реакційОКИСНО-ВІДНОВНІ ПРОЦЕСИ – одні з найважливіших
процесів природи. Ці реакції належать до числа найбільш
розповсюджених хімічних реакцій та мають величезне
значення в теорії і практиці. До них належать:
- Основні процеси життєдіяльності – дихання та обмін
речовин у живих організмах, гниття й бродіння, фотосинтез
у зелених частинах рослин.
- Основні процеси в природі: колообіг елементів у
природі, процеси корозії, згоряння речовин, виверження
вулкана з утворенням сірки, зв’язування атмосферного
азоту киснем під час грозових розрядів, потемніння
срібних речей.
- Основні процеси чорної та кольорової металургії:
добування металів, кислот, лугів, амоніаку, та багатьох
інших цінних продуктів, електрохімічне виробництво.
ProPowerPoint.Ru
25.
Домашнє завданняОпрацювати §15,
вивчити поняття, впр.
178 (п.).
ProPowerPoint.Ru



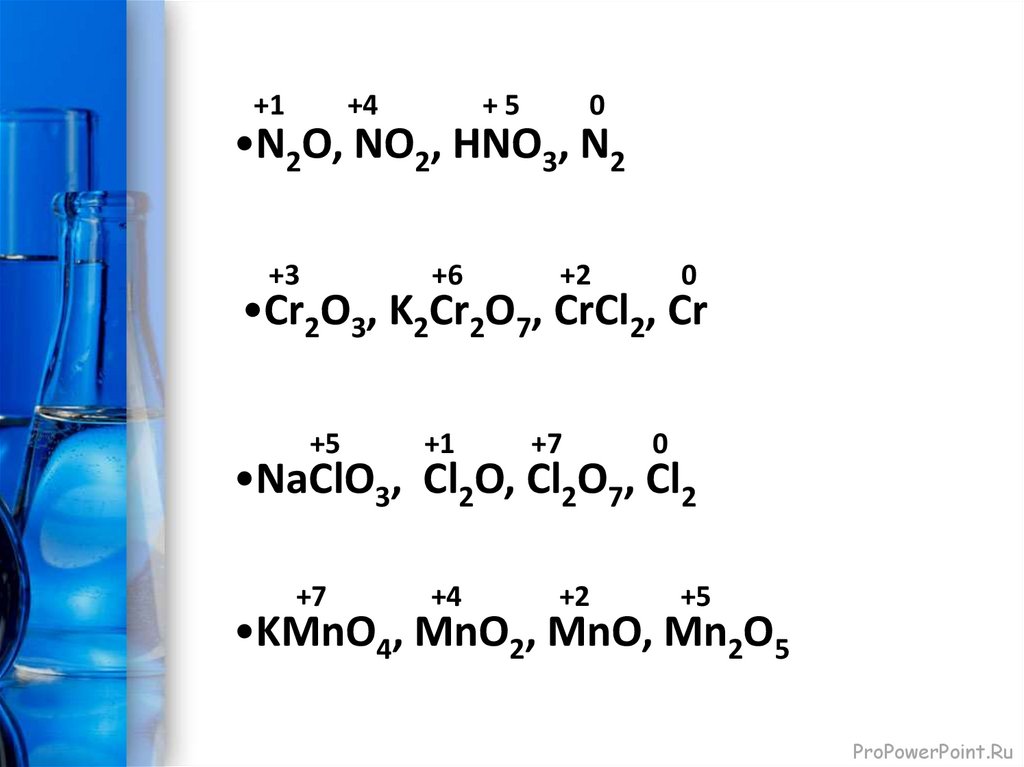

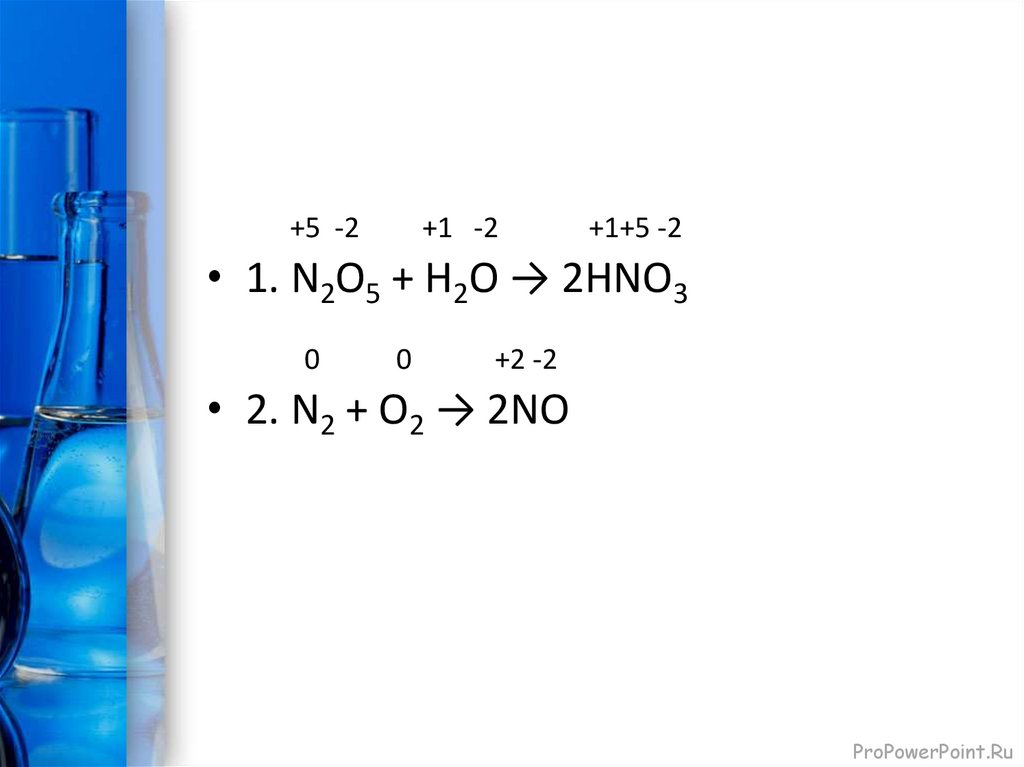














 Химия
Химия








