Похожие презентации:
Химическое превращение. Стехиометрическое уравнение. Термодинамический анализ химических превращений. (Тема 4.1-4.2)
1. Тема 4
Химический процесс науровне химической
реакции
2. Тема 4 (4.1 - 4.2)
Химическое превращениеСтехиометрическое уравнение
Термодинамический
анализ
химических превращений:
- Направленность
реакции
и
химическое равновесие
- Изменение
равновесного
превращения
3.
Целью исследованийхимического процесса на
уровне химической
реакции является
построение кинетической
модели - зависимости
скорости реакции от
условий ее протекания
4. Химическое превращение
Химическойреакцией
считается любое изменение
вещества, при котором
образуются или разрываются
связи между атомами.
5. Химическое превращение
В газовой фазе при обычных условиях молекулызанимают лишь менее 1 % объема фазы
В этих условиях каждая молекула испытывает в
секунду около 109 двойных столкновений.
Число тройных столкновений не превышает 105
в секунду.
Одновременное столкновение большого числа
молекул существенно ниже.
Поэтому реакции в основном состоят из
бимолекулярных стадий.
6. Химическое превращение
Вероятность возникновения реакции пристолкновении зависит от кинетической
энергии соударяющихся молекул.
Реагировать будут только те молекулы,
кинетическая энергия которых
превышает необходимый минимум,
называемый энергией активации
реакции Е, т.е. 0,5 Мu2 > Е
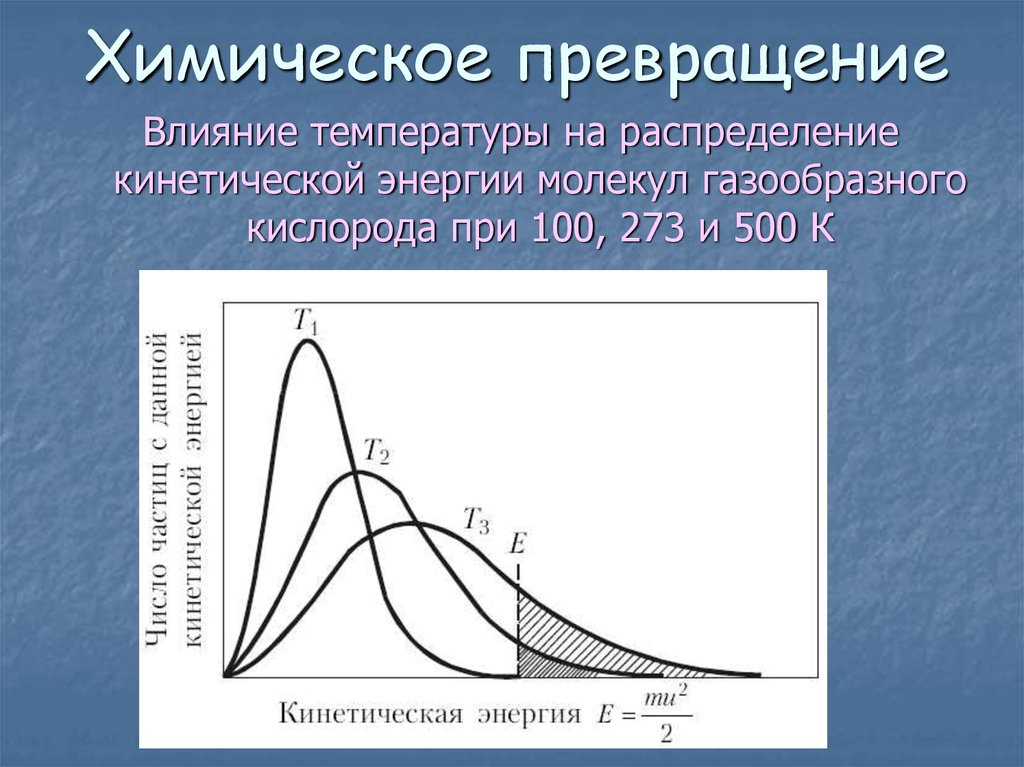
7. Химическое превращение
Влияние температуры на распределениекинетической энергии молекул газообразного
кислорода при 100, 273 и 500 К
8. Химическое превращение
Возможность прохождения реакциимежду веществами в общем случае
зависит:
От энергии столкновения
От надлежащей взаимной
ориентации молекул
9. Химическое превращение
Вероятность того, что столкнувшиеся молекулыбудут иметь достаточную для реакции энергию,
пропорциональна
Е
е RT
Вероятность их нужной ориентации в момент
соударения пропорциональна энтротийному
вкладу
S
е R
Вероятность того, что столкнувшиеся молекулы
будут иметь и достаточную энергию и
надлежащую ориентацию, пропорциональна
произведению этих двух величин.
10. Стехиометрическое уравнение
Стехиометрические уравнения-
составляются на основе фундаментальных
законов природы:
закон сохранения массы
закон сохранения эквивалентов
закон постоянства состава соединения
закон кратных отношений
закон Авогадро
закон Гей-Люссака.
11. Стехиометрическое уравнение
Простая реакция (реакция окислениядиоксида серы):
SO2 + 0,5O2 = SO3
но сложная по механизму.
Сложная реакция (реакция окисления
метанола):
2СН3ОН + О2 = 2СН2О + 2Н2О;
2СН3ОН + 3О2 = 2СО2 + 4Н2О).
12. Стехиометрическое уравнение
--
Базисная система стехиометрических
уравнений, однозначно и полно
описывающая баланс процесса, должна
содержать число стехиометрически
независимых уравнений:
для обменных реакций:
У = В – (Э – 1)
для окислительно-восстановительных
реакций:
У= В – Э
13. Стехиометрическое уравнение
Стехиометрически независимыми считаютсяуравнения, которые не могут быть получены
линейной комбинацией других .
При составлении базисной системы стехиометрически
независимые уравнения целесообразно использовать
в такой форме, чтобы в каждом из них исходным
оказалось одно и то же вещество.
Если исходная реакционная смесь имеет
неэквимолярный состав, то состав реагирующей
смеси удобно выражать через степень превращения
того вещества, которое находится в недостатке
(ключевой компонент), т.к. когда ключевой
компонент превращается полностью, другие
исходные компоненты еще остаются.
14. Стехиометрическое уравнение
Концентрация i-го компонента вреагирующей смеси при изменении объема
реакционной смеси
Ci 0 i C A0 x A
A
Ci
1 C A0 x A
A
Концентрация i-го компонента в
реагирующей смеси при постоянном объеме
реакционной смеси
i
Ci Ci 0 C A0 x A
A
15. Химическое превращение
Пример: конверсия метанаСН4 + Н2О = СО + 3Н2;
СО + Н2О = СО2 + Н2.
СН4 + 2Н2О = СО2 + 4Н2.
Базисные (стехиометрически независимые)
уравнения для расчета процесса
СН4 + Н2О = СО + 3Н2;
СН4 + 2Н2О = СО2 + 4Н2.
16. Химическое превращение
;Пример: конверсия метана
Концентрации компонентов (в мольных
долях)
С 1 х
См
;
м0
1 2С м 0 х
Свп
Свп 0 С м 0 х1 2 х
1 2С м 0 х
С м 0 3х1 4 х2
Св
1 2С м 0 х
С м 0 х1
Соу
1 2С м 0 х
С м 0 х2
Сду
1 2С м 0 х
17. Направленность реакции
Δ Gр,Т 0- реакция возможна
Δ Gр,Т > 0 - реакция не
возможна
Δ Gр,Т = 0 - система находится
в термодинамическом
равновесии
18. Направленность реакции
Изменение химического состава реагирующейсмеси приводит к изменению ее энтальпии
(теплосодержания) НТ.
При отсутствии справочных данных тепловой
эффект реакции рассчитывается через
энтальпии образования или сгорания
веществ, участвующих в реакции:
НТ i HТ обр.
19. Направленность реакции
Если [( НТ)обр]прод < [( НТ)обр] исх , товыделяется теплота (теплота реакции)
qр ~ - НТ – реакция экзотермическая.
Если [( НТ)обр]прод > [( НТ)обр] исх , то
теплосодержание смеси увеличивается,
теплота поглощается, тепловой эффект
реакции qр ~ НТ – реакция
эндотермическая.
20. Направленность реакции
Тепловой эффект реакцииq p H T
N i
i
В справочной литературе тепловой эффект реакции обычно
относят к 1 молю или 1 кг превращенного вещества.
Если тепловой эффект реакции указан непосредственно в
уравнении реакции, то для приведения теплового эффекта к 1
молю вещества необходимо учесть стехиометрический
коэффициент.
21. Химическое равновесие
Изотерма химической реакции(уравнение Вант-Гоффа)
i
0
GT GT R T ln Ci
i
В условиях равновесия
Сi
i
равн .
i
рi
i
i
равн .
C RR C S S
A
B
C A CB
К р ,С
равн .
р RR р S S
A
B
р
р
A B
К р,р
равн .
22. Химическое равновесие
Изотерма химической реакции приравновесии
0
GT
0
Н Т
Т S
Тогда
0
H T0
S
ln K p
R
RT
или
ln K p
GT0
RT
23. Химическое равновесие
Для идеальных газовых смесей ижидкостей Кр зависит:
- от природы реагентов и температуры и
не зависит от давления.
Для реальных газовых смесей при
высоком давлении:
- с повышением константа равновесия
уменьшается.
24. Химическое равновесие
Например:при синтезе аммиака при 450 °С по
реакции N2+ЗН2
2NH3 при
увеличении давления с 10,1 до 101,0
МПа константа равновесия уменьшается
с 0,988 до 0,443.
25. Изменение равновесного превращения
Изменения химического равновесиядостигают, изменяя внешние условия
процесса.
Направленность влияния способов
управления определяется принципом ЛеШателье:
Если воздействовать на систему,
находящуюся в химическом равновесии, то
состояние системы изменяется таким
образом, что ослабляется следствие этого
воздействия.
26. Изменение равновесного превращения
Изменение температуры27. Изменение равновесного превращения
Изменение давленияПри увеличении давления в газовой системе
происходит уменьшение объема системы и
увеличение числа молей в единице объема.
Такому воздействию должно противостоять
действие, приводящее к снижению числа
молей в системе, т.е. должна усиливаться
реакция, протекающая с уменьшением числа
молей и объема системы
28. Изменение равновесного превращения
Разбавление реакционной смесиинертным веществом
Эффект от разбавления инертным
веществом равнозначен уменьшению
давления
29. Изменение равновесного превращения
Избыток и удаление компонентовРавновесие в реагирующей смеси
представлено равенством
R S
С
СS
R
K p
А
В
С
С
А В
Вещество В взято в избытке.
Тогда в равновесной смеси концентрация Св
будет существенно выше и для выполнения
указанного равенства, при постоянном Кр,
концентрация исходного компонента (СА) в
равновесной смеси резко уменьшится, т.е.
возрастет степень превращения компонента А.




























 Физика
Физика








