Похожие презентации:
Анализ кинетической модели химических превращений. (Тема 4.4)
1. Раздел 4
Химический процесс науровне химической
реакции
2. Тема 4.4
Анализ кинетическоймодели химических
превращений:
Необратимые реакции;
Обратимые реакции.
3. Анализ кинетической модели химических превращений
Простая необратимая реакцияА=R
Кинетическое уравнение
r kC
n
1 x
n
n
k0C0 1 x
r
r
n
n
kC0
e
E RT
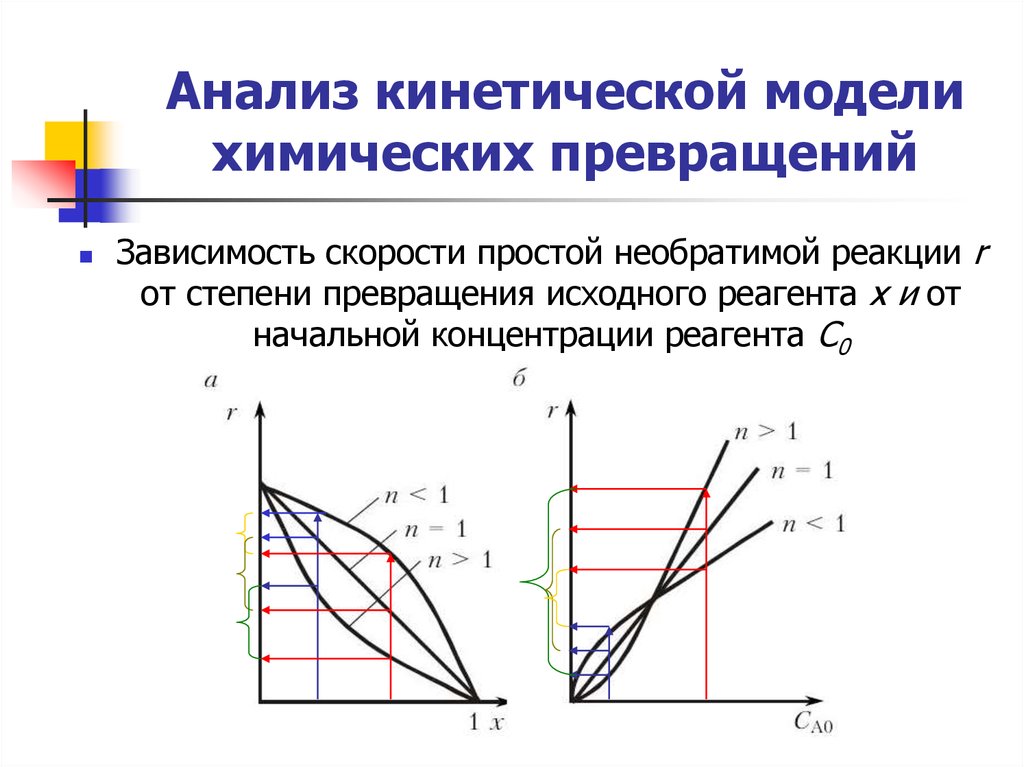
4. Анализ кинетической модели химических превращений
Зависимость скорости простой необратимой реакции rот степени превращения исходного реагента х и от
начальной концентрации реагента С0
5. Анализ кинетической модели химических превращений
k 0C 1 xr
e
n
0
E RT
n
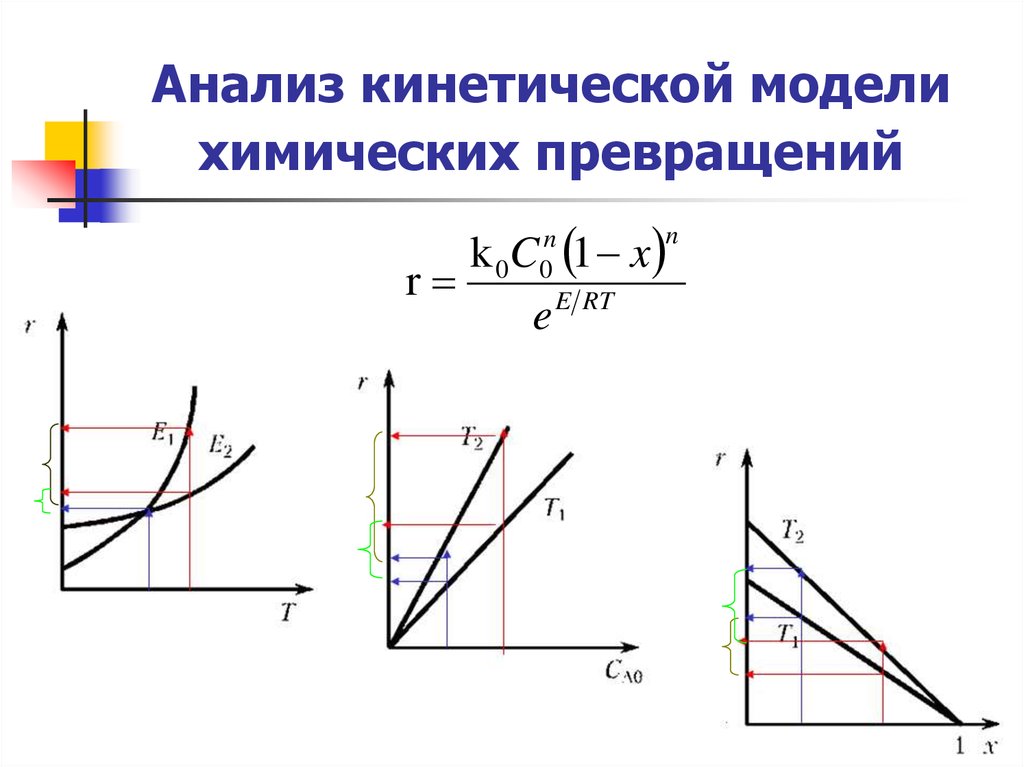
6. Анализ кинетической модели химических превращений
Кинетическое уравнение газофазнойнеобратимой реакции
A
B
r k p p A pB
A
B
r kN A N B
A B
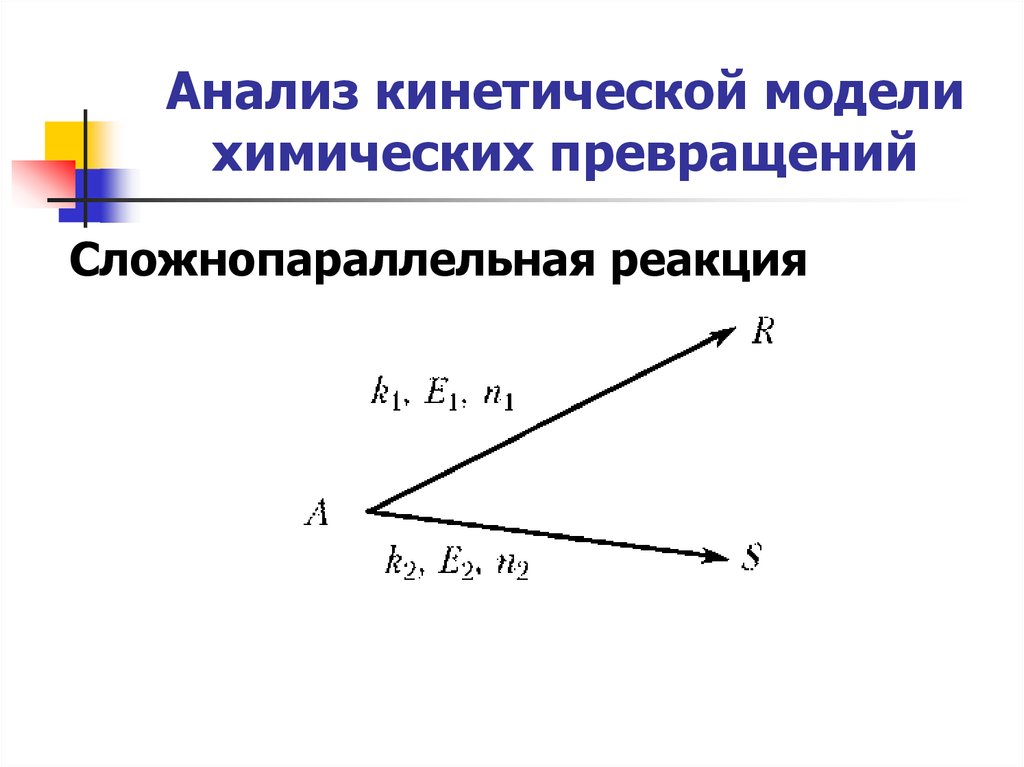
7. Анализ кинетической модели химических превращений
Сложнопараллельная реакция8. Анализ кинетической модели химических превращений
Дифференциальная селективность —отношение скорости превращения
исходного вещества в определенный
продукт к общей скорости его
превращения.
При составлении кинетической модели
сложнопараллельной реакции
необходима зависимость, связывающая
дифференциальную селективность с
влияющими параметрами реакции.
9. Анализ кинетической модели химических превращений
Дифференциальная селективностьобразования продуктов
WR
k1C An1
SR
WR WS k1C An1 k 2 C An2
WS
k 2 C An2
SS
WR WS k1C An1 k 2 C An2
S R/S
k1 n1 n2
CA
k2
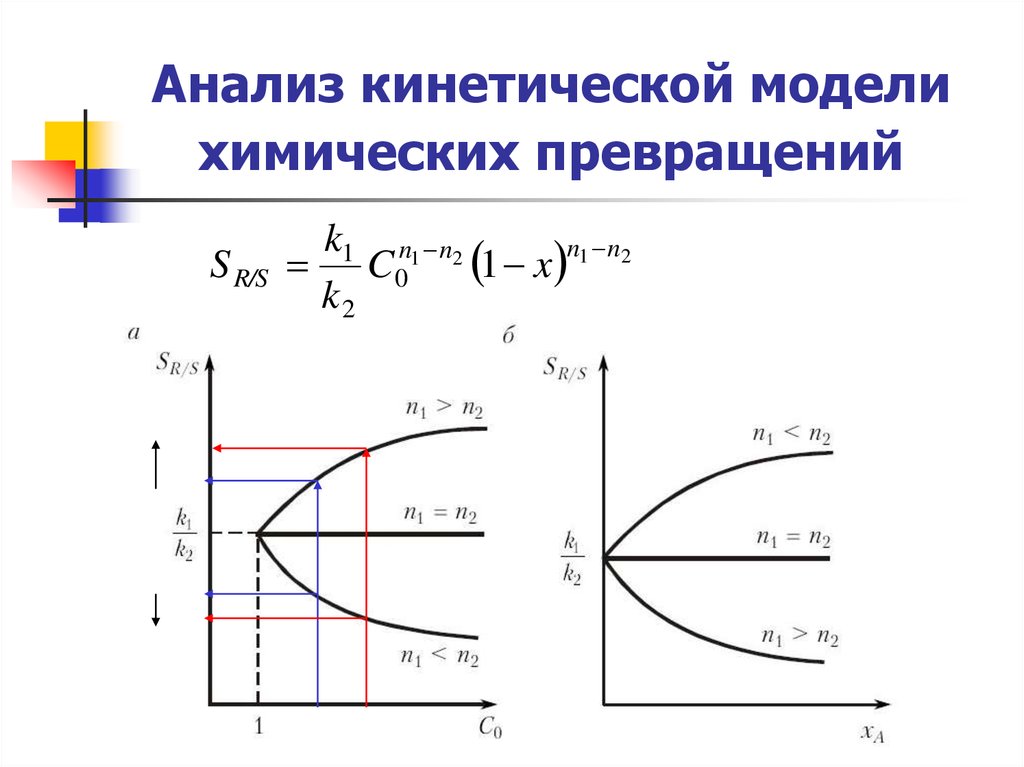
10. Анализ кинетической модели химических превращений
S R/Sk1 n1 n2
1 x n1 n2
C0
k2
11. Анализ кинетической модели химических превращений
Влияние температуры Т надифференциальную селективность
SR S
k1 k1,0 E1 E2 RT
e
k 2 k 2 ,0
12. Анализ кинетической модели химических превращений
Сложно-последовательная реакцияWR k1C A k2CR
k2CR
SR
1
WA
k1C A
k1C A
k 2C R
SR 1
k1C A0 1 х А
13. Анализ кинетической модели химических превращений
Простая обратимая реакцияЕсли частные реакции в обоих
направлениях первого порядка, то
k 2C R
r k1C A k 2 C R k1C A 1
k1C A
C
1
R
r k1C A 1
К C
р
A
14. Анализ кинетической модели химических превращений
1r k1C0 1 х 1
К
р
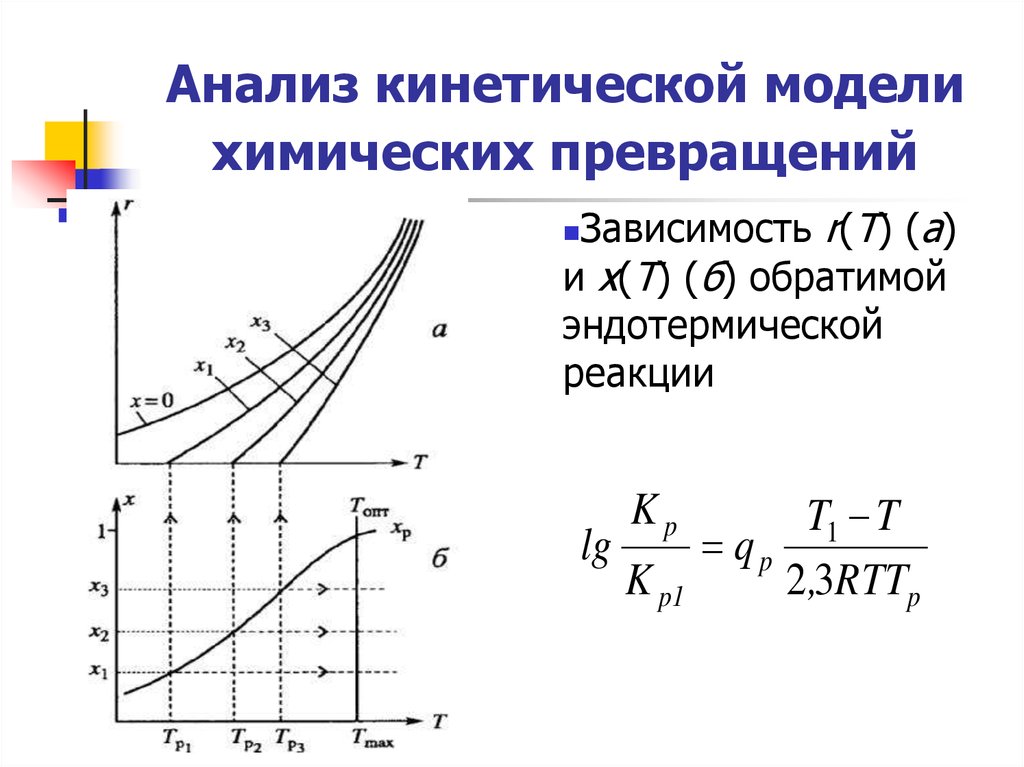
15. Анализ кинетической модели химических превращений
Зависимость r(Т) (а)и х(Т) (б) обратимой
эндотермической
реакции
lg
Kp
K p1
T1 T
qp
2,3RTTp
16. Анализ кинетической модели химических превращений
Зависимость r(Т) (а)и х(Т) (б) обратимой
экзотермической
реакции
lg
Kp
K p1
T1 T
qp
2 ,3RTTp
17. Анализ кинетической модели химических превращений
Влияние давления на кинетикугазофазной обратимой реакции,
протекающей с уменьшением числа молей
r r1 r2 k1 p A p B k 2 p R
18. Анализ кинетической модели химических превращений
Исходные реагенты взяты в равныхмольных количествах, т.е. рА0 = рВ0
r
r
2
k1 p А0
2
k1 p А0
1 х
2
2
k 2 p А0 х.
р А0 х
1
1 х 1
.
2
2
К
р р А0 1 х
19. Анализ кинетической модели химических превращений
Кинетическое уравнение газофазнойобратимой реакции, протекающей с
уменьшением числа молей
r
2
k1 p А0
2
1
х
1 х 1
.
2
К р р А0 1 х
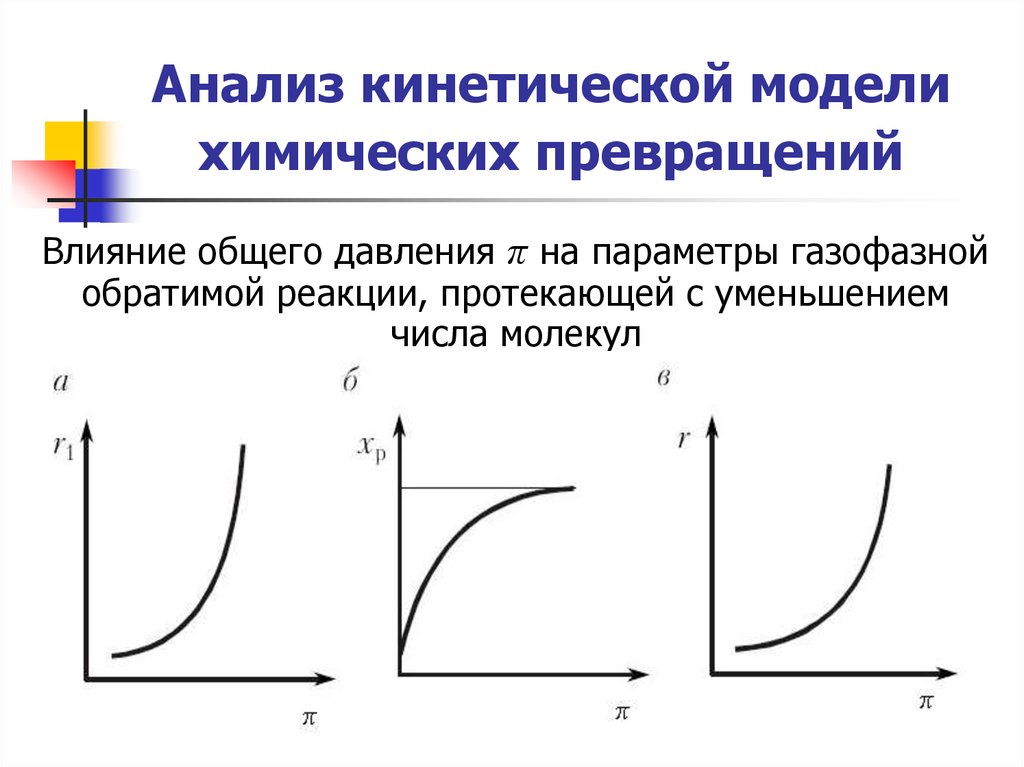
20. Анализ кинетической модели химических превращений
Влияние общего давления π на параметры газофазнойобратимой реакции, протекающей с уменьшением
числа молекул
21. Анализ кинетической модели химических превращений
Влияние давления на кинетикугазофазной обратимой реакции,
протекающей с увеличением числа молей
r r1 r2 k1 p A k 2 p R p S
22. Анализ кинетической модели химических превращений
Продукты реакции образуются вэквимолярных количествах, т.е. рR = рS
r k1 p A0 1 х
2
2
k 2 p А0 х .
23. Анализ кинетической модели химических превращений
Кинетическое уравнение газофазнойобратимой реакции, протекающей с
увеличением числа молей
2
1 р А0 х
r k1 p А0 1 х 1
.
К р 1 х
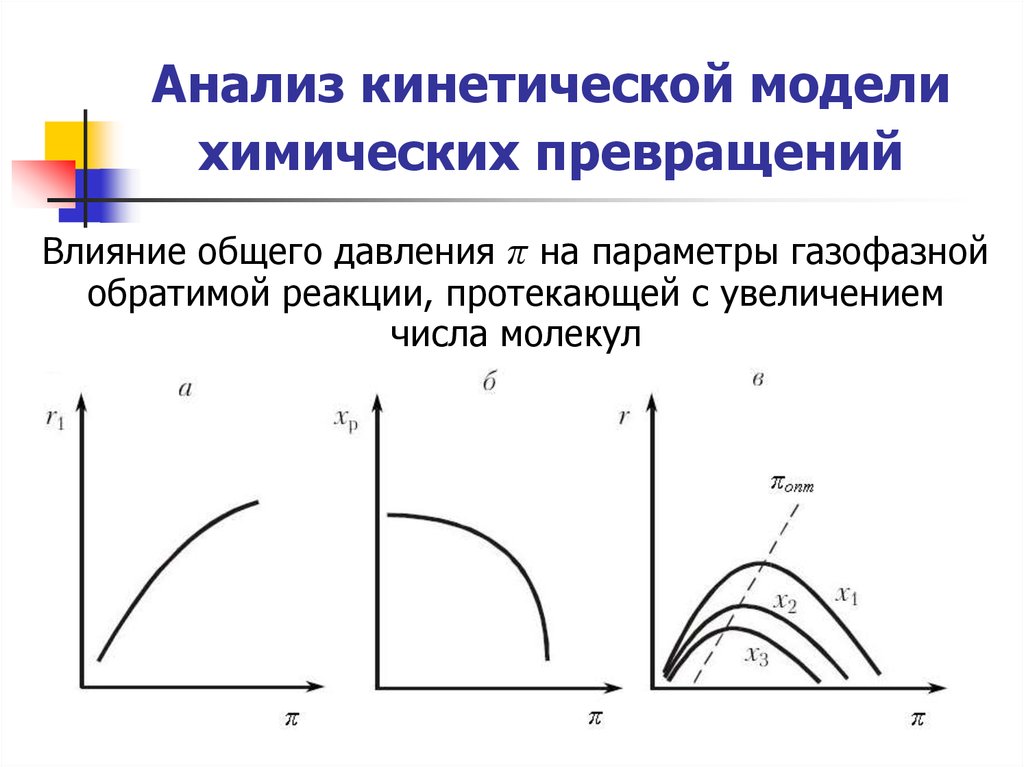
24. Анализ кинетической модели химических превращений
Влияние общего давления π на параметры газофазнойобратимой реакции, протекающей с увеличением
числа молекул
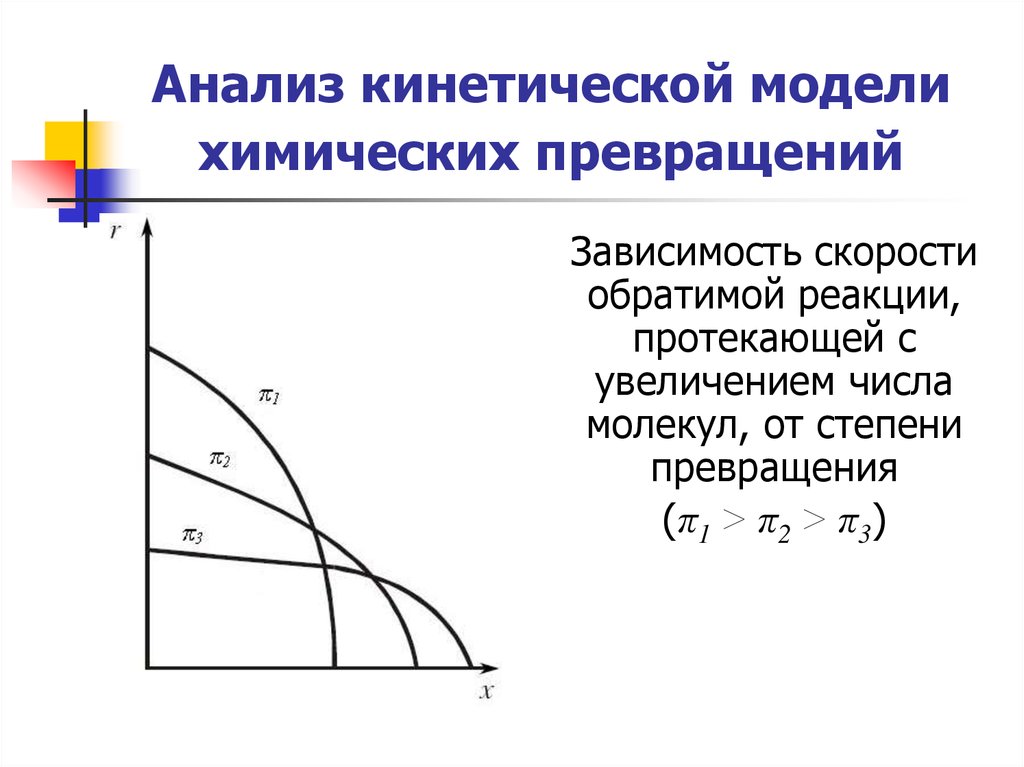
25. Анализ кинетической модели химических превращений
Зависимость скоростиобратимой реакции,
протекающей с
увеличением числа
молекул, от степени
превращения
(π1 > π2 > π3)
26. Анализ кинетической модели химических превращений
Газофазные обратимые реакции: влияниедавления на равновесное состояние
ΔN = (νR – νS) – (νА – νВ).
При повышении давления равновесие
смещается:
а)
при ΔN < 0 вправо, в сторону получения
целевого продукта;
б)
при ΔN > 0 влево, в сторону исходных
веществ;
в)
при ΔN = 0 равновесие не изменяется.
27. Скорость тепловыделения
Скорость тепловыделения q определяетколичество теплоты, выделяющейся в
реакции, в единицу времени в единице
реакционного пространства.
q = qр·r
Скорость тепловыделения при протекании
сложной реакции
q q pj r j



















 Физика
Физика








