Похожие презентации:
Кинетика химических превращений. (Тема 4.3)
1. Тема 4
Химический процесс науровне химической
реакции
2. Тема 4.3
Кинетика химическихпревращений:
Схема превращения;
Скорость превращения и скорость
реакции;
Кинетическое уравнение реакции.
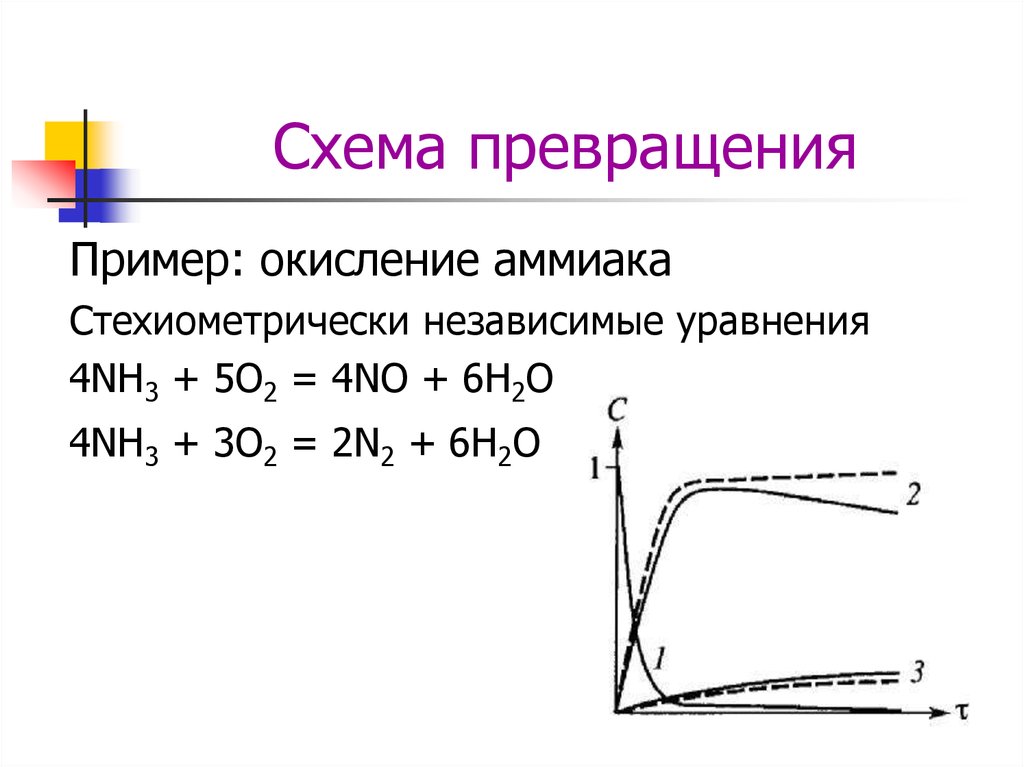
3. Схема превращения
Пример: окисление аммиакаСтехиометрически независимые уравнения
4NH3 + 5O2 = 4NO + 6H2O
4NH3 + 3O2 = 2N2 + 6H2O
4. Схема превращения
Пример: окисление аммиакаДействительные превращения
4NH3 + 5O2 = 4NO + 6H2O
4NH3 + 3O2 = 2N2 + 6H2O
2NО = N2 + O2
6NО + 4NH3 = 5N2 + 6H2O
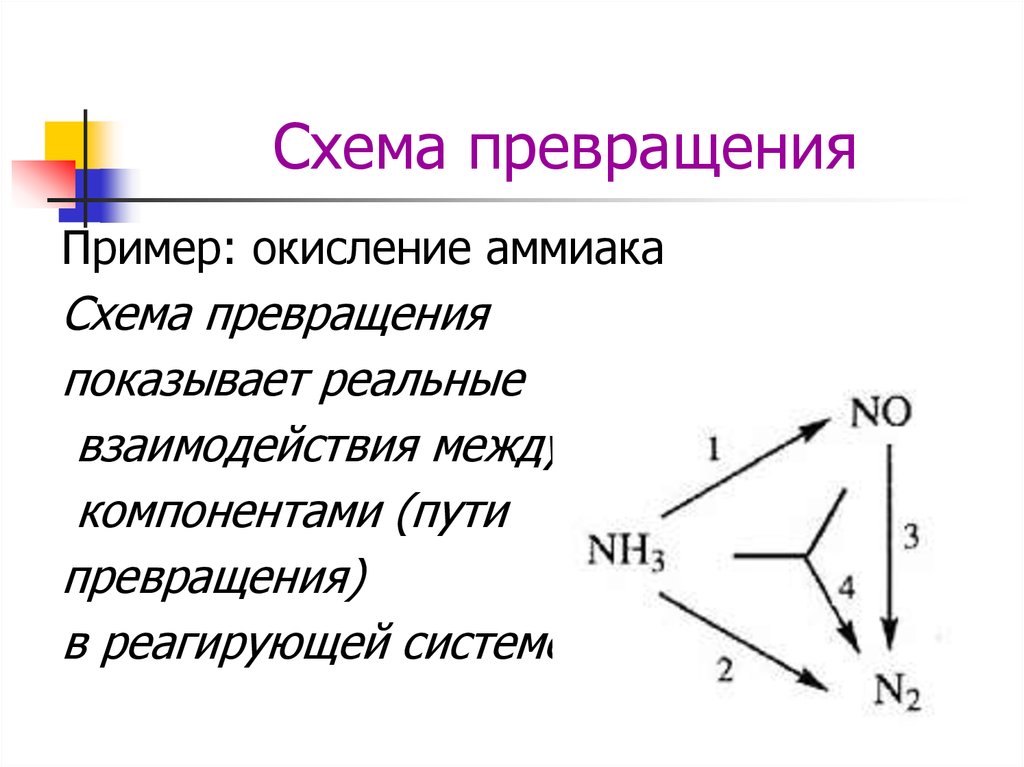
5. Схема превращения
Пример: окисление аммиакаСхема превращения
показывает реальные
взаимодействия между
компонентами (пути
превращения)
в реагирующей системе
6. Скорость превращения и скорость реакции
Скорость превращения вещества —изменение количества компонента
реакционной смеси за единицу времени
в единице реакционного пространства
dNi
Wi
V d
dСi
Wi
d
7. Скорость превращения и скорость реакции
Для скоростей превращения различныхкомпонентов реакции
АА + ВВ + …= RR + SS +…
справедливо следующее соотношение
W A WR Wi
r
A R i
Для сложнопараллельных реакций
Wi ij r j
8. Скорость превращения и скорость реакции
Истинная или мгновенная скоростьреакции - скорость, определяемая за
бесконечно малый отрезок времени dτ
Суммарная или средняя скорость реакции
- скорость протекания химической реакции за
время , необходимое для достижения нужной
степени превращения исходного вещества
C0 x
rc
9. Скорость превращения и скорость реакции
Например, реакция синтезааммиака
N2 + 3H2 = 2NH3
0,5N2 + 1,5H2 = NH3.
10. Кинетическое уравнение реакции
Зависимость скорости превращения илискорости реакции от условий ее
протекания называют кинетическим
уравнением или кинетической
моделью реакции.
В составе кинетических уравнений
различают параметры химической
реакции и химического процесса.
11. Скорость превращения и скорость реакции
Параметры химической реакции –константы кинетического уравнения,
зависящие от свойств реагирующих веществ,
входящие в кинетические уравнения в виде
постоянных коэффициентов.
Параметры химического процесса –
внешние факторы, непосредственно не
связанные со свойствами реагентов,
определяющие условия протекания процесса и
влияющие на скорость химического
превращения
12. Скорость превращения и скорость реакции
Кинетическое уравнение в общем видеrij f j ,Ci pi ,T
Совокупность таких уравнений для всех
ключевых компонентов системы
составляет кинетическую модель
превращения.
13. Скорость превращения и скорость реакции
АА + ВВ + …= RR + SS +…Кинетическое уравнение простой
необратимой реакции (или частной
необратимой реакции в сложной
схеме превращения)
r kC A CB ...
14. Скорость превращения и скорость реакции
Порядок реакции по реагенту –параметр реакции, показывающий, как
скорость реакции зависит от
концентрации данного компонента.
Порядок реакции (общий) – это
эмпирическая величина, равная сумме
порядков реакции по компонентам
(показателей степеней) , с которыми
концентрации реагентов входят в
выражение для скорости реакции.
15. Скорость превращения и скорость реакции
16. Скорость превращения и скорость реакции
Энергия активации элементарной реакцииЕ – минимальный избыток энергии над
средней внутренней энергией молекул,
необходимый для того, чтобы произошло
химическое взаимодействие.
Это энергетический барьер, который должны
преодолеть молекулы при переходе из одного
состояния реакционной системы в другое.
17. Скорость превращения и скорость реакции
а) чем выше энергияактивации реакции (линия
1), тем более
чувствительна она к
изменению температуры;
б) химические реакции
более чувствительны к
изменению температуры в
области более низкой
температуры.
18. Скорость превращения и скорость реакции
Для ориентировочной оценки влияния температуры наскорость реакции можно пользоваться правилом ВантГоффа: при повышении температуры повышении
температуры на каждые 10 градусов константа
скорости гомогенной элементарной реакции
увеличивается в два—четыре раза
T T
r2 r1
2
Действует при температуре 10–400 °С и Е=60-120
КДж/моль
10
1
19. Скорость превращения и скорость реакции
Кинетическое уравнение простойобратимой реакции
R S
k 2C R CS
A B
r k1C A C B 1
A B
k1C A C B
k2
r r1 1
k1
i
Ci
1
r r1 1
К
р
Ci
i
20. Скорость превращения и скорость реакции
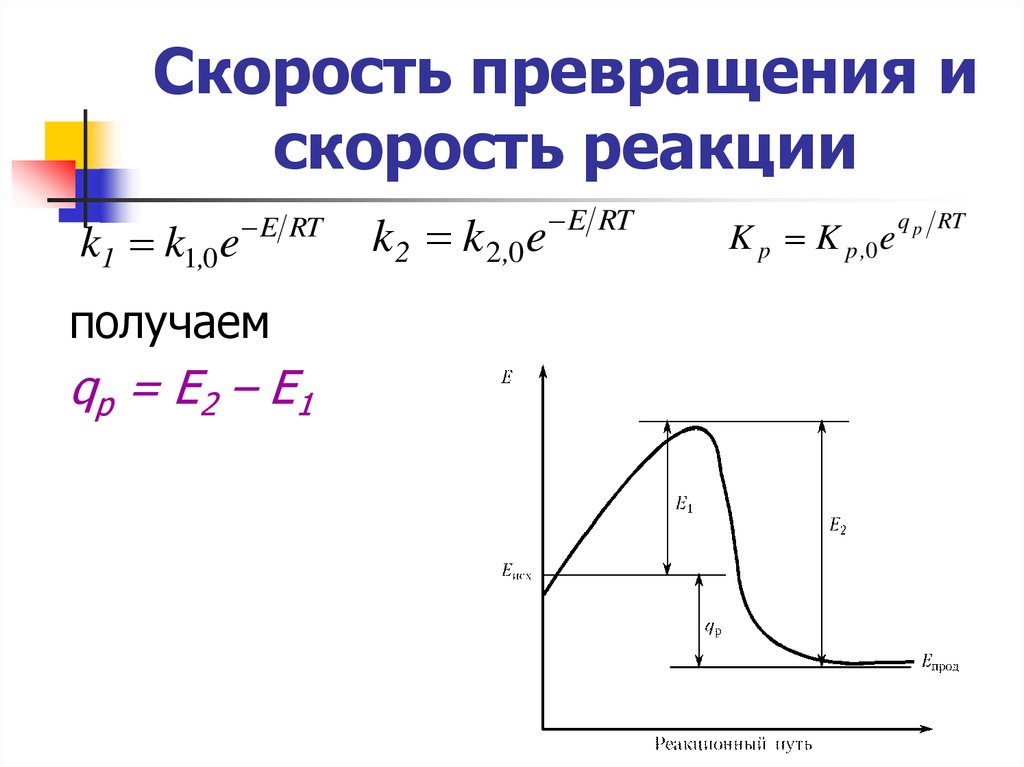
k1 k1,0 eE RT
получаем
qр = Е2 – Е1
k 2 k 2,0 e
E RT
K p K p ,0 e
q p RT
21. Скорость превращения и скорость реакции
Первая стадия реакцииk1СА(СК0 – САК) = k2САК
Общая скорость реакции определяется
скоростью второй стадии
r = k3САК
Кинетическая модель гомогеннокаталитической реакции r k1k3C AC K 0
k 2 k1C A


















 Физика
Физика








