Похожие презентации:
Молекулярная физика и термодинамика
1. Молекулярная физика и термодинамика
Лекция 7Молекулярная физика
и термодинамика
2. §§ Введение
Термодинамика или общая теориятеплоты, изучает общие свойства
макроскопических систем,
отвлекаясь от микроскопического
строения вещества (энергетический
подход).
Она изучает только равновесные
состояния тел, а также медленные
процессы – равновесные состояния,
непрерывно следующие друг за другом.
02
3.
Молекулярная физикаизучает строение и свойства вещества,
исходя из атомно-молекулярного
представления и рассматривает
теплоту как беспорядочное движение
атомов и молекул
(статистический подход)
МФ также называют молекулярнокинетической теорией строения
вещества.
03
4.
При нормальных условиях1 см3 воздуха содержится
27 000 000 000 000 000 000 = 2,7∙1019
1) В
молекул
2) средняя скорость движения молекул
≈ 500 м/с и она растет с увеличением
температуры
3) средняя длина свободного пробега
молекул ≈ 10–7 м
4) за 1 с молекула испытывает около
5 млрд. столкновений
04
5. §§ Термодинамическая система
это совокупность макроскопических тел,обменивающихся энергией между собой
и с другими телами
Физические величины, характеризующие
состояние термодин. системы называются
термодинамическими параметрами
Любое изменение в системе, связанное
с изменением хотя бы одного параметра,
называется термодинамическим
процессом
05
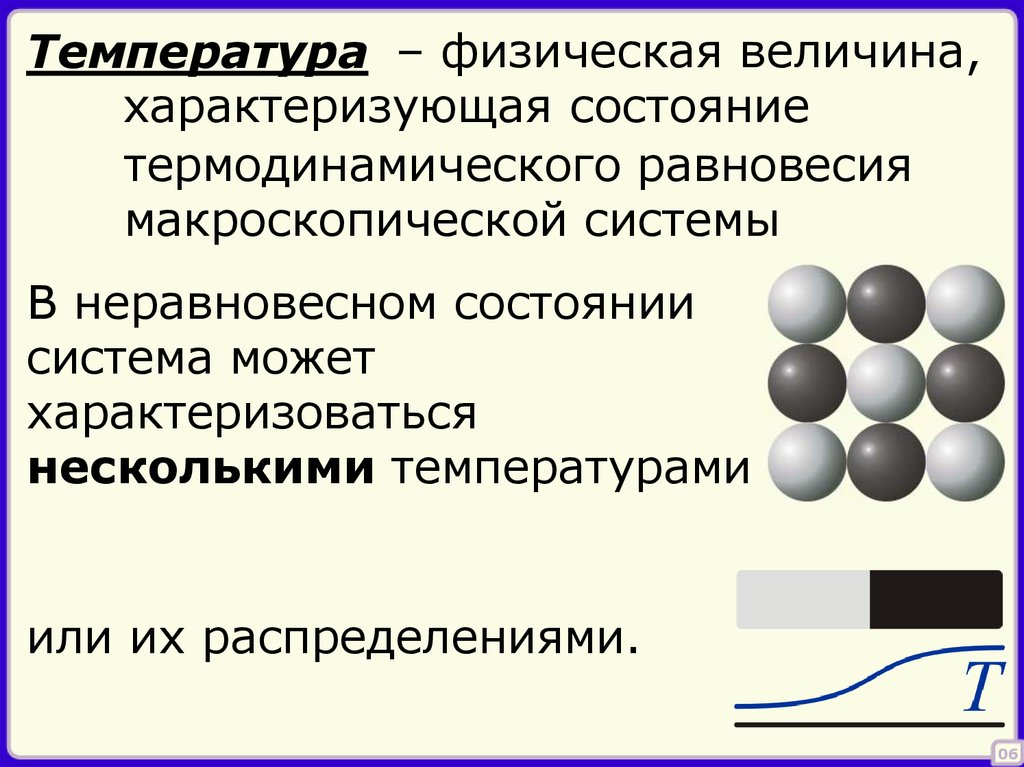
6.
Температура – физическая величина,характеризующая состояние
термодинамического равновесия
макроскопической системы
В неравновесном состоянии
система может
характеризоваться
несколькими температурами
или их распределениями.
06
7.
Давление – физическая величина,равная отношению силы, действующей
по нормали на некоторую площадку
к величине этой площадки
dFn
P
dS
Удельный объем – величина, обратная
к плотности
dV 1
dm
если ρ = const, то систему характеризуют
общим объемом V
07
8. §§ Уравнение состояния
Состояние некоторой массы газаопределяется тремя ТД параметрами:
p – давление, V – объем, T – температура
Уравнение состояния устанавливает
связь между ними:
f ( p ,V , T ) 0
или
pV f (V , T )
В настоящее время предложено много
(более 100) уравнений состояния,
различающихся точностью и сложностью
08
9. §§ Идеальный газ
это модель среды (как с.м.т. или а.т.т.),определяемая положениями:
1) суммарный объем молекул газа
пренебрежимо мал
(по сравнению с объемом сосуда)
2) между молекулами отсутствуют
силы взаимодействия
3) столкновения между молекулами
и стенкой – абсолютно упругие
09
10.
Нормальные условияP = 1 атм = 760 мм Hg ≈ 105 Па
Физическая атмосфера: 1,013250·105 Па
Техническая атмосфера: 0,980665·105 Па
Температура:
T = 273,15 К (0 °С)
Стандартные условия (химия) :
P = 1 атм, T = 298,15 К (25 °С)
Многие газы при НУ, а также при низком
давлении и при высокой температуре,
можно считать идеальными
10
11.
Уравнение Менделеева–КлапейронаPV RT
m
N
– число молей газа
M NA
M ,гр моль
m – масса газа, кг
M – молярная масса газа, кг/моль
N – число молекул
NA = 6,022·1023 – число Авогадро
R = 8,31 Дж/(моль∙К)
11
12.
NN R
PV
RT P
T P n kB T
NA
V NA
N
n
– концентрация молекул, м–3
V
kB = 1,38∙10–23 Дж/К – постоянная
Больцмана
Замечание
Уравнение Менделеева–Клапейрона
оказывается справедливым только
при малой плотности реального газа
0, Vm V
12
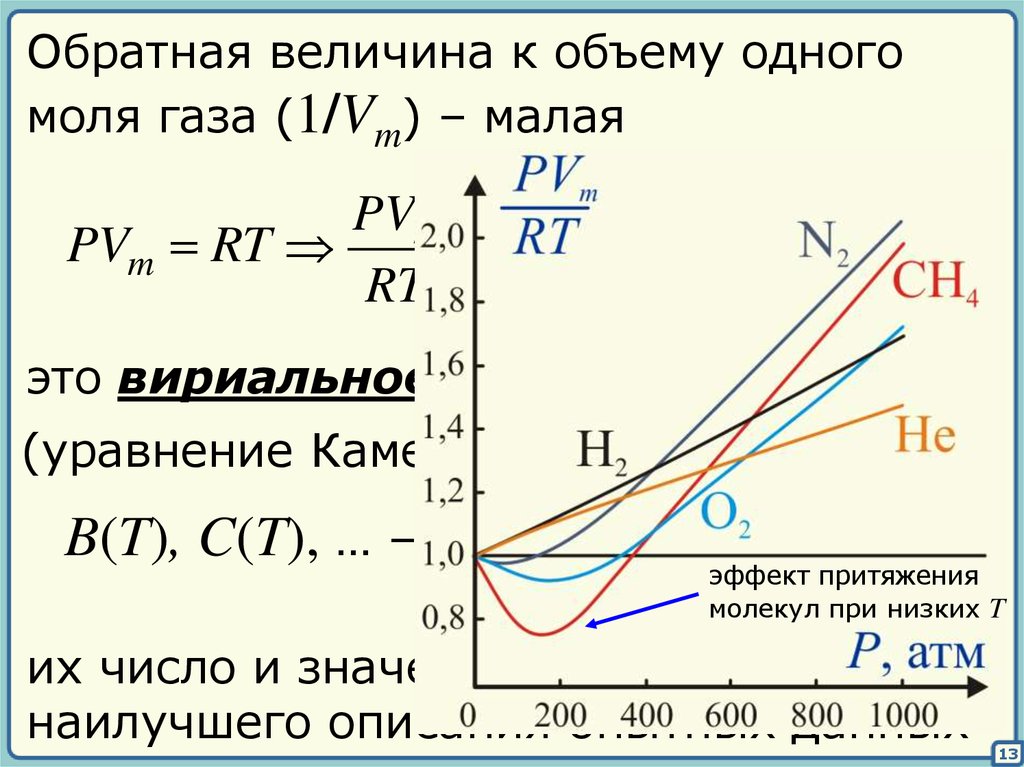
13.
Обратная величина к объему одногомоля газа (1/Vm) – малая
B (T ) C (T )
PVm
2 ...
PVm RT
1
Vm
RT
Vm
это вириальное уравнение состояния
(уравнение Камерлинг-Оннеса, 1901)
B(T), C(T), … – вириальные
эффект притяжения
молекул при низких T
коэффициенты
их число и значения выбирают для
наилучшего описания опытных данных
13
14. §§ Барометрическая формула
Если на газ в сосуде действует сила,то концентрация молекул установится в
результате действия «противоположных»
факторов:
1) внешнее воздействие
2) хаотическое движение молекул
Пусть температура газа постоянна.
Пусть на газ действует сила тяжести,
которая не меняется с высотой.
14
15.
ПустьS – площадь основания
z : [ P2 P1 ]S (n dz S ) m0 g 0
m0 – масса одной молекулы
[n( z )k BT n( z dz )k BT ] n( z )dz m0 g 0
m0 g dz
dn
dn
k BT n( z ) m0 g
k BT
n
dz
вычислим интеграл от обеих частей
15
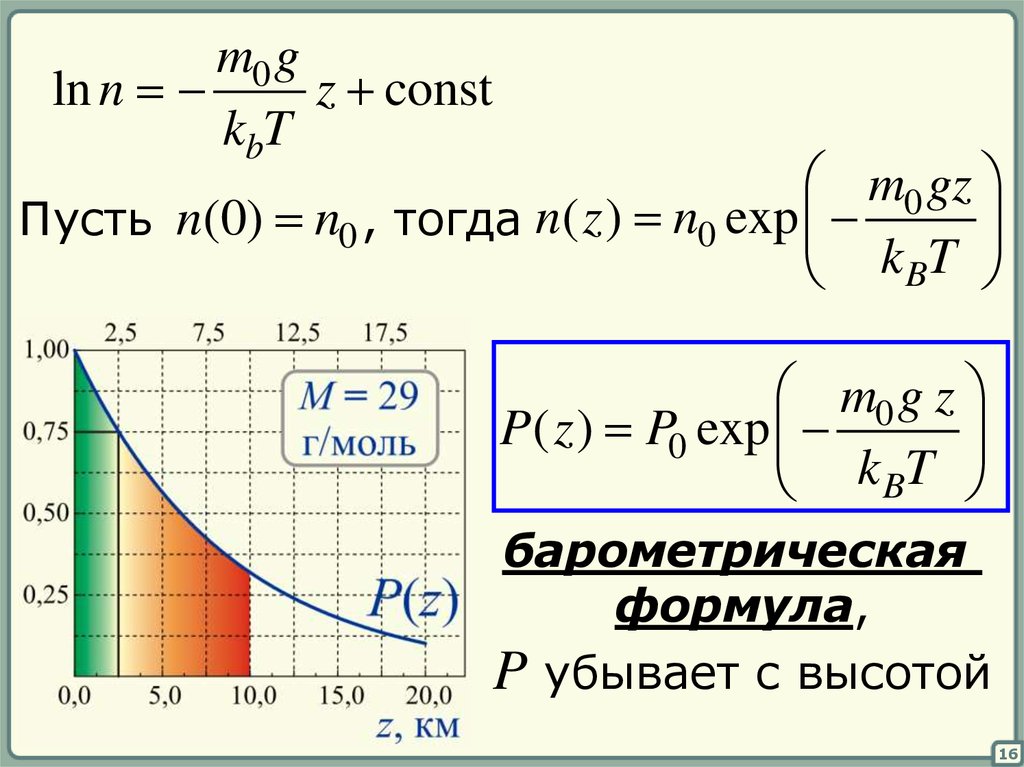
16.
m0 gz const
ln n
kbT
m0 gz
Пусть n(0) n0 , тогда n( z ) n0 exp
k BT
m0 g z
P( z ) P0 exp
k BT
барометрическая
формула,
P убывает с высотой
16
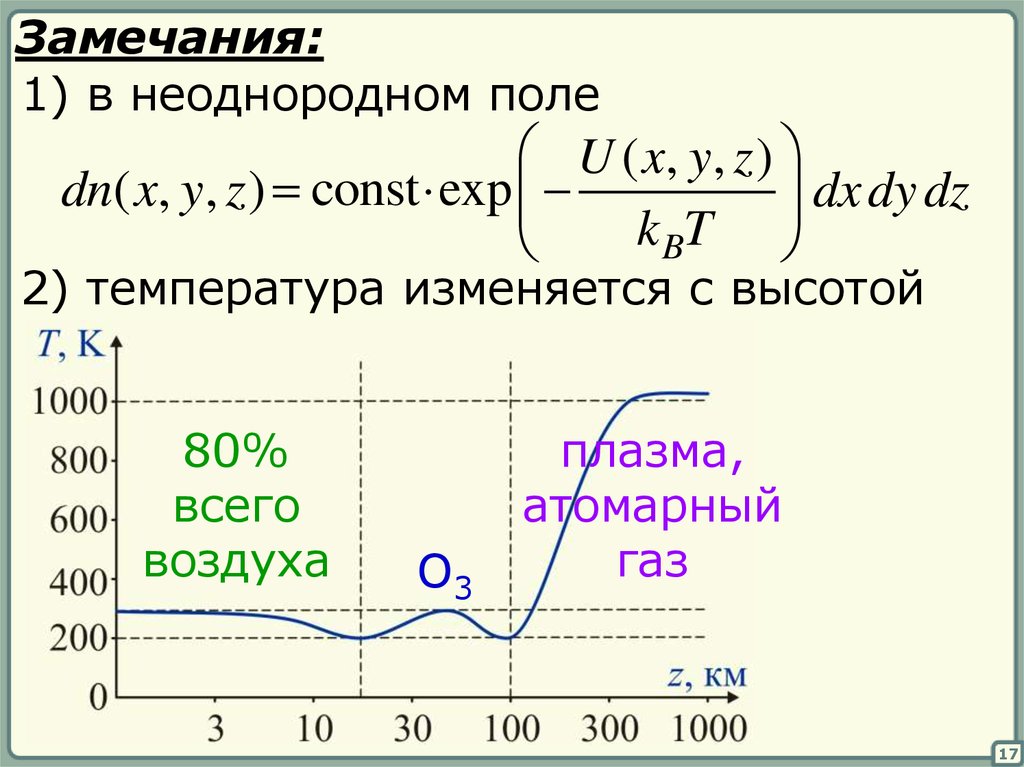
17.
Замечания:1) в неоднородном поле
U ( x, y , z )
dn( x, y, z ) const exp
dx dy dz
k BT
2) температура изменяется с высотой
80%
всего
воздуха
O3
плазма,
атомарный
газ
17
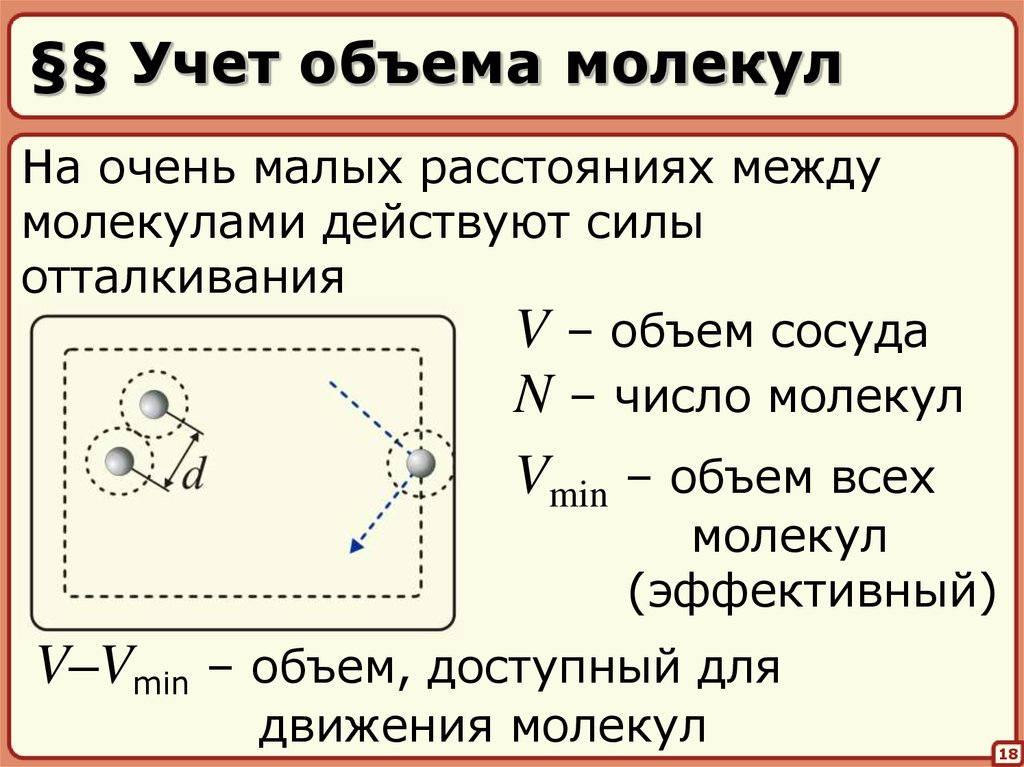
18. §§ Учет объема молекул
На очень малых расстояниях междумолекулами действуют силы
отталкивания
V – объем сосуда
N – число молекул
Vmin – объем всех
молекул
(эффективный)
V–Vmin – объем, доступный для
движения молекул
18
19.
Основное уравнение МКТ:или
N
k BT
P n ' k BT
V Vmin
N
P(V Vmin )
RT
NA
Пусть
b – минимальный объем 1 моля
(объемная поправка)
тогда
P (V b) RT – уравнение Дюпре
19
20.
Газb,
см3/моль
Ne
17,09
He
23,70
H2
26,61
NO
27,89
H2O
30,49
O2
31,83
Ar
32,19
NH3
37,07
N2
39,13
Kr
39,78
CO
39,85
CO2
42,67
CH4
42,78
NO2
44,24
Xe
51,05
Cl2
56,22
SO2
56,36
C2H6
63,80
C3H8
84,45
Величина b обычно принимает
значения 15–60 см3/моль
Например, в 1 м3 воздуха
при н.у. содержится ≈ 40 моль
газа и собственный объем
молекул ≈ 1,4 литра (0,14 %)
При увеличении температуры
b уменьшается вместе с
радиусом зоны ограждения.
d ≈ 10–9–10–10 м
20
21. §§ Внутреннее давление
На больших расстояниях междумолекулами действуют силы притяжения
В центре – практически
уравновешены.
Вблизи стенки – сила
направлена к центру.
Следовательно, давление реального газа
выше давления идеального газа,
но на стенку такой газ оказывает
меньшее давление.
21
22.
Пустьx – расстояние от стенки сосуда,
U(x) – потенциальная энергия молекулы
согласно распределению Больцмана
U ( x)
n( x) n0 exp
k BT
n0 – концентрация молекул в точке, где
U = Umin = 0 (центр объема)
Давление газа на стенку (x = 0):
U0
P n(0) k BT n0 k BT exp
k BT
22
23.
Концентрация молекул возле стенкиТогда
N
n0
V b
V – объем сосуда
U0
P (V b) RT exp
k BT
Сила, действующая на пристеночную
молекулу пропорциональна числу
молекул газа N, и, следовательно,
U0 – тоже
N
U 0 NN A a
U0
V
k BT
VRT
VRT
23
24.
aP(V b) RT exp
VRT
– уравнение Дитеричи
a – константа для данного газа
a , 10–3
Па·м6/моль2
He
H2
N2
O2
Ar
Ne
Cl2
CO2
H2O
34
24
135
136
134
209
650
361
554
a
a
Если a VRT, то exp
≈ 1
VRT
VRT
24
25.
P(V b) RTa
2
V
2
a
P
(V b) RT
V (V b)
Если V b , то получаем
2
a
P 2 (V b) RT
V
– уравнение Ван-дер-Ваальса
25
26.
P – давление газа на стенку сосудаP'
P
a
2
V
2
a
2
V
2
– внутреннее давление
– давление газа при
исчезновении сил притяжения
между молекулами.
При пренебрежении внутренним
давлением и объемной поправкой
оно переходит в уравнение
PV RT
26
27. §§ Изобары реального газа
Каждый реальный газ представляетсобой ненасыщенный (перегретый) пар,
т.е. при соответствующем понижении
температуры он конденсируется,
превращаясь в жидкость или кристалл
Рассмотрим воду, налитую в
сосуд, закрытый подвижным
поршнем (P = const)
Будем подводить теплоту,
начиная с T = 273 K (0 °С)
27
28.
А: жидкость, T = 273 KA-B: расширение
жидкости при
нагревании
При дальнейшем подведении тепла вода
начинает испаряться (т.В, T = 373 K)
и объем, занятый водой и паром
начинает быстро расти.
Температура, при этом, остается
постоянной (изотерма = изобаре)
28
29.
C: T = 373 KВ сосуде – жидкость и влажный пар
(содержит капельки жидкости,
увлеченные с поверхности)
D: T = 373 K
Это точка конденсации пара.
В сосуде – сухой насыщенный пар
(капелек не содержит)
E: При дальнейшем увеличении
температуры пар становится
ненасыщенным (перегретым)
29
30.
Кипение и конденсация – фазовыепереходы I-го рода, сопровождающиеся
поглощением или выделением теплоты,
изменением состояния и объема.
Теплота, выделяющаяся при ФП I-го
рода (скрытая теплота) – энергия,
равная отрицательной потенциальной
энергии притяжения молекул
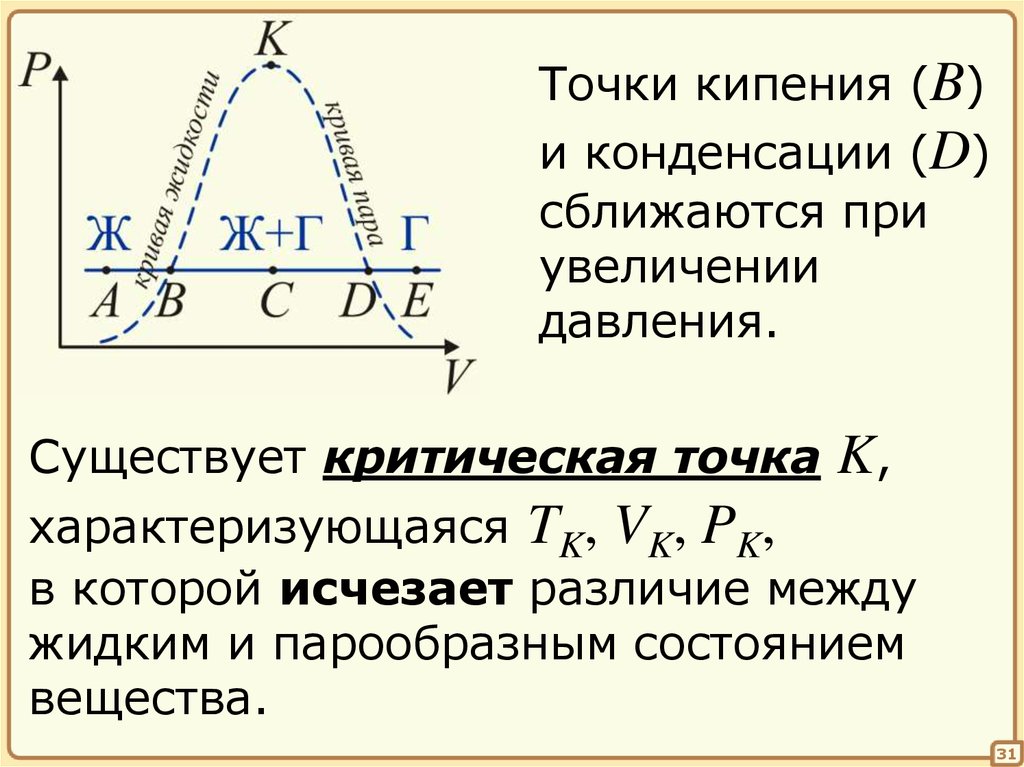
Замечание о критической точке
Чем больше давление, тем больше
расширяется жидкость, прежде чем
закипеть (участок АВ).
30
31.
Точки кипения (B)и конденсации (D)
сближаются при
увеличении
давления.
Существует критическая точка
K,
характеризующаяся TK, VK, PK,
в которой исчезает различие между
жидким и парообразным состоянием
вещества.
31
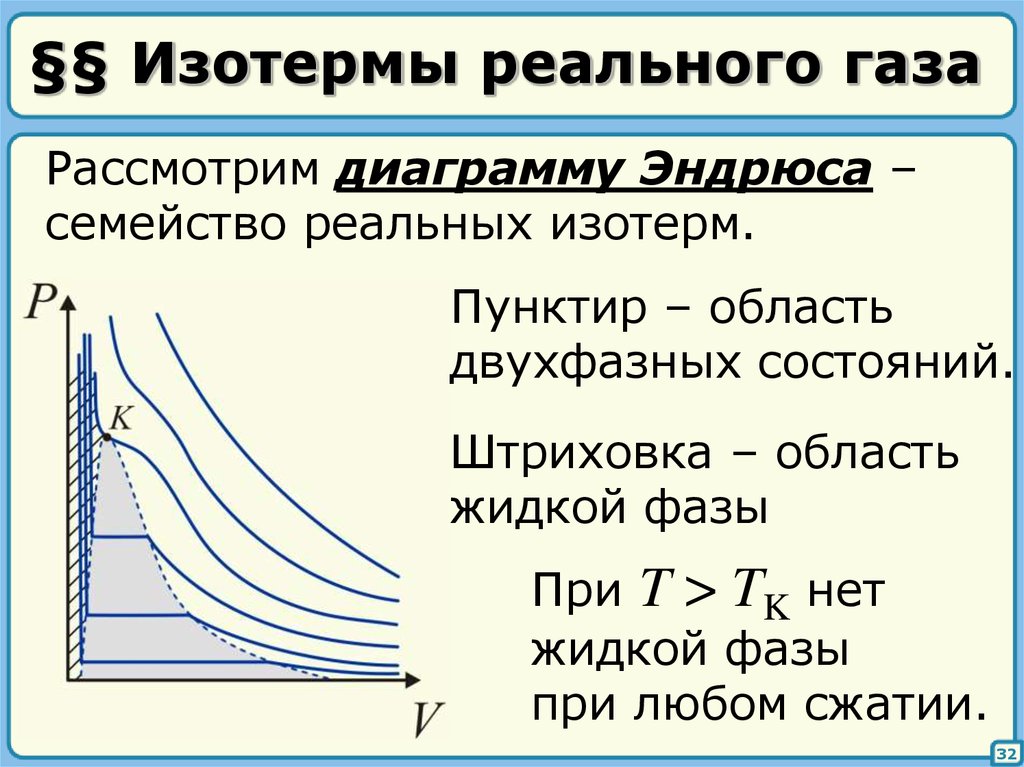
32. §§ Изотермы реального газа
Рассмотрим диаграмму Эндрюса –семейство реальных изотерм.
Пунктир – область
двухфазных состояний.
Штриховка – область
жидкой фазы
При T > TK нет
жидкой фазы
при любом сжатии.
32
33.
1-2-3 – переходпар-жидкость,
минуя двухфазную
область.
Участок BD – область
фазового перехода
(P,T = const)
Рассмотрим т.C и определим содержание
жидкой и газообразной фазы
Пусть VГ, mГ – объем и масса газа,
VЖ, mЖ – объем и масса жидкости
33
34.
ТогдаVC VЖ VГ
mЖ
mГ
VB
VD
mГ mЖ
mГ mЖ
VГ
VЖ
(т.к. эта функция должна быть линейной
и в крайних точках совпадать с VB и VD)
(mЖ mГ )VC mЖVB mГVD
или
mЖ (VC VB ) mГ (VD VC )
mЖ VD VC
mГ VC VB
– правило
рычага
34
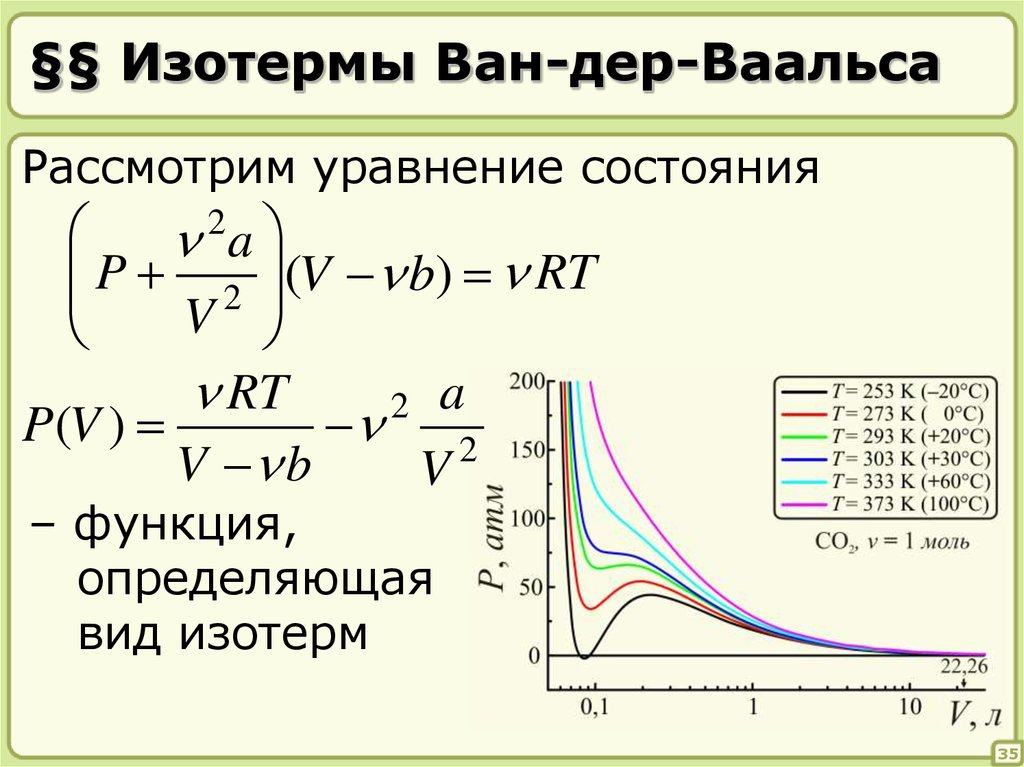
35. §§ Изотермы Ван-дер-Ваальса
Рассмотрим уравнение состояния2
a
P 2 (V b) RT
V
RT
2 a
P(V )
2
V b
V
– функция,
определяющая
вид изотерм
35
36. §§ Об уравнениях состояния
Для описания состояния газа в широкоминтервале P, V, T необходимо
пользоваться таблично заданным УС.
Для функциональной зависимости
требуется не менее 5 индивидуальных
параметров.
Из рассмотренных уравнений наиболее
точными являются вириальное и
уравнение Дитеричи.
36
37.
Уравнение ВДВ хорошо описываетсостояние газа при низком давлении
и T > TK
Для сжатых газов уравнение оправдано
в немногих случаях (CO2, N2, этилен)
Поведение плотных газов и жидкостей
оно описывает только качественно.
Для описания существенных сторон
физических явлений мы будем
использовать только уравнение
Менделеева–Клапейрона.
37
38. §§ Степени свободы молекулы
Число независимых координат,полностью определяющих положение
тела в пространстве, называется
числом степеней свободы.
Рассмотрим многоатомную молекулу
Пусть атомы в молекуле
не располагаются на одной
прямой и связи между
ними не жесткие
38
39.
Энергия молекулы: E Ek E p2
m x
2
2
m y
2
2
m z
2
iпост = 3
( Ek E p )
iкол
2
J x
2
2
J y
2
2
J z
2
iвращ = 3
колебательные
степени свободы
Поскольку положения
молекуле определяют
N атомов в
3N координат, то
iкол = 3N – (iпост + iвращ)
39
40.
гипотеза Больцмана (з-н Максвелла)в т.с., находящейся в состоянии
равновесия, на каждую поступательную
и вращательную степень свободы
приходится энергия ½kBT
и kBT – на каждую колебательную.
Средняя энергия молекулы:
i
E k BT
2
i = iпост + iвращ + 2iкол
40
41.
Пример: одноатомная молекулаi 3 (только поступ. движение)
3
E k BT
2
Пример:
двухатомная молекула
с жесткой связью
i 5
5
E k BT
2
J x J y , J z– вращением относительно
оси
x можно пренебречь
41
42.
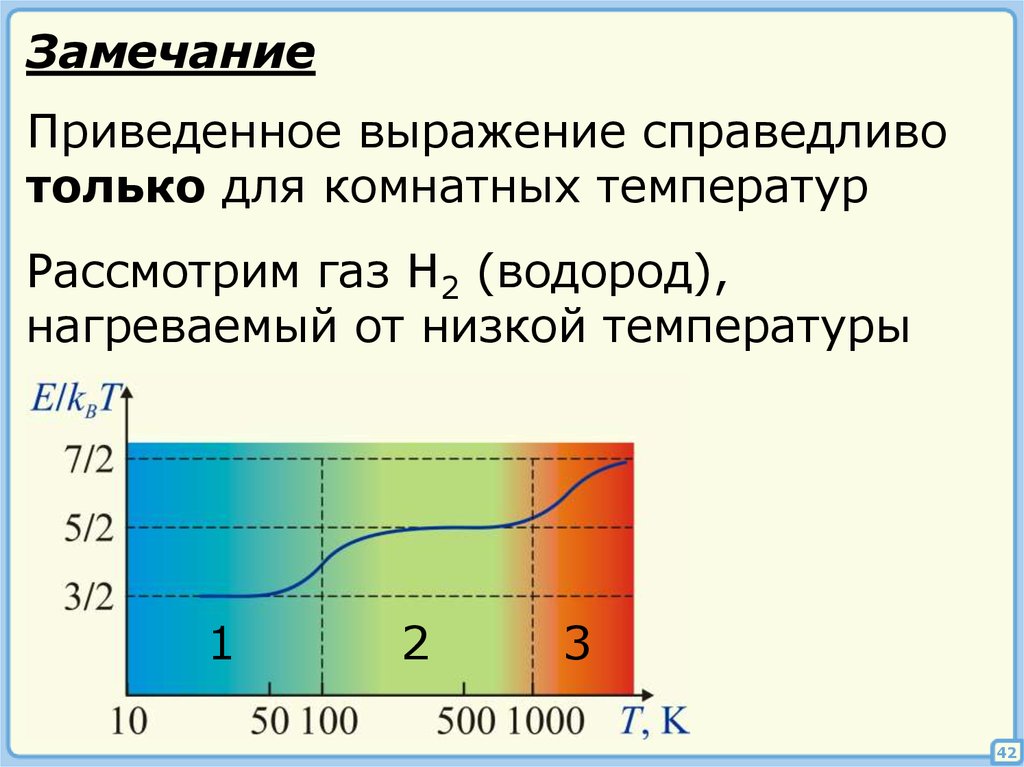
ЗамечаниеПриведенное выражение справедливо
только для комнатных температур
Рассмотрим газ H2 (водород),
нагреваемый от низкой температуры
1
2
3
42
43.
1) Для молекулы, состоящей из любогочисла атомов, i = 3.
Для возбуждения вращательной степени
свободы молекулам необходима
некоторая минимальная энергия
2) В газе есть молекулы с i = 3 и i = 5.
(вращательные уровни «разморожены»)
3) Энергии достаточно для возбуждения
колебательных степеней свободы,
но диссоциация наступает раньше,
чем их полное «размораживание»
43
44. §§ Средняя скорость молекул
Средняя кинетическая энергия молекулыm0 3
E
k BT
2
2
2
3k BT
m0
2
Средняя квадратичная скорость
кв
2
1
3k BT
2
i
N
m0
Средняя арифметическая скорость
1
i
N
46
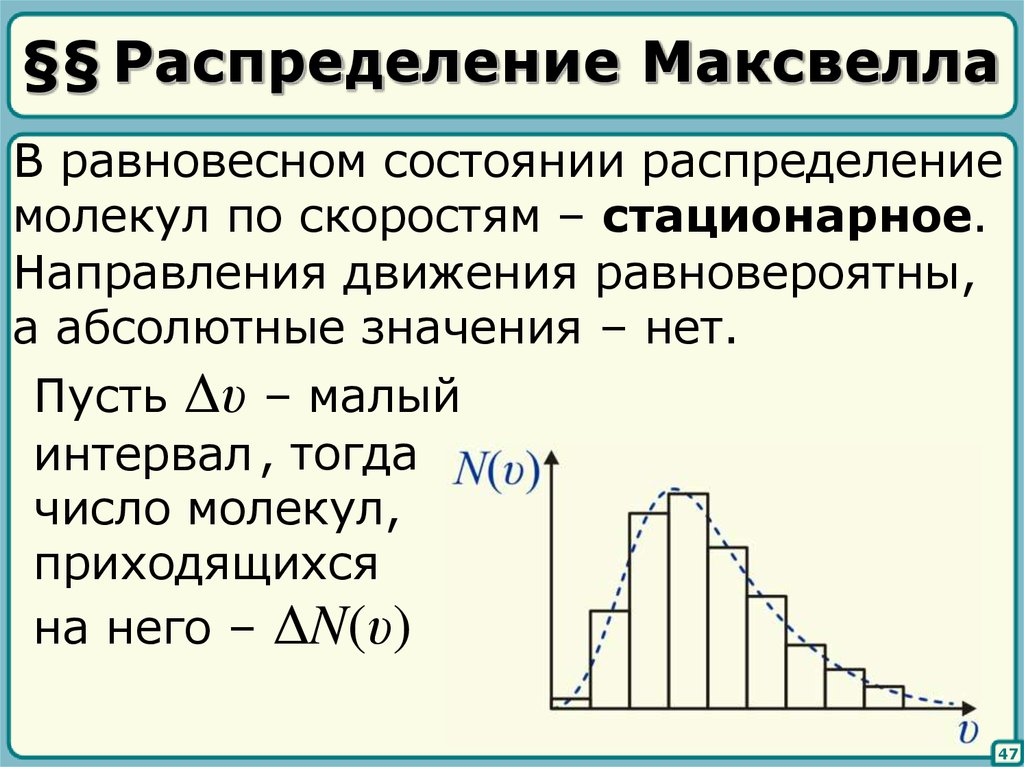
45. §§ Распределение Максвелла
В равновесном состоянии распределениемолекул по скоростям – стационарное.
Направления движения равновероятны,
а абсолютные значения – нет.
Пусть Δυ – малый
интервал , тогда
число молекул,
приходящихся
на него – ΔN(υ)
47
46.
f ( ) – функция распределениямолекул по скоростям
dN
f ( )d – относительное число
N
молекул со скоростями
в интервале [ , d ]
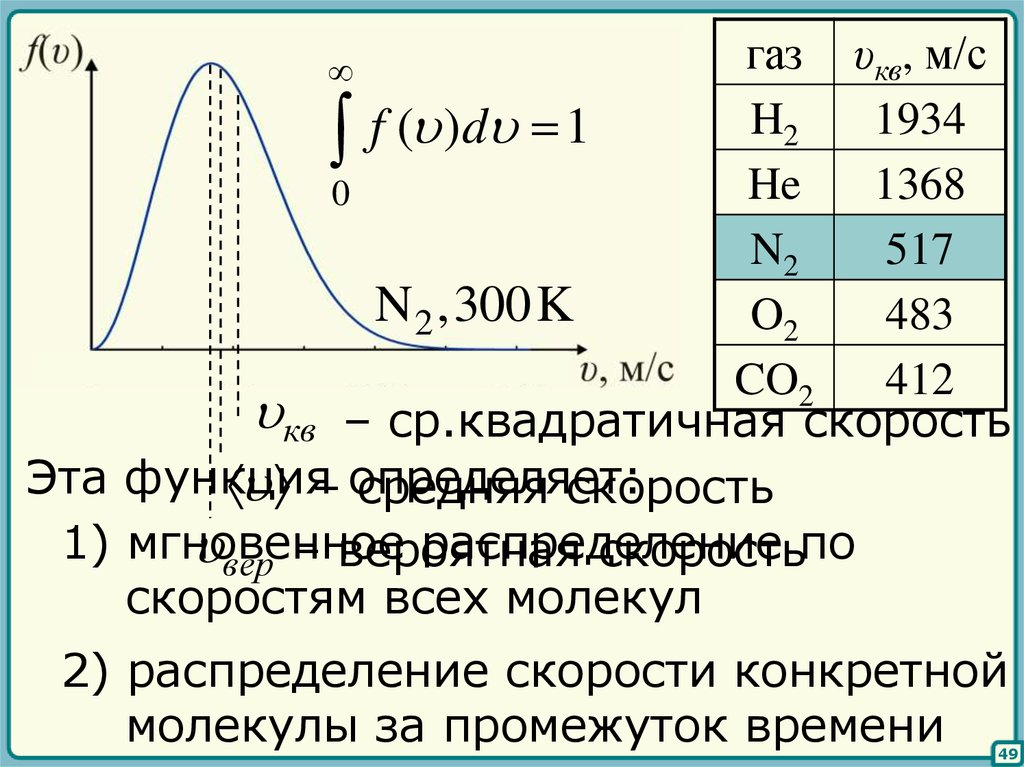
32
m0 2
m0 2
f ( ) 4
exp
2 k BT
2k BT
– функция распределения Максвелла
48
47.
газ υкв, м/сH2
1934
f ( ) d 1
He
1368
0
N2
517
N 2 ,300K
O2
483
CO2
412
кв – ср.квадратичная скорость
Эта функция
– определяет:
средняя скорость
1) мгновенное
распределение
вер – вероятная
скоростьпо
скоростям всех молекул
2) распределение скорости конкретной
молекулы за промежуток времени
49
48.
Вычислим наиболее вероятную скоростьdf
0
d
f ( ) exp( )
2
2
2
3
2
f '( ) 2 exp( ) 2 exp( )
2k BT
2
1 0 вер
m0
Вычислим среднюю скорость.
Учтем, что f(υ) – вероятность (плотность
вероятности) иметь молекуле данную
скорость
50
49.
Тогдаf ( )d exp( )d
3
0
2
0
2
2
2
2
exp( ) d x
20
u x d exp( x)dx
x exp( x)dx
du dx 1 exp( x)
20
8k BT
exp(
x
)
dx
2
m0
2 0
2
51
50.
2k BTвероятная скорость: вер
m0
2
вер 1,13 вер
средняя скорость:
ср. квадратичная:
3
кв
вер 1,22 вер
2
Замечание
Если в сосуде несколько сортов
молекул, то в состоянии равновесия
средние энергии у них – одинаковы
52
51. §§ Понятие температуры
Распределение молекул по скоростяму разряженного газа, находящегося
при высокой температуре описывается
законом Максвелла
i
E k BT
2
В области низких температур
3
E k BT
2
53
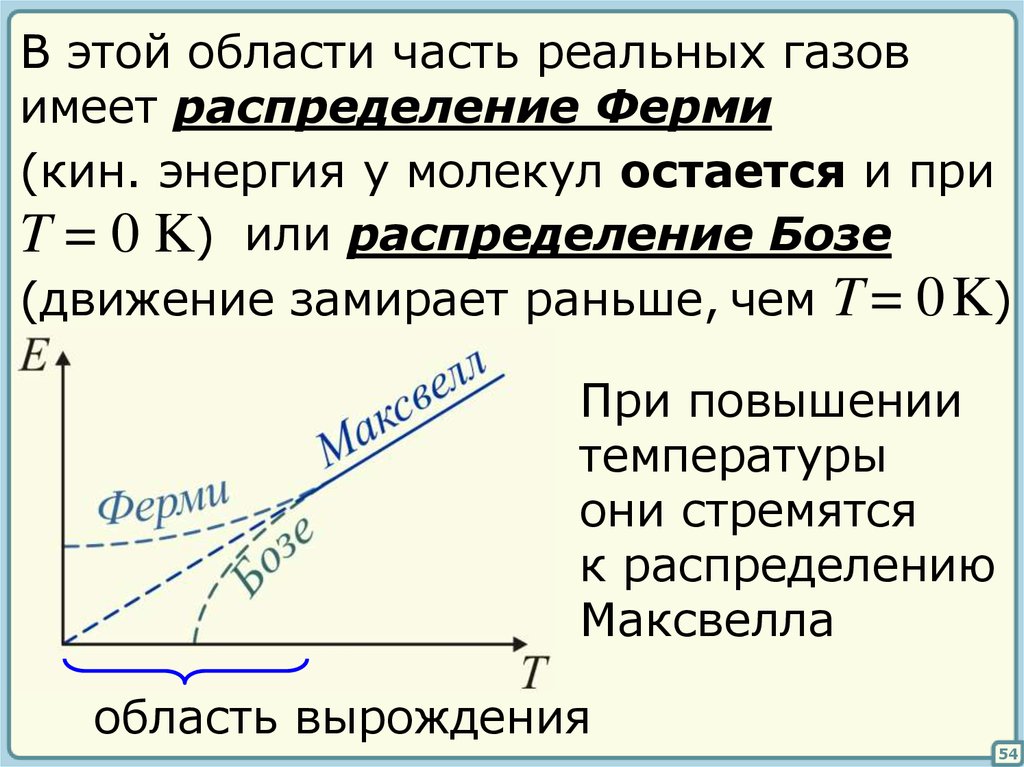
52.
В этой области часть реальных газовимеет распределение Ферми
(кин. энергия у молекул остается и при
T = 0 K) или распределение Бозе
(движение замирает раньше, чем T = 0 K)
При повышении
температуры
они стремятся
к распределению
Максвелла
область вырождения
54
53.
Понятие температуры сейчас не имеетнаглядного молекулярно-кинетического
представления.
До создания квантовой теории, понятие
температуры было одним из самых
простых, а сейчас – одно из наиболее
сложных.
Под температурой следует понимать
величину, которая устанавливается
независимо от представлений об
идеальном газе.
55
54. §§ Длина свободного пробега
Пусть d – эффективныйдиаметр молекулы (d ~ 2–3
Å)
– средняя скорость молекулы
Пусть z – число соударений
за время Δt, тогда все эти
молекулы находились в
объеме ломанного цилиндра
1 2
z Vn d t n , n – концентрация
4
44
55.
Расчет, учитывающий движение всехмолекул дает
z 2 d t n
2
За время
Δt молекула прошла путь t
Средняя длина свободного пробега:
t
1
2
z
2 d n
Для нормальных условий
,м с
H2
O2
1700
425
,м
z
1,1·10–7 15·109
0,7·10–7 6,5·109
45




































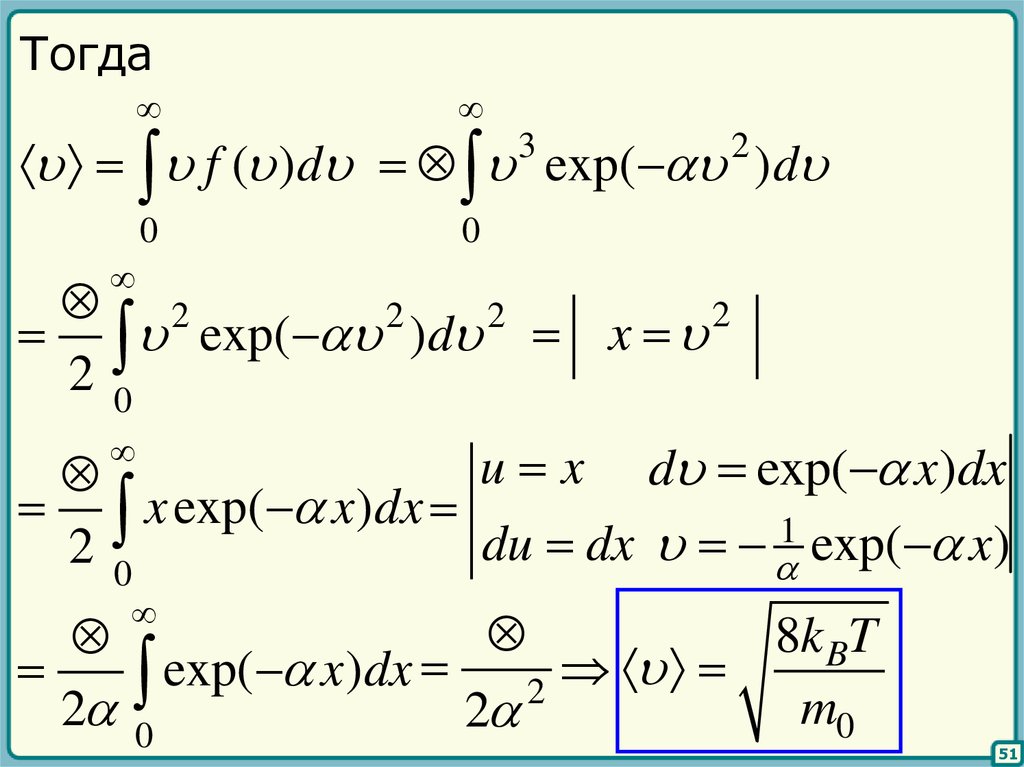





 Физика
Физика








