Похожие презентации:
Ароматические соединения (арены)
1. Ароматические соединения (арены)
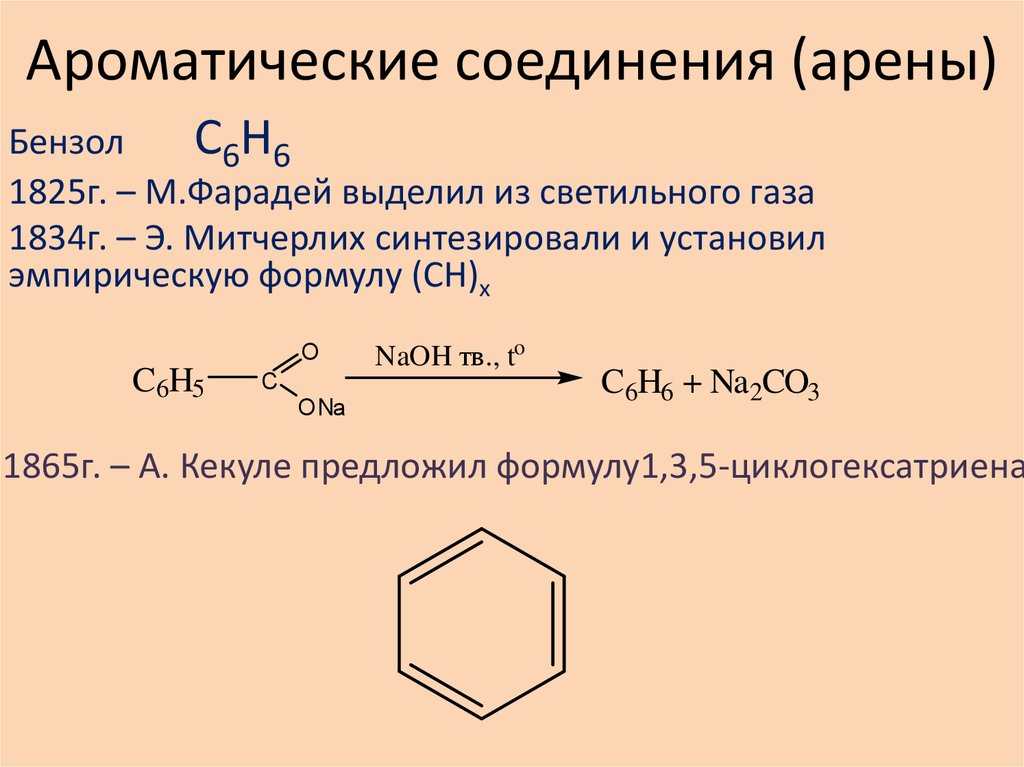
БензолС6H6
1825г. – М.Фарадей выделил из светильного газа
1834г. – Э. Митчерлих синтезировали и установил
эмпирическую формулу (СН)х
O
C6H5
C
ONa
NaOH тв., to
C6H6 + Na2CO3
1865г. – А. Кекуле предложил формулу1,3,5-циклогексатриена
2.
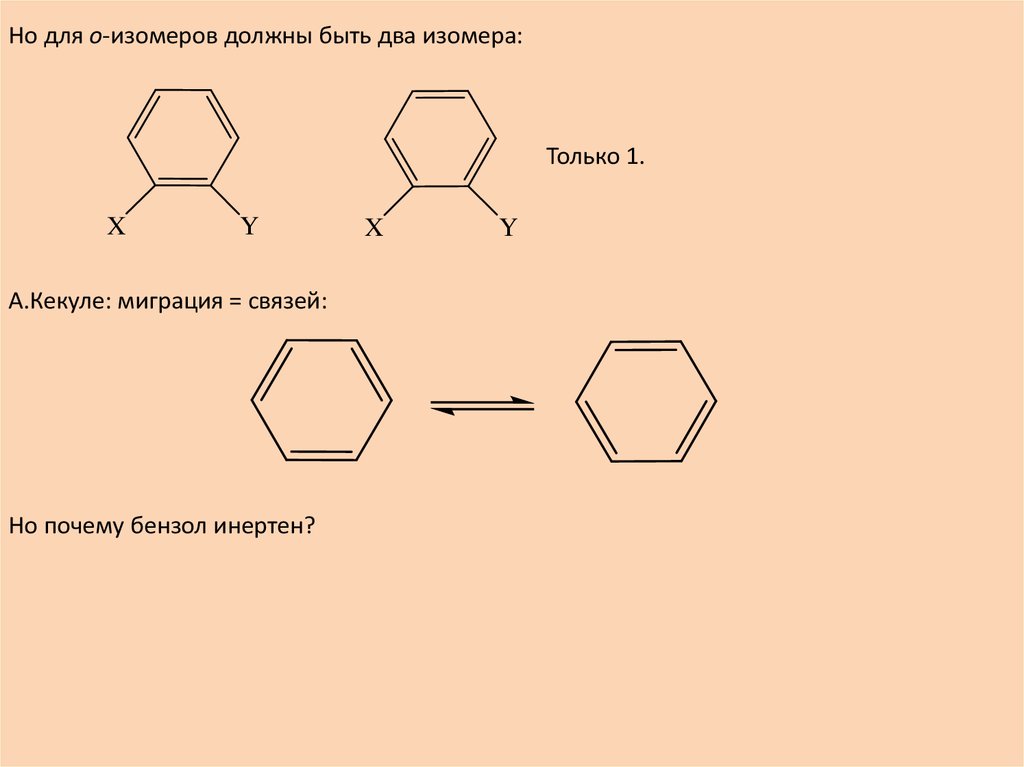
Но для о-изомеров должны быть два изомера:Только 1.
X
Y
А.Кекуле: миграция = связей:
Но почему бензол инертен?
X
Y
3.
Появились варианты структур:Призман
Ладенбурга
Центрический
бензол Клауса
Современный подход – по теории МО ЛКАО
Робинсон
Полинг
Бицикло [2.2.0]
гексадиен 2,5
(Дьюар)
4.
Энергия МОнесвязывающая
орбиталь
Все связывающие
орбитали заняты, а
разрыхляюшие вакантны
Правило ароматичности Хюккеля (1930г.)
Ароматическими называются плоские моноциклические содеинения, содержащие
замкнутую систему (4n+2) p-электронов, где n=0,1,2,3… (т.е. 2,6,10,14 p-электронов в
цикле).
Соединения, содержащие 4n p-электронов в сопряженной циклической системе,
называются антиароматическими.
Соединения, в которых отсутствует система сопряженных двойных связей, называют
неароматическими.
Моноциклические соединения, содержащие чередующиеся двойные и простые связи,
называют аннулены (лат. – annylus – колечко).
5.
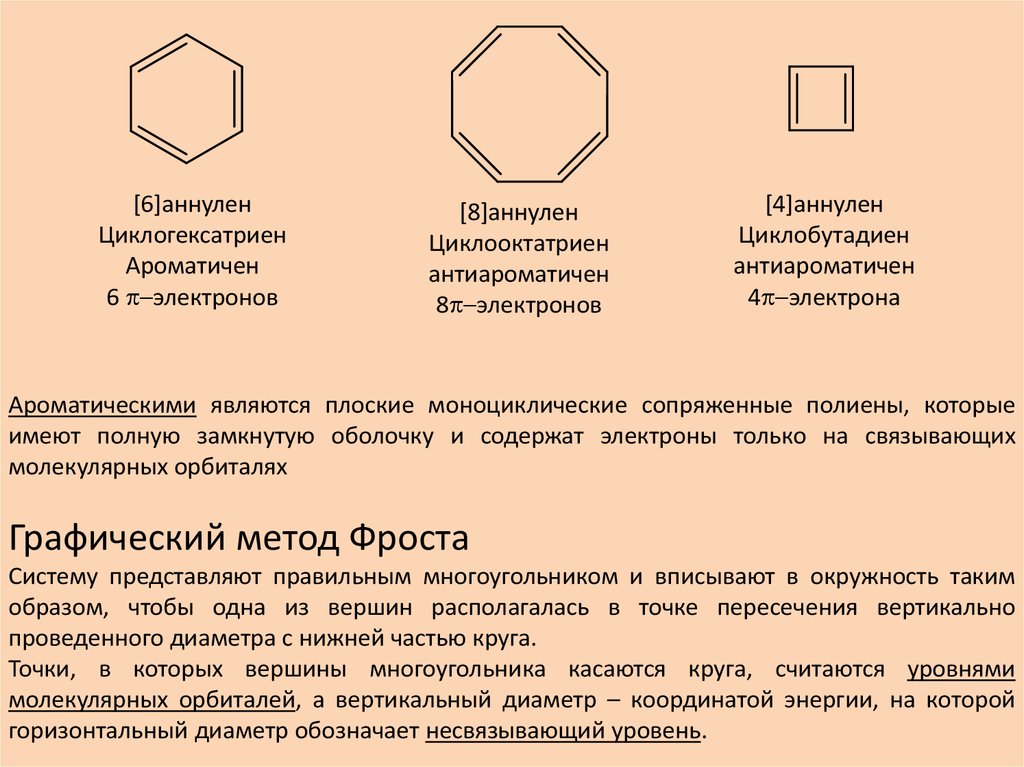
[6]аннуленЦиклогексатриен
Ароматичен
6 p-электронов
[8]аннулен
Циклооктатриен
антиароматичен
8p-электронов
[4]аннулен
Циклобутадиен
антиароматичен
4p-электрона
Ароматическими являются плоские моноциклические сопряженные полиены, которые
имеют полную замкнутую оболочку и содержат электроны только на связывающих
молекулярных орбиталях
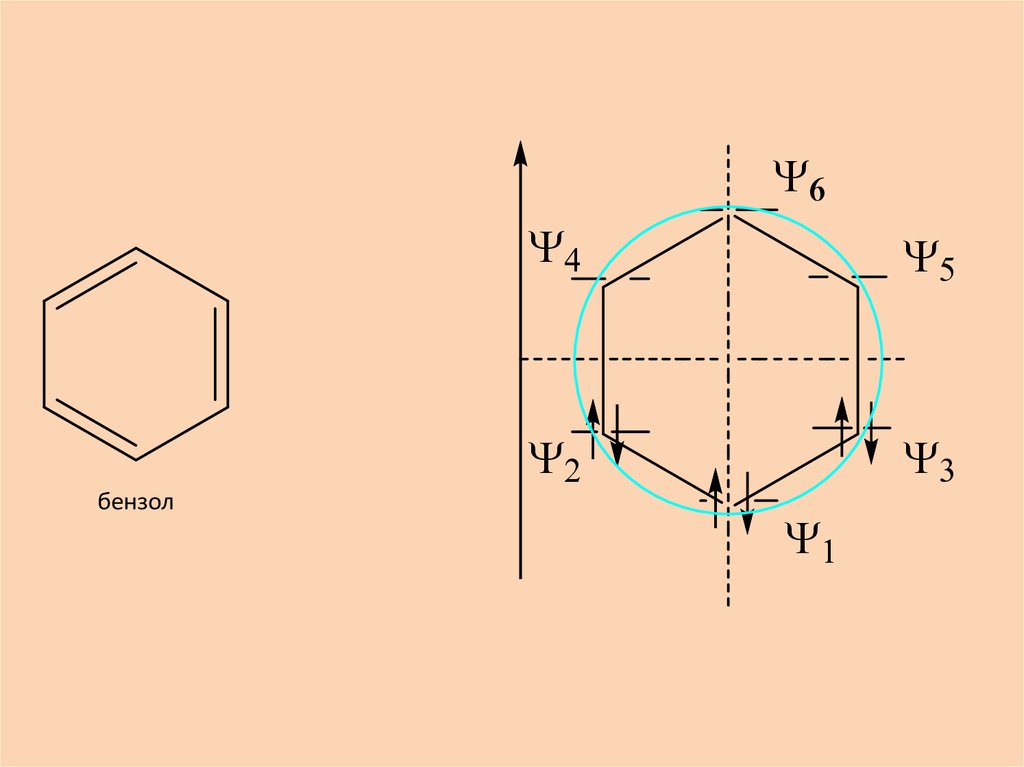
Графический метод Фроста
Систему представляют правильным многоугольником и вписывают в окружность таким
образом, чтобы одна из вершин располагалась в точке пересечения вертикально
проведенного диаметра с нижней частью круга.
Точки, в которых вершины многоугольника касаются круга, считаются уровнями
молекулярных орбиталей, а вертикальный диаметр – координатой энергии, на которой
горизонтальный диаметр обозначает несвязывающий уровень.
6.
бензол7.
циклобутадиенантиароматичен
ароматичен
8.
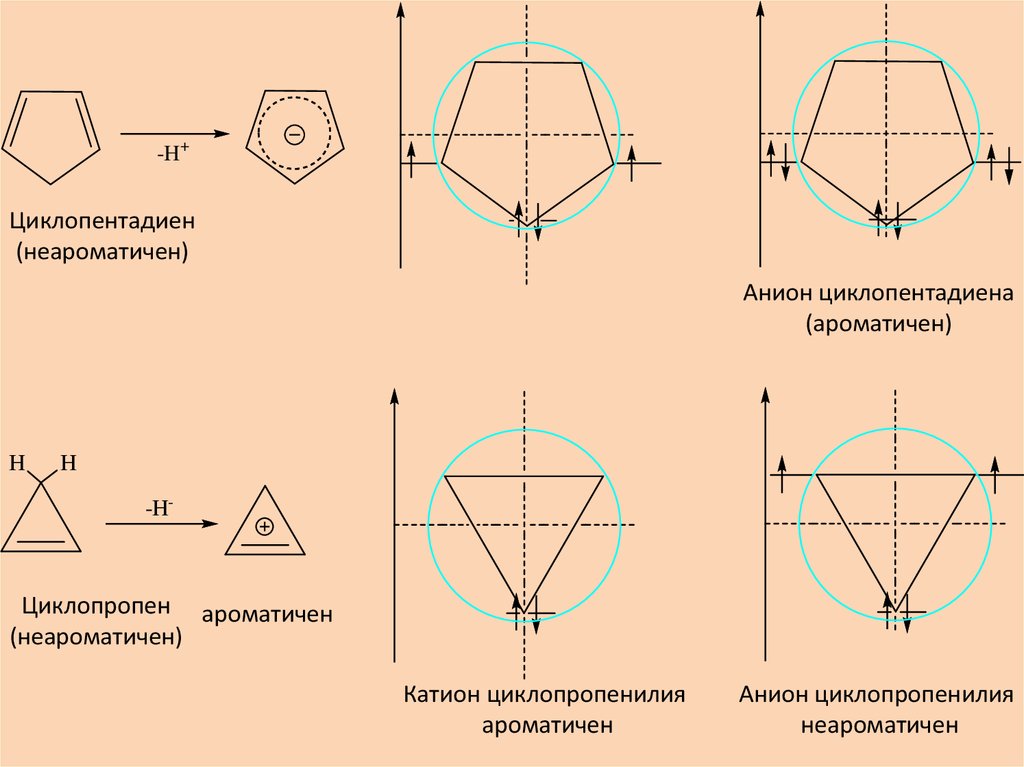
-H+Циклопентадиен
(неароматичен)
Анион циклопентадиена
(ароматичен)
H
H
-H-
Циклопропен ароматичен
(неароматичен)
Катион циклопропенилия
ароматичен
Анион циклопропенилия
неароматичен
9.
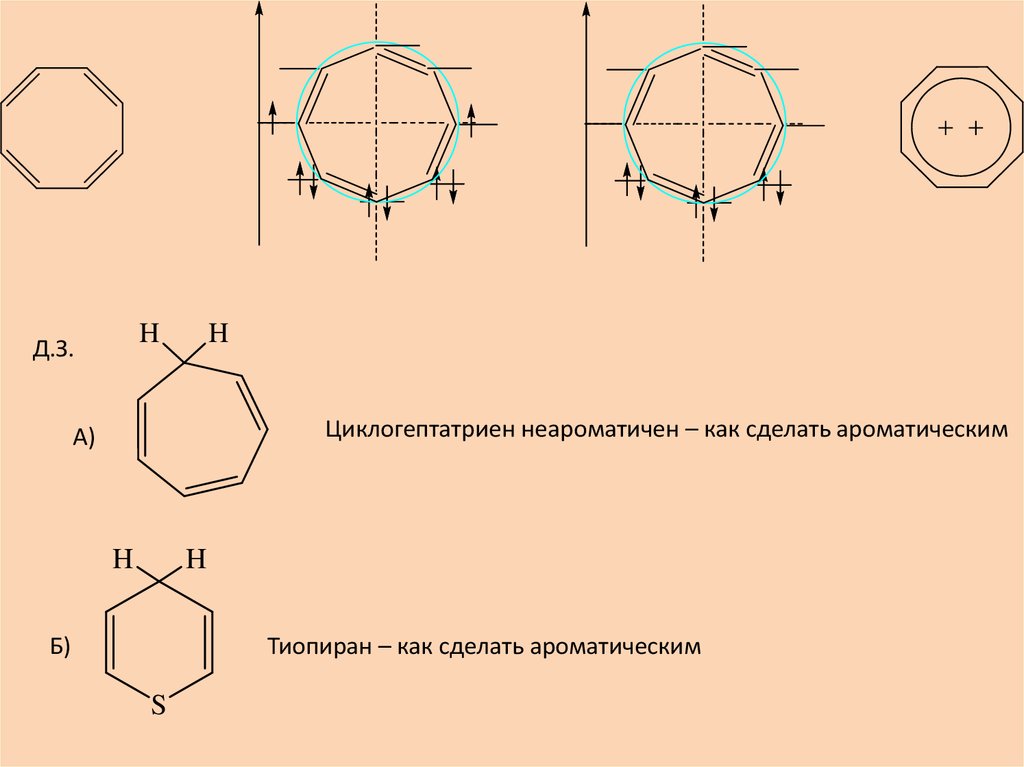
HД.З.
H
Циклогептатриен неароматичен – как сделать ароматическим
А)
H
H
Б)
Тиопиран – как сделать ароматическим
S
10.
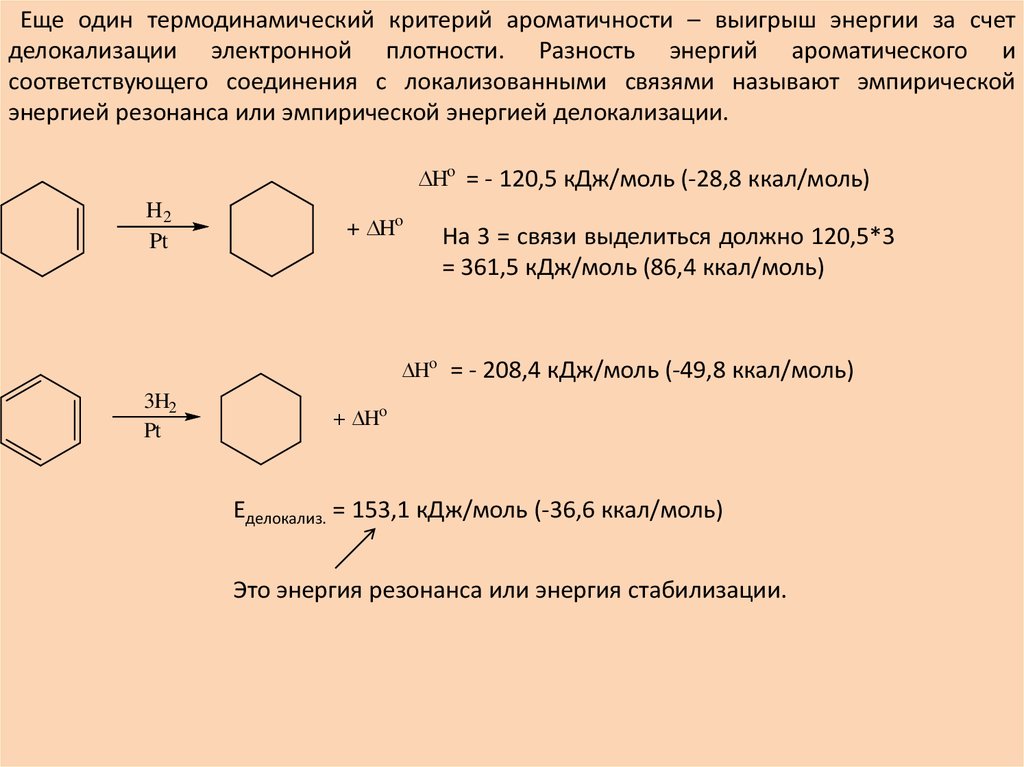
Еще один термодинамический критерий ароматичности – выигрыш энергии за счетделокализации электронной плотности. Разность энергий ароматического и
соответствующего соединения с локализованными связями называют эмпирической
энергией резонанса или эмпирической энергией делокализации.
Ho = - 120,5 кДж/моль (-28,8 ккал/моль)
H2
Pt
+ Ho
На 3 = связи выделиться должно 120,5*3
= 361,5 кДж/моль (86,4 ккал/моль)
Ho = - 208,4 кДж/моль (-49,8 ккал/моль)
3H2
Pt
+ Ho
Eделокализ. = 153,1 кДж/моль (-36,6 ккал/моль)
Это энергия резонанса или энергия стабилизации.
11.
Кинетический критерий ароматичности – легкость (скорость)электрофильного замещения (SEAr)
Термодинамический и кинетический подходы не всегда совпадают:
N
+ NO2+
k1
+ NO2+
k2
протекания
NO2
+ H+
NO2
+ H+
N
k1 >> k1, хотя энергия резонанса (термодинамический фактор) больше у пиридина
12.
Механизм SEArArE + H+
ArH + E+
E+ - NO2+, Br+, R+, ArN2+ .....
Механизм ступенчатый:
f
+ E+
E+
X-
X-
p
E
H
S
E+
X-
X-
E
H
X-
E
H
s-комплекс В общем случае аренониевый ион
E
f
H+
X-
p
E
E
H+
X-
E
H
+ HX
E
H
13.
Энергетическая диаграмма реакции:E
На
приведенной
диаграмме
стадия
образования
s-комплекса
является
лимитирующей
Координата реакции
Для веществ, меченных дейтерием или тритием, сравнивают константы скоростей по
отношению к обычным соединениям. Если kH/ kD = 10-20, говорят о наличии
кинетического изотопного эффекта (КИЭ).
КИЭ указывает на то, что стадия разрыва связи С-Н влияет на скорость всей реакции, т.е.
является лимитирующей.
14.
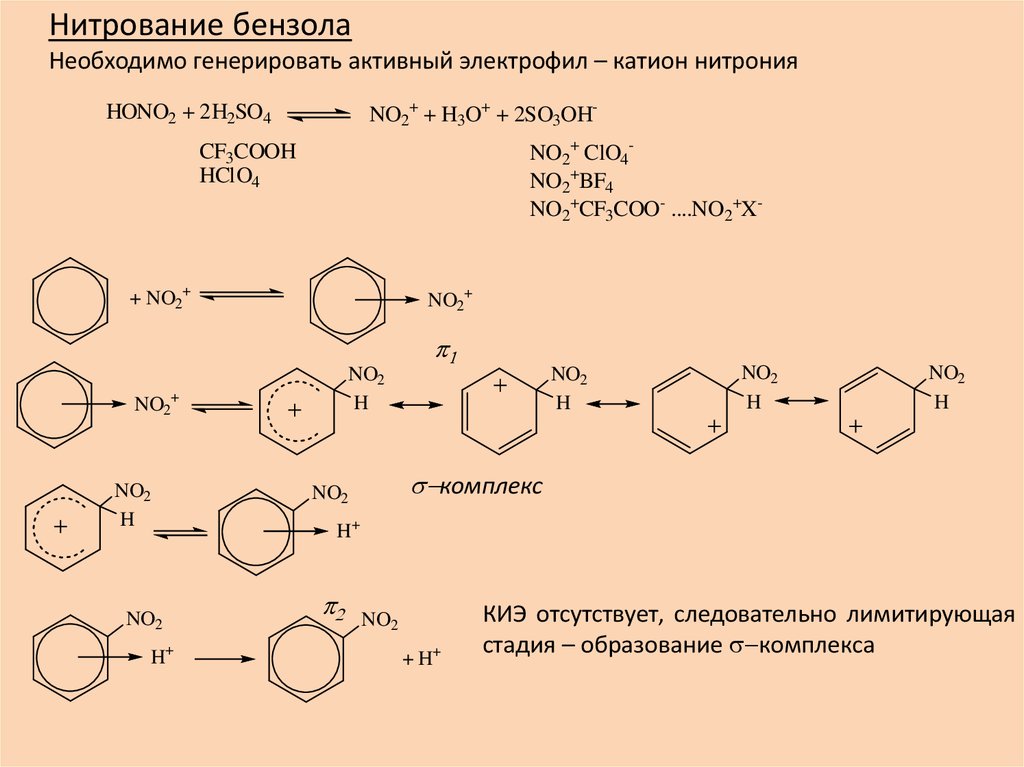
Нитрование бензолаНеобходимо генерировать активный электрофил – катион нитрония
NO2+ + H3O+ + 2SO3OH-
HONO2 + 2H2SO4
NO2+ ClO4NO2+BF4
NO2+CF3COO- ....NO2+X-
CF3COOH
HClO4
+ NO2+
NO2+
NO2
H
NO2+
NO2
H
NO2
H+
p
NO2
H
NO2
H
NO2
H
s-комплекс
NO2
H+
p
NO2
+ H+
КИЭ отсутствует, следовательно лимитирующая
стадия – образование s-комплекса
15.
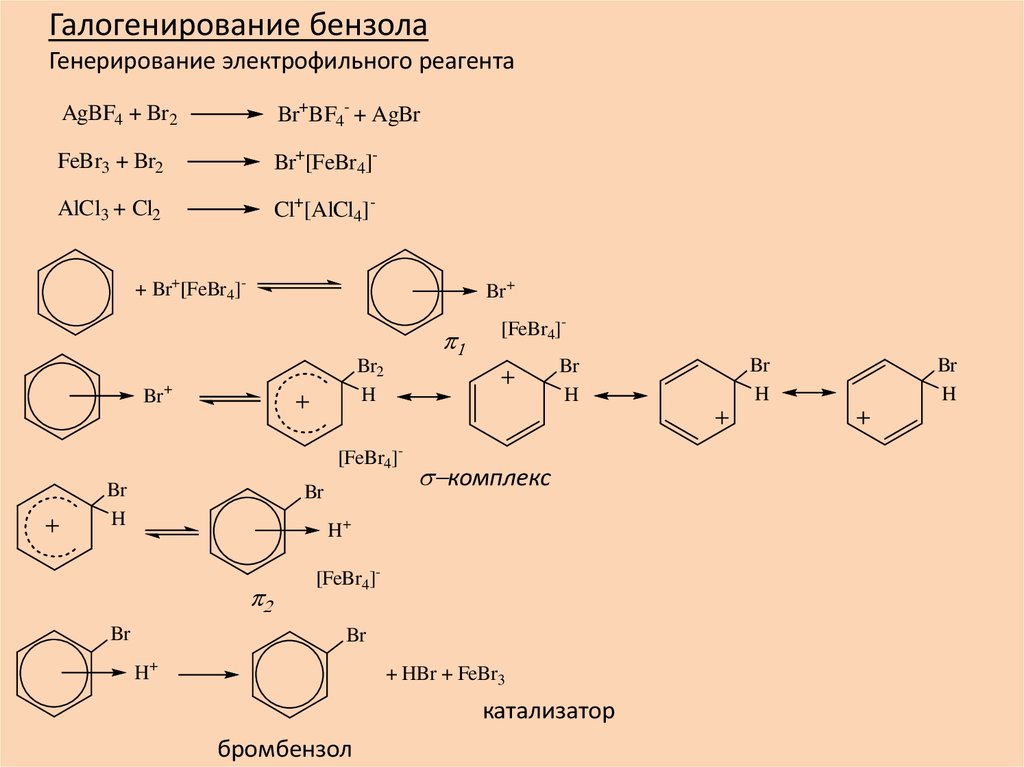
Галогенирование бензолаГенерирование электрофильного реагента
AgBF4 + Br 2
Br+BF4- + AgBr
FeBr3 + Br2
Br+[FeBr 4]-
AlCl3 + Cl2
Cl+[AlCl4] -
+ Br+[FeBr 4]-
Br +
p
Br2
H
Br +
[FeBr4]-
Br
H
Br
[FeBr4]Br
H
s-комплекс
H+
p
Br
[FeBr4]-
Br
H+
+ HBr + FeBr3
катализатор
бромбензол
Br
H
Br
H
16.
Ацилирование бензолаO
R C
Hal
ацил
O
Галогенангидриды и ангидриды
хорошие ацилирующие агенты
кислот
O
O
O
H C
R C O C R
H3C C
Формильная
группа
O
+ H3C C
Cl
+ AlCl 3
Ацетильная
группа
AlCl4
-
Slow
H
p
O ..... AlCl3
CH3
H+
C
H
O ..... AlCl3
CH3
s-комплекс
O ..... AlCl3
CH3
Ацетофенон
(метилфенилкетон)
H
-
AlCl4-
CH3
p
C
Бензоильна
я группа
C
C
f ast
O
C6H5 C
O
H3O+
–
+ H+
AlCl3Расходуется за счет
комплексообразования
с ацетофеноном,
настоящий
регенерирующийся
катализатор HClO4
17.
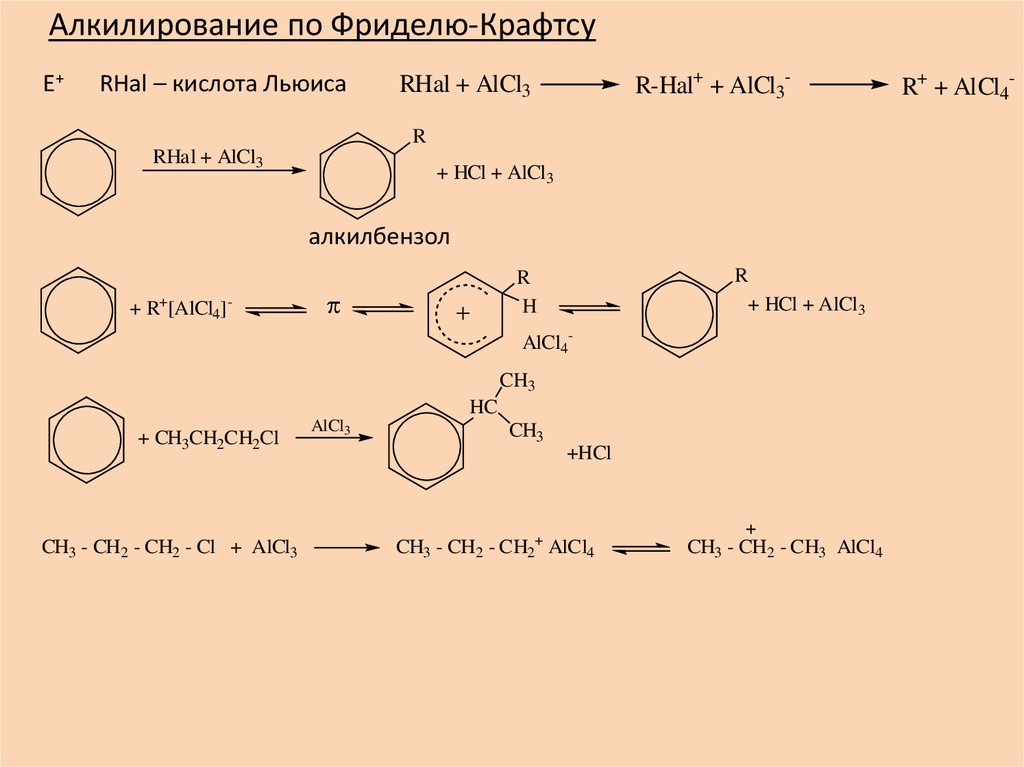
Алкилирование по Фриделю-КрафтсуE+
RHal – кислота Льюиса
R-Hal+ + AlCl3-
RHal + AlCl3
R
RHal + AlCl3
+ HCl + AlCl 3
алкилбензол
+ R+[AlCl4] -
R
+ HCl + AlCl 3
R
H
p
AlCl4-
CH3
HC
+ CH3CH2CH2Cl
CH3 - CH2 - CH2 - Cl + AlCl3
AlCl 3
CH3
+HCl
CH3 - CH2 - CH2+ AlCl4
CH3 - CH2 - CH3 AlCl4
R+ + AlCl4-
18.
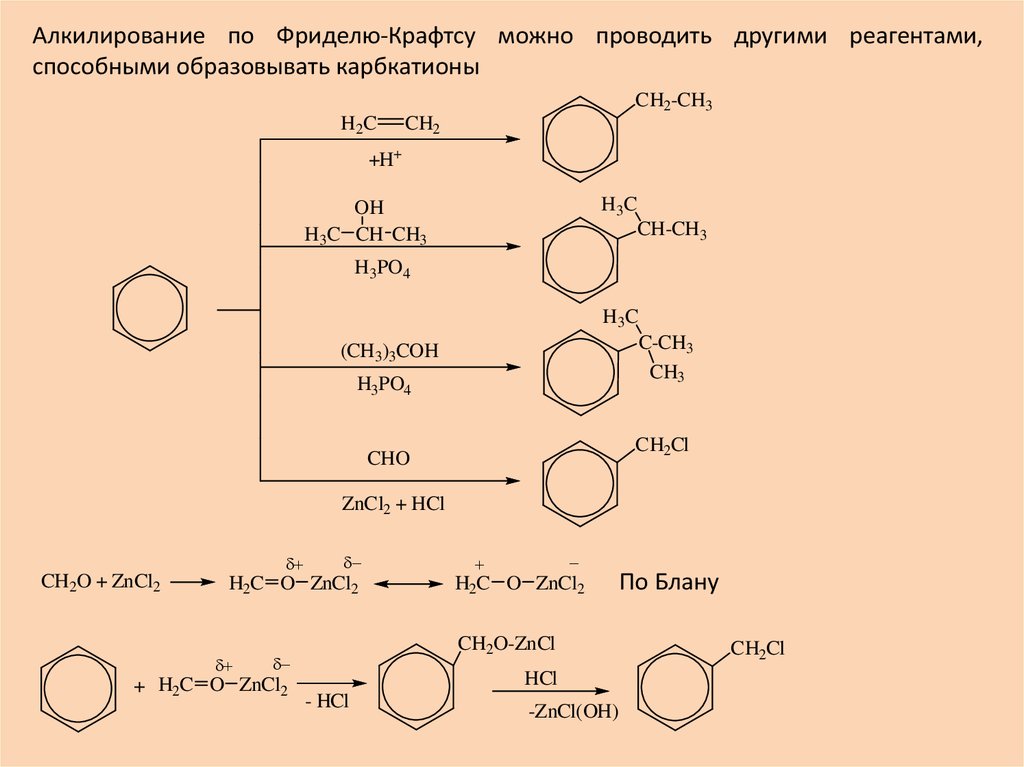
Алкилирование по Фриделю-Крафтсу можно проводить другими реагентами,способными образовывать карбкатионы
CH2-CH3
H2C
CH2
+H+
H 3C
OH
H3C CH CH3
CH-CH3
H3PO4
H 3C
C-CH3
CH3
(CH3)3COH
H3PO4
CH2Cl
CHO
ZnCl2 + HCl
CH2O + ZnCl2
-
H2C O ZnCl2
H2C O ZnCl2
По Блану
CH2O-ZnCl
-
+ H2C O ZnCl2
-
HCl
- HCl
-ZnCl(OH)
CH2Cl
19.
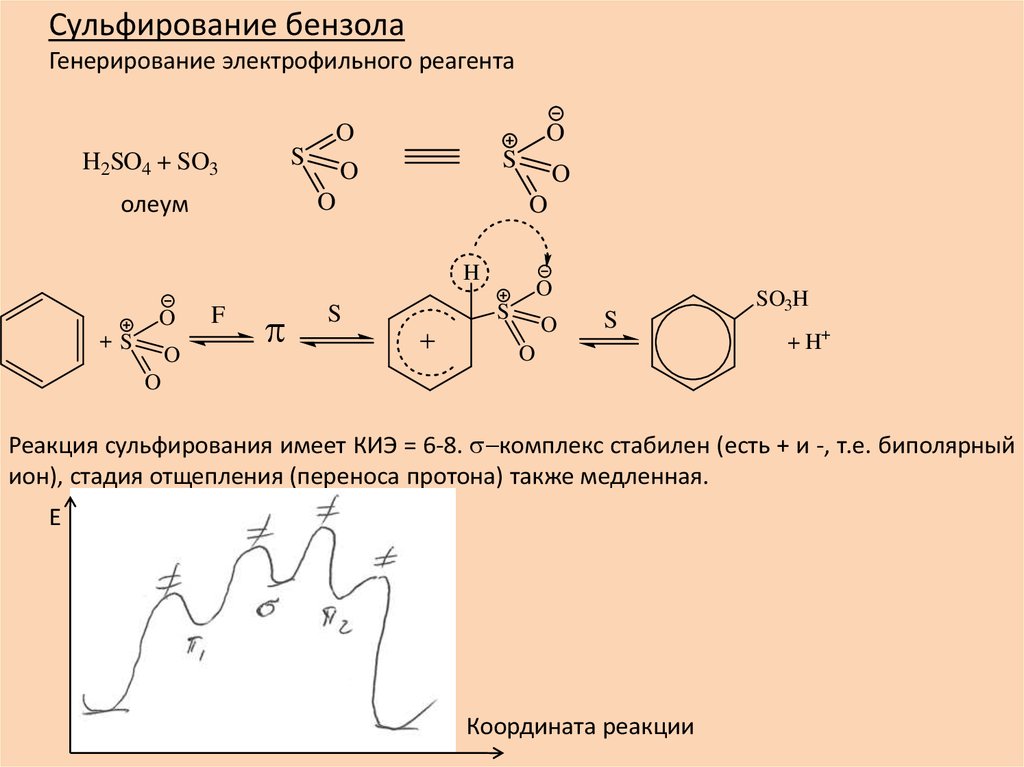
Сульфирование бензолаГенерирование электрофильного реагента
O
S
H2SO4 + SO3
O
S
O
O
олеум
O
O
H
O
+S
O
F
p
S
O
S
O
S
O
SO3H
+ H+
O
Реакция сульфирования имеет КИЭ = 6-8. s-комплекс стабилен (есть + и -, т.е. биполярный
ион), стадия отщепления (переноса протона) также медленная.
E
Координата реакции







 Химия
Химия