Похожие презентации:
Ароматические углеводороды. Арены
1. Ароматические углеводороды
2. Арены
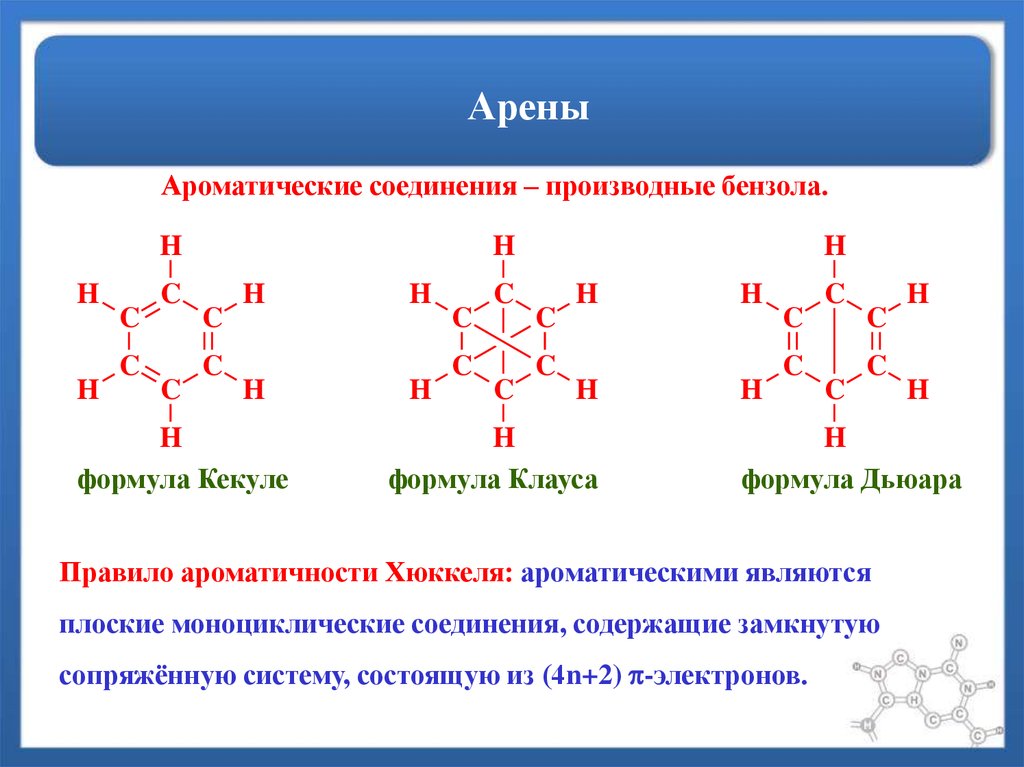
Ароматические соединения – производные бензола.H
H
H
C
C
C
C
H
C
C
H
H
H
формула Кекуле
H
H
C
C
C
C
H
C
C
H
H
H
формула Клауса
H
H
C
C
C
C
C
C
H
H
H
формула Дьюара
Правило ароматичности Хюккеля: ароматическими являются
плоские моноциклические соединения, содержащие замкнутую
сопряжённую систему, состоящую из (4n+2) -электронов.
3. Арены
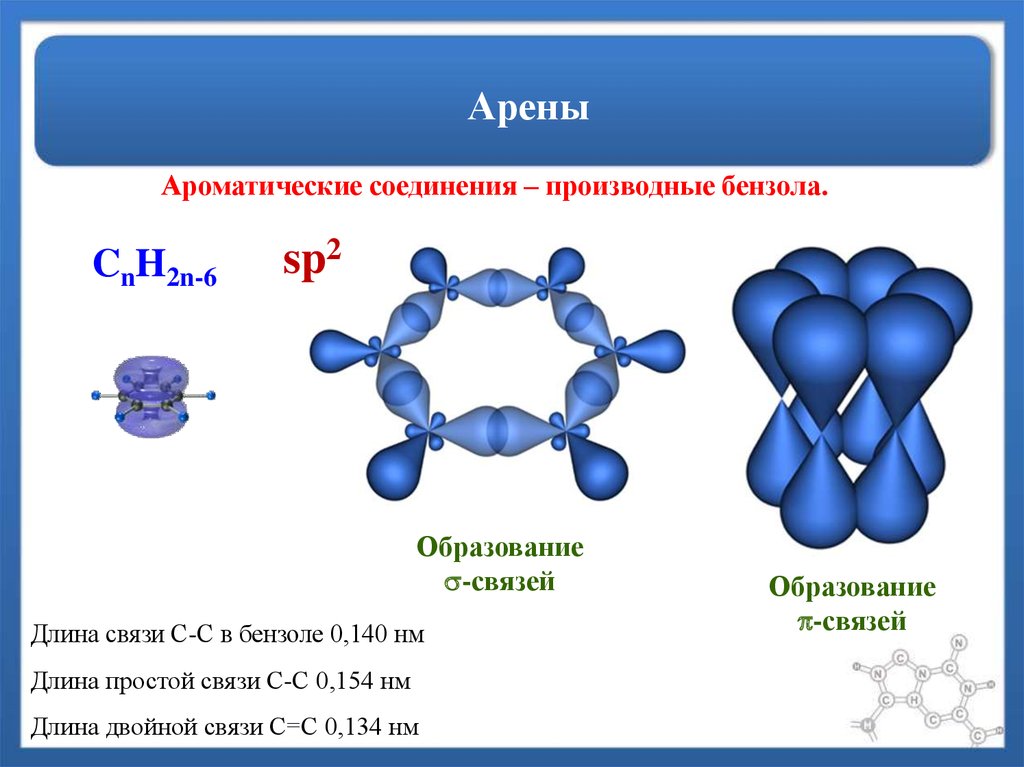
Ароматические соединения – производные бензола.CnH2n-6
sp2
Образование
-связей
Длина связи С-С в бензоле 0,140 нм
Длина простой связи С-С 0,154 нм
Длина двойной связи С=С 0,134 нм
Образование
-связей
4. Арены
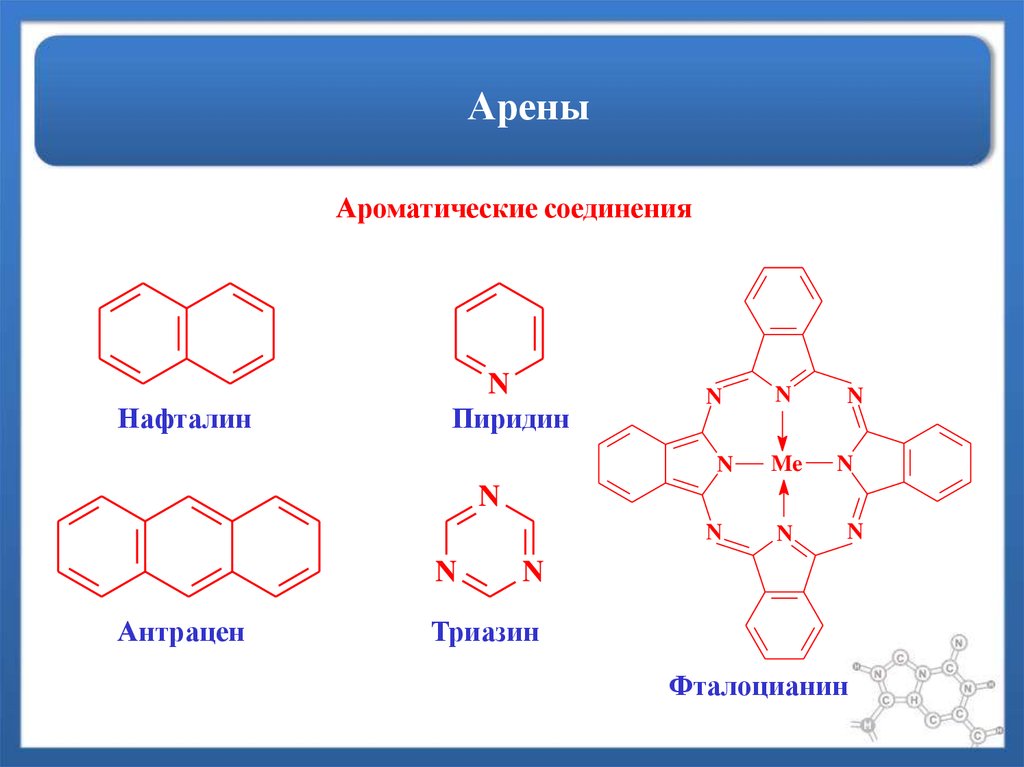
Ароматические соединенияНафталин
N
Пиридин
N
N
N
Me
N
N
N
N
N
Антрацен
N
N
N
Триазин
Фталоцианин
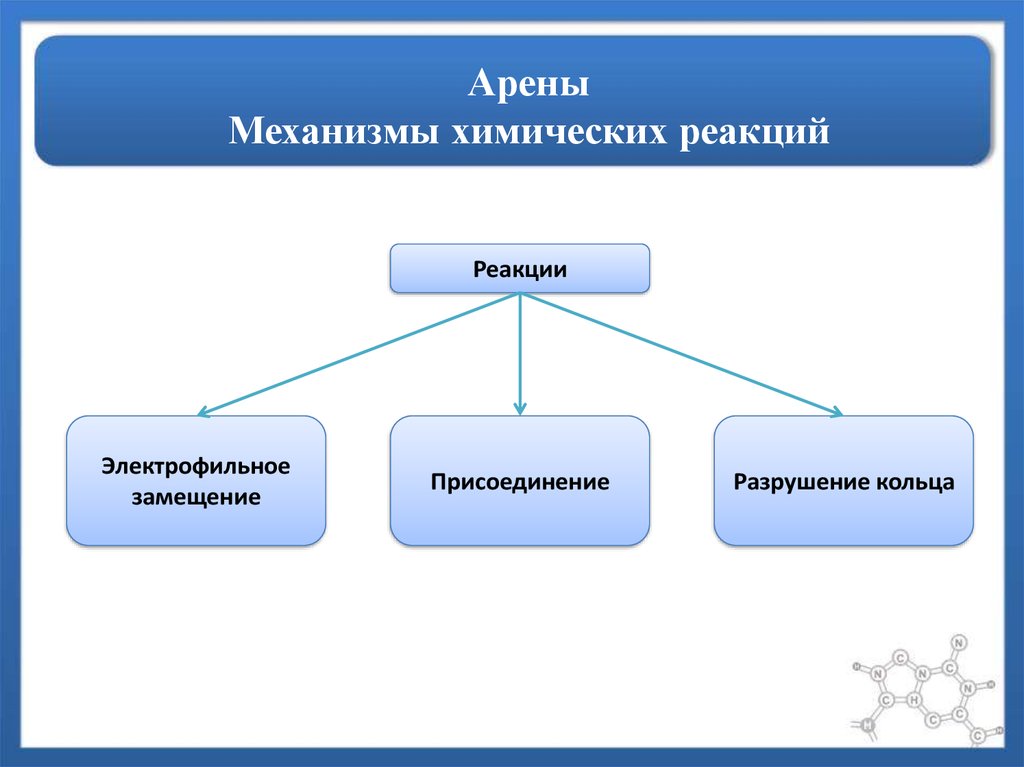
5. Арены Механизмы химических реакций
РеакцииЭлектрофильное
замещение
Присоединение
Разрушение кольца
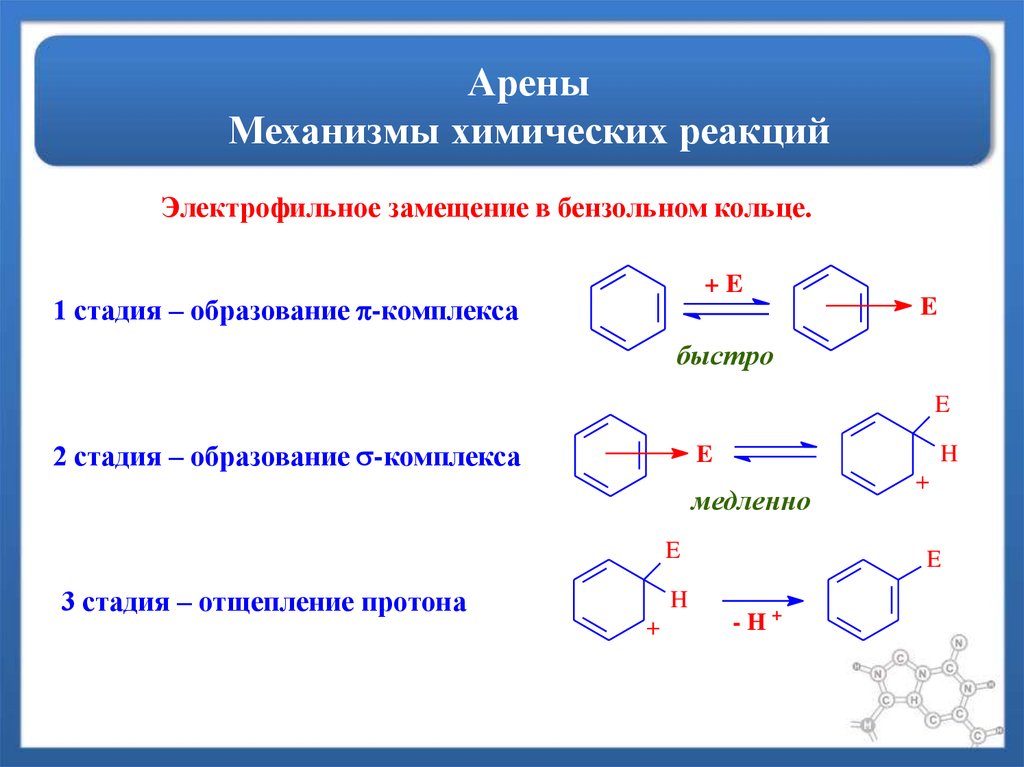
6. Арены Механизмы химических реакций
Электрофильное замещение в бензольном кольце.+E
1 стадия – образование -комплекса
E
быстро
E
2 стадия – образование -комплекса
H
E
медленно
E
3 стадия – отщепление протона
H
+
+
E
-H+
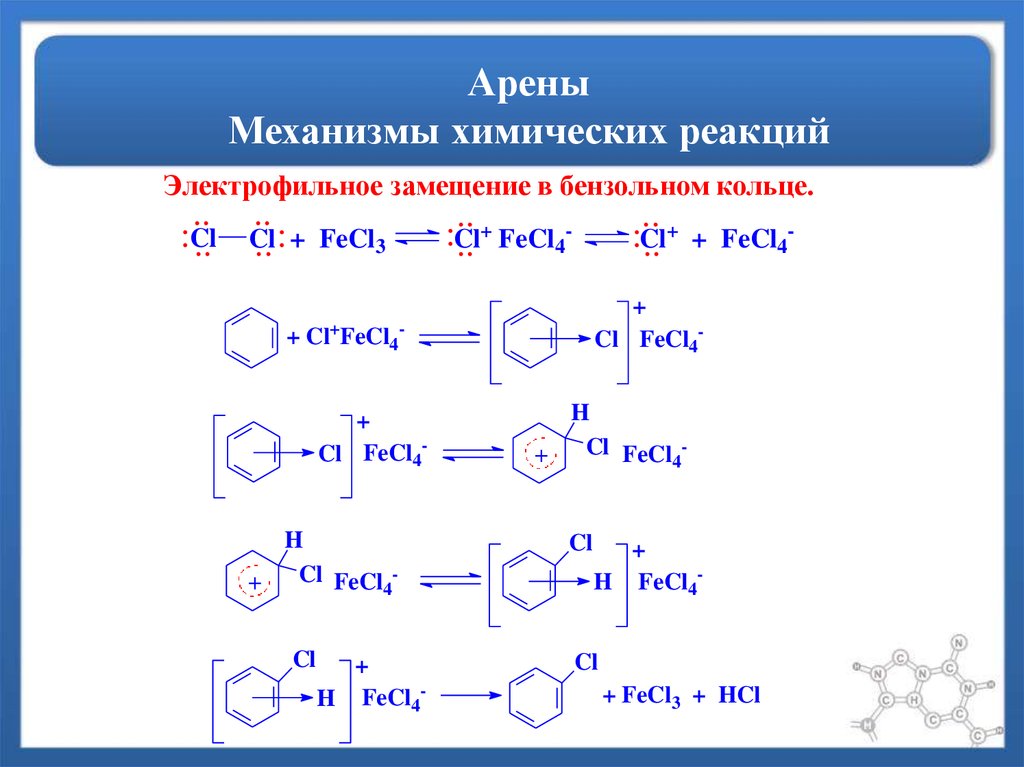
7. Арены Механизмы химических реакций
Электрофильное замещение в бензольном кольце...
:Cl
..
..
Cl
.. : +
.. +
:Cl
FeCl
4
..
FeCl3
+
+ Cl FeCl4
H
Cl FeCl +
4
+
H FeCl4-
+ FeCl4-
+
Cl FeCl4-
-
+
Cl FeCl4-
Cl
.. +
:Cl
..
H
Cl FeCl +
4
Cl
+
H FeCl4-
Cl
+ FeCl3 + HCl
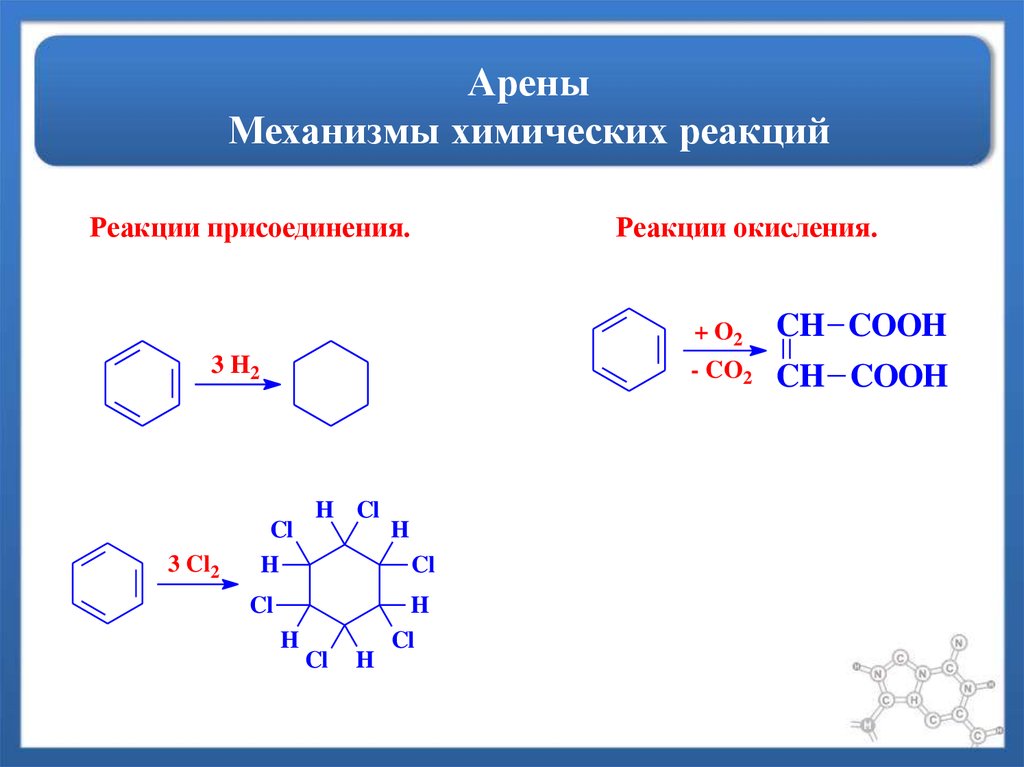
8. Арены Механизмы химических реакций
Реакции присоединения.Реакции окисления.
3 H2
3 Cl2
Cl
H
H Cl
Cl
Cl
H
H
Cl
H
H
Cl
+ O2
CH COOH
- CO2
CH COOH
9. Арены Правила ориентации
Правила ориентации – закономерности, определяющие направлениереакций замещения в бензольном кольце.
Активирующая группа – заместитель, который делает кольцо
бензола более реакционно способным в реакциях электрофильного
замещения по сравнению с незамещенным бензолом.
Дезактивирующая группа – заместитель, который делает кольцо
бензола менее реакционно способным в реакциях электрофильного
замещения по сравнению с незамещенным бензолом.
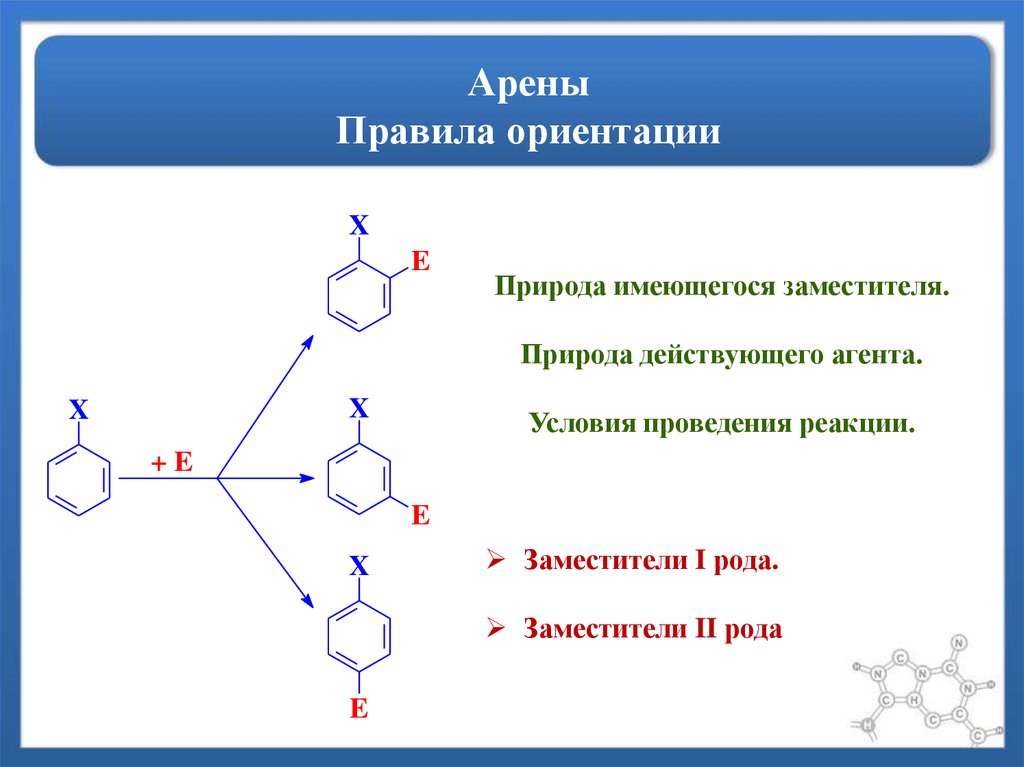
10. Арены Правила ориентации
XE
Природа имеющегося заместителя.
Природа действующего агента.
X
X
Условия проведения реакции.
+E
E
X
Заместители I рода.
Заместители II рода
E
11. Арены Правила ориентации
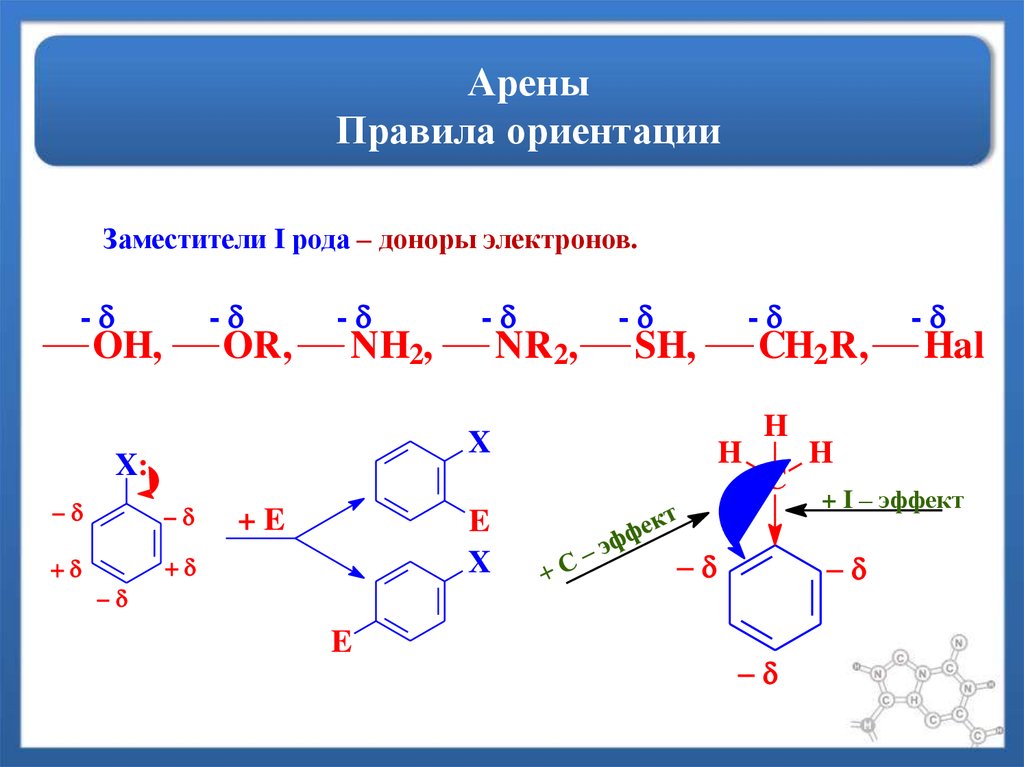
Заместители I рода – доноры электронов.-
-
OH,
OR,
-
NH2,
-
NR2,
-
SH,
X
X:
+E
E
X
E
-
CH2R,
H
H
C
Hal
H
+ I – эффект
-
12. Арены Правила ориентации
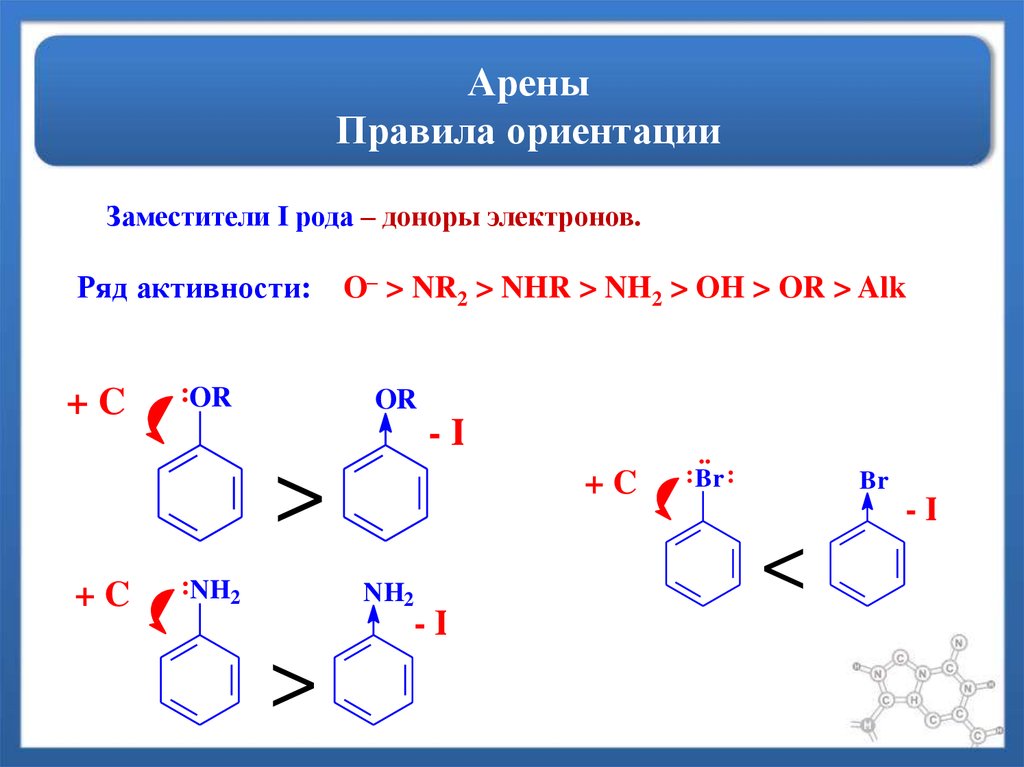
Заместители I рода – доноры электронов.Ряд активности:
+C
:OR
O– > NR2 > NHR > NH2 > OH > OR > Alk
OR
-I
>
+C
:NH2
+C
NH2
-I
>
..
: Br :
Br
-I
<
13. Арены Правила ориентации
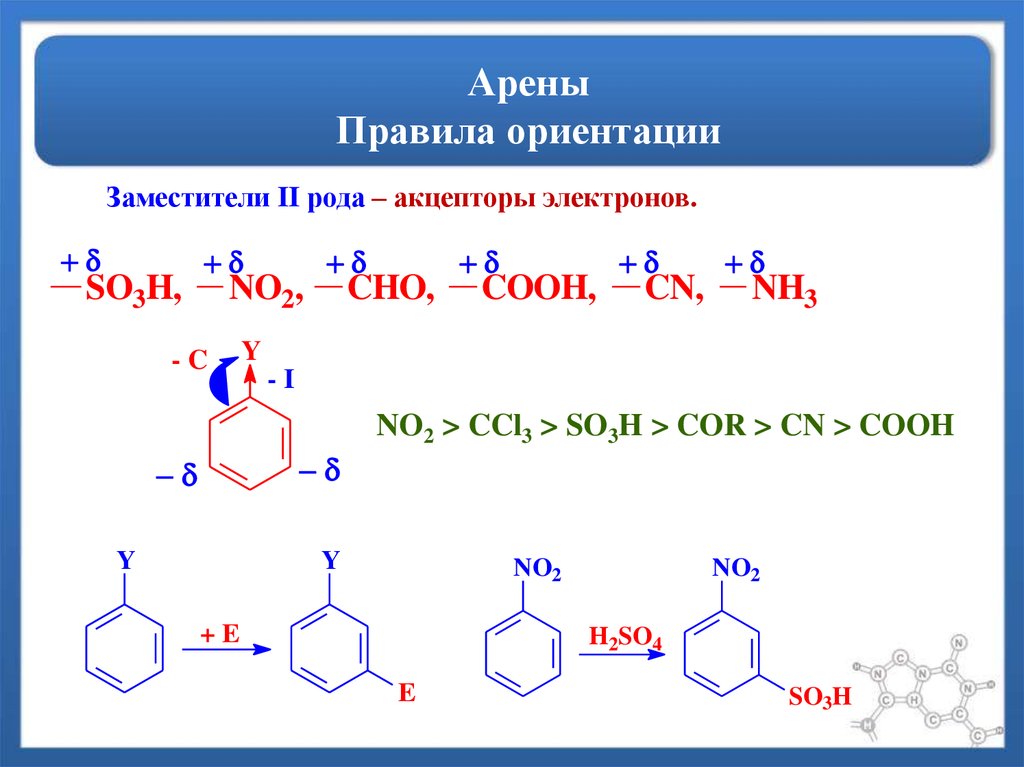
Заместители II рода – акцепторы электронов.SO3H,
NO2,
-C
CHO,
COOH,
CN,
NH3
Y
-I
NO2 > CCl3 > SO3H > COR > CN > COOH
Y
Y
NO2
+E
NO2
H2SO4
E
SO3H
14. Арены Правила ориентации
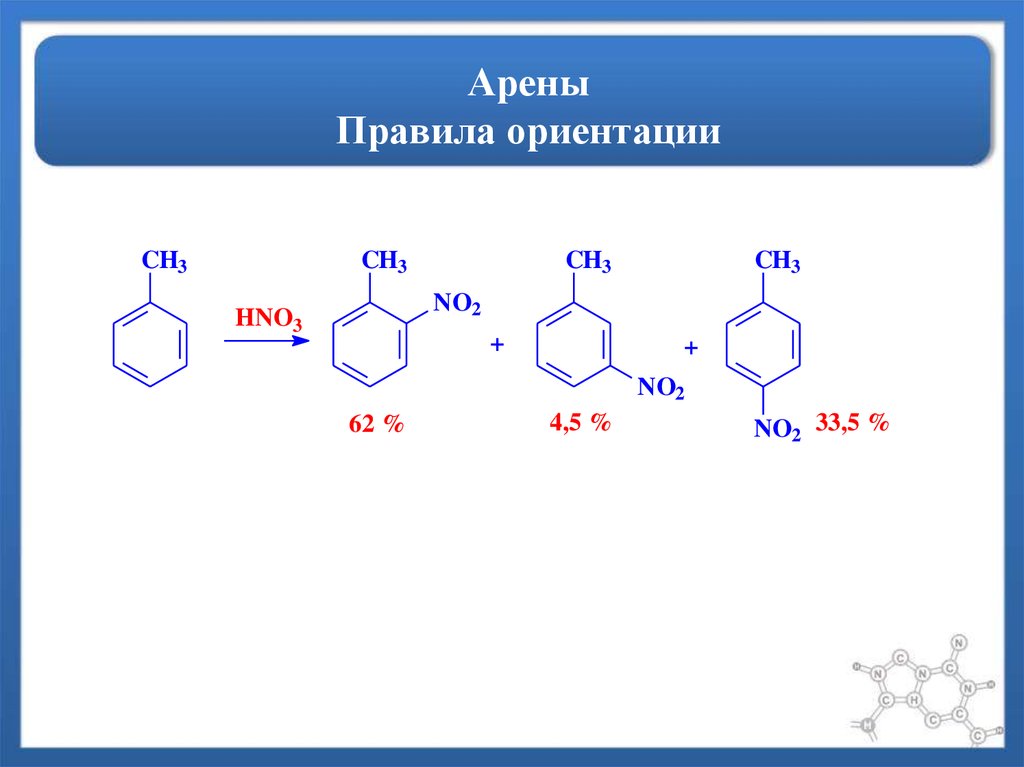
CH3CH3
CH3
CH3
NO2
HNO3
+
+
NO2
62 %
4,5 %
NO2 33,5 %
15. Арены Правила ориентации
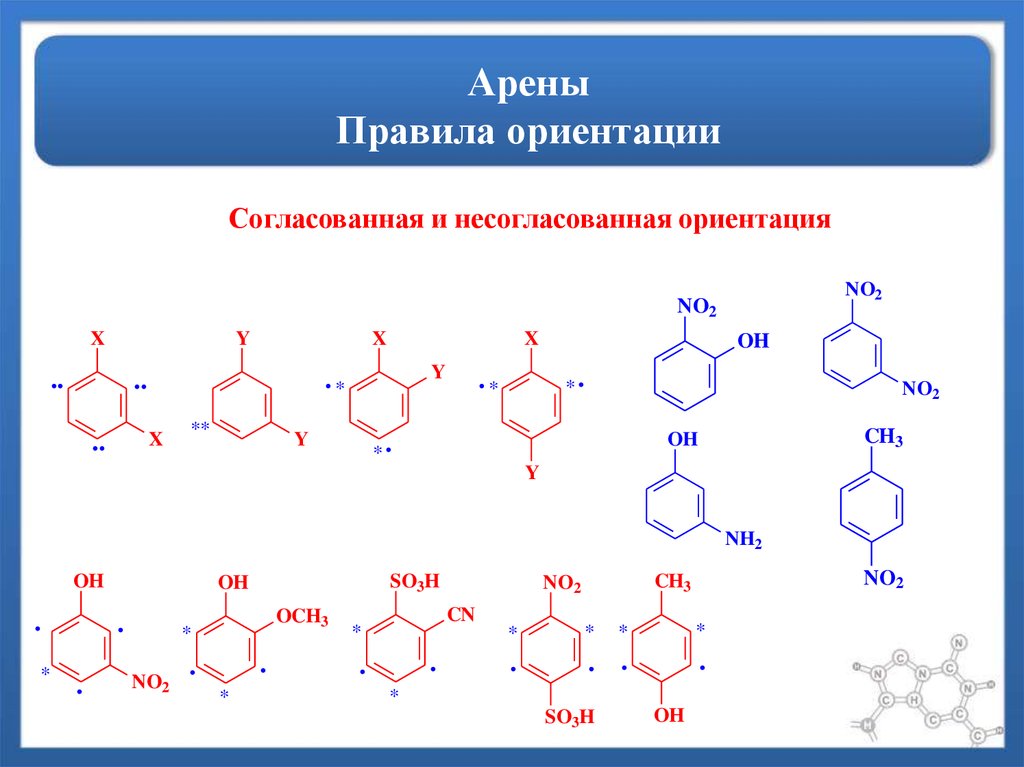
Согласованная и несогласованная ориентацияNO2
NO2
X
Y
..
X
Y
.*
..
X
..
X
**
Y
OH
*.
.*
NO2
CH3
OH
*.
Y
NH2
OH
.
*
.
.
SO3H
OH
OCH3
*
NO2
.
.
*
CN
*
.
.
NO2
CH3
NO2
*
*
*
*
.
. .
.
*
SO3H
OH
16. Арены Правила ориентации
ВАЖНО!!!Все заместители первого рода являются более сильными
ориентантами, чем заместители второго рода.
Все активирующие о-, п-ориентанты доминируют над галогенами,
которые являются дезактивирующими о- и п-ориентантами.
Сильно и умеренно активирующие о- и п-ориентанты (-NH2, -OH,
OCH3 и т.д.) являются более сильными ориентантами, чем более
слабые (-CH3, -CH2-CH3 и т.д.).
17. Арены Химические свойства
CH3H3C
H2C
CH2Br
Br2, hv
CH3
HC
CH3
CH3
CH3
Br
Br2, FeBr3
CH3
COOH
+
Br
CH2NO2
HNO3 (aq)
t, P
CH3
CH3
HNO3
H2SO4
NO2
+
O2N
CH3




 Химия
Химия