Похожие презентации:
Химическая кинетика
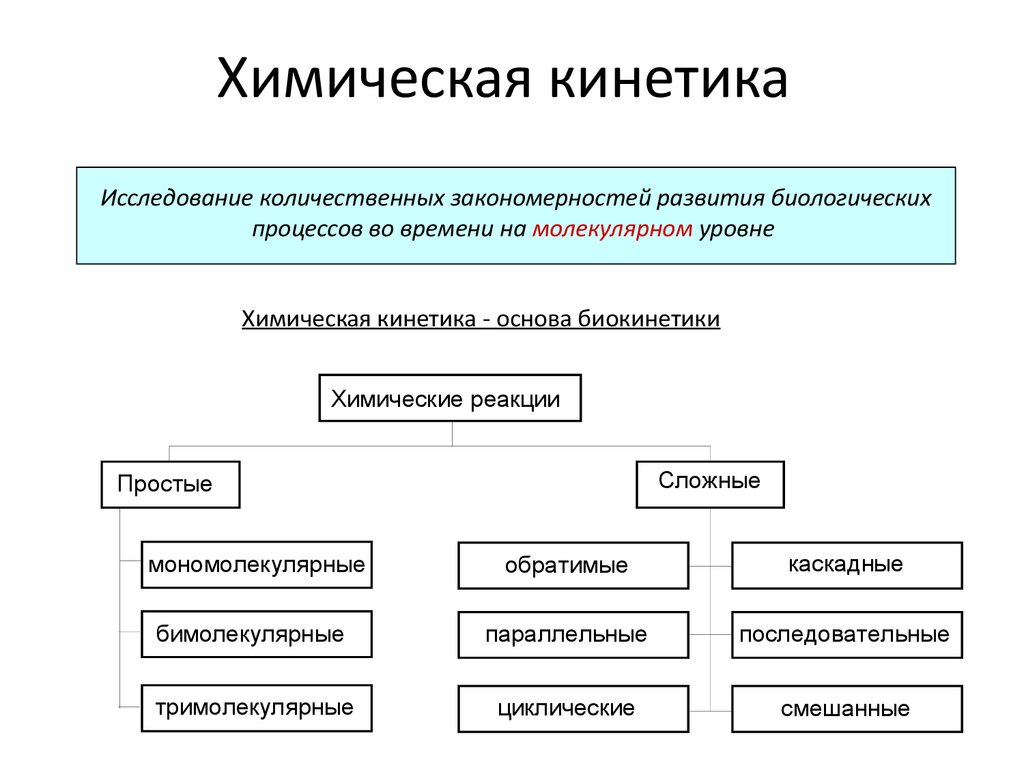
1. Химическая кинетика
Исследование количественных закономерностей развития биологическихпроцессов во времени на молекулярном уровне
Химическая кинетика - основа биокинетики
Химические реакции
Сложные
Простые
мономолекулярные
обратимые
каскадные
бимолекулярные
параллельные
последовательные
тримолекулярные
циклические
смешанные
2.
Основы химической кинетики- наука о скоростях и механизмах химических превращений
стехиометрическим уравнение:
1 A1 2 A2 ... n An 1 B1 2 B2 ... k Bk
стехиометрические коэффициенты
Пример:
2H H 2
вещества
исходные
промежуточные
конечные
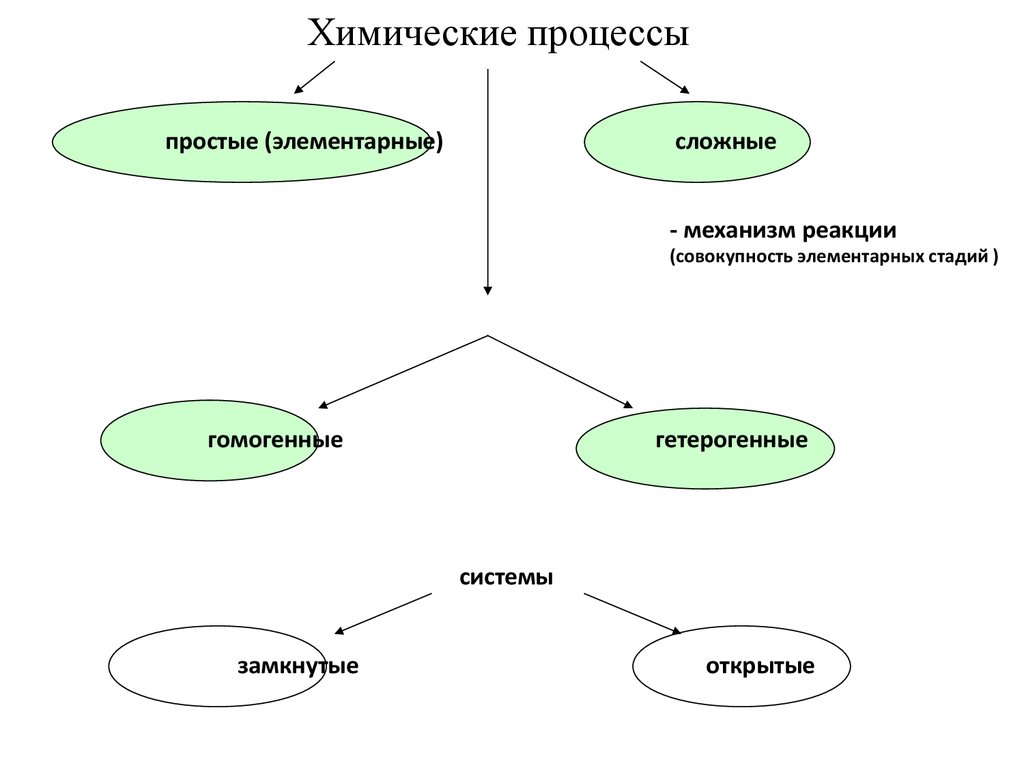
3.
Химические процессыпростые (элементарные)
сложные
- механизм реакции
(совокупность элементарных стадий )
гомогенные
гетерогенные
системы
замкнутые
открытые
4.
Скорость химической реакции1 1 dN Ai
1 1 dN B j
w
i V dt
j V dt
V = const
1 d Ai
1 d Bj
w
i dt
j dt
Элементарная реакция: w = число элементарных актов реакции
в единице объема в единицу времени.
5.
Закон действующих массw k T A1
1
A2
2
... An
n
порядок реакции по n -му реагенту
константа скорости
k Ae
E
RT
энергия активации
(Аррениус, 1889)
предэкспонент
Аррениусовские координаты:
ln k ln A
E 1
RT
6.
принцип независимости элементарных стадий:k1
A
B
k2
B
C
константа равновесия
обратимые реакции
k1
A
B
k 1
B
A
dA
dt k1 A
dB
k1 A k 2 B
dt
dC
dt k 2 B
равновесие:
dA
0
k1 A k 1 B
dt
A k 1
K
B
k1
7.
Реакция первого порядкаРеакция второго порядка
k
A1 A2 продукты
k
A продукты
d A
w
k A
dt
A A 0 e
d A1
k A1 A2
dt
w
x Ai 0 Ai
kt
:
A1 0 A2 0 x
ln
k A2 0 A1 0 t
A2 0 A1 0 x
Обратимые реакции
k1
A
B
1
B k
A
d A
dt k1 A k 2 B
d B k A k B
1
2
dt
A
K
A 0 B 0 K A 0 B 0
k1
k 1
1 K
1 K
e k1 k 1 t
константа равновесия
8.
Влияние pH на скорость химической реакцииA H AH
A P
A H AH
AH P
b)
b
kэ фф
a)
c
a
c)
A H AH
AH H AH 2
AH P
pH
W k эфф A0
pH log 10 H
9.
Влияние T на скорость химической реакцииk A(T )e
E
RT
- закон Аррениуса
A(T ) - слабая функция от T для химических реакций
A(T ) - резкая функция от T для биохимических реакций
Причина – конформация белков значительно зависит от Т
10.
Ферментативный катализСхема Михаэлиса-Ментен:
фермент
dX
k1 E S (k 1 k 2 ) X
dt
W0
dP
k2 X
dt
E0 E X
k1
k2
E S
X
E P
k 1
субстрат
S const
комплекс
11.
Ферментативный катализP (t )
k 2 E0 S
k 2 E0 S
exp k1 S K m t 1
t
K m S 0 k1S k 1 k 2
Km S
стационарная скорость
Km
Wm S
W
Km S
k 1 k 2
k1
константа Михаэлиса
Wm Wmax k 2 E 0
максимальная скорость
12.
Некоторые кинетические схемы,приводящие к уравнению Михаэлиса
Схема
k1
E S1
X
k2
X S 2
E P
k
1
k2
k3
E S X 1
X 2
E P
k 1
k1
k2
kn 1
E S X 1
... X n
E P
k
1
Wm
k1 S1 E0
Km
k1 S1
k2
k 2 k3
E0
k 2 k3
k 1k 3
k1k 2 k1k 3
E0
k 1
n 1
1
k
i 2 i
n 1
1
k1k 2
i 2 k i










 Химия
Химия








