Похожие презентации:
Гидроксилпроизводные углеводородов
1. ГИДРОКСИЛПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ
2.
Гидроксилпроизводные – это такиепроизводные углеводородов, в состав
молекулы которых входит одна или несколько
гидроксильных групп.
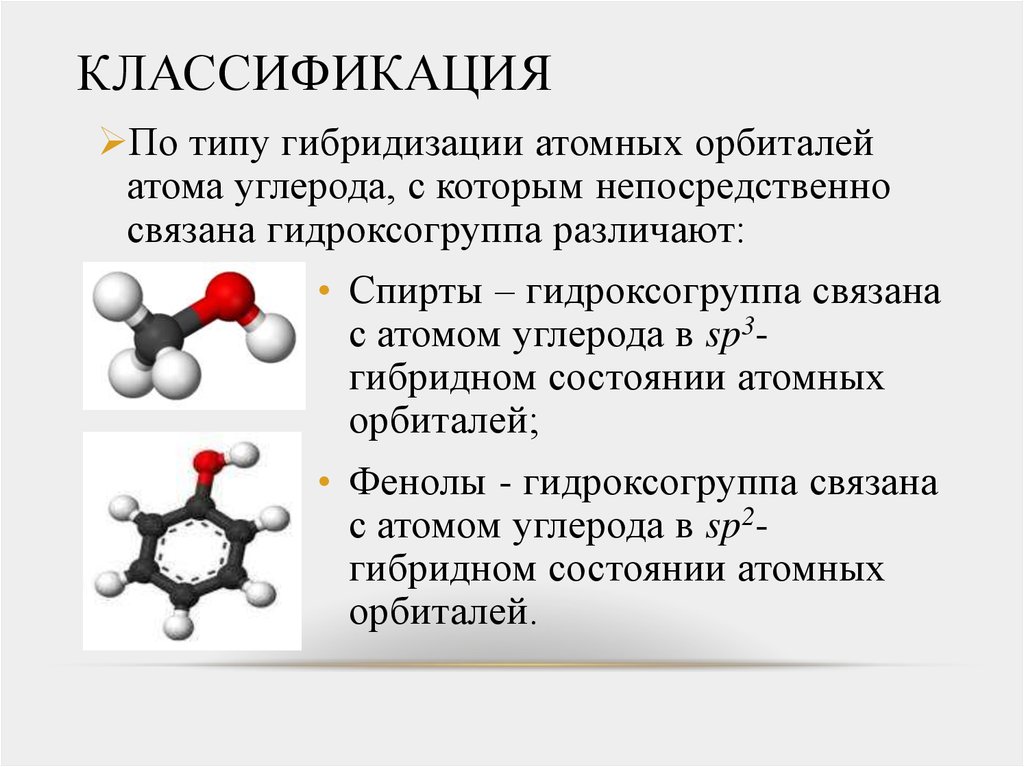
3. КЛАССИФИКАЦИЯ
По типу гибридизации атомных орбиталейатома углерода, с которым непосредственно
связана гидроксогруппа различают:
• Спирты – гидроксогруппа связана
с атомом углерода в sp3гибридном состоянии атомных
орбиталей;
• Фенолы - гидроксогруппа связана
с атомом углерода в sp2гибридном состоянии атомных
орбиталей.
4. СПИРТЫ
5. КЛАССИФИКАЦИЯ
В зависимости от количества гидроксильных группразличают:
• Одноатомные;
• Двухатомные;
• Трех- и многоатомные.
В зависимости от типа углеродного скелета различают:
• Нециклические (ациклические);
• Циклические.
В зависимости от наличия кратных связей различают:
• Насыщенные;
• Ненасыщенные.
6.
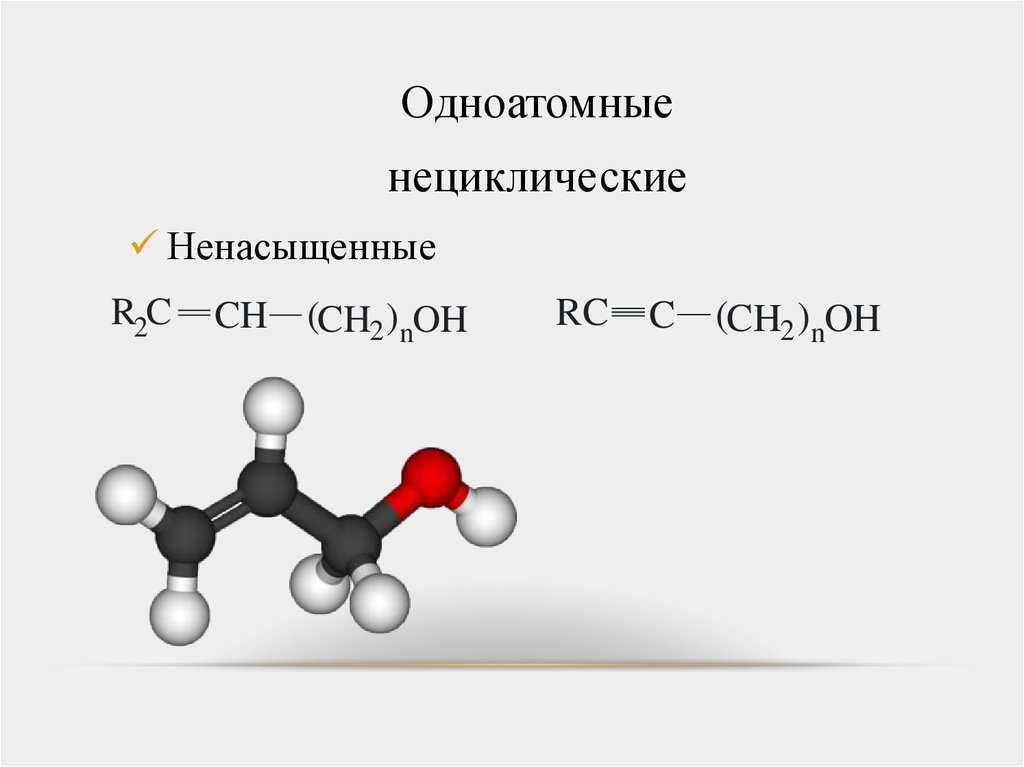
Одноатомныенециклические
Насыщенные
C nH2n+1OH
7.
Одноатомныенециклические
Ненасыщенные
R2C
CH
(CH2 )nOH
RC
C
(CH2 )nOH
8.
Одноатомныециклические
Насыщенные
OH
Ненасыщенные
OH
(CH2)n OH
9.
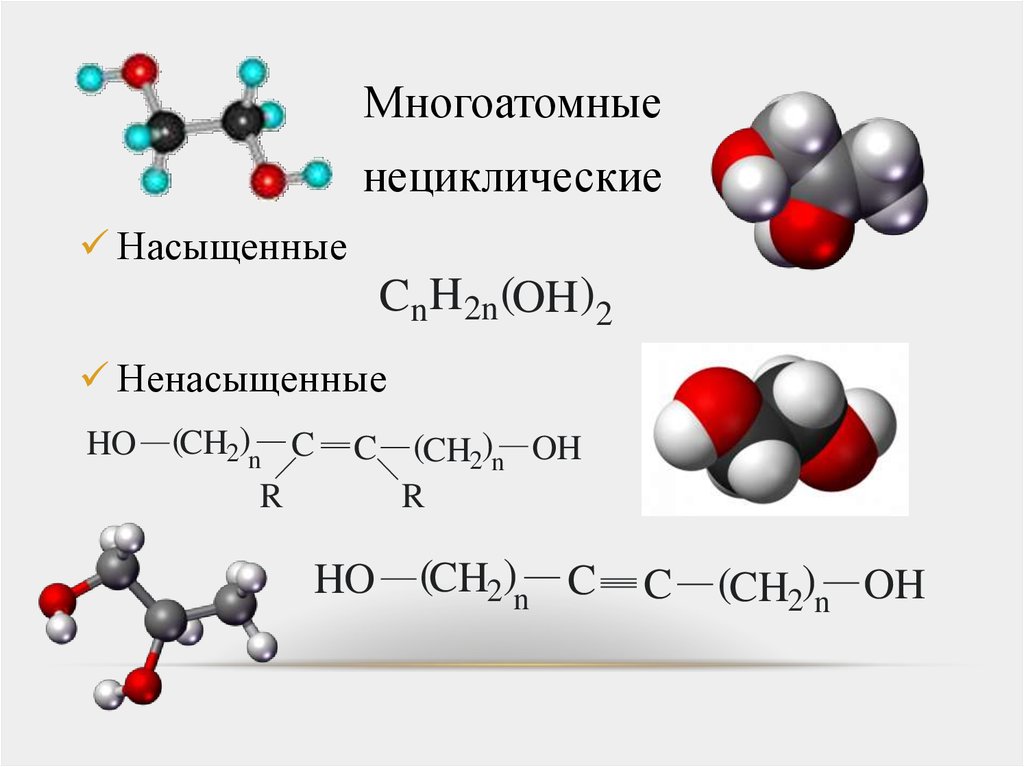
Многоатомныенециклические
Насыщенные
Cn H2n (OH )2
Ненасыщенные
HO
(CH2)n C
R
C
HO
(CH2)n OH
R
(CH2)n C
C
(CH2)n OH
10.
Многоатомныенециклические
C nH2n-1(OH)3
C n H 2n+2-m(OH)m
11. СПИРТЫ
НЕЦИКЛИЧЕСКИЕ ОДНОАТОМНЫЕ12.
13.
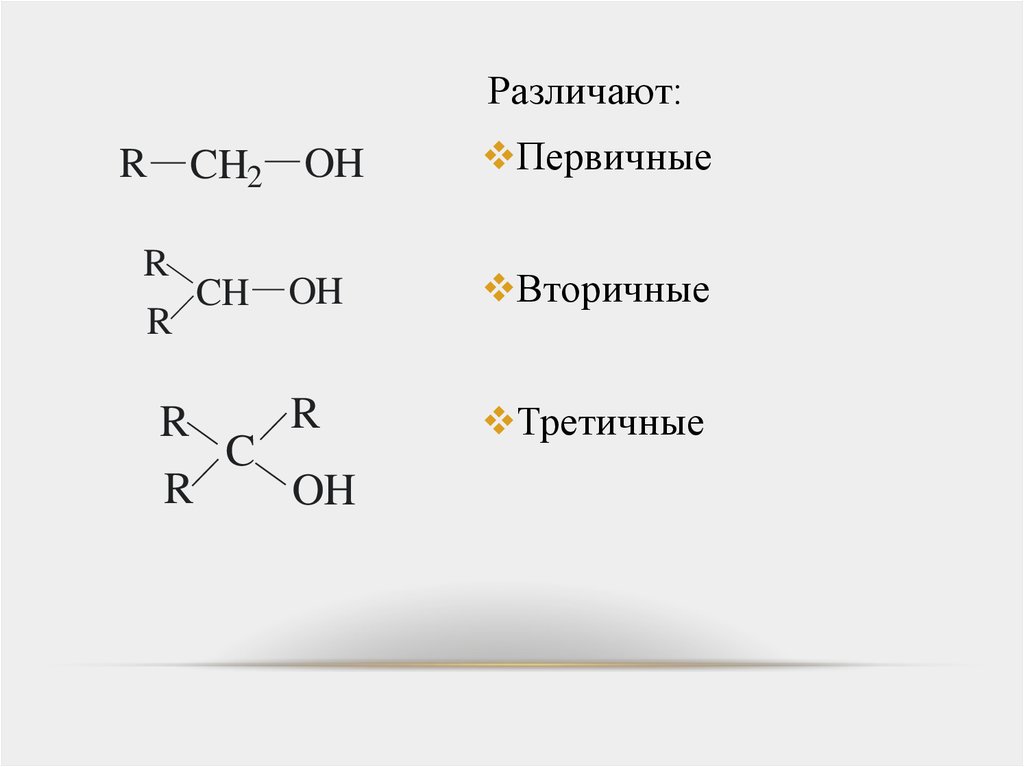
Различают:R
CH2 OH
R
CH
R
OH
R
R
C
R
OH
Первичные
Вторичные
Третичные
14.
Спиртыодноатомн
ые
многоатомн
ые
C n H 2n+2-m(OH)m
первичные
R
CH2 OH
вторичные
R
CH
R
OH
третичные
R
R
C
R
OH
15. НОМЕНКЛАТУРА
При наименовании одноатомных спиртовсамую длинную цепь углеродных атомов
выбирают так чтобы атом углерода, связанный с
гидроксогруппой, в нее входил непременно и
нумерацию начинают с того края к которому он
ближе.
К корню слова, обозначающему количество
атомов углерода в основной цепи, прибавляют
суффикс, обозначающий кратную связь (если она
есть) и суффикс
ол
Радикалы указывают в приставке.
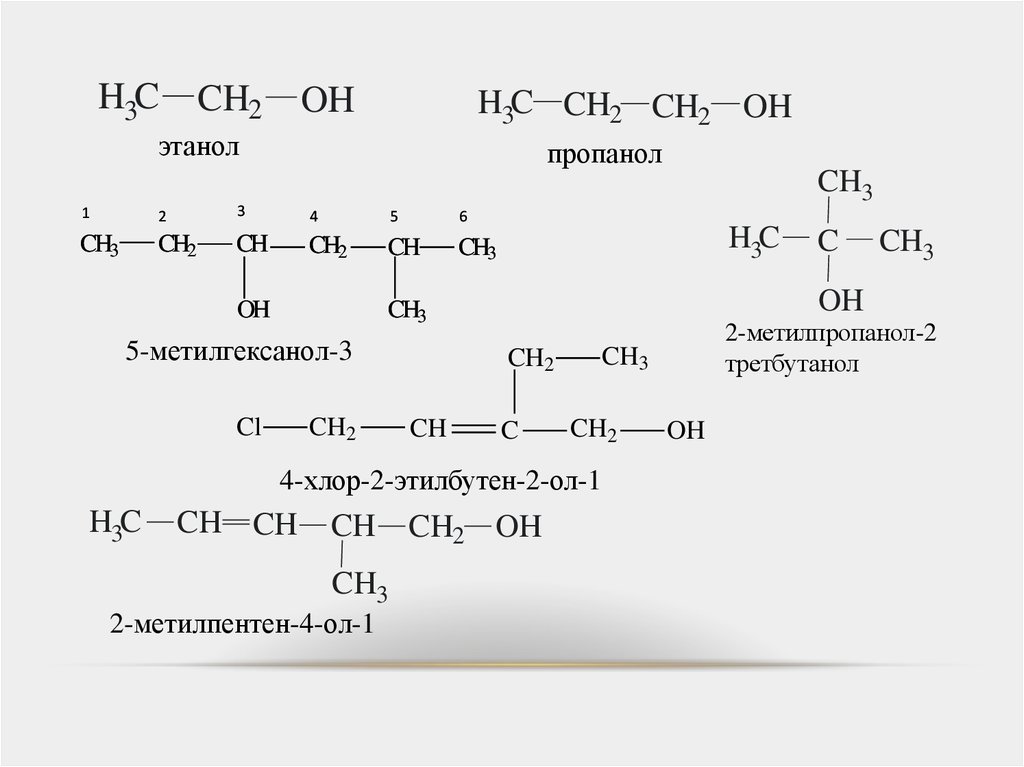
16.
H3CCH2
OH
H3C CH2 CH2 OH
этанол
пропанол
CH3
1
2
3
4
5
6
CH3
CH2
CH
CH2
CH
CH3
OH
H3C
Cl
CH2
CH2
CH
C
CH CH
CH
CH3
2-метилпентен-4-ол-1
CH2 OH
2-метилпропанол-2
третбутанол
CH3
CH2
4-хлор-2-этилбутен-2-ол-1
H3C
CH3
OH
CH3
5-метилгексанол-3
C
OH
17. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ
• Метанол (метиловый спирт, древесный спирт,карбинол)
Метанол — это первый представитель
гомологического ряда предельных одноатомных спиртов.
•жидкость без цвета с температурой кипения 64 С,
•с характерным запахом, легче воды, горит бесцветным
пламенем.
•С воздухом в объёмных концентрациях 6,72—36,5 % образует
взрывоопасные смеси (температура вспышки 15,6 °C).
•Метанол смешивается в любых соотношениях с водой и
большинством органических растворителей.
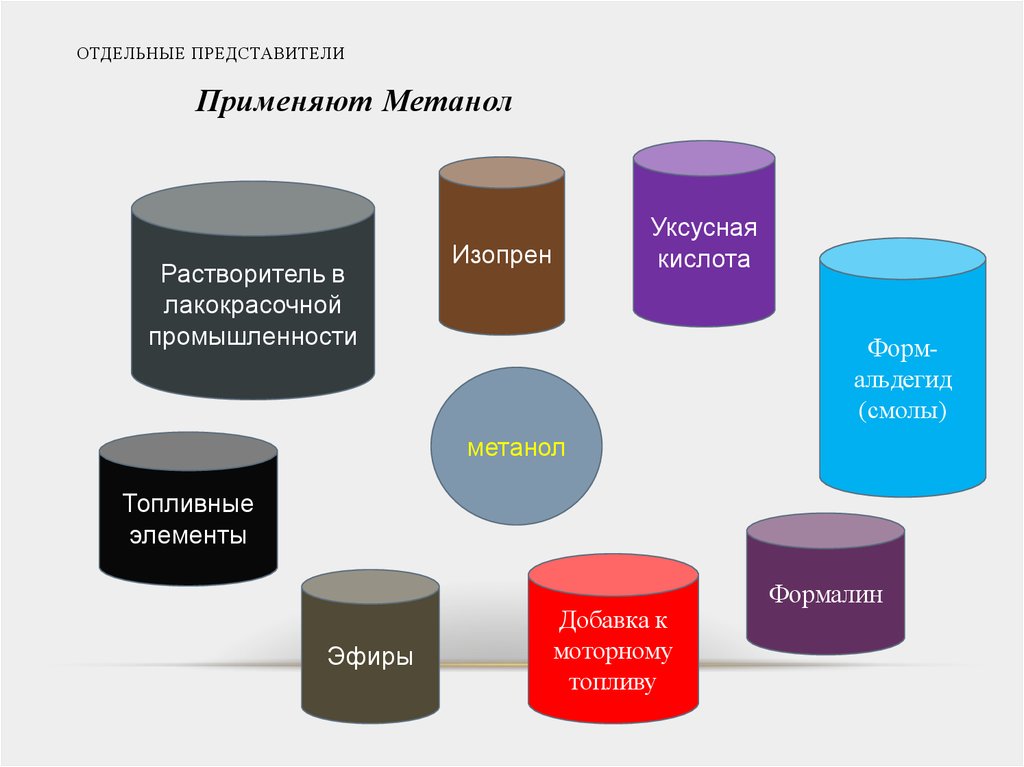
18. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ
Применяют МетанолРастворитель в
лакокрасочной
промышленности
Уксусная
кислота
Изопрен
Формальдегид
(смолы)
метанол
Топливные
элементы
Эфиры
Добавка к
моторному
топливу
Формалин
19.
В газовой промышленности используется для борьбы собразованием гидратов. (При добыче газа гидраты могут
образовываться в стволах скважин, промышленных
коммуникациях и магистральных газопроводах. Отлагаясь на
стенках труб, гидраты резко уменьшают их пропускную
способность. )
• Во многих странах метанол применяется в качестве добавки к
этиловому спирту при производстве парфюмерии.
• В России использование метанола в потребительских товарах
запрещено.
• Метанол — опаснейший яд, приём внутрь 5—10 мл метанола
приводит к тяжёлому отравлению и слепоте, а 30 граммов и
более — к смерти.
• ПДК метанола в воздухе рабочей зоны равна 5 мг/м³
• (у этанола — 1000 мг/м³).
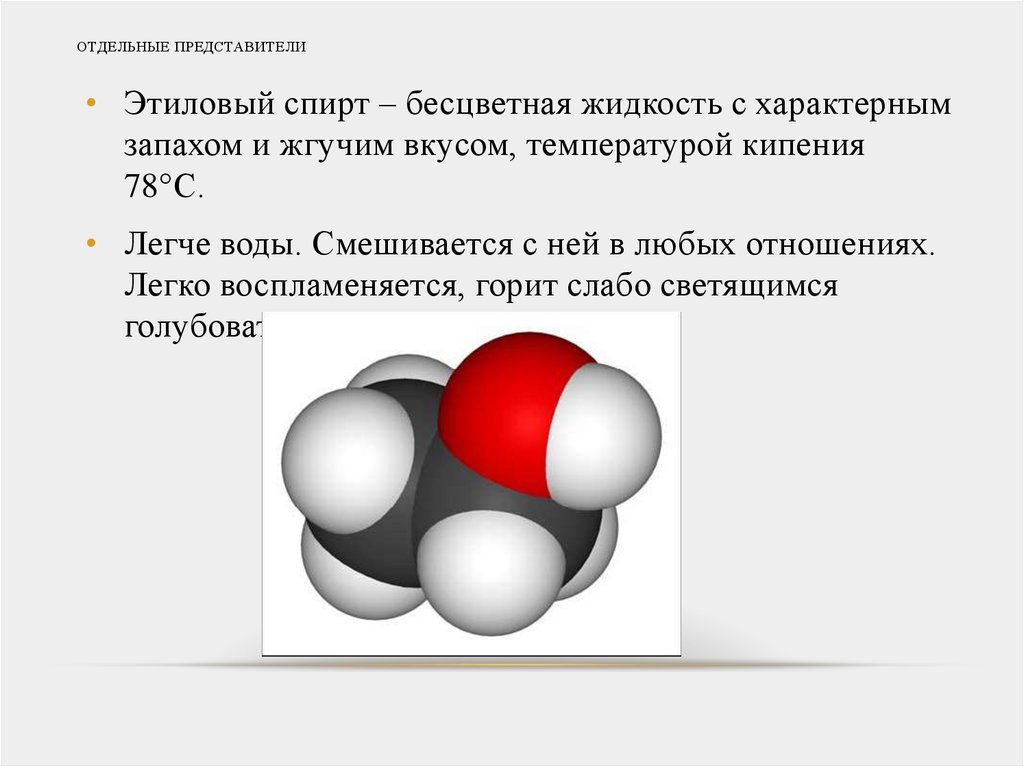
20. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ
• Этиловый спирт – бесцветная жидкость с характернымзапахом и жгучим вкусом, температурой кипения
78 С.
• Легче воды. Смешивается с ней в любых отношениях.
Легко воспламеняется, горит слабо светящимся
голубоватым пламенем.
21. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ
• Этиловый спирт. Применение.Химическая промышленность
этилен
уксусная
кислота
Ацетальдегид
диэтиловый
эфир
хлороформ
Тетраэтилсвинец
этилацетат
22. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ
• Этиловый спирт. Применение.Растворитель
В лакокрасочной промышленности,
в производстве товаров бытовой химии
(в чистящих и моющих средствах, в
особенности для ухода за стеклом и
сантехникой) ;
является компонентом антифризов и
стеклоомывателей;
получение репеллентов
23. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ
• Этиловый спирт. Применение.Парфюмерия и косметика
Является универсальным
растворителем различных
веществ и основным
компонентом духов,
аэрозолей.
Входит в состав зубных паст,
шампуни, средств для душа.
24. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ
Этиловый спирт. Применение.Этиловый спирт также используется как топливо.
Применяется для консервирования биологических
препаратов.
Является наполнителем в спиртовых термометрах.
Этанол
Т пл = -114,3 0С
Т кип = 78,4 0С
Ртуть
Т пл = +2,295 0С
Т кип = 626 0С
25. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ
Этиловый спирт. Применение.В медицине
антисептик;
подсушивающие и дубящие свойства 96%-го этилового спирта
используются для обработки операционного поля или для обработки
рук хирурга;
растворитель для лекарственных средств, для приготовления настоек,
экстрактов из растительного сырья и др.;
пеногаситель при подаче кислорода, искусственной вентиляции легких;
в согревающих компрессах;
компонент общей анестезии в ситуации дефицита медикаментозных
средств;
противоядие при отравлении некоторыми токсичными метанолом и
этиленгликолем.
26. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ
Этиловый спирт. Применение.Пищевая промышленность
Является основным компонентом спиртных напитков.
В небольших количествах содержится в ряде напитков,
получаемых брожением, но не причисляемых к
алкогольным.
Растворитель для пищевых ароматизаторов.
Может быть использован как консервант для
хлебобулочных изделий, а также в кондитерской
промышленности.
27. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ
Этиловый спирт.Этиловый спирт по своему действию на организм человека
является:
• Депресантом – психоактивным веществом, угнетающим центральную
нервную систему.
• В зависимости от дозы, концентрации, пути попадания в организм и
длительности воздействия этанол может обладать наркотическим и
токсическим действием.
• смертельная разовая доза — 4-12 граммов этанола на килограмм
массы тела (на 50 кг от 500 г водки)
28. ВАЖНЕЙШИЕ ПРЕДСТАВИТЕЛИ ОДНОАТОМНЫХ СПИРТОВ гомологический ряд
H3C OHH3C
CH2
OH
H3C CH2 CH2 OH
H3C
CH CH3
метанол
Метиловый спирт
этанол
Этиловый спирт
пропанол
Пропиловый спирт
Пропанол-2
Изопропиловый спирт
бутанол
Бутиловый спирт
OH
H3C (CH2)3 OH
29.
ВАЖНЕЙШИЕ ПРЕДСТАВИТЕЛИ ОДНОАТОМНЫХ СПИРТОВгомологический ряд
H3C CH CH2 OH
2-метилпропанол-1
CH3
H3C CH CH2 CH3
Бутанол-2
Втор.бутанол
2-метилпропанол-2
Изобутанол
Трет.бутанол
этенол
Виниловый спирт
Пропен-2-ол-1
Аллиловый спирт
OH
CH3
H3C
C
CH3
OH
H2C
H2C
CH
OH
CH CH2 OH
30. ИЗОМЕРИЯ
Структурная изомерия (или изомерияуглеродного скелета)
Положения гидроксогруппы
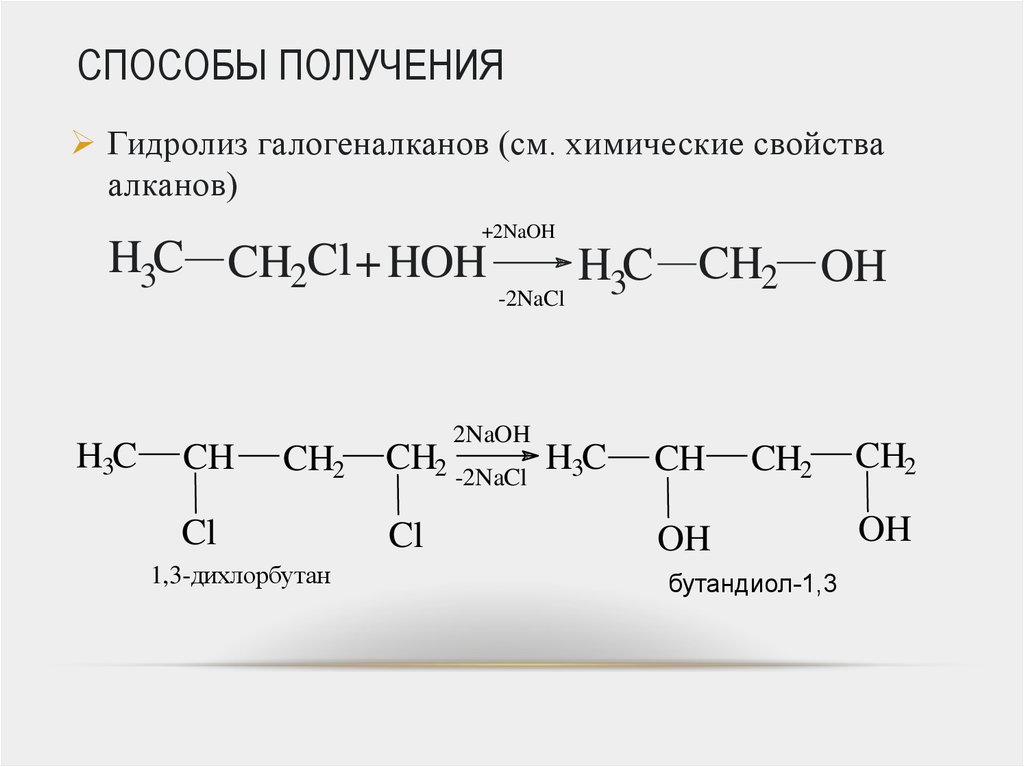
31. СПОСОБЫ ПОЛУЧЕНИЯ
Гидролиз галогеналканов (см. химические свойстваалканов)
+2NaOH
H3C CH2Cl + HOH
H3C
CH
CH2
Cl
1,3-дихлорбутан
1,3-дихлорбутан
-2NaCl
2NaOH
H3C CH2 OH
CH2 -2NaCl H3C
CH
Cl
OH
CH2
CH2
OH
1,3-бутандиол
бутандиол-1,3
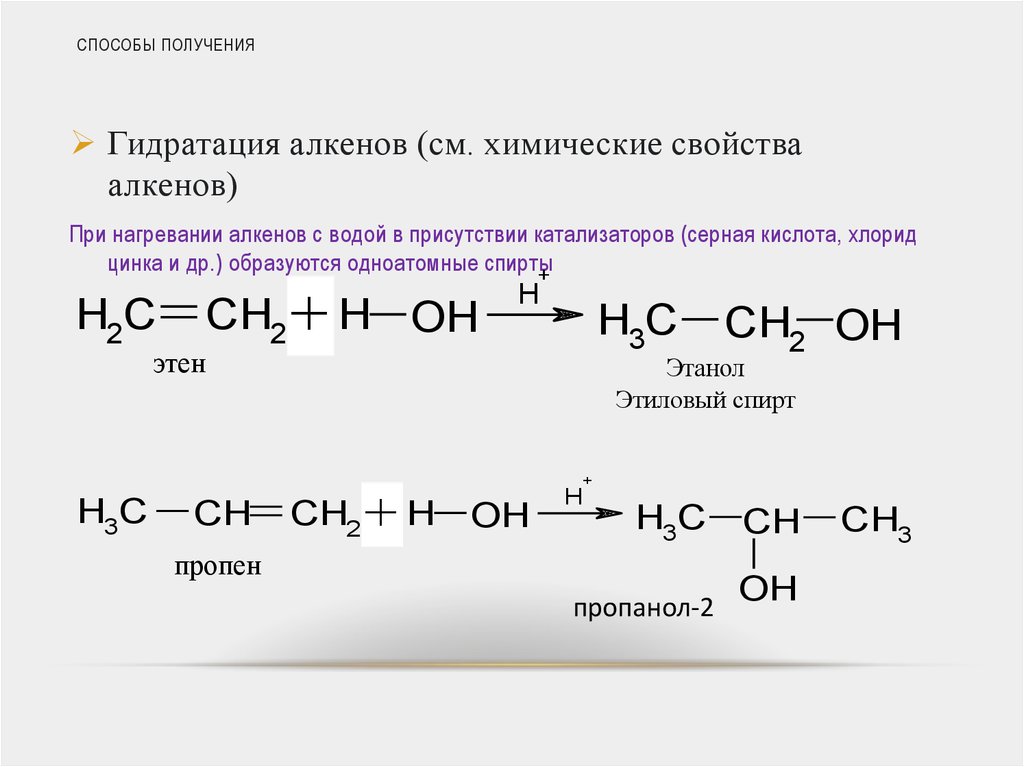
32. СПОСОБЫ ПОЛУЧЕНИЯ
Гидратация алкенов (см. химические свойстваалкенов)
При нагревании алкенов с водой в присутствии катализаторов (серная кислота, хлорид
цинка и др.) образуются одноатомные спирты
+
H2C
этен
H3C
CH2 + H OH
CH
H
H3C
CH2 OH
Этанол
Этиловый спирт
CH2 + H
+
OH
H
H3C
пропен
пропанол-2
CH
OH
CH3
33. СПОСОБЫ ПОЛУЧЕНИЯ
Гидратация алкинов (см. химические свойстваалкинов)
При нагревании алкинов с водой в присутствии катализаторов (серная кислота,
хлорид цинка и др.) образуются двухатомные спирты
H3C
C CH + H OH
пропин
+
H
H3C CH CH2 OH
OH
прпандиол-1,2
пропиленгликоль-1,2
34. СПОСОБЫ ПОЛУЧЕНИЯ
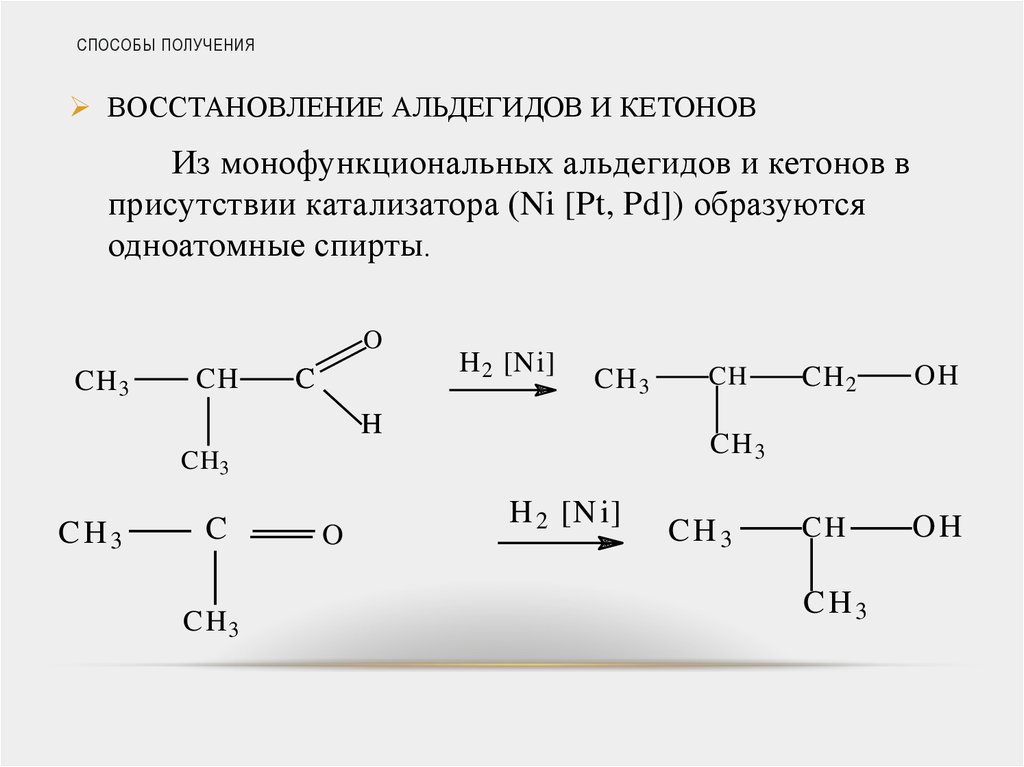
ВОССТАНОВЛЕНИЕ АЛЬДЕГИДОВ И КЕТОНОВИз монофункциональных альдегидов и кетонов в
присутствии катализатора (Ni [Pt, Pd]) образуются
одноатомные спирты.
O
CH 3
CH
C
H 2 [Ni]
CH 3
H
CH3
C H3
O
CH 2
OH
CH
OH
CH 3
CH3
C
CH
H 2 [N i]
CH3
CH3
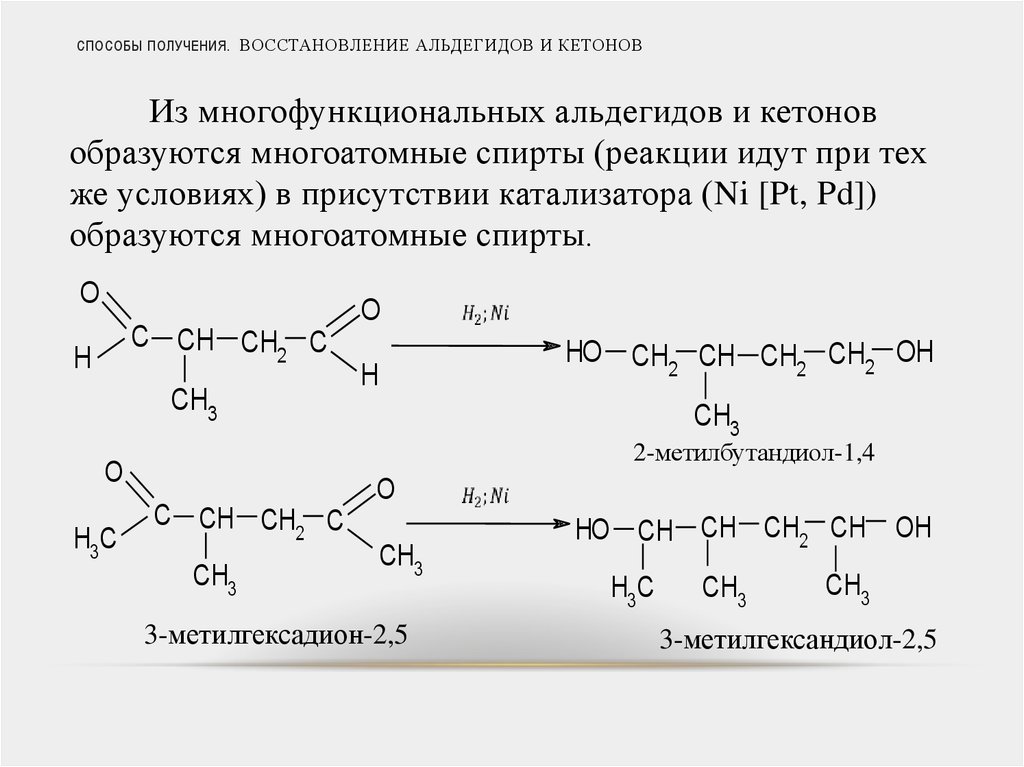
35. СПОСОБЫ ПОЛУЧЕНИЯ. ВОССТАНОВЛЕНИЕ АЛЬДЕГИДОВ И КЕТОНОВ
Из многофункциональных альдегидов и кетоновобразуются многоатомные спирты (реакции идут при тех
же условиях) в присутствии катализатора (Ni [Pt, Pd])
образуются многоатомные спирты.
O
C CH CH C
2
H
CH3
H
HO CH2 CH CH2 CH2 OH
CH3
2-метилбутандиол-1,4
O
H3C
O
C CH CH C
2
CH3
O
CH3
3-метилгексадион-2,5
HO CH CH CH2 CH OH
H3C
CH3
CH3
3-метилгександиол-2,5
36. СПОСОБЫ ПОЛУЧЕНИЯ
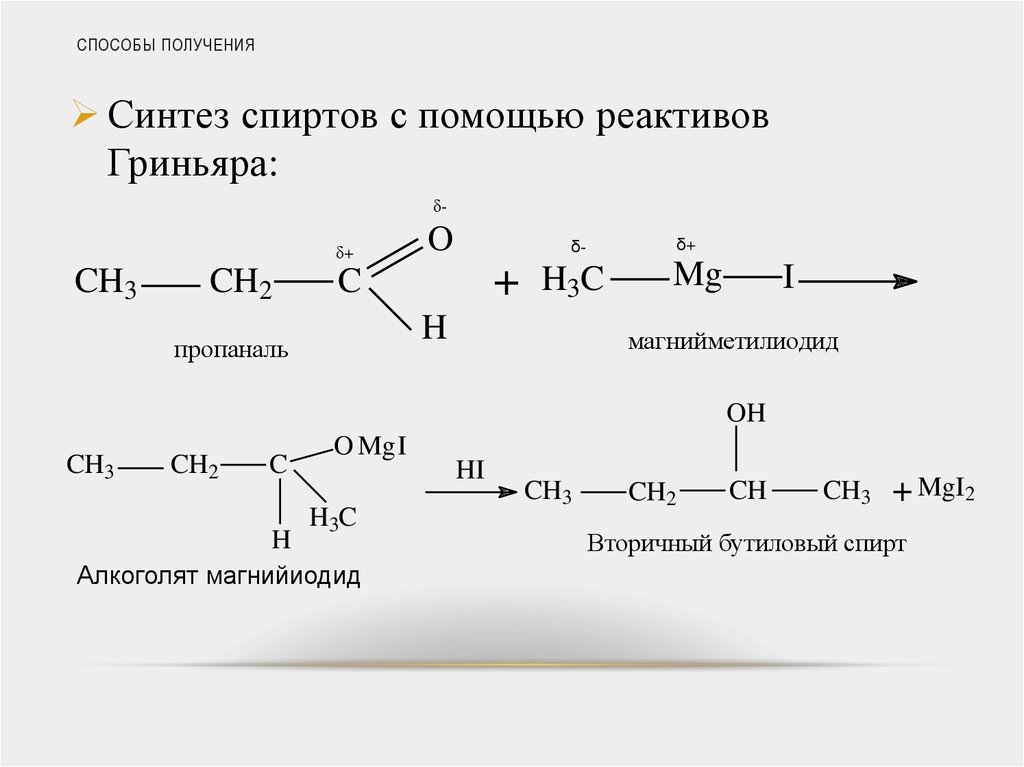
Синтез спиртов с помощью реактивовГриньяра:
δδ+
CH3
CH2
O
+
C
H3C
H
пропаналь
δ+
δ-
Mg
I
магнийметилиодид
OH
CH3
CH2
C
H
O MgI
H3C
Алкоголят магнийиодид
HI
CH3
CH2
CH
CH3
+ MgI2
Вторичный бутиловый спирт
37. СПОСОБЫ ПОЛУЧЕНИЯ
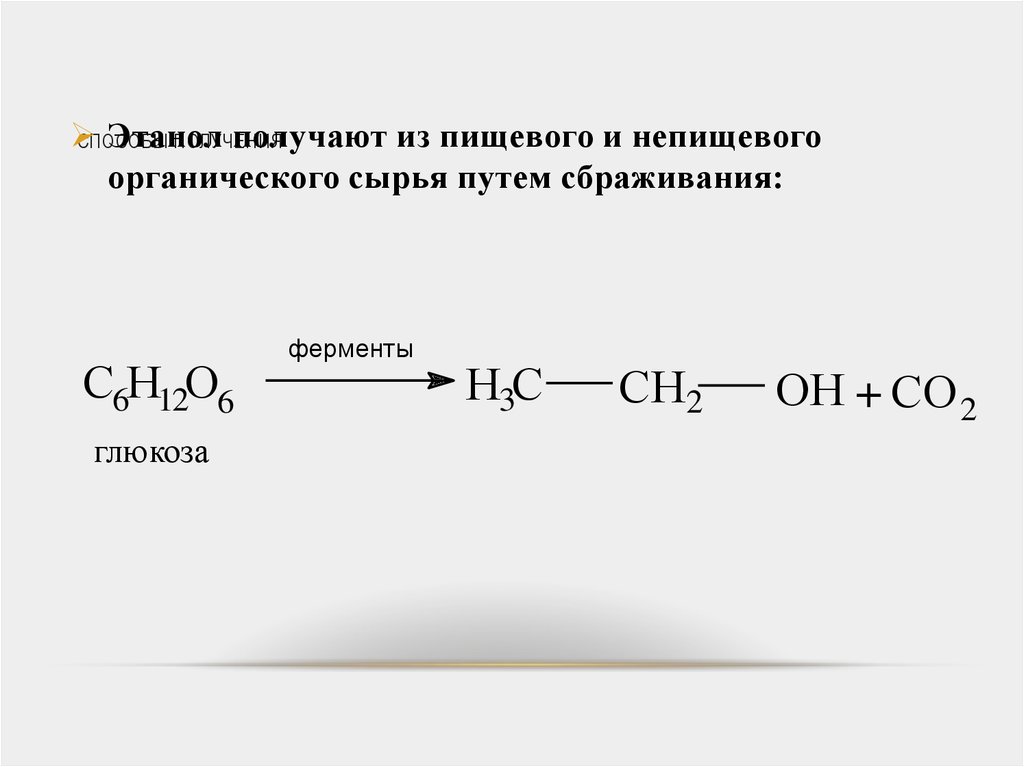
Этанолполучают из пищевого и непищевого
СПОСОБЫ
ПОЛУЧЕНИЯ
органического сырья путем сбраживания:
C6H12O6
глюкоза
ферменты
H3C
CH2
OH + CO 2
38. СПОСОБЫ ПОЛУЧЕНИЯ
Получение смеси спиртов – синтолаУсловия: Нагревание, высокое давление, катализатор
(Fe, Co)
nCO 2nH 2 Cn H 2n 1OH (n -1)H 2O
39. СПОСОБЫ ПОЛУЧЕНИЯ
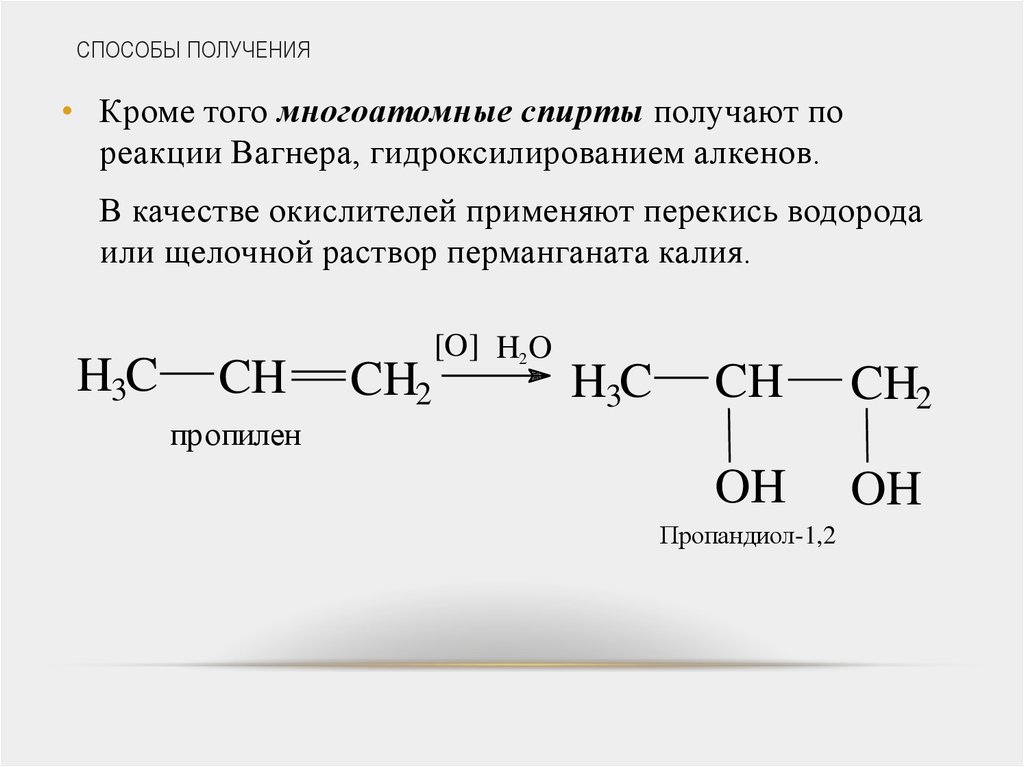
• Кроме того многоатомные спирты получают пореакции Вагнера, гидроксилированием алкенов.
В качестве окислителей применяют перекись водорода
или щелочной раствор перманганата калия.
H3C
CH
CH2
[O] H2 O
H3C
CH
CH2
OH
OH
пропилен
Пропандиол-1,2
1,2-пропандиол
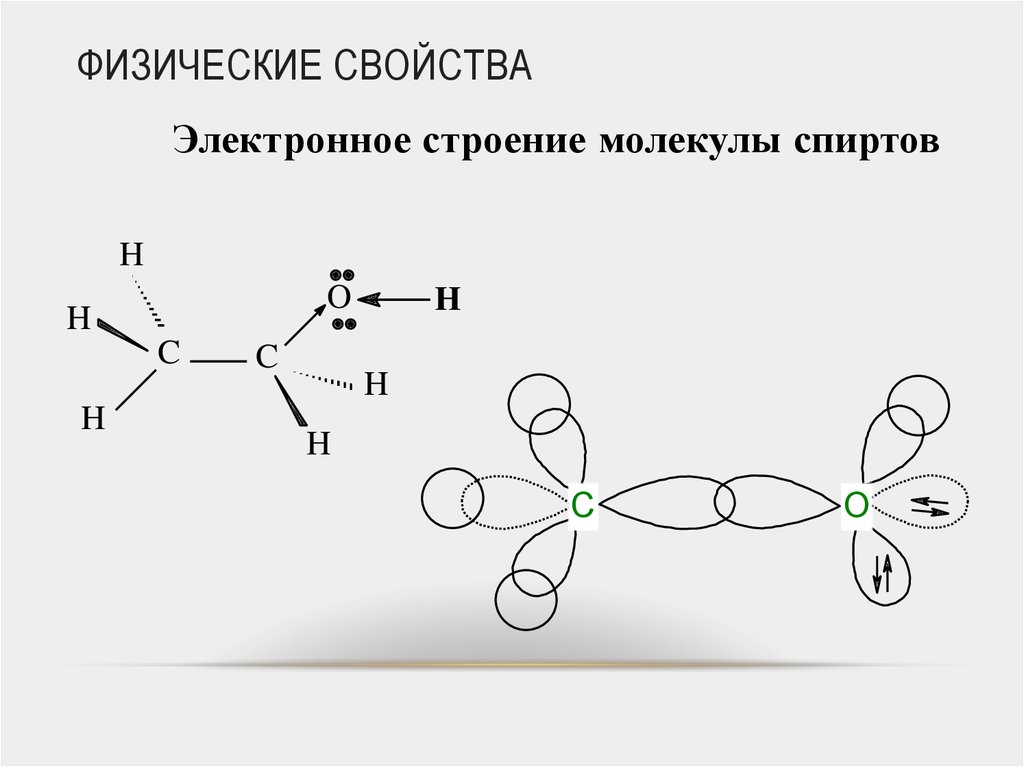
40. ФИЗИЧЕСКИЕ СВОЙСТВА
Электронное строение молекулы спиртовH
O
H
C
H
C
H
H
H
C
O
41. ФИЗИЧЕСКИЕ СВОЙСТВА
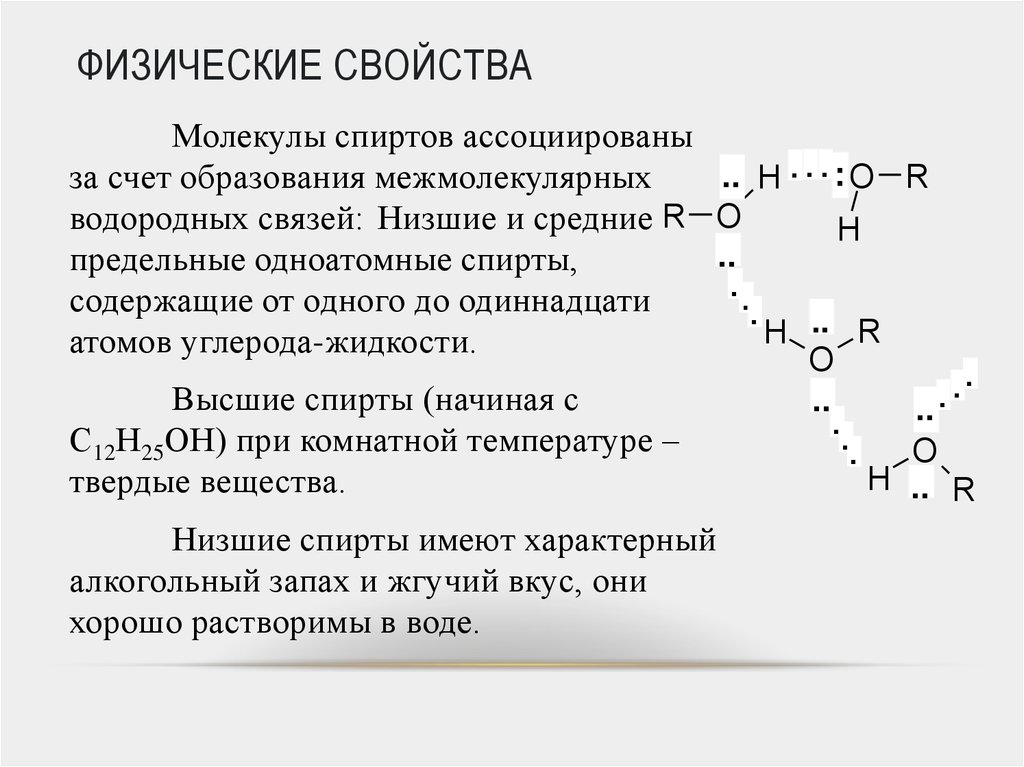
Молекулы спиртов ассоциированы.. H . . . : O
за счет образования межмолекулярных
водородных связей: Низшие и средние R O
H
..
предельные одноатомные спирты,
..
содержащие от одного до одиннадцати
.
.. R
H
атомов углерода-жидкости.
O
Высшие спирты (начиная с
..
.
.
С12Н25ОН) при комнатной температуре –
.
H
твердые вещества.
Низшие спирты имеют характерный
алкогольный запах и жгучий вкус, они
хорошо растворимы в воде.
R
.
.
.
..
O
.. R
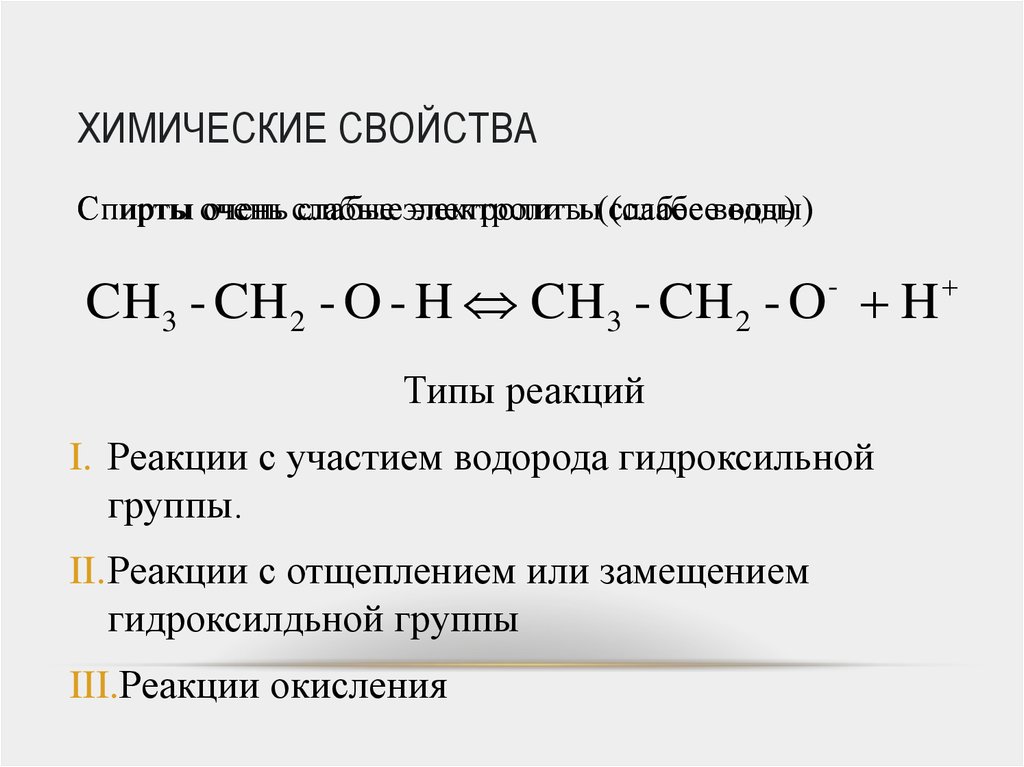
42. ХИМИЧЕСКИЕ СВОЙСТВА
Спирты оченьочень слабые
слабыеэлектролиты
электролиты(слабее
(слабееводы)
воды)
CH3 - CH 2 - O - H CH3 - CH 2 - O H
-
Типы реакций
I. Реакции с участием водорода гидроксильной
группы.
II.Реакции с отщеплением или замещением
гидроксилдьной группы
III.Реакции окисления
43. ХИМИЧЕСКИЕ СВОЙСТВА
Реакциипротекающие с разрывом связи
ХИМИЧЕСКИЕ
СВОЙСТВА
O
H
• Образование алкоголятов
Замещение гидроксильного атома водорода на металл.
(Na,Mg,Al)
2R O H 2Na 2R ONa H 2
Алкоголят натрия
Такие алкоголяты относятся к солям, образованным сильными
основаниями и слабыми кислотами, поэтому в водных растворах
подвергаются гидролизу по аниону.
CH3 CH 2 ONa H 2O CH3 CH 2 O H NaOH
44. ХИМИЧЕСКИЕ СВОЙСТВА. Реакции протекающие с разрывом связи
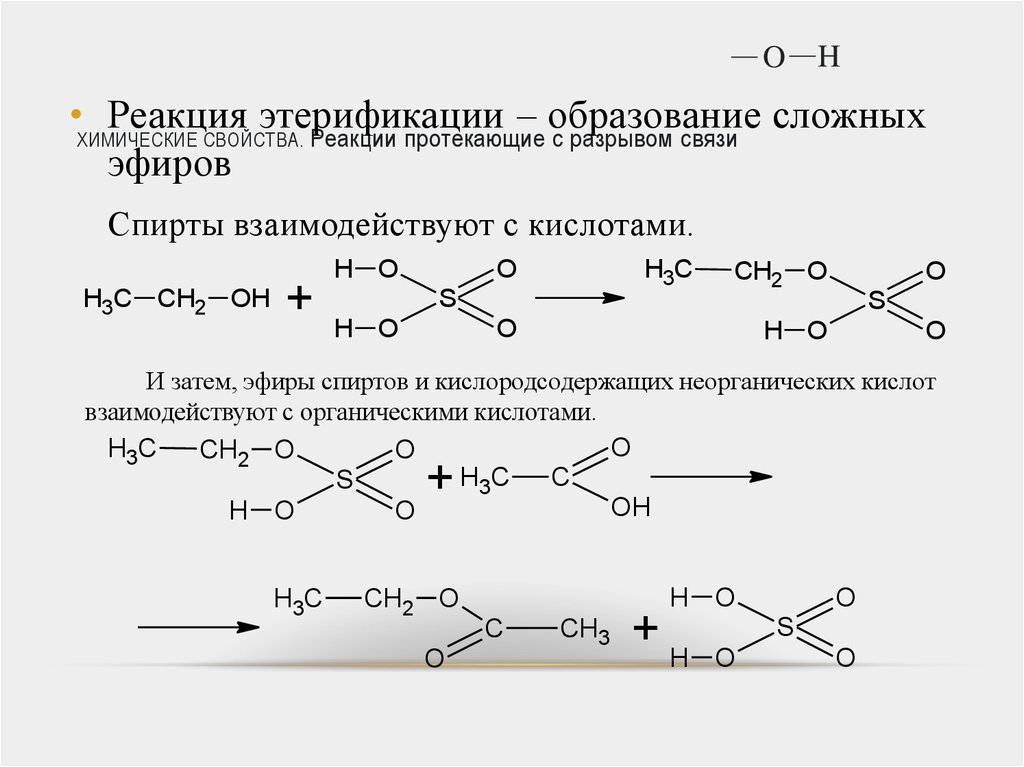
OH
•ХИМИЧЕСКИЕ
Реакция
этерификации
–
образование
сложных
СВОЙСТВА. Реакции протекающие с разрывом связи
эфиров
Спирты взаимодействуют с кислотами.
H3C CH2 OH
+
H O
O
H3C
S
H O
CH2 O
O
O
S
H O
O
И затем, эфиры спиртов и кислородсодержащих неорганических кислот
взаимодействуют с органическими кислотами.
O
H3C
CH2 O
O
H3C
C
S
OH
H O
O
+
H3C
CH2 O
O
H O
C
CH3
+H
O
S
O
O
45. ХИМИЧЕСКИЕ СВОЙСТВА. Реакции протекающие с разрывом связи
OH
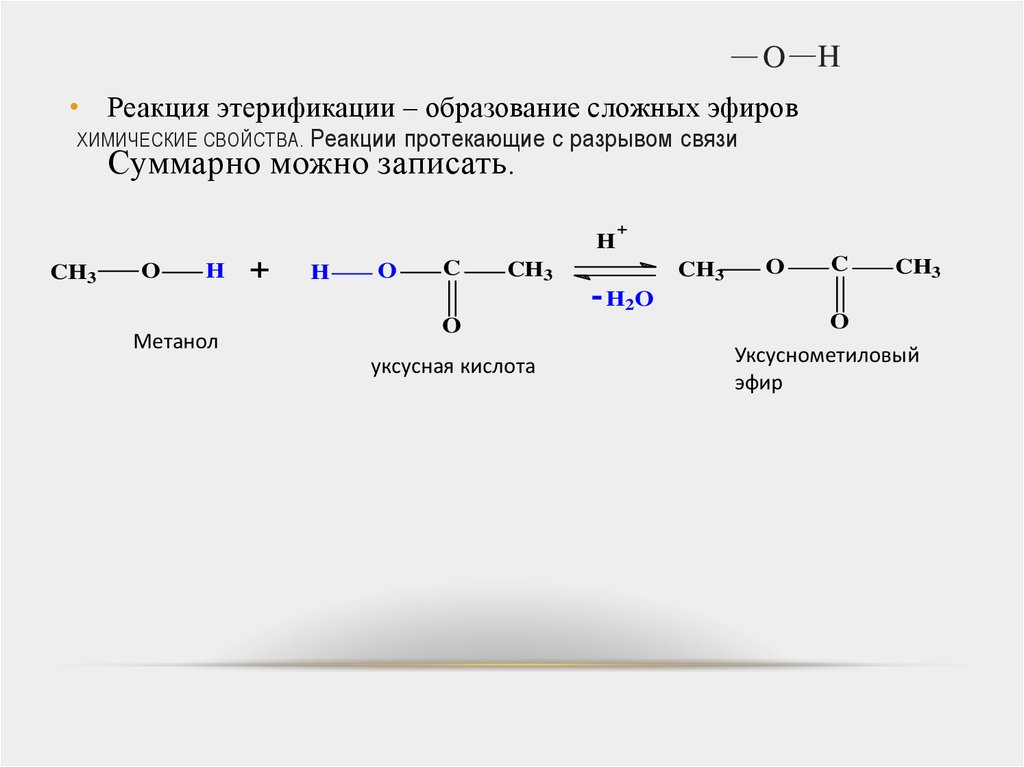
• Реакция этерификации – образование сложных эфиров
ХИМИЧЕСКИЕ СВОЙСТВА.
Реакции протекающие с разрывом связи
Суммарно можно записать.
H
CH3
O
H
Метанол
+
H
O
C
CH3
O
уксусная кислота
+
- H2O
CH3
O
C
CH3
O
Уксуснометиловый
эфир
46. ХИМИЧЕСКИЕ СВОЙСТВА
Реакциис отщеплением или замещением
ХИМИЧЕСКИЕ
СВОЙСТВА
гидроксильной группы
• Замещение гидроксила на галоген
CH3 CH 2OH PBr5 CH3 CH 2 Br POBr3 HBr
этанол
бромэтан
CH3 CH 2 CH 2 OH SOCl2 CH3 CH 2 CH 2Cl SO2 HCl
пропанол
хлорпропанол
CH3 CH 2OH HBr CH 3 CH 2 Br H 2O
этанол
бромэтан
47. ХИМИЧЕСКИЕ СВОЙСТВА. Реакции с отщеплением или замещением гидроксильной группы
ХИМИЧЕСКИЕ СВОЙСТВА.Реакции с отщеплением или замещением гидроксильной
•группы
Отщепление воды с образованием алкенов
Условия: Нагревание с конц. H2SO4 или ZnCl2 (Al2O3)
H
H
H
C
C
H
H
- H2O
O
CH2
CH2
H
CH3 H
CH3
C
O
H
C
H
CH3
CH3
- H2O
CH3
C
CH
Правило Зайцева
Водород уходит от наименее
гидрогенизированного атома
CH3
48. ХИМИЧЕСКИЕ СВОЙСТВА. Реакции с отщеплением или замещением гидроксильной группы
ХИМИЧЕСКИЕ СВОЙСТВА.Реакции с отщеплением или замещением гидроксильной
•группы
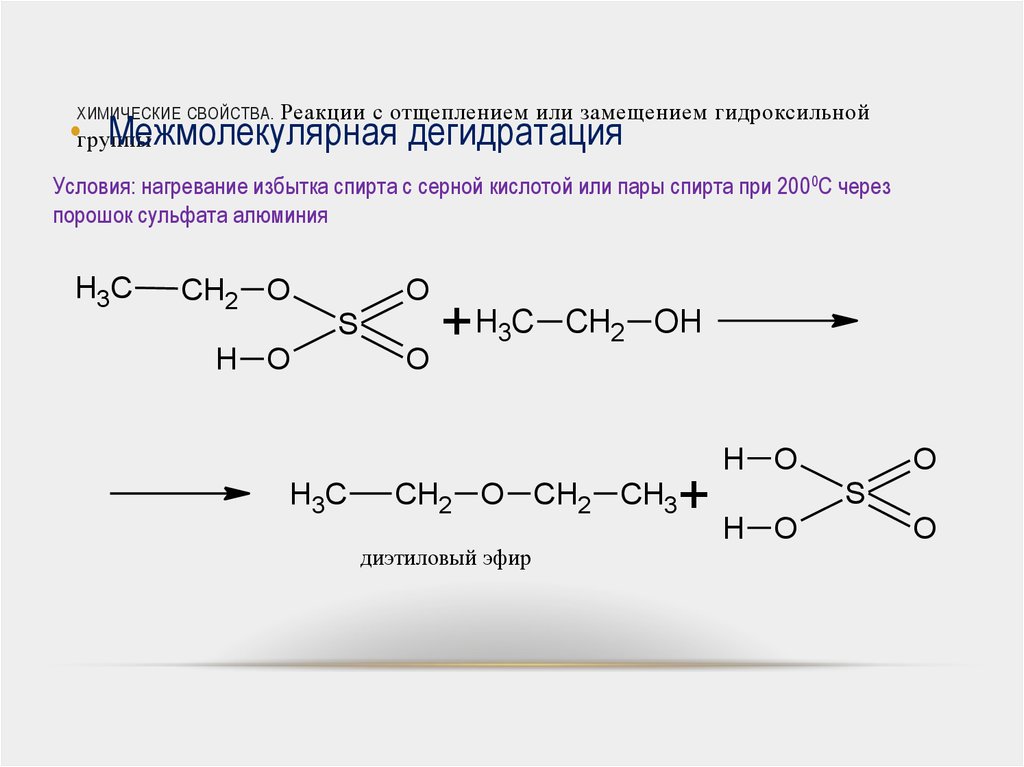
Межмолекулярная дегидратация
Условия: нагревание избытка спирта с серной кислотой или пары спирта при 2000С через
порошок сульфата алюминия
H3C
CH2 O
O
S
H O
O
+ H3C
CH2 OH
H O
H3C
+H
CH2 O CH2 CH3
диэтиловый эфир
O
S
O
O
49. ХИМИЧЕСКИЕ СВОЙСТВА. Реакции с отщеплением или замещением гидроксильной группы
ХИМИЧЕСКИЕ СВОЙСТВА.Реакции с отщеплением или замещением гидроксильной
•группы
Замена гидроксила на аминогруппу
Условия: 3000С, Al2O3
CH3 CH 2 OH NH3 CH3 CH 2 NH 2 HOH
этиламин
50.
OHOH
OH


























 Химия
Химия








