Похожие презентации:
Электролитическая диссоциация (9 класс)
1.
ХИМИЯ9 класс
Электролитическая диссоциация
Мария Дмитриевна Смирнова
Smirnova@sch2101.ru
Vk.com/masha2101
1
2.
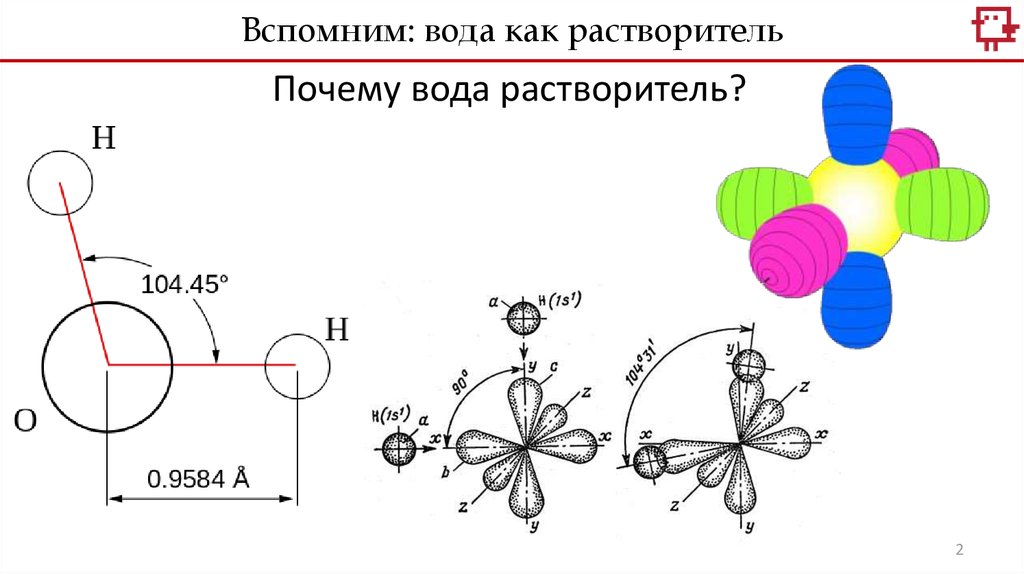
Вспомним: вода как растворительПочему вода растворитель?
2
3.
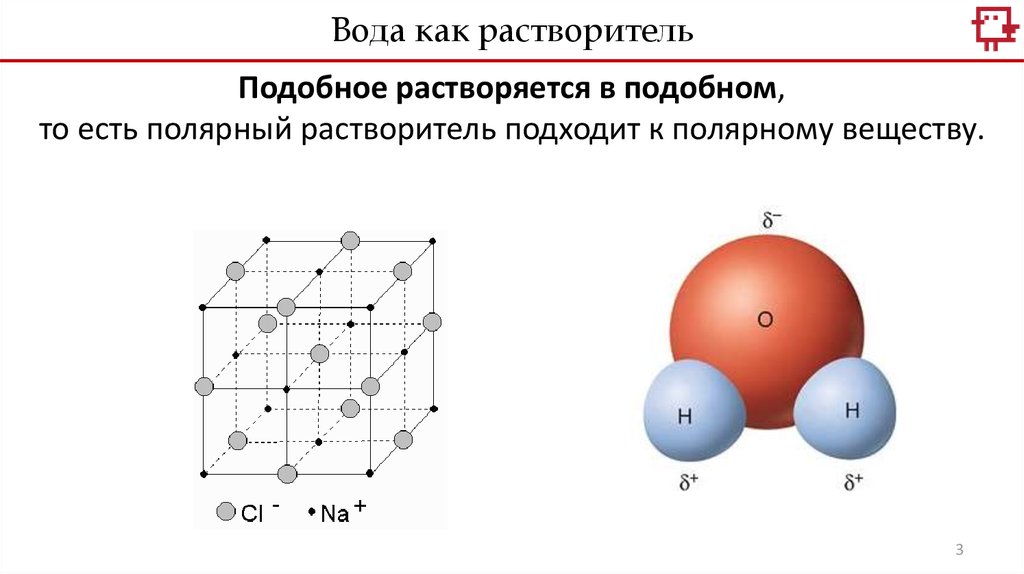
Вода как растворительПодобное растворяется в подобном,
то есть полярный растворитель подходит к полярному веществу.
3
4.
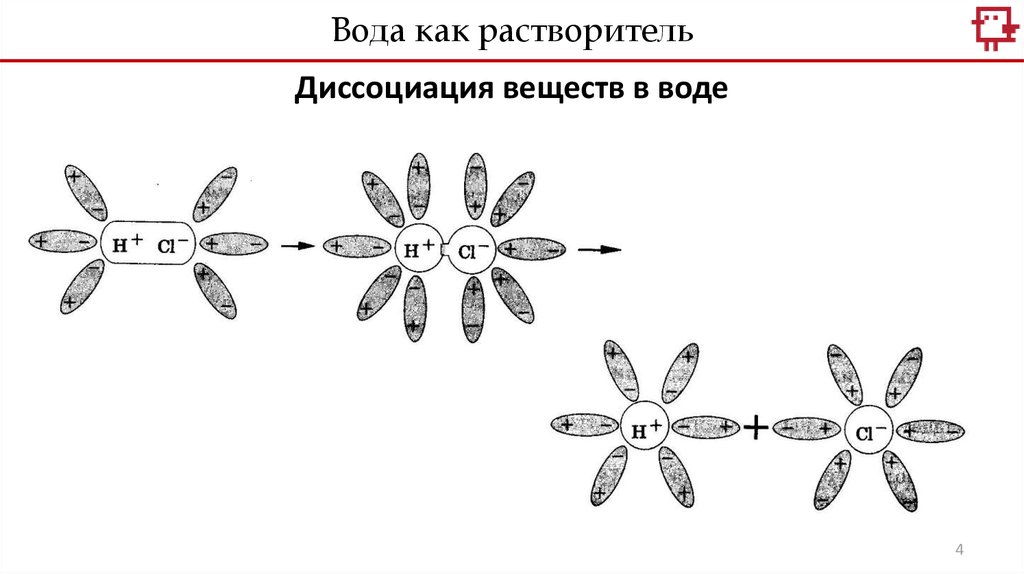
Вода как растворительДиссоциация веществ в воде
4
5.
Гидратация – ещё один способ реакции с водойГидратация – присоединение воды к ионам, атомам или
молекулам. Продукты такого процесса называют гидратами.
Обратная реакция называется дегидратацией.
6.
ГидратацияКристаллогидраты – кристаллические вещества, в состав которых
входит химически связанная вода. Такую воду называют
кристаллизационной водой.
CuSO4x5H2O
Пентагидрат
FeSO4x4H2O
Тетрагидрат
7.
Основные положения электролитической диссоциацииОсновные положения теории электролитической диссоциации:
1. Электролиты при растворении или плавлении распадаются на
ионы (диссоциируют) – положительные и отрицательные.
2. Под действием электрического тока ионы приобретают
направленное движение: положительные ионы стремятся к
катоду, отрицательные - к аноду.
3. Направленное движение происходит в результате притяжения
их противоположно заряженными электродами.
4. Диссоциация – обратимый процесс: одновременно вещество
распадается на ионы и ионы собираются в вещество.
8.
Диссоциация разных веществДиссоциировать в водных растворах могут соли, кислоты, щелочи.
Наиболее хорошо диссоциируют вещества с ионной связью
(большой разностью электроотрицательностей).
2H2O
К
и
с
л
о
т
ы
H3O+
Ион гидроксония
HCl
H+ + ClHCl + H2O
H3O+ + ClHNO3 + nH2O
H3O+ + NO3- + mH2O
HNO3 NO3- + H+
9.
Диссоциация кислотКислоты – такие вещества, при диссоциации в водных растворах
которых в качестве катиона отщепляется только водород (или
гидроксония ион).
2H2O
К
и
с
л
о
т
ы
H+ + OH-
HCl
H+ + ClHCl + H2O
H3O+ + ClHNO3 + nH2O
H3O+ + NO3- + mH2O
HNO3 NO3- + H+
10.
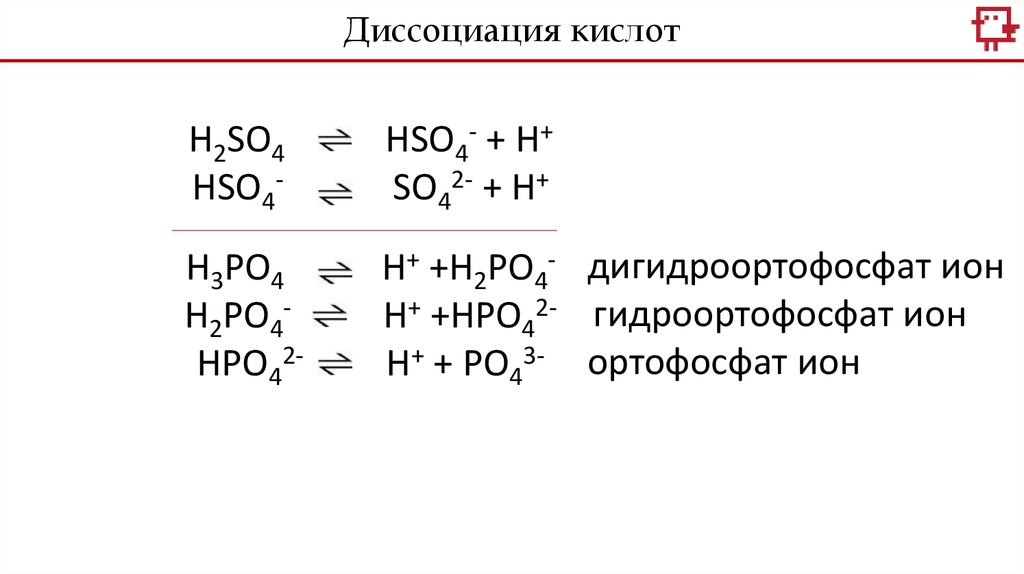
Диссоциация кислотH2SO4
HSO4-
HSO4- + H+
SO42- + H+
H3PO4
H2PO4HPO42-
H+ +H2PO4- дигидроортофосфат ион
H+ +HPO42- гидроортофосфат ион
H+ + PO43- ортофосфат ион
11.
Диссоциация щелочейОснованиями называются электролиты, при диссоциации которых
в качестве анионов образуются только гидроксид-ионы (OH -).
Щ
е
л
о
ч
и
2H2O
H+ + OH-
NaOH
Na+ + OH-
Гидроксид-ион
Ba(ОН)2 Bа(ОН)+ + OHBa(OH)+ Ba2++OH-
12.
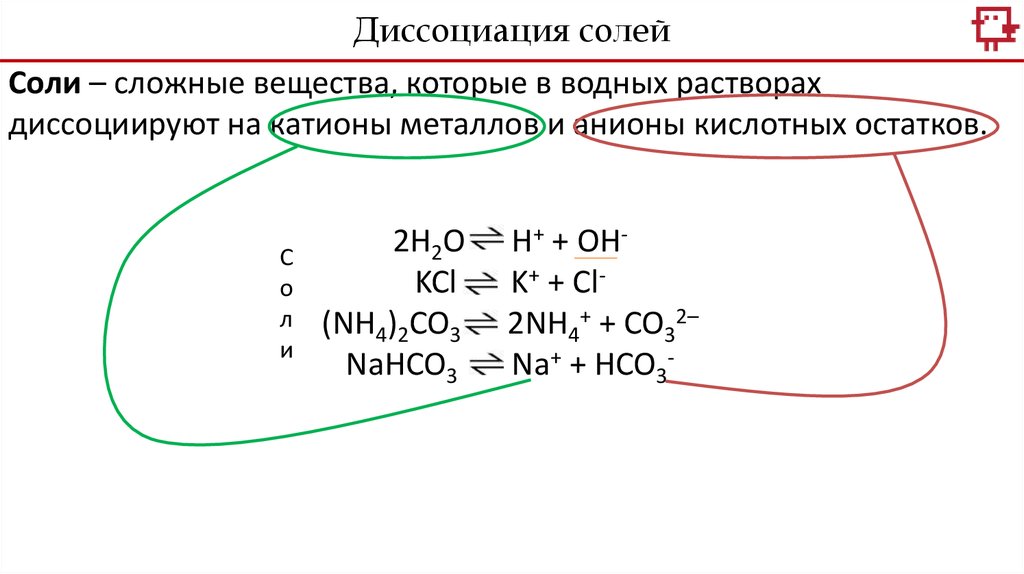
Диссоциация солейСоли – сложные вещества, которые в водных растворах
диссоциируют на катионы металлов и анионы кислотных остатков.
С
о
л
и
2H2O
KCl
(NH4)2CO3
NaHCO3
H+ + OHK+ + Cl2NH4+ + CO32–
Na+ + HCO3-







 Химия
Химия








