Похожие презентации:
Ароматические углеводороды (арены)
1.
Ароматические углеводородыЦиклические соединения, объединяемые
понятием ароматичности, которая
обуславливает общие признаки в строении
и химических свойствах
2.
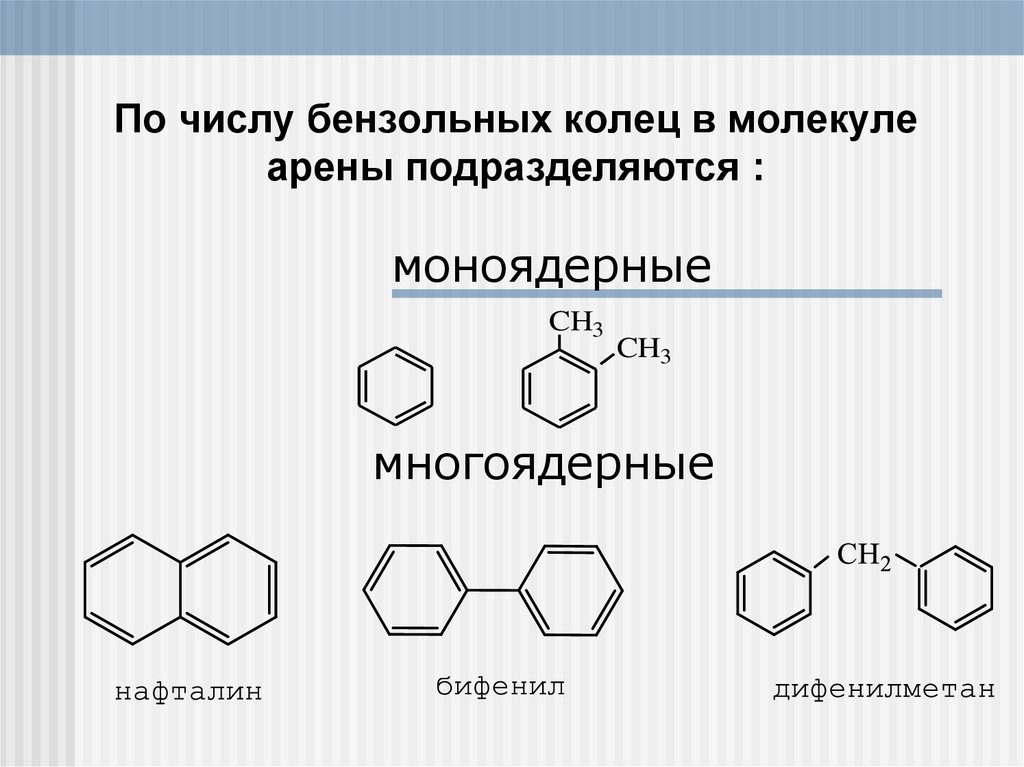
По числу бензольных колец в молекулеарены подразделяются :
моноядерные
CH3
CH3
многоядерные
3.
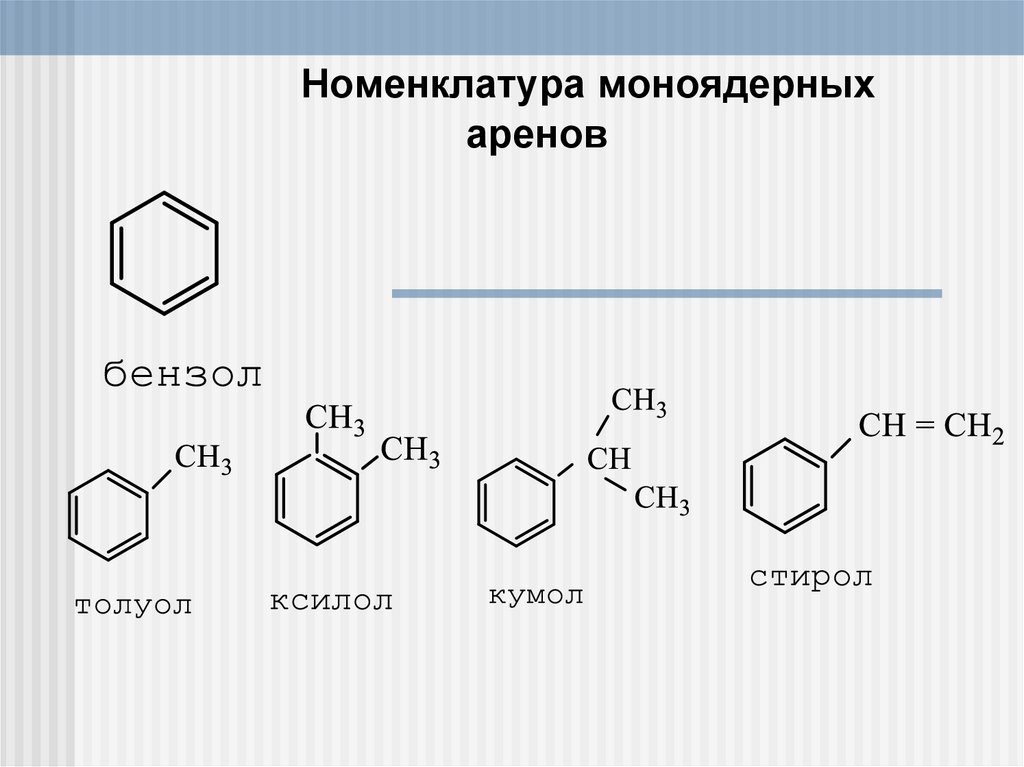
Номенклатура моноядерныхаренов
4.
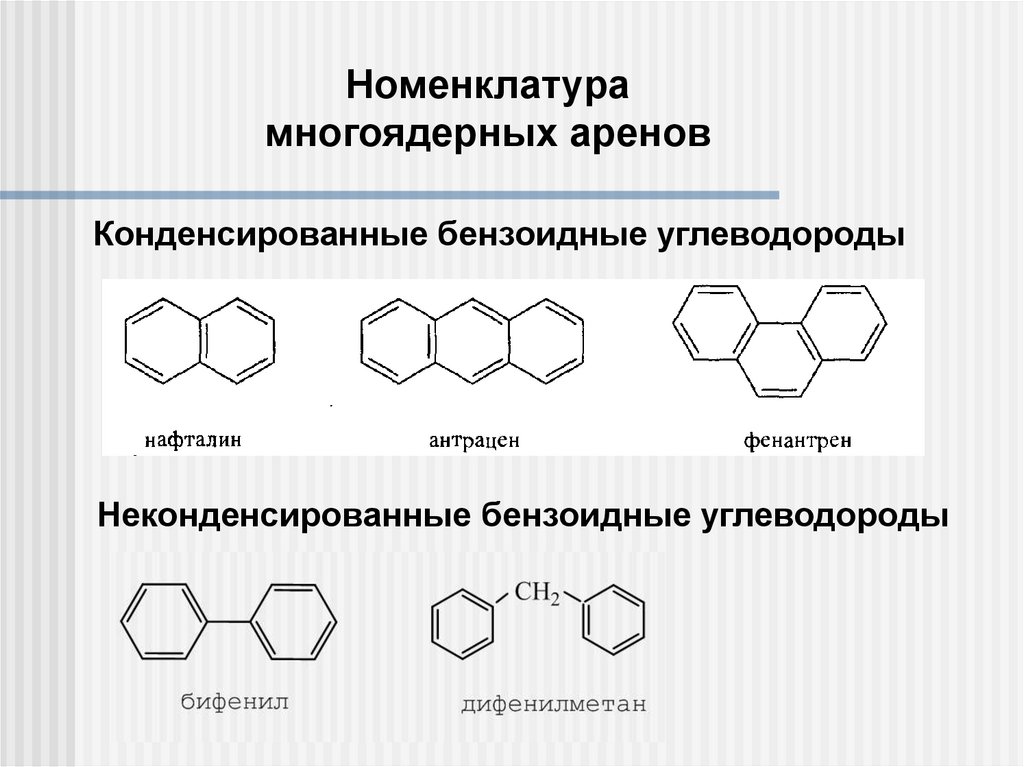
Номенклатурамногоядерных аренов
Конденсированные бензоидные углеводороды
Неконденсированные бензоидные углеводороды
5.
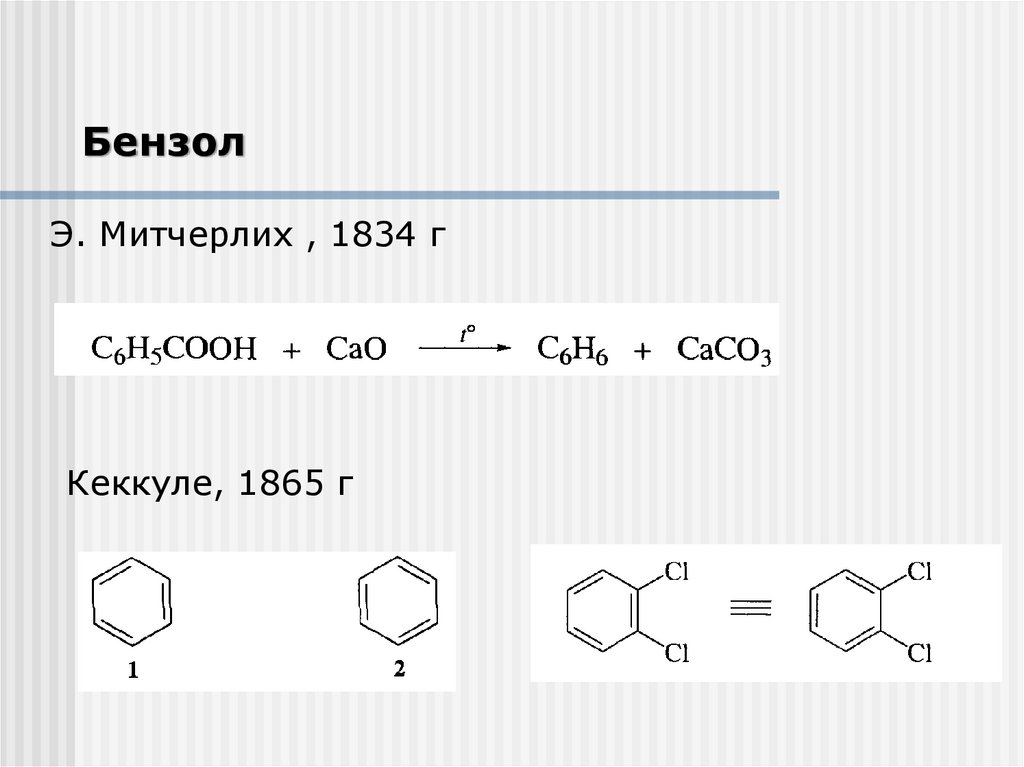
БензолЭ. Митчерлих , 1834 г
Кеккуле, 1865 г
6.
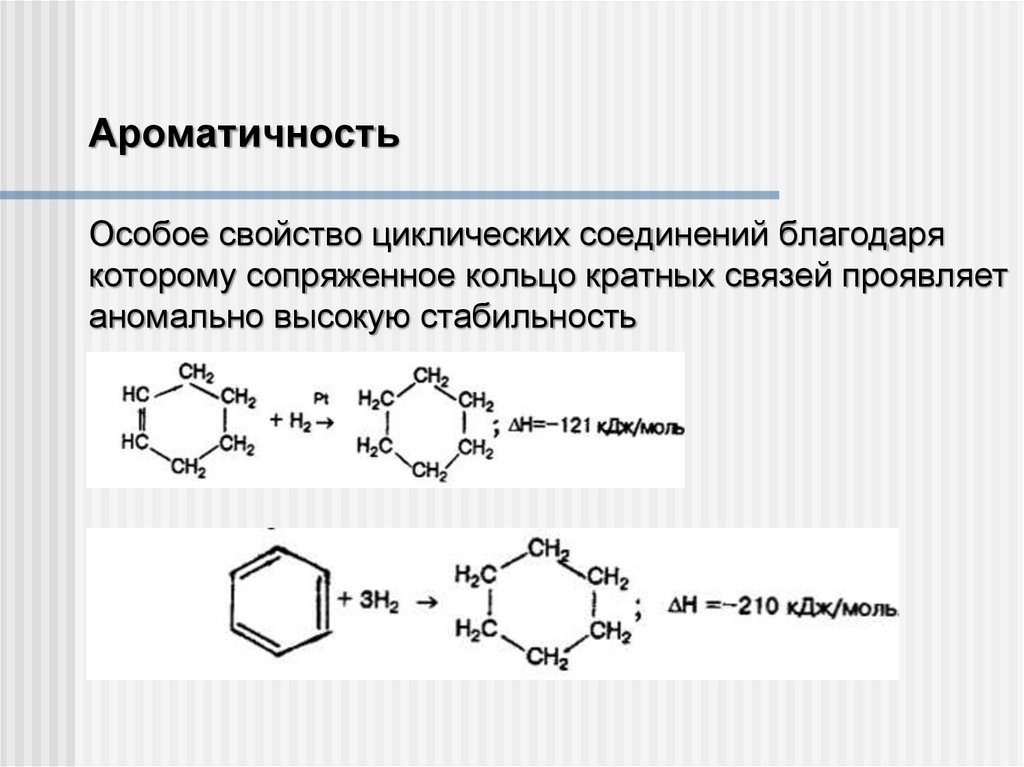
АроматичностьОсобое свойство циклических соединений благодаря
которому сопряженное кольцо кратных связей проявляет
аномально высокую стабильность
7.
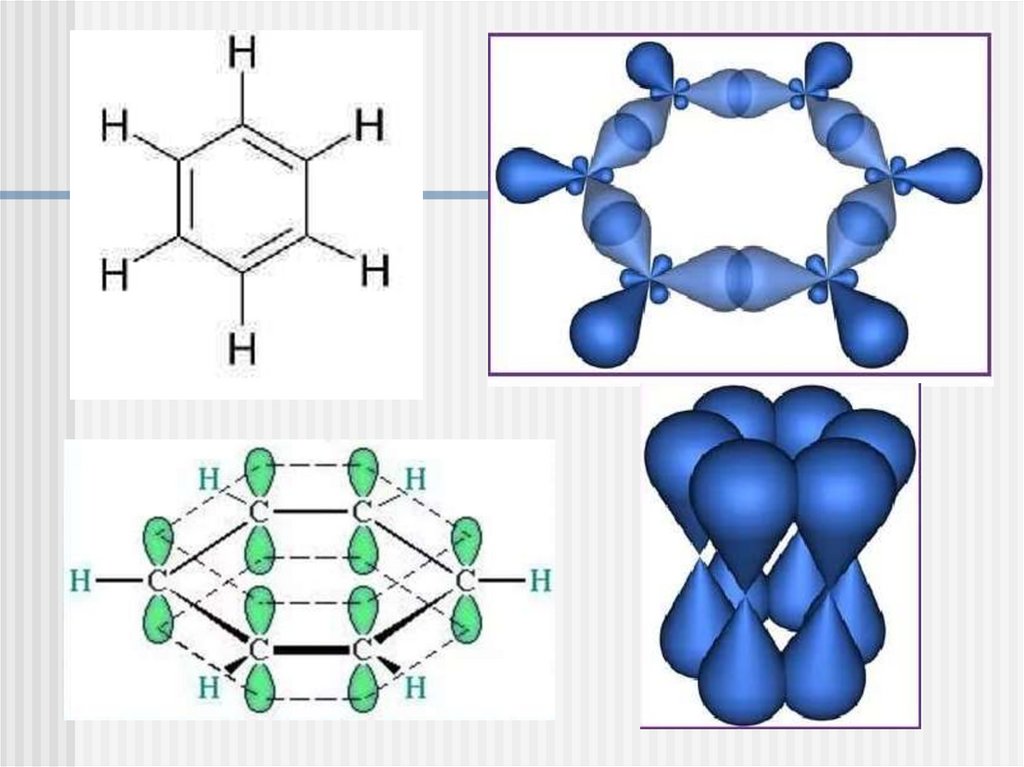
Соединение обладает ароматичностью, если оно имеет:плоский циклический σ-скелет
• сопряженную замкнутую π-электронную систему,
охватывающую все атомы цикла;
• содержащую 4n + 2 электронов, где n = 1, 2, 3 и
т.д. (правило Хюккеля)
8.
9.
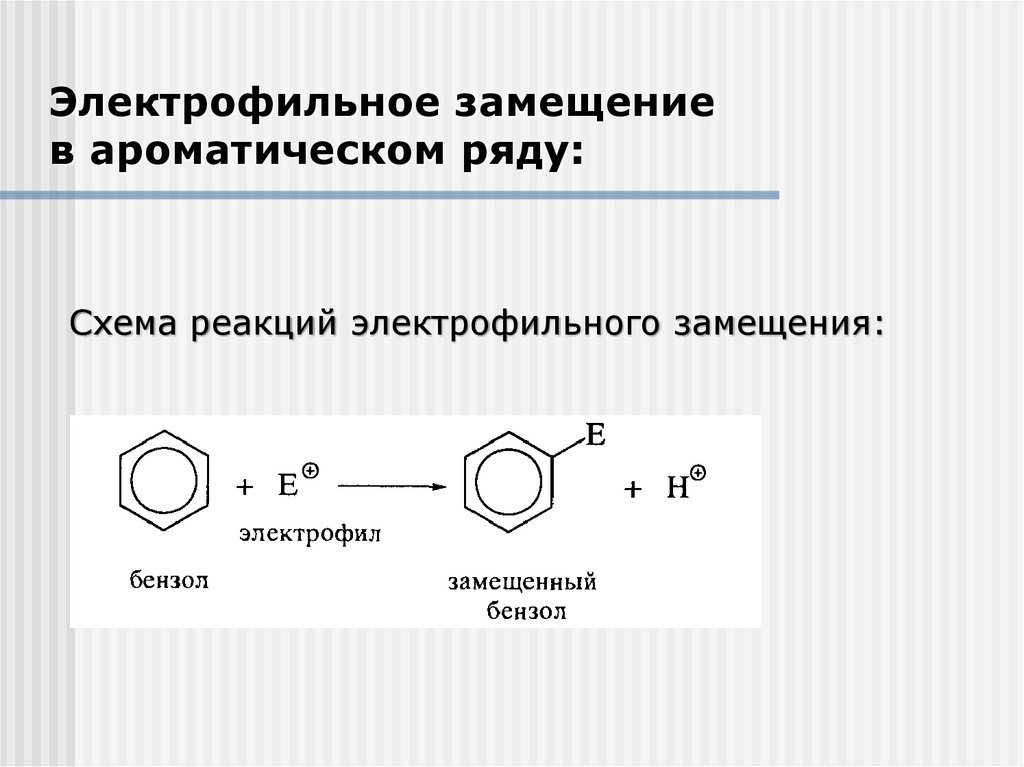
Электрофильное замещениев ароматическом ряду:
Схема реакций электрофильного замещения:
10.
Механизм реакций электрофильногоароматического замещения:
Стадия 1- образование электрофильного
агента
Стадия 2- образование π-комплекса 1
11.
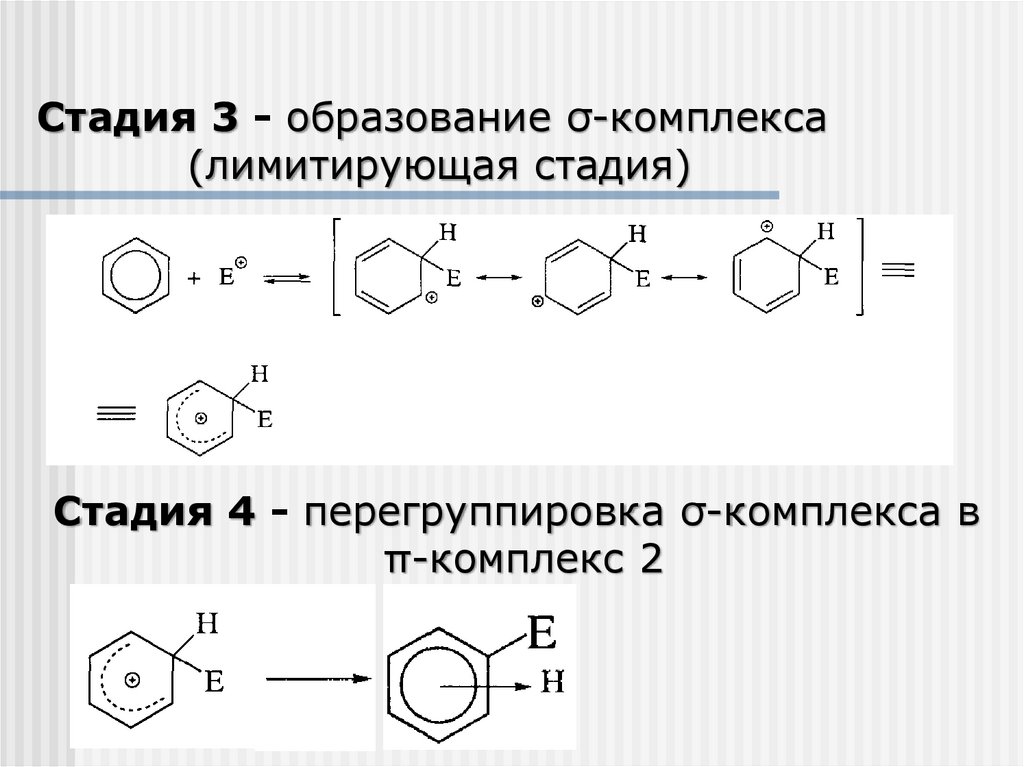
Стадия 3 - образование σ-комплекса(лимитирующая стадия)
Стадия 4 - перегруппировка σ-комплекса в
π-комплекс 2
12.
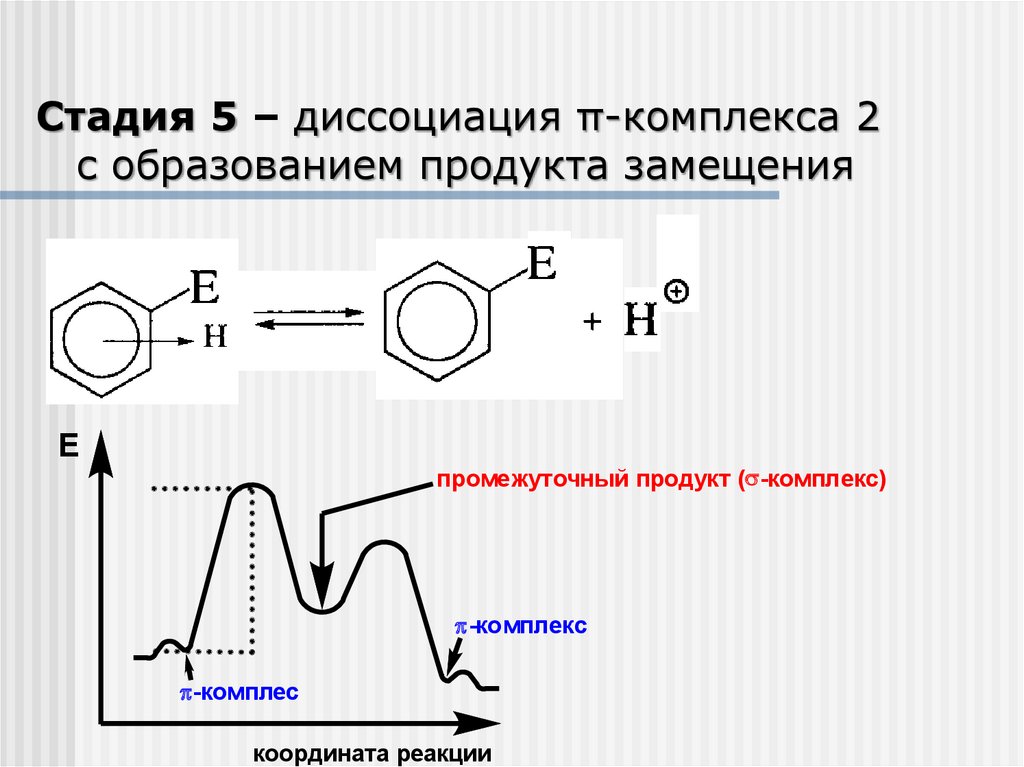
Стадия 5 – диссоциация π-комплекса 2с образованием продукта замещения
E
промежуточный продукт ( -комплекс)
-комплекс
-комплес
координата реакции
13.
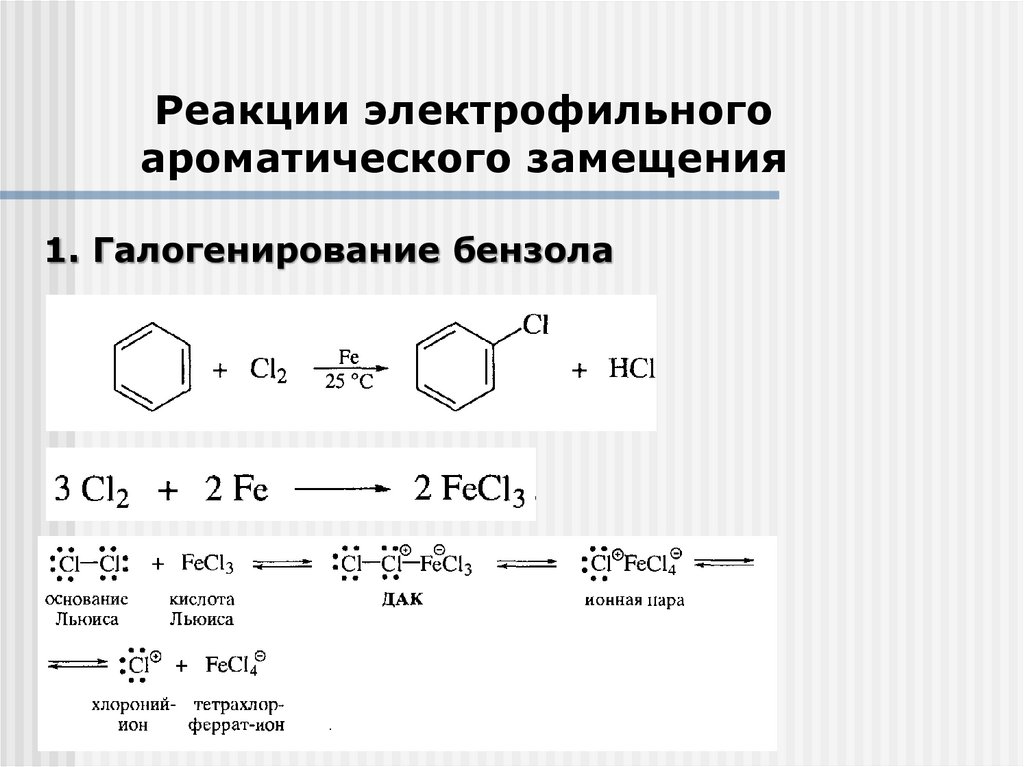
Реакции электрофильногоароматического замещения
1. Галогенирование бензола
14.
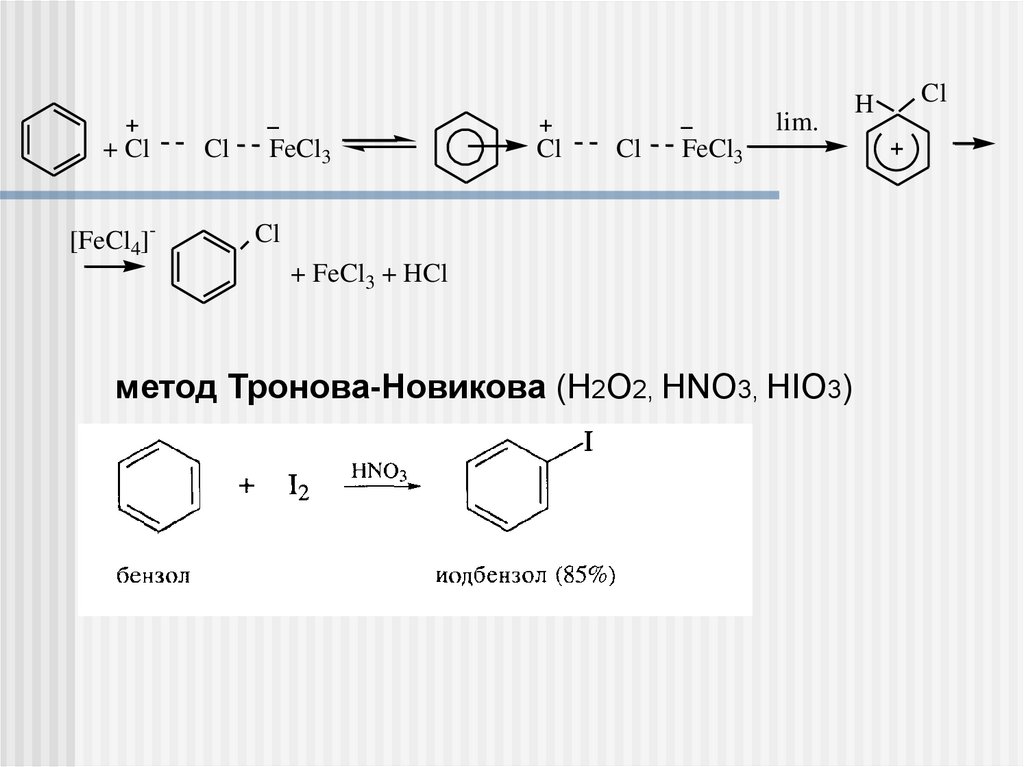
lim.+ Cl
[FeCl4]-
Cl
FeCl3
Cl
Cl
FeCl3
Cl
+ FeCl3 + HCl
метод Тронова-Новикова (H2О2, HNO3, HIO3)
H
Cl
15.
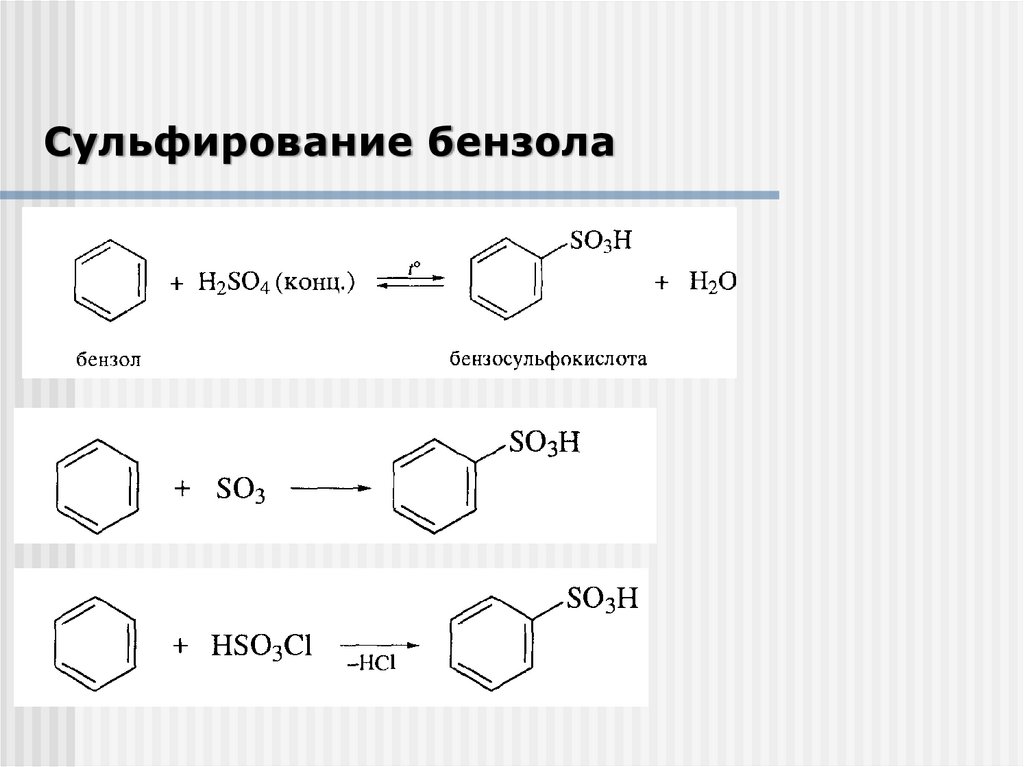
Сульфирование бензола16.
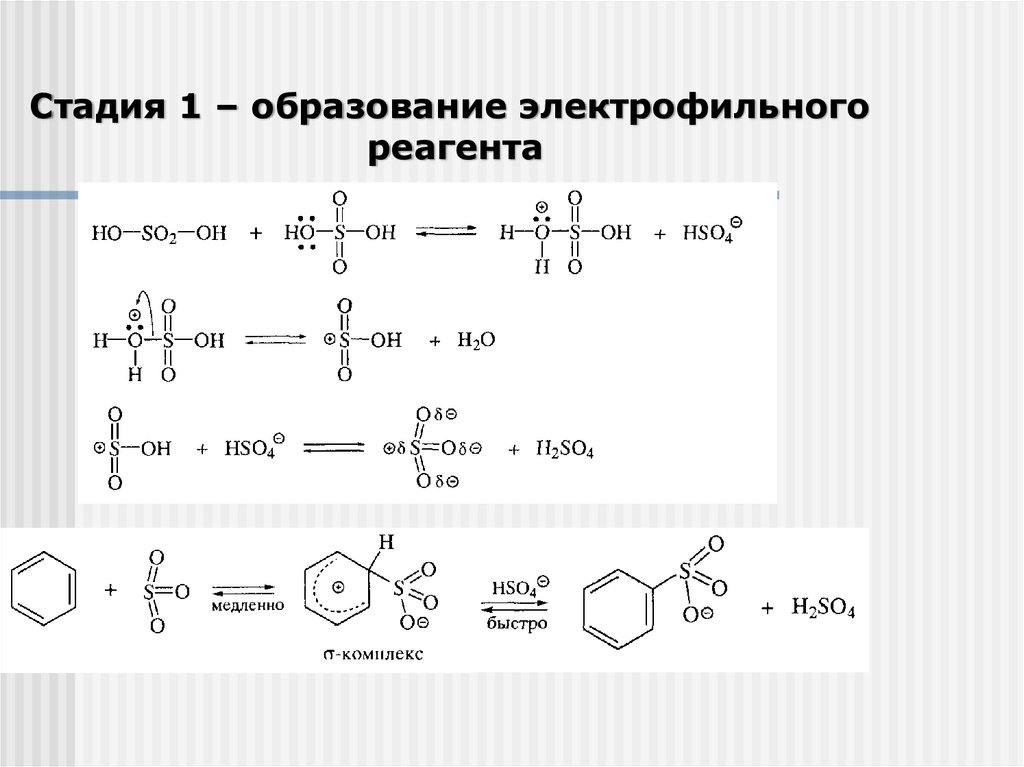
Стадия 1 – образование электрофильногореагента
17.
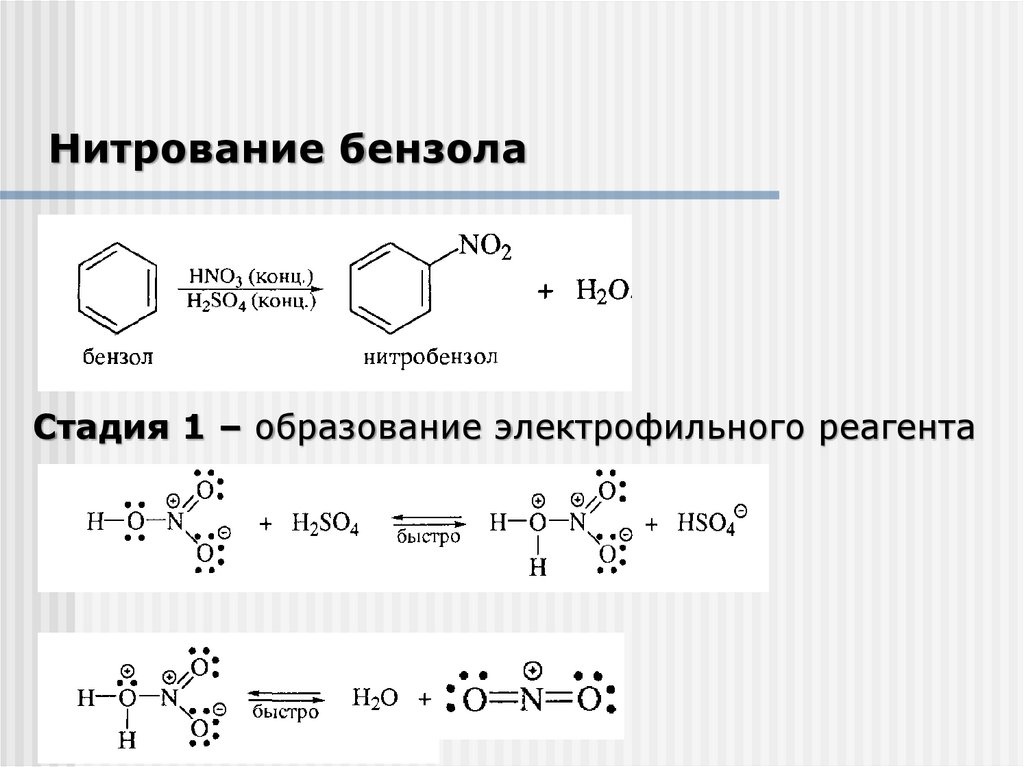
Нитрование бензолаСтадия 1 – образование электрофильного реагента
18.
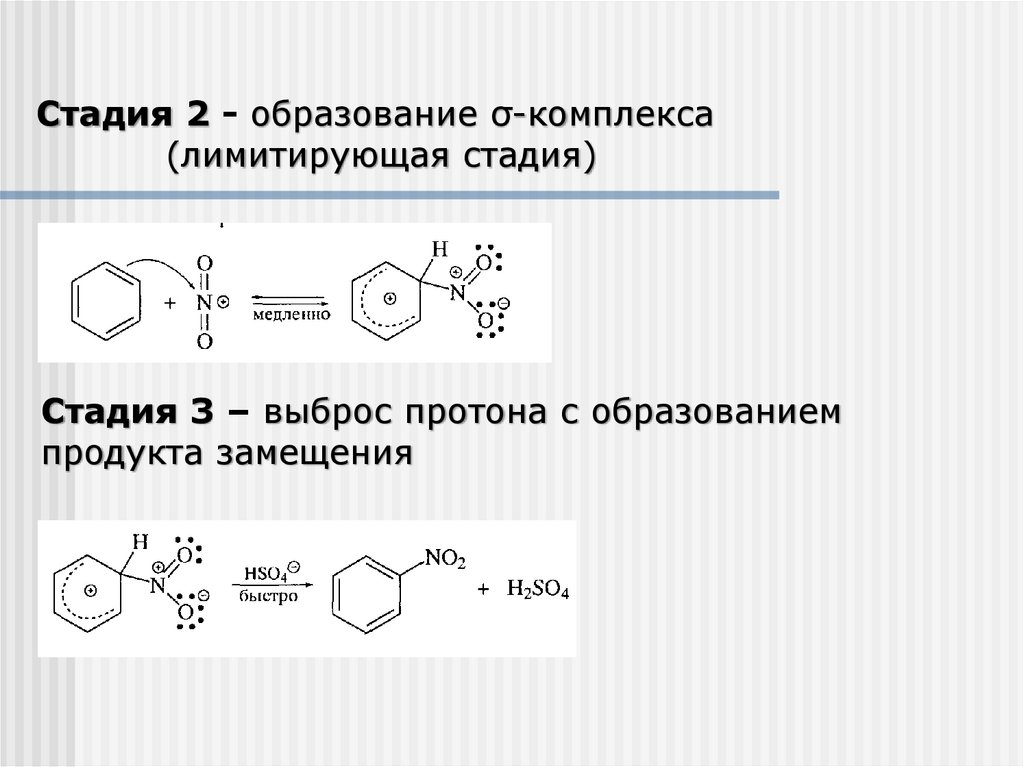
Стадия 2 - образование σ-комплекса(лимитирующая стадия)
Стадия 3 – выброс протона с образованием
продукта замещения
19.
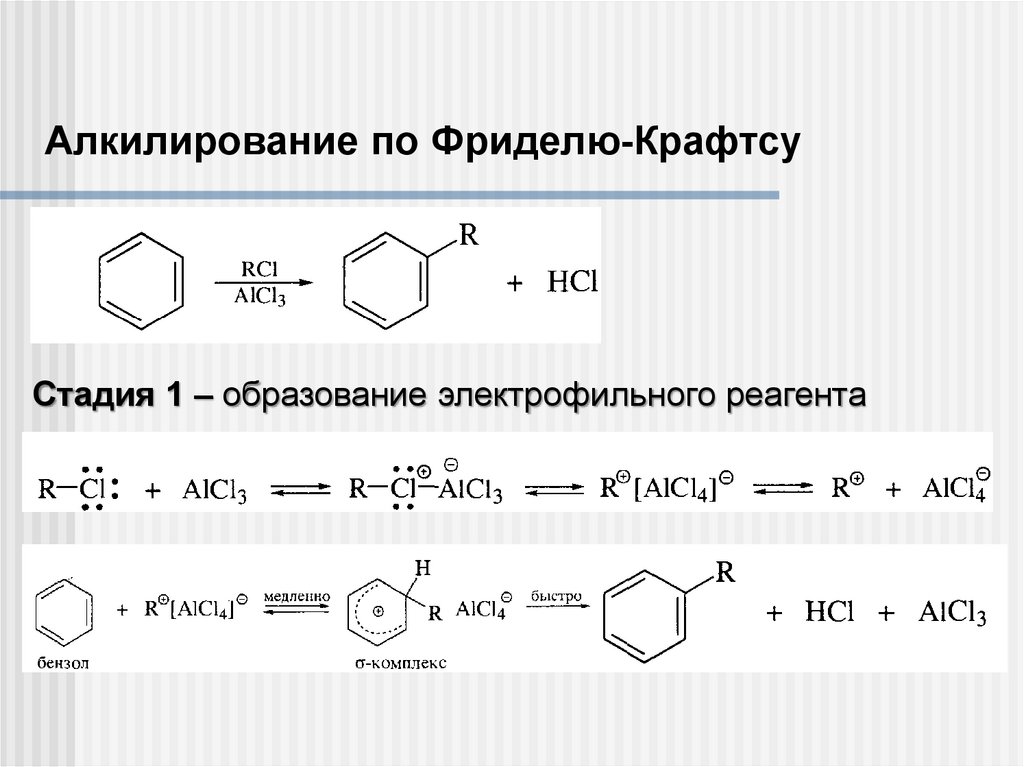
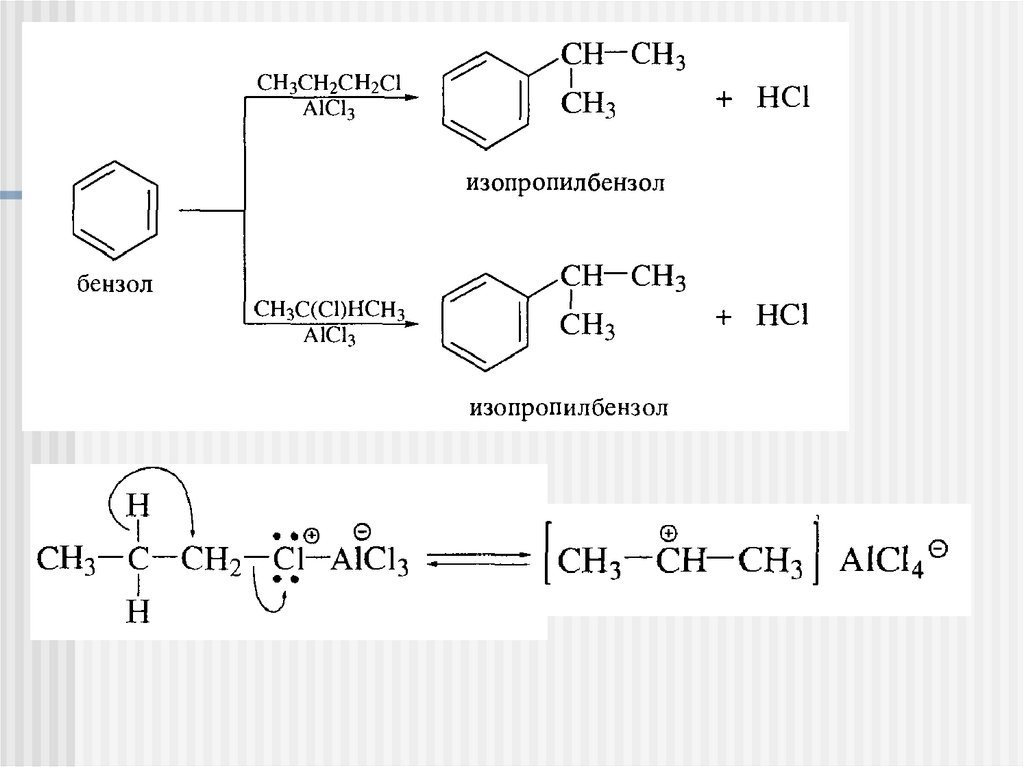
Алкилирование по Фриделю-КрафтсуСтадия 1 – образование электрофильного реагента
20.
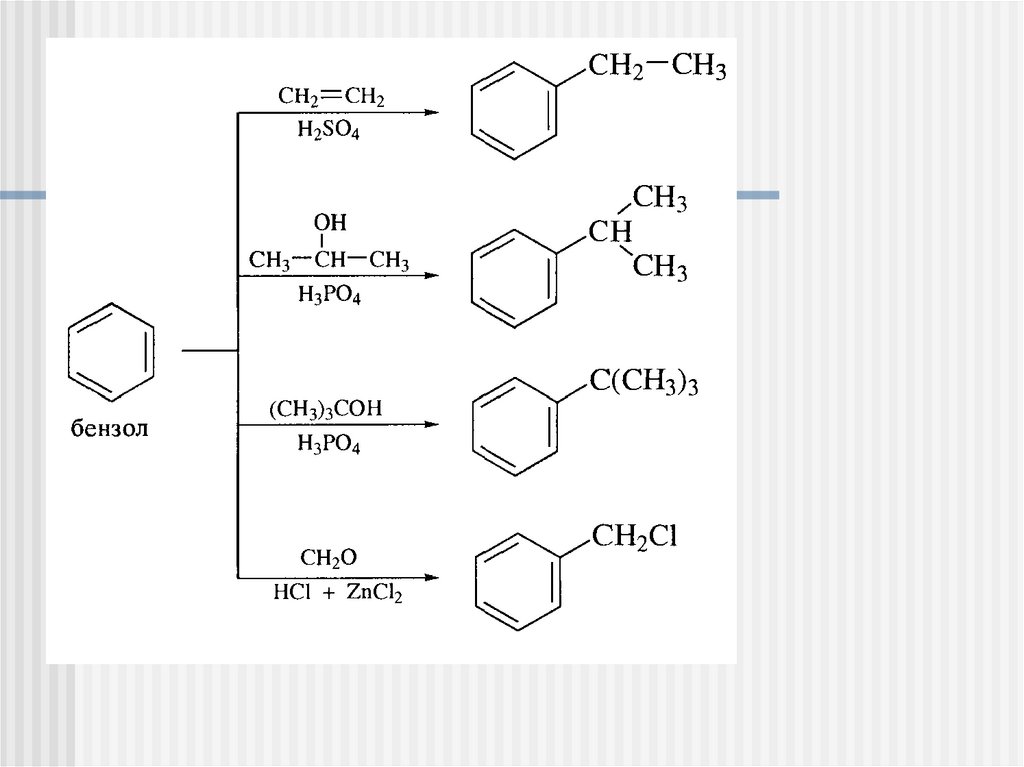
21.
22.
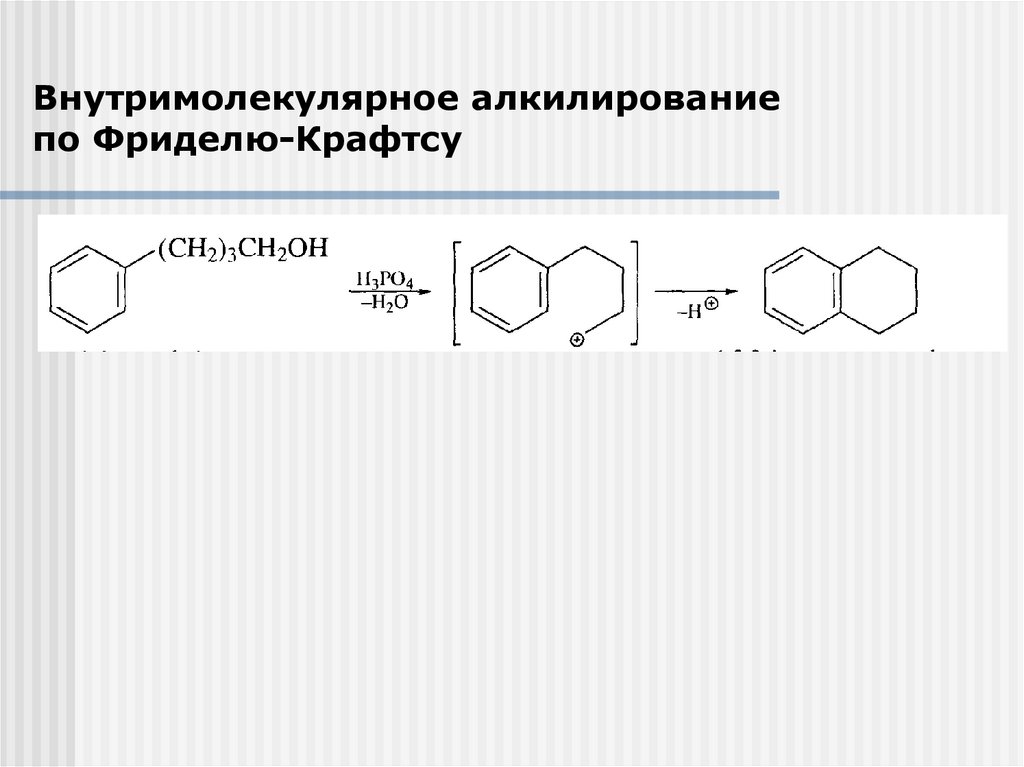
Внутримолекулярное алкилированиепо Фриделю-Крафтсу
23.
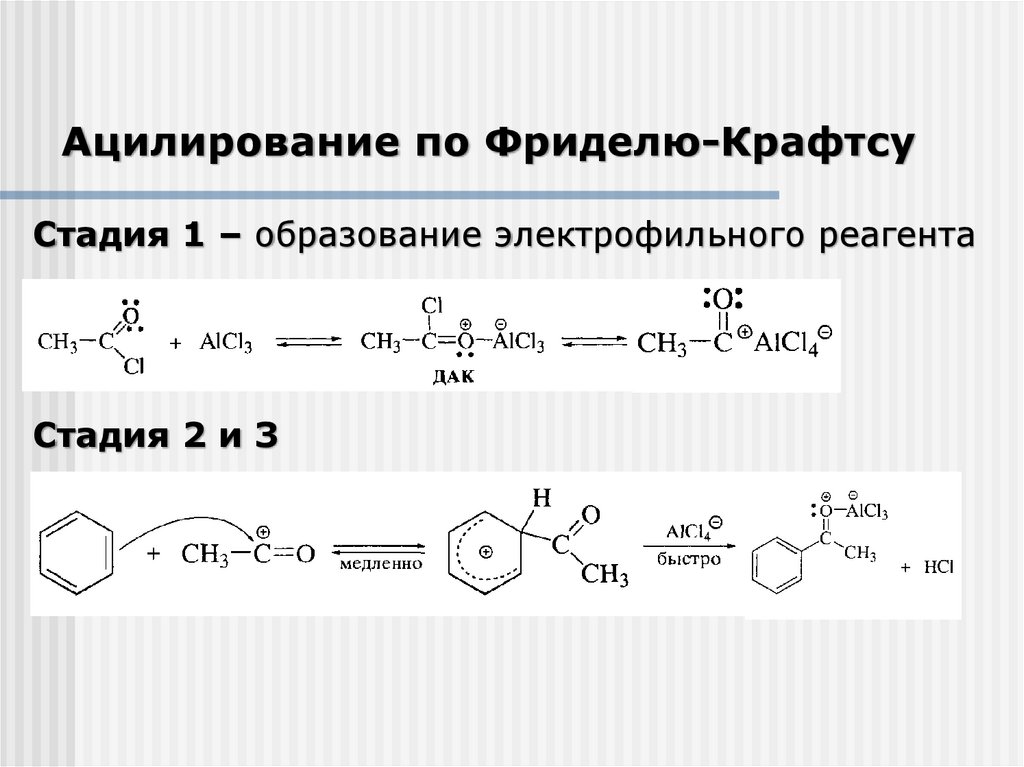
Ацилирование по Фриделю-КрафтсуСтадия 1 – образование электрофильного реагента
Стадия 2 и 3
24.
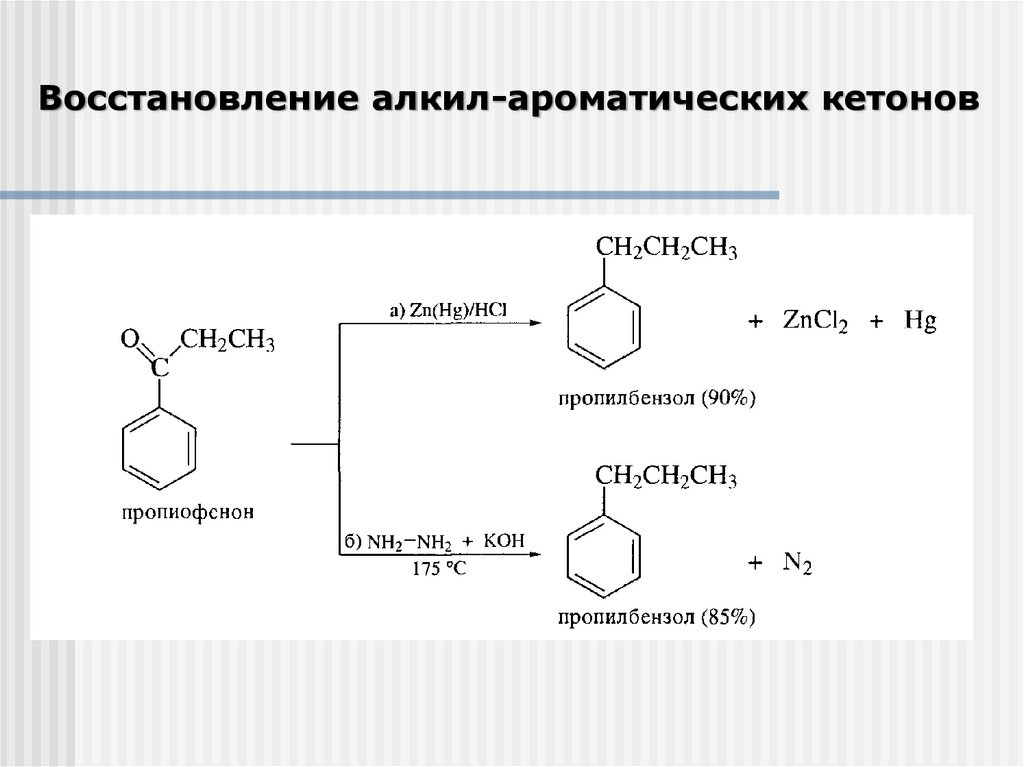
Восстановление алкил-ароматических кетонов25.
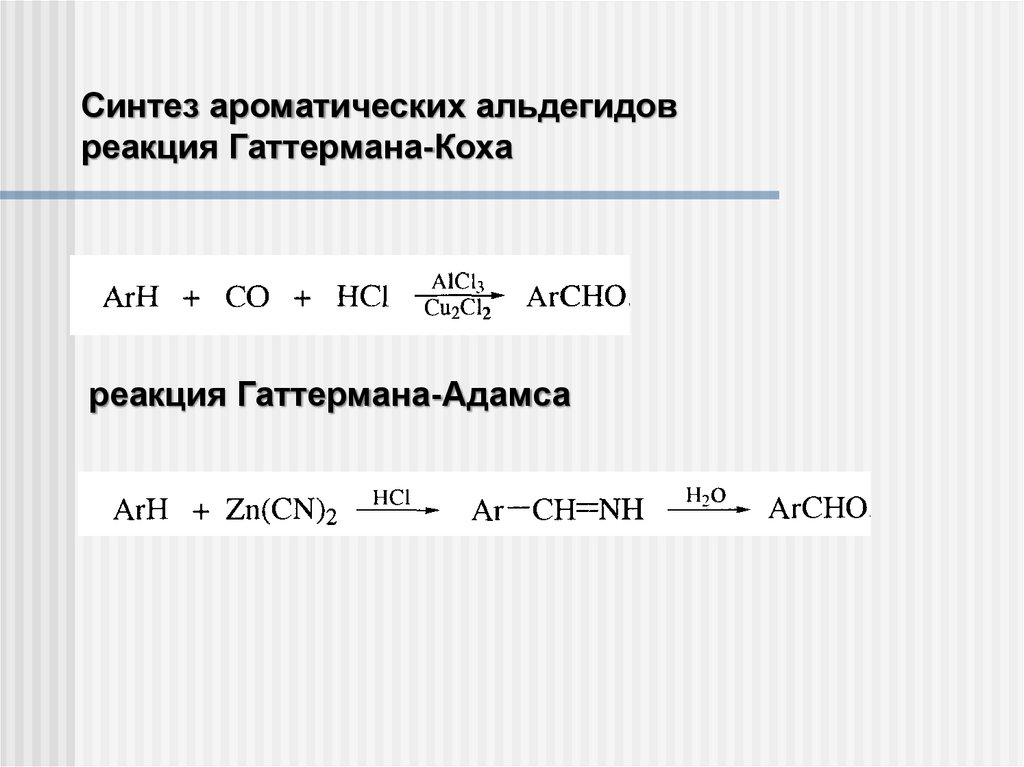
Синтез ароматических альдегидовреакция Гаттермана-Коха
реакция Гаттермана-Адамса
26.
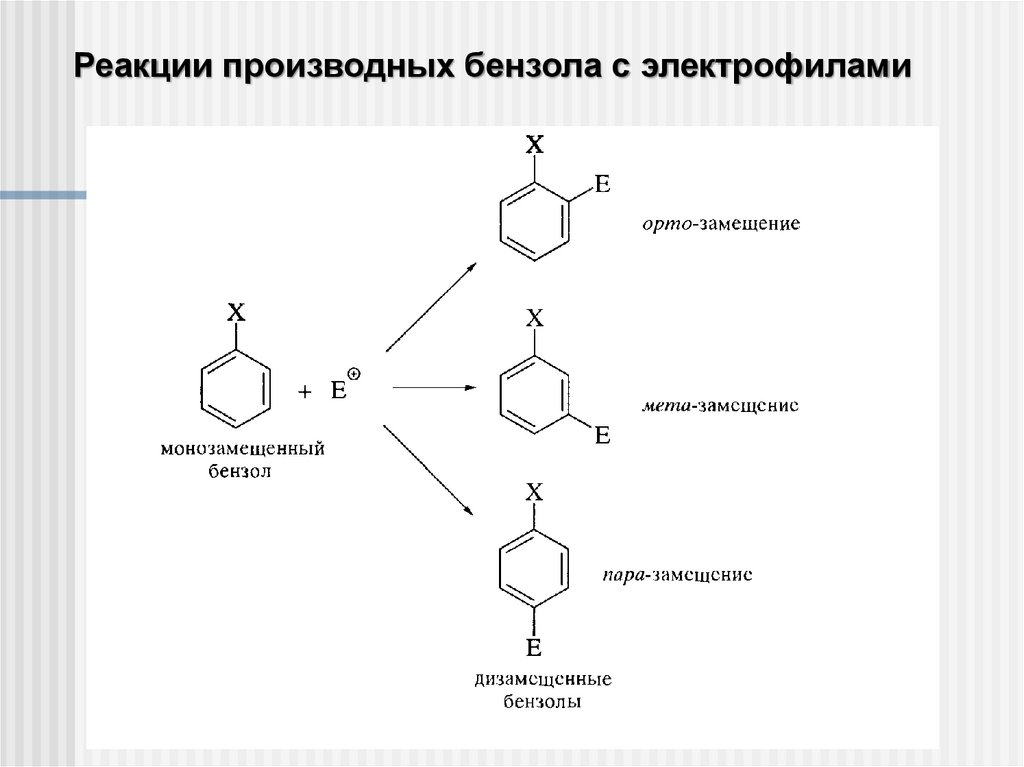
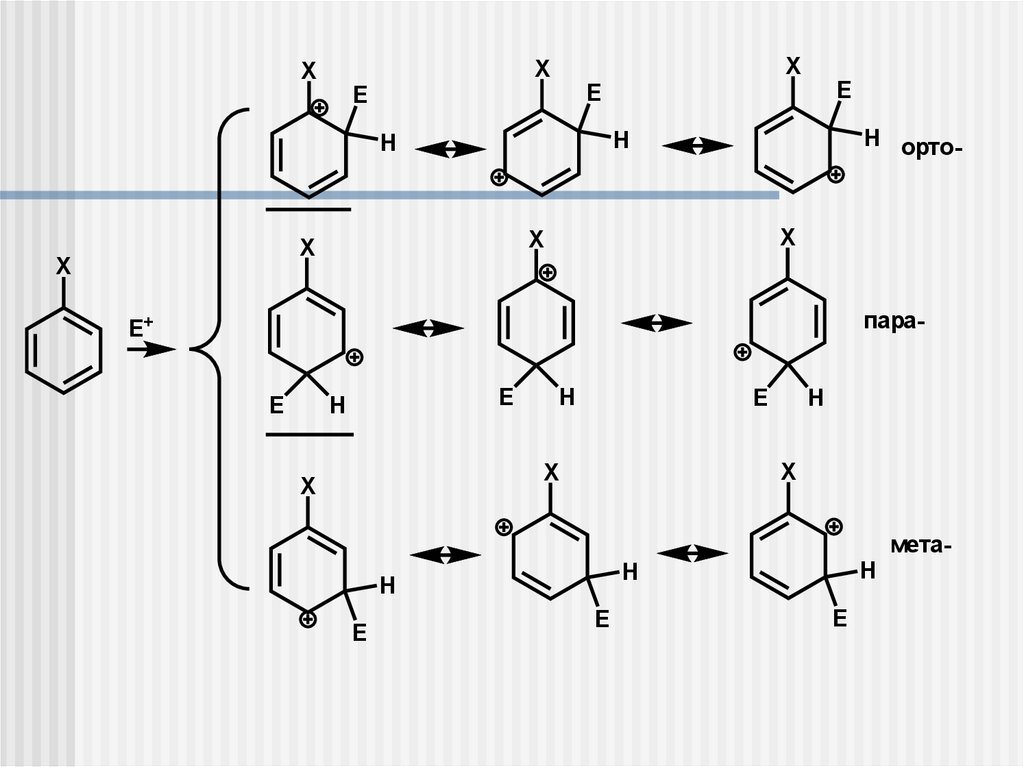
Реакции производных бензола с электрофилами27.
XX
X
H орто-
H
H
X
X
X
X
E
E
E
пара-
E+
E
E
H
H
E
X
X
X
H
мета-
E
H
H
H
E
E
28.
29.
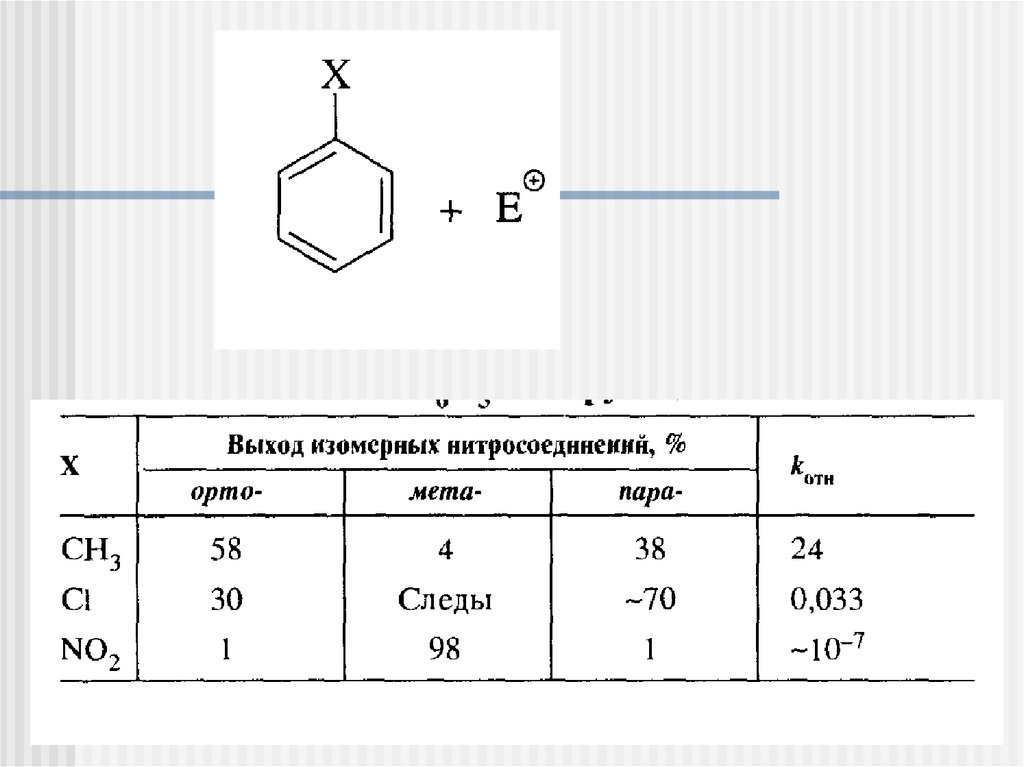
Влияние заместителей на реакционнуюспособность и ориентацию электрофильного
замещения
Заместители I рода – электронодонорные,
активирующие группы, орто- и пара-ориентанты:
-NH2, - NHR, - NR2, -OH
-OCH3, -OR, -NHCOR
-CH3
- C6H5, -- CH = CH2
- F, -Cl, -Br, -I
+M>> -I
+M> -I
+I
+M> -I
- I> +M
сильно активируют
умеренно активируют
слабо активируют
слабо активируют
слабо дезактивируют (ЭАЗ)
30.
Заместители II рода – электроноакцепторные,дезактивирующие группы, мета-ориентанты:
- С ≡ N, -CHO, -COR, -COOH,
-COOR, -SO3H
-CF3, CCl3
-NO2
-I, -M
умеренно дезактивируют
-I
сильно дезактивируют
-I, -M сильно дезактивируют
31.
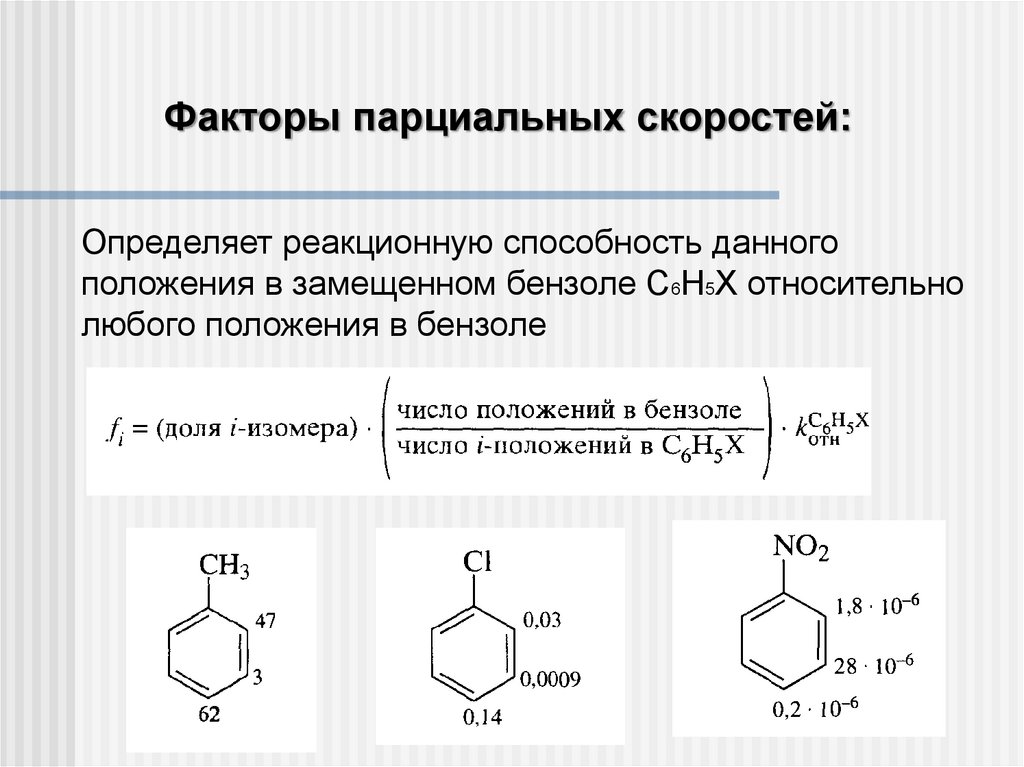
Факторы парциальных скоростей:Определяет реакционную способность данного
положения в замещенном бензоле С6Н5X относительно
любого положения в бензоле
32.
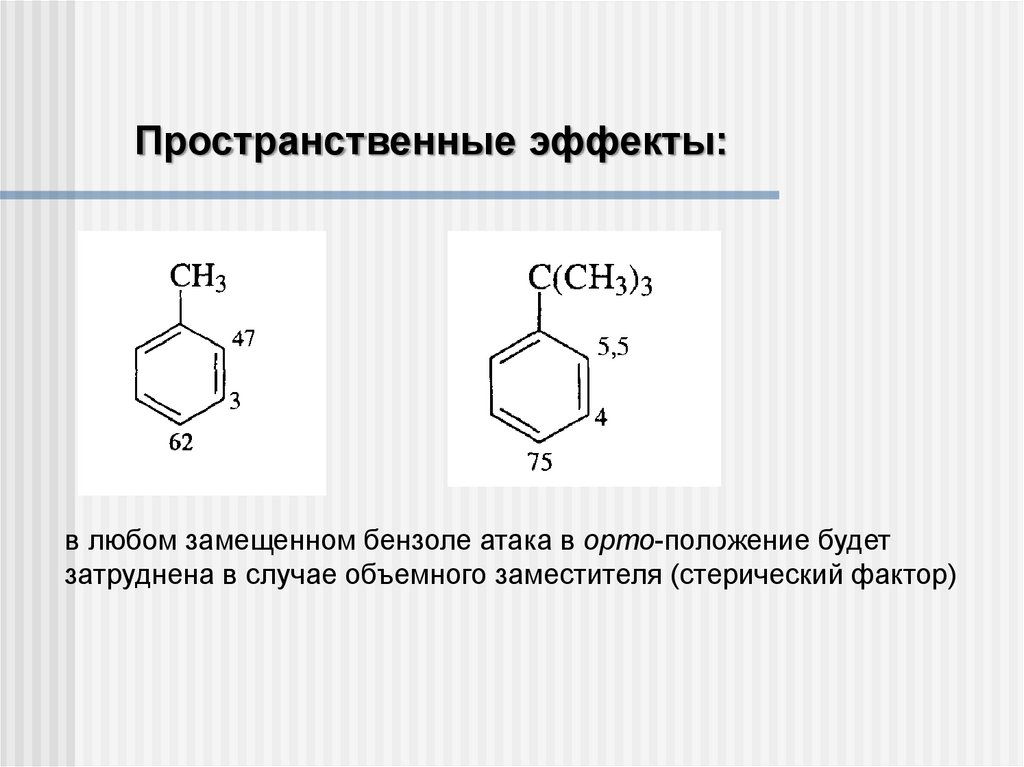
Пространственные эффекты:в любом замещенном бензоле атака в орто-положение будет
затруднена в случае объемного заместителя (стерический фактор)
33.
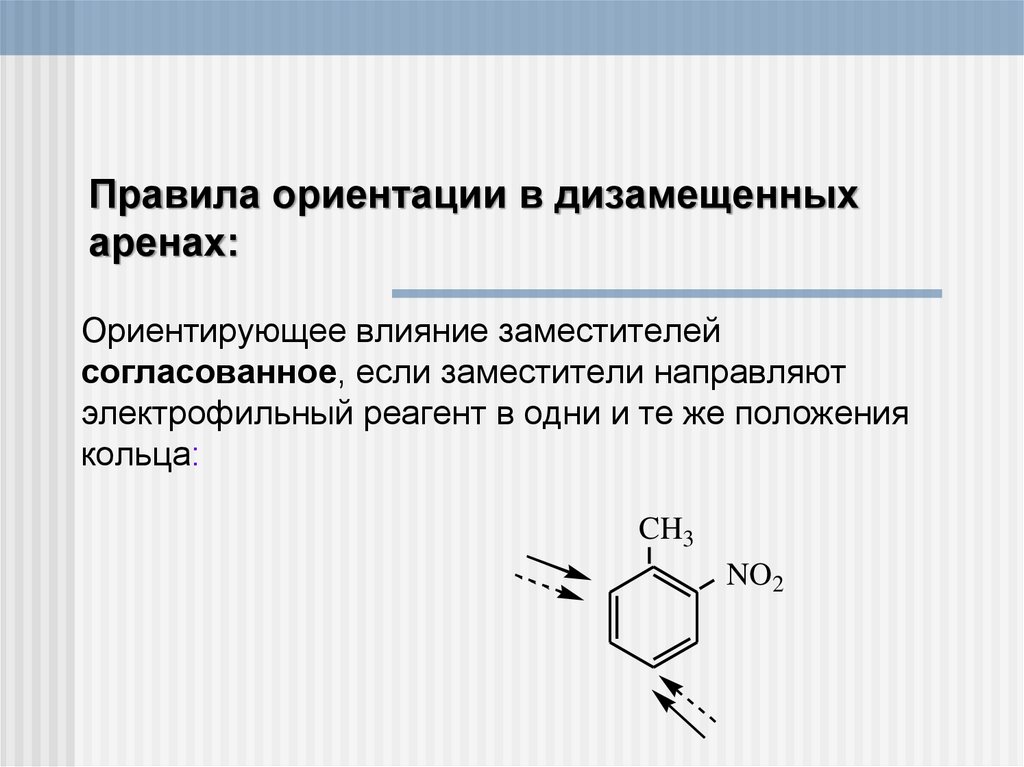
Правила ориентации в дизамещенныхаренах:
Ориентирующее влияние заместителей
согласованное, если заместители направляют
электрофильный реагент в одни и те же положения
кольца:
CH3
NO2
34.
Несогласованная ориентация заместителей:1.
Орто-, пара-ориентанты доминируют над мета-ориентантами;
2. Все активирующие орто- и пара-ориентанты доминируют над
галогенами;
3. Сильно и умеренно активирующие орто- и пара-ориентанты
доминируют над умеренно активирующими;
4. Атакующий электрфил, как правило, не замещает водород в
кольце между двумя заместителями, находящимися в мета –
положении относительно друг друга (стерические препятствия);
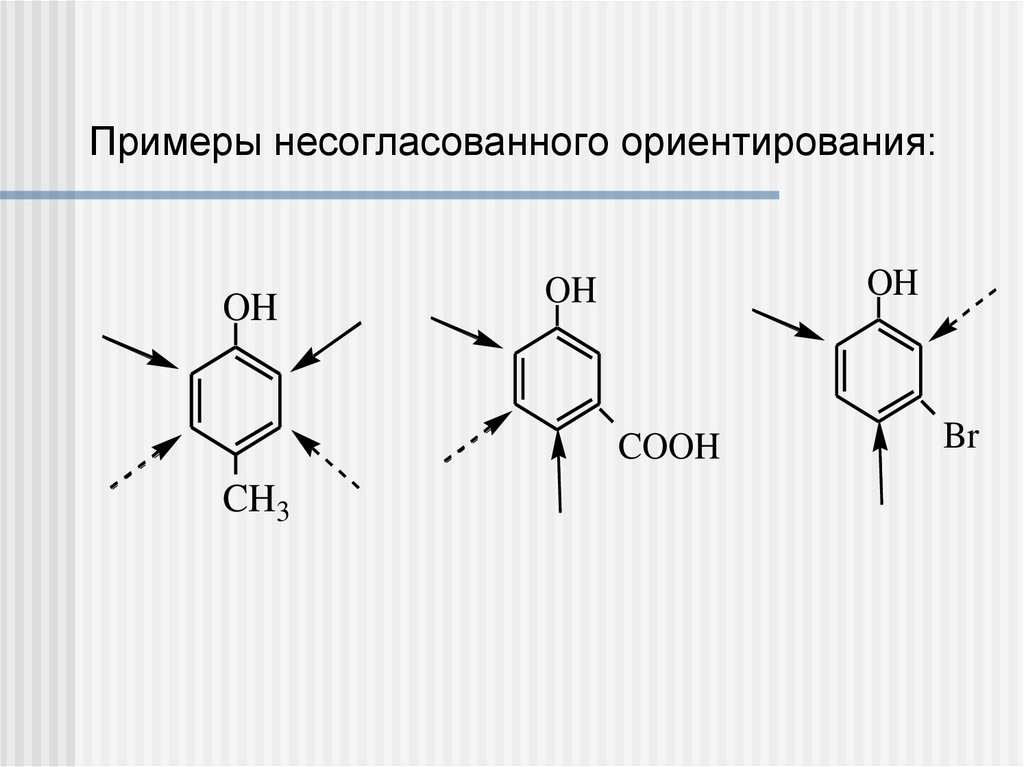
35.
Примеры несогласованного ориентирования:OH
OH
OH
COOH
CH3
Br
36.
Реакции электрофильного замещения, которые могут протекать только сароматическими субстратами, не менее реакционноспособными, чем
хлорбензол:
1. Реакции Фриделя-Крафтса (алкилирование, ацилирование)
2. Реакции с карбокатионами, генерируемыми тем или иным способом
3. Реакции формилирования (Гаттермана-Адамса и Гаттермана-Коха)
Реакции нитрования, сульфирования, хлорирования и бромирования
могут происходить с практически любыми ароматическими субстратами
Вывод:
1. Практически сложно провести селективно реакцию алкилирования
(реакционная способность продукта выше, чем у исходного бензола)
2. Реакции ацилирования и формилирования могут приводить только к продуктам
монозамещения (реакционная способность продукта гораздо ниже, чем у исходного
бензола)
37.
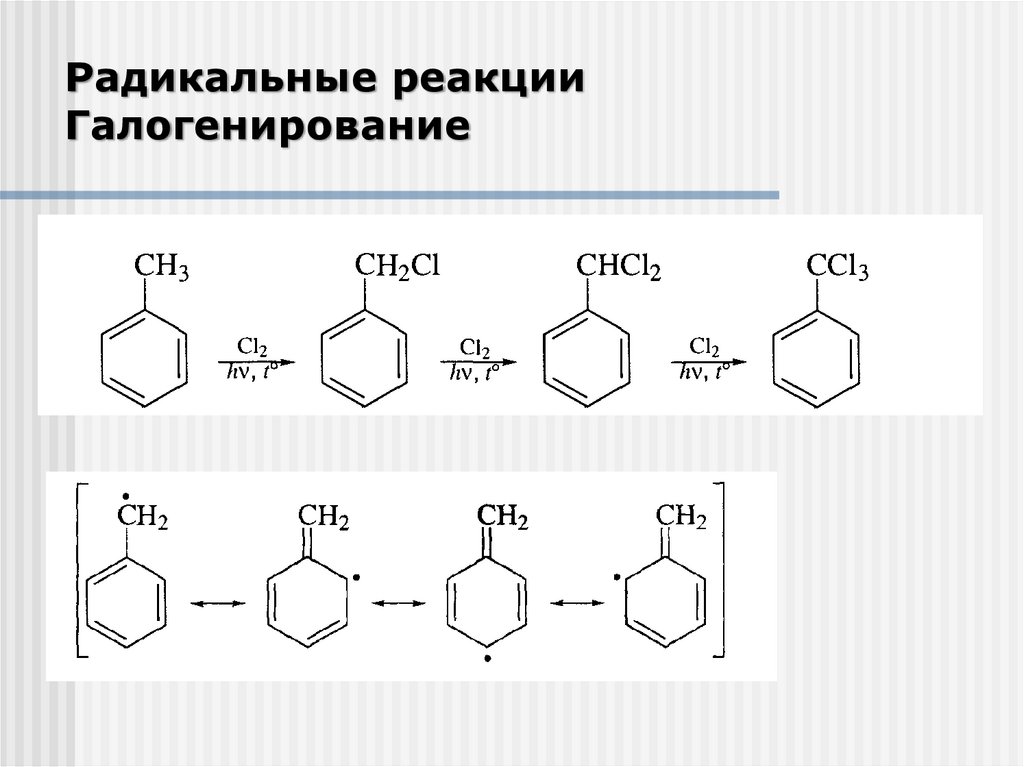
Алкилбензолы38.
Радикальные реакцииГалогенирование
39.
Нитрование40.
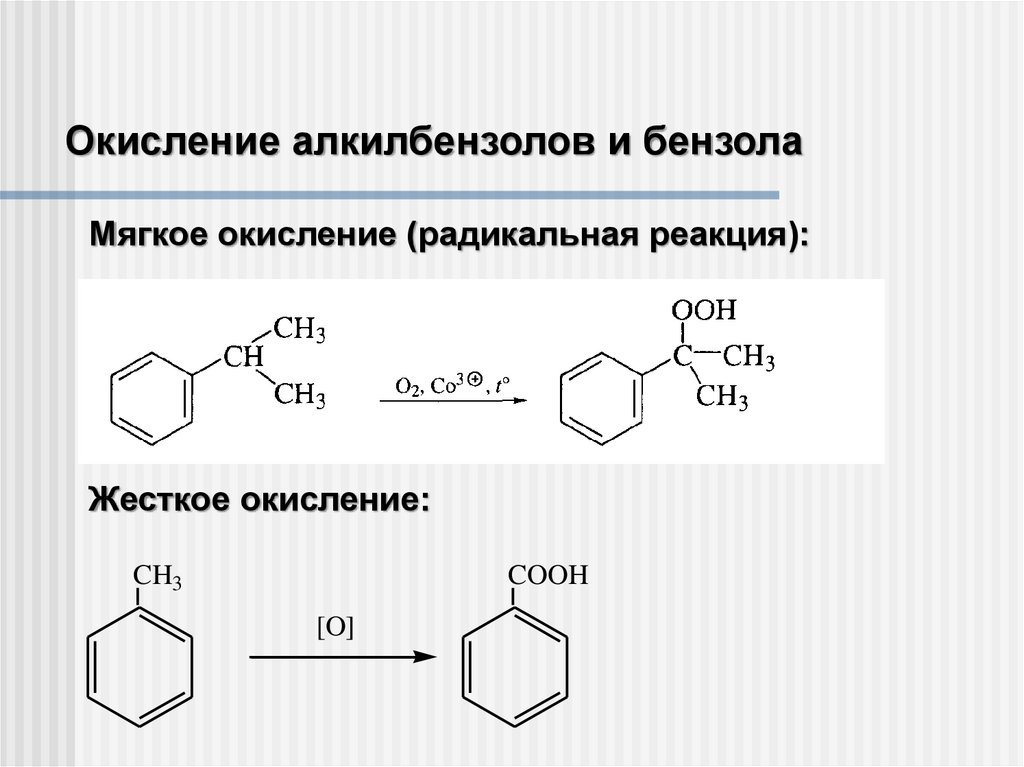
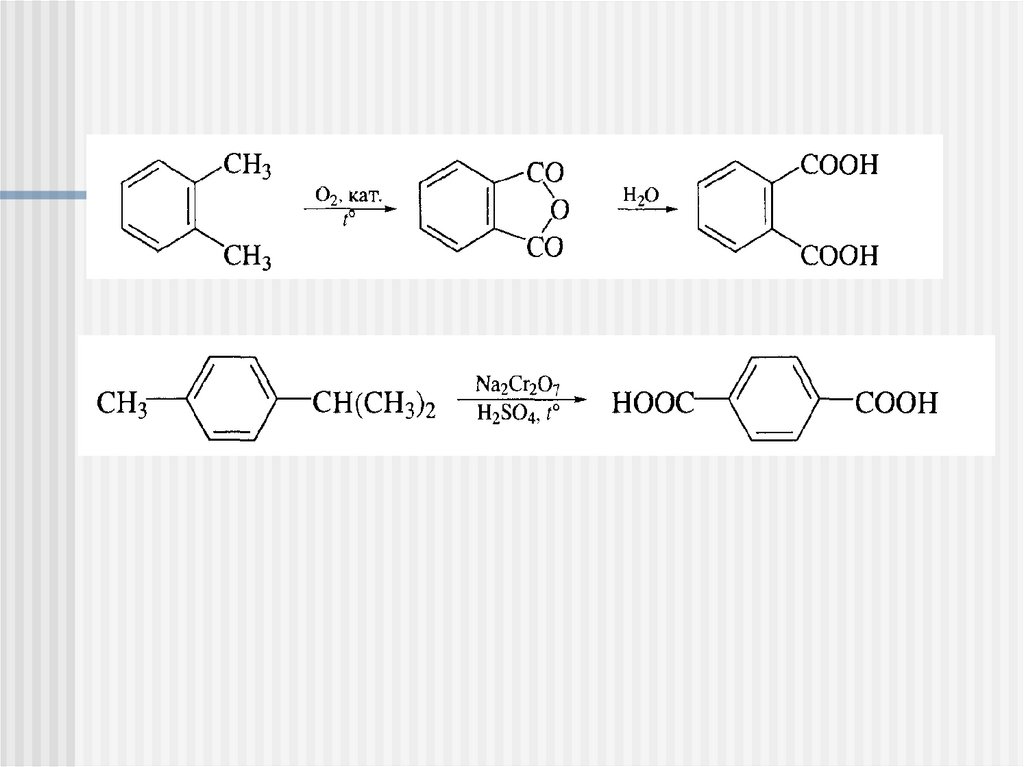
Окисление алкилбензолов и бензолаМягкое окисление (радикальная реакция):
Жесткое окисление:
CH3
COOH
[O]
41.
42.
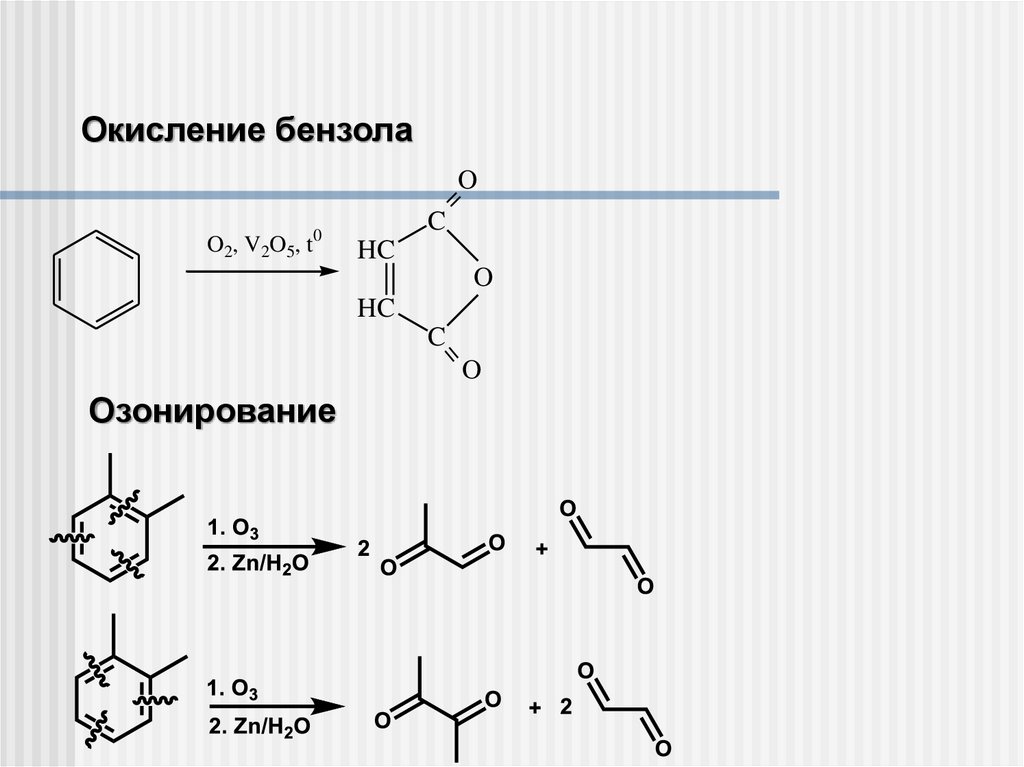
Окисление бензола=
O
O2, V2O5, t
0
C
HC
O
HC
C
=
Озонирование
O
43.
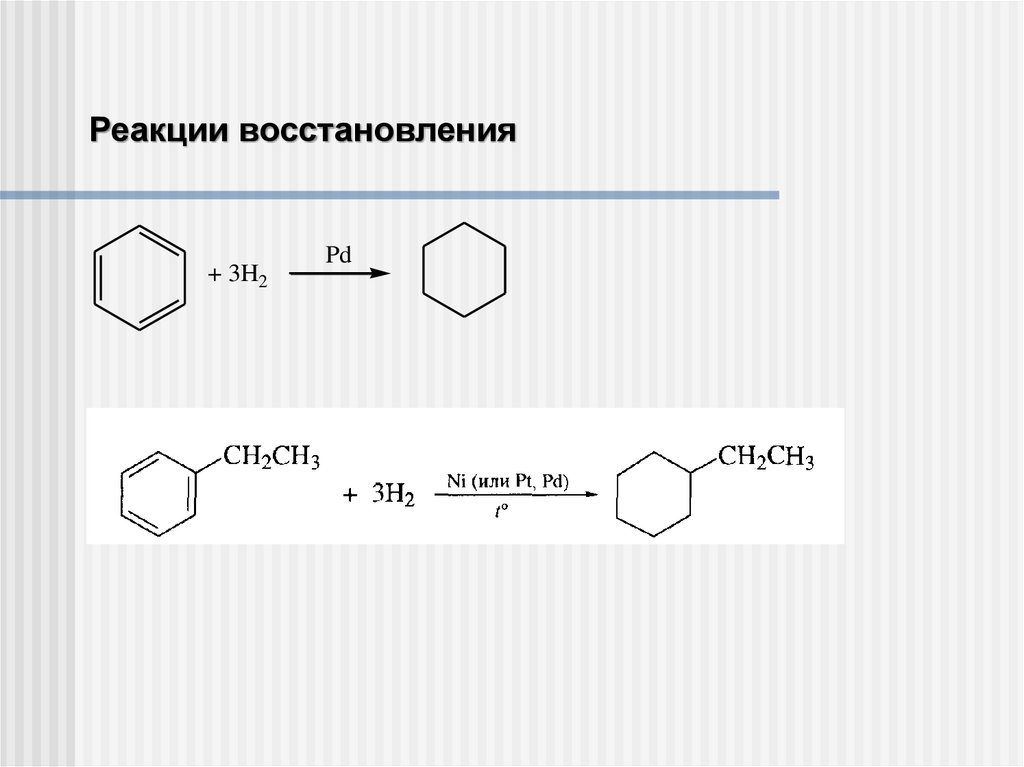
Реакции восстановления+ 3H2
Pd
44.
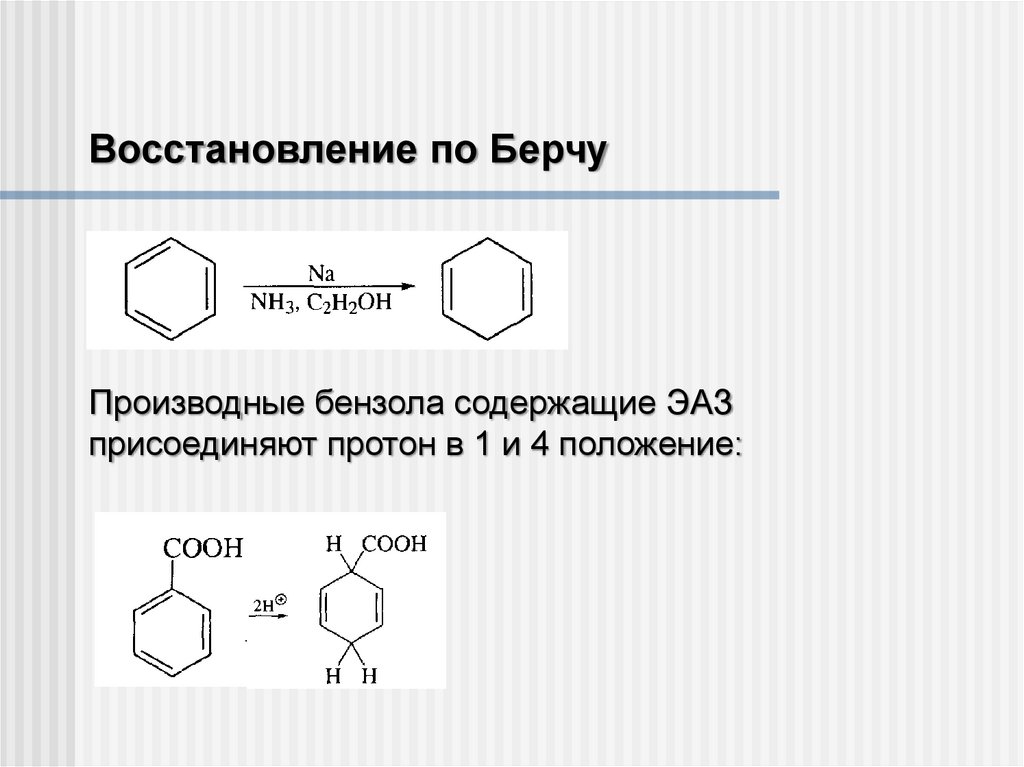
Восстановление по БерчуПроизводные бензола содержащие ЭАЗ
присоединяют протон в 1 и 4 положение:
45.
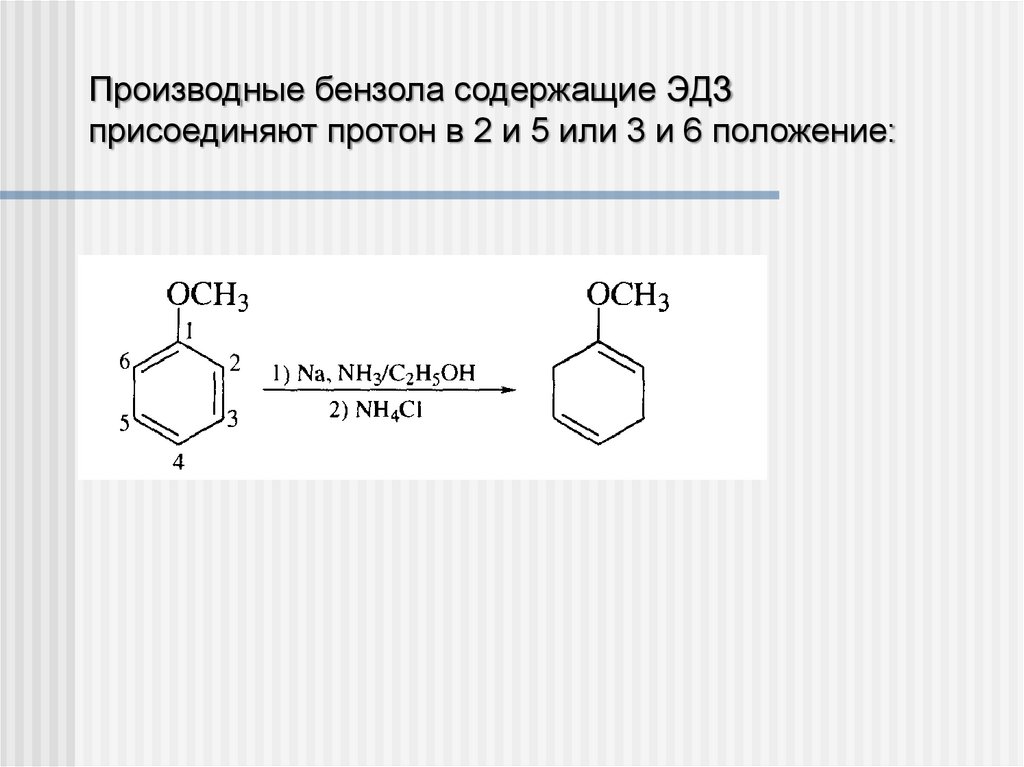
Производные бензола содержащие ЭДЗприсоединяют протон в 2 и 5 или 3 и 6 положение:
46.
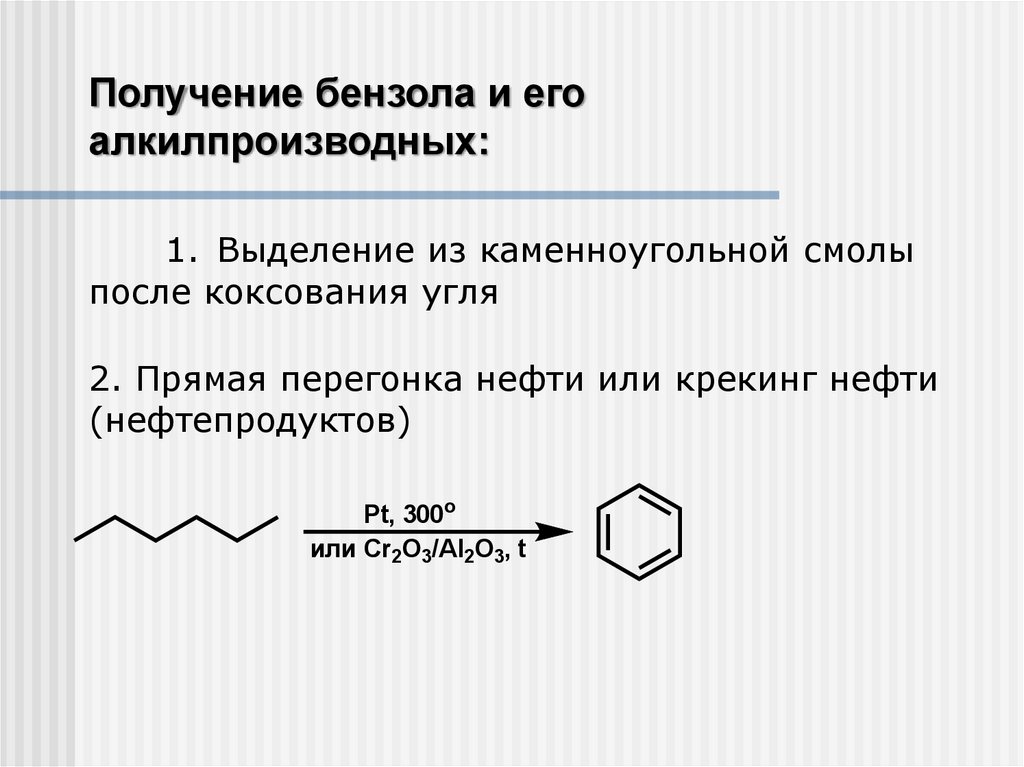
Получение бензола и егоалкилпроизводных:
1. Выделение из каменноугольной смолы
после коксования угля
2. Прямая перегонка нефти или крекинг нефти
(нефтепродуктов)
Pt, 300o
или Cr2O3/Al2O3, t
47.
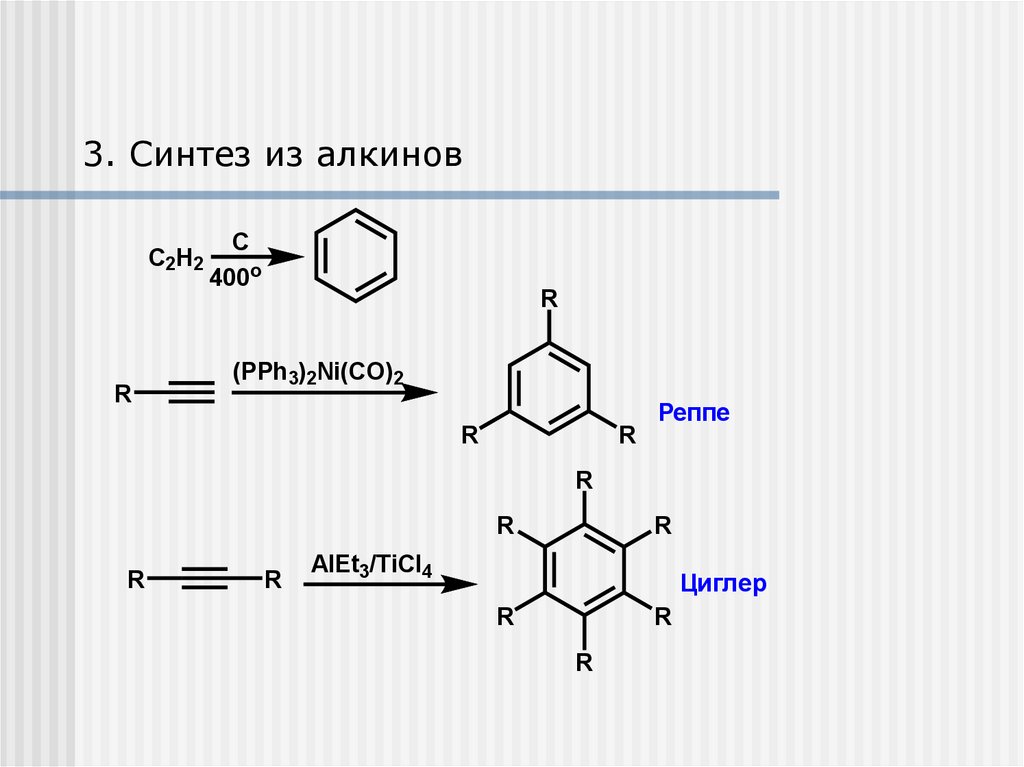
3. Синтез из алкиновC2H2
R
C
400o
R
(PPh3)2Ni(CO)2
R
R
Реппе
R
R
R
R
R
AlEt3/TiCl4
Циглер
R
R
R
48.
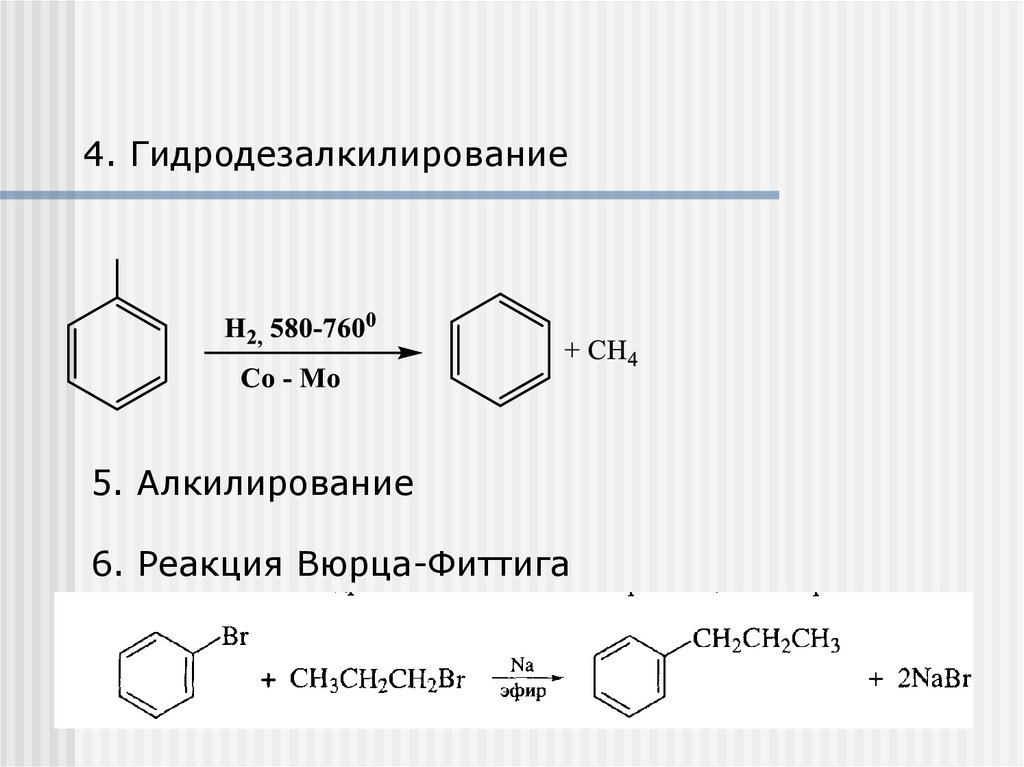
4. Гидродезалкилирование5. Алкилирование
6. Реакция Вюрца-Фиттига








 Химия
Химия