Похожие презентации:
Непредельные углеводороды ряда ацетилена (алкины). Состав и строение
1.
Непредельные углеводороды ряда ацетилена (алкины). Состав истроение
Алкинами называются углеводороды, в молекулах которых два атома углерода находятся в
состоянии sp-гибридизации и связаны друг с другом тройной связью. Общая формула
гомологического ряда алкинов — CnH2n-2 при n 2. Простейший представитель — ацетилен C2H2.
sp-Гибридные орбитали
атома углерода
НСН = 1800
Пространственная структура
молекулы ацетилена
Длина связи углерод-углерод в молекуле
ацетилена — 0,121 нм, энергия — 838,3 кДж/моль.
Изомерия: строение углеродной цепи и положение тройной связи. Алкины
изомерны диенам. По рациональной номенклатуре алкины называют как производные ацетилена:
По систематической – заменяя суффикс -ан в названиях алканов на
суффикс -ин: C2H2 – этин (ацетилен), C3H4 – пропин, C4H6 – бутин
и т. д. Правила составления названий ацетиленовых
углеводородов разветвленного строения аналогичны HC C CH CH3
соответствующим правилам для алкенов:
CH3
3-метилбутин-1
При составлении названий углеводородов, содержащих двойную
и тройную связи, предпочтение при выборе направления нумерации
цепи отдается двойной:
HC C CH3
метилацетилен
H3 C C C CH3
диметилацетилен
H3 C CH C C CH3
CH3
4-метилпентин-2
CH2 C CH2 C CH
CH3
2-метилпентен-1-ин-4
2.
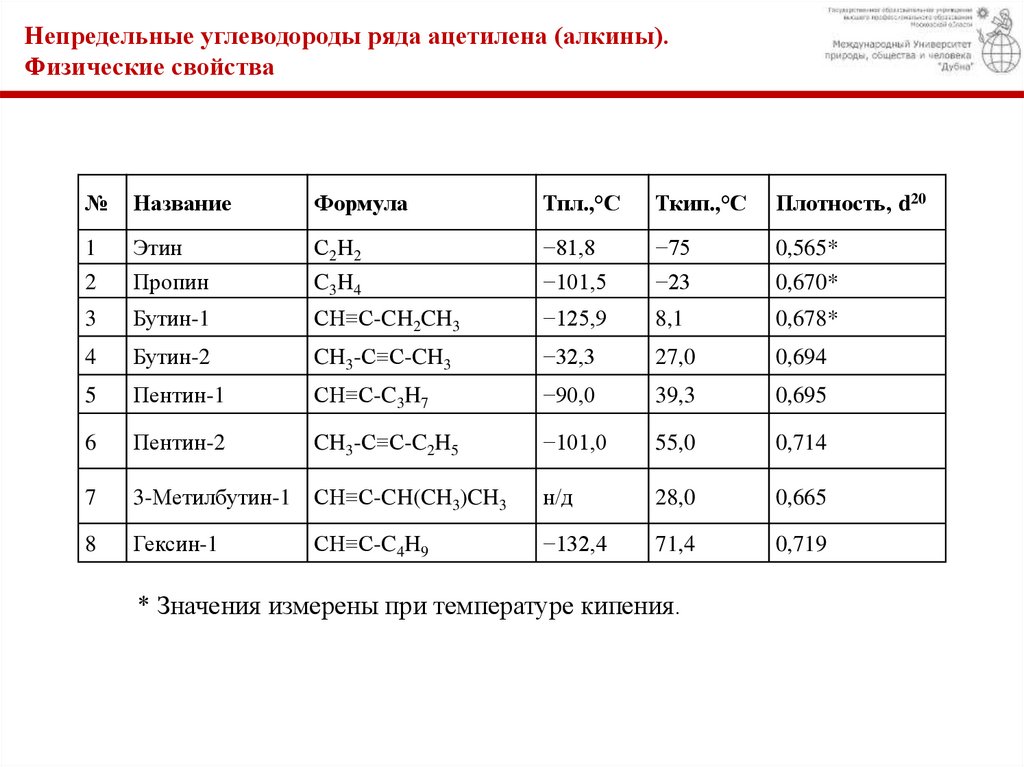
Непредельные углеводороды ряда ацетилена (алкины).Физические свойства
№
Название
Формула
Тпл.,°С
Ткип.,°С
Плотность, d20
1
2
Этин
Пропин
С2H2
C3H4
−81,8
−101,5
−75
−23
0,565*
0,670*
3
Бутин-1
CH≡C-CH2CH3
−125,9
8,1
0,678*
4
Бутин-2
CH3-C≡C-CH3
−32,3
27,0
0,694
5
Пентин-1
CH≡C-C3H7
−90,0
39,3
0,695
6
Пентин-2
CH3-C≡C-C2H5
−101,0
55,0
0,714
7
3-Метилбутин-1
CH≡C-CH(CH3)CH3
н/д
28,0
0,665
8
Гексин-1
CH≡C-C4H9
−132,4
71,4
0,719
* Значения измерены при температуре кипения.
3.
Непредельные углеводороды ряда ацетилена (алкины).Способы получения
1. Получение ацетилена.
1.1. Гидролиз карбида кальция.
3 C + CaO
2500 0C
2. Методы создания тройной связи.
2.1. Дегалогенирование дигалогеналканов.
H Br
CaC2 + CO
CaC2 + 2 H2O
C2H2 + Ca(OH)2
CH3 CH2 C C CH3
H Br
1.2. Пиролиз алканов.
2 CH4
2 CH4
1500 0C
C2H2 + 3 H2
электрический разря д
C2H6
1200 0C
C2H2 + 3 H2
C2H2 + 2 H2
+NaOH(спирт)
NaBr, H2O
CH3 CH2 C C CH3
2.2. Взаимодействие ацетиленидов металлов с
первичными галогеналканами.
CH3 I
+ Na C CH
CH3 C CH + NaI
4.
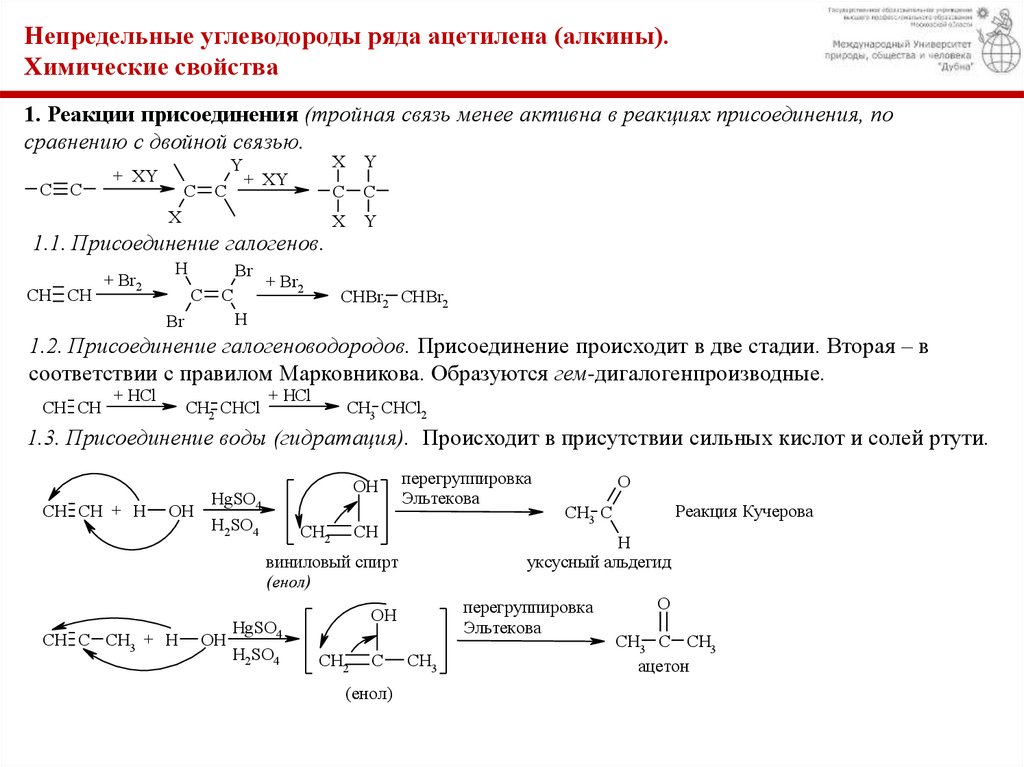
Непредельные углеводороды ряда ацетилена (алкины).Химические свойства
1. Реакции присоединения (тройная связь менее активна в реакциях присоединения, по
сравнению с двойной связью.
C
C
Y
+ XY
C
C
+ XY
X
1.1. Присоединение галогенов.
CH CH
+ Br2
H
Br
C
C
+ Br2
Y
C
C
X
Y
CHBr2 CHBr2
H
Br
X
1.2. Присоединение галогеноводородов. Присоединение происходит в две стадии. Вторая – в
соответствии с правилом Марковникова. Образуются гем-дигалогенпроизводные.
CH CH
+ HCl
CH2 CHCl
+ HCl
CH3 CHCl2
1.3. Присоединение воды (гидратация). Происходит в присутствии сильных кислот и солей ртути.
CH CH + H
OH
HgSO4
OH
H2SO4
CH2
перегруппировка
Эльтекова
CH
OH
HgSO4
H2SO4
перегруппировка
Эльтекова
OH
CH2
C
(енол)
Реакция Кучерова
CH3 C
H
уксусный альдегид
виниловый спирт
(енол)
CH C CH3 + H
O
CH3
O
CH3 C CH3
ацетон
5.
Непредельные углеводороды ряда ацетилена (алкины).Химические свойства
1.4. Присоединение водорода. Протекает при повышенной температуре (~ 150 оС) в присутствии
катализаторов гидрирования (Pd, Pt, Ni). Тройная связь гидрируется легче двойной.
R
C
CH
+ H2
кат., t
R
CH
CH2
+ H2
кат., t
R
CH2 CH3
1.5. Реакции винилирования.
CH
C
R + R'OH
KOH, давл.
CH2 C
R
OR'
R'OH
R'SH
R'2NH
CH
C
R
R'COOH
R'CONH2
HCN
CH2 C
R Простые виниловые эфиры
CH2
OR'
C R Винилсульфиды
CH2
SR'
C R Виниламины (енамины)
CH2
NR'2
C R Сложные виниловые эфиры
OCOR'
CH2 C R N-виниламиды
CH2
NHCOR'
C R Замещенные акрилонитрилы
CN
Протекают под действием
солей ртути (II) и меди (II).
Спирты и тиолы могут
присоединяться в присутствии
твердого едкого кали.
6.
Непредельные углеводороды ряда ацетилена (алкины).Химические свойства
1.6. Карбонилирование ацетилена.
CH + CO + HX
HC
O
Ni(CO)4
CH2 CH C
где X = OH, OR, NH2, NHR
X
2. Кислотные свойства
Csp 2,6 < Csp 2,8 < Csp 3,2 Орбитальная электроотрицательность
Стабильность карбаниона
CH3 CH2 < CH2 CH < CH C
CH3 CH3 < CH2 CH2 < CH CH
Кислотность соединения
2
3
CH CH + NaH2
R
C
NH3(ж.)
CH + NaH2
CH CNa + NH3
ацтиленид натрия
NH3(ж.)
R C CNa + H2O
R
C
CH + CH3 MgBr
R
C
CH + [Ag(NH3)2]OH
R
C
CNa + NH3
R C CH + NaOH
CH3 C
C
MgBr + CH4
R
C
C
Ag + 2NH3 + H2O
осадок белого цвета
R
C
CH + [Cu(NH3)2]Cl
Cu + NH3 + NH4Cl
осадок красно-бурого
цвета
R
C
C
Качественные реакции на
концевую тройную связь
7.
Непредельные углеводороды ряда ацетилена (алкины).Химические свойства
3. Реакции окисления
3.1. Горение
2 C2H2 + 5 O2
4 CO2 + 2 H2O
3.2. Неполное окисление под влиянием перманганата калия, бихромата натрия, озона.
O
HC
CH + 4 [O]
O
C
C
HO
R
C
C
R'
[O], H2O
OH
O
R
O
+ R'
C
OH
C
OH
Концевая метиновая группа окисляется в оксид углерода (II):
R
C
CH
[O], H2O
O
R
+ CO2
C
OH
Обесцвечивание раствора перманганата калия – качественная реакция на алкины.
8.
Непредельные углеводороды ряда ацетилена (алкины).Химические свойства
4. Реакции олигомеризации.
4.1. Образование линейных олигомеров.
CH + HC
HC
3 HC
CH
CuCl, H+
CH
NH4Cl
CuCl, H+
NH4Cl
CH2 CH C CH
винилацетилен (димер)
CH2 CH C C CH CH2
дивинилацетилен (тример)
4.2. Образование циклических олигомеров.
3 HC
400 0C
C
CH
бензол
4 HC
CH
Ni(CN)2, 600C, давл.
циклооктатетраен
H3 C
C
CH
CH3
металлоорганические
соединения Cr, Ni, Co
H3 C
CH3
1,3,5-триметилбензол
9.
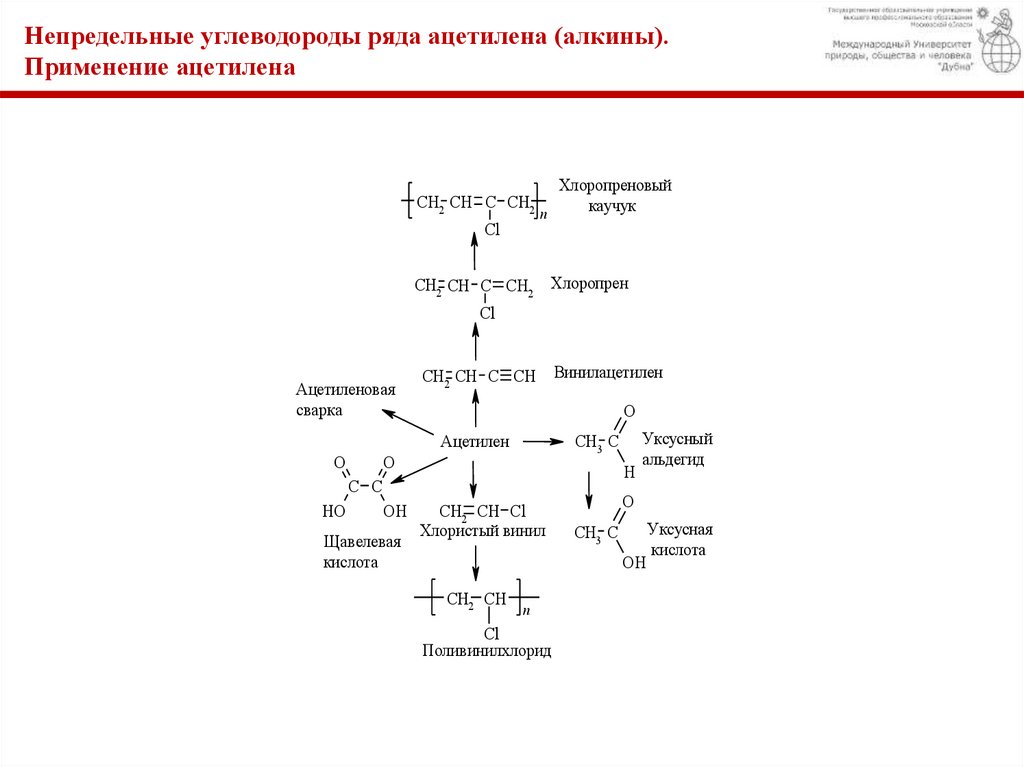
Непредельные углеводороды ряда ацетилена (алкины).Применение ацетилена
CH2 CH C CH2
Cl
Хлоропреновый
каучук
n
CH2 CH C CH2 Хлоропрен
Cl
Ацетиленовая
сварка
CH2 CH C CH Винилацетилен
O
Ацетилен
O
CH3 C
O
H
C C
HO
OH
Щавелевая
кислота
CH2 CH Cl
Хлористый винил
Уксусный
альдегид
O
CH3 C
OH
CH2 CH
n
Cl
Поливинилхлорид
Уксусная
кислота






 Химия
Химия








