Похожие презентации:
Молекулярная физика
1.
МОЛЕКУЛЯРНАЯФИЗИКА
2.
Изучает физические свойства иагрегатные состояния тел в
зависимости от их молекулярного строения, сил взаимодействия между частицами, характера
теплового движения.
3.
МЕТОДЫТермодинамический
•основан на опыте;
•состоит в изучении свойств
тел путем анализа условий и
количественных соотношений превращения энергии;
•оперирует макроскопическими измеряемыми
величинами: давлением ,
объемом, температурой .
Молекулярно кинетический
•основан на статистических
закономерностях;
•оперирует величинами,
усредненными для
большого количества
частиц: средней
скоростью, средней
энергией.
4.
P, V, T –термодинамические
параметры
5.
Атомная массаАтомная единица массы (а.е.м.) - это 1/12
12
массы атома изотопа углерода 6 C .
Относительная атомная масса вещества
выражается в а.е.м.
m0
M ат 1
12 m0 C
Масса атома (г)
Масса атома 126 С (г)
6.
Количество вещества1 моль — это количество вещества, в котором
содержится столько же атомов, сколько их в
12 г углерода 126 С .
Количество атомов в 1 моле равно числу
Авогадро:
N A 6, 02 10 , моль
23
1
Количество вещества найдем по формуле:
N
NA
7.
Молярная массаМолярная масса М - это масса одного
моля вещества в граммах.
M m0 N A
Молярная масса равна выраженной в
граммах относительной атомной массе .
m
M
8.
Состояния и процессыСостояние характеризуется набором ТД-параметров.
Если все параметры имеют определенные значения,
состояние равновесное.
Процесс сопровождается изменением ТД-параметров.
Равновесный процесс – это медленный переход
между равновесными состояниями.
Если какой-то параметр не изменяется, то процесс
называют изопроцессом.
9.
ИДЕАЛЬНЫЙ ГАЗ•Размеры молекул пренебрежимо малы;
•Молекулы не взаимодействуют;
•Столкновения – упругие.
10.
Экспериментальные газовые законыдля данной массы газа
1. Закон Бойля-Мариотта для
изотермического процесса.
T = const.
PV const.
11.
2. Закон Шарля для изохорногопроцесса.
V const.
P P0 (1 t )
1 0 1
( C)
273
1
P P0 t
T t 273
Т – абсолютная температура
12.
P PT0
P
P0
T
P
P
const.
T
T
13.
3. Закон Гей-Люссака для изобарногопроцесса.
P const.
V V0 (1 t )
V
V
const.
T
T
14.
4. Закон Авогадро1 киломоль любого газа занимает
при одинаковых условиях
одинаковый объем.
При нормальных условиях
(t 0 C , P 10 Па) :
0
5
VкМ 22,4 м / кМ
3
15.
5. Закон ДальтонаДавление смеси газов равно
сумме парциальных давлений.
P Pi
i
Pi
парциальные давления
(каждого газа в отдельности)
16.
Уравнение состояния газаp1V1 p2Vпр
Vпр V2
T T
2
1
p1V1
p2V2
Vпр
Vпр
T1
T2
p1V1 p2V2
T1
T2
pV
const .
T
17.
Для одного моля газаpV
R
T
R - универсальная газовая постоянная
Дж
R 8,31
моль К
Для молей газа
pV
R
T
18.
УравнениеМенделеева — Клапейрона
pV RT
19.
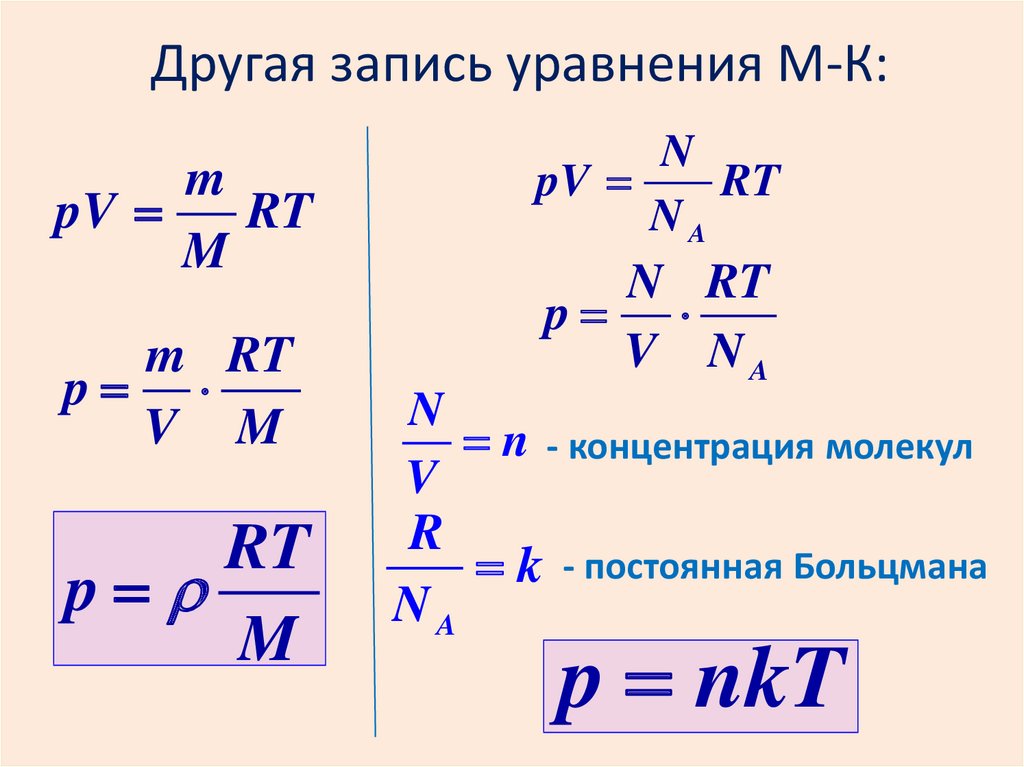
Другая запись уравнения М-К:m
pV
RT
M
m RT
p
V M
RT
p
M
N
pV
RT
NA
N RT
p
V NA
N
n - концентрация молекул
V
R
k
NA
- постоянная Больцмана
p nkT
20.
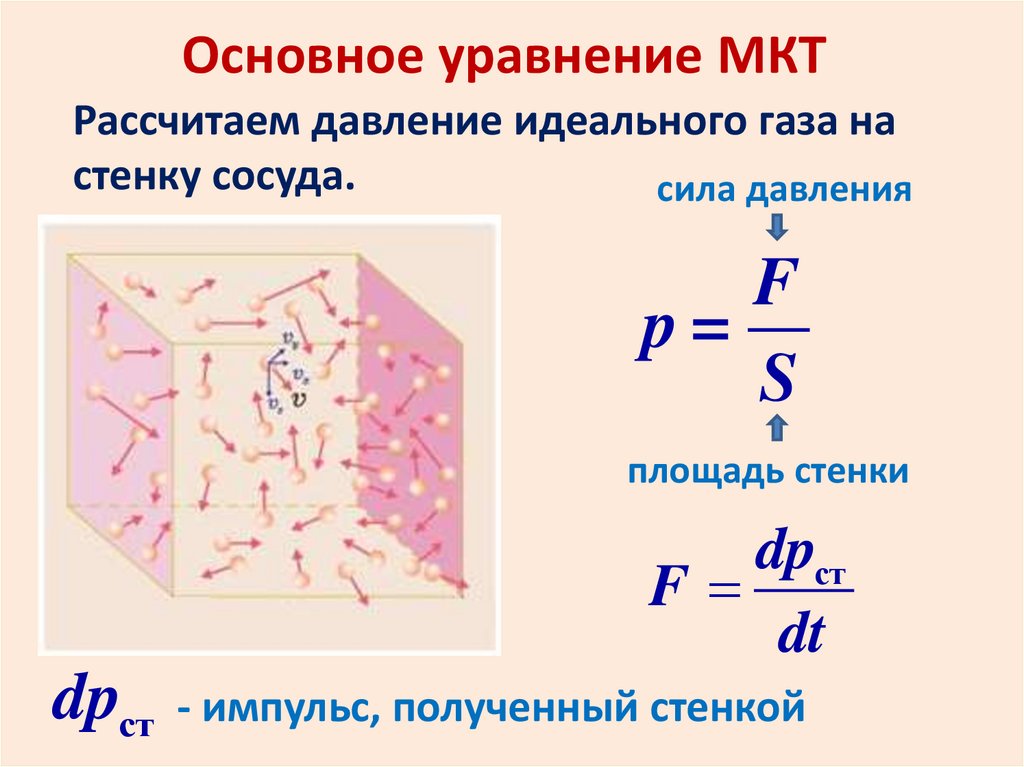
Основное уравнение МКТРассчитаем давление идеального газа на
стенку сосуда.
сила давления
F
p=
S
площадь стенки
dpст
F
dt
dpст
- импульс, полученный стенкой
21.
У куба 6 граней. Пусть к каждой гранидвижется 1/6 часть всех молекул со
средней скоростью <v>.
y
v
x
z
22.
Изменение импульса одной молекулы:dp p2 p1 m0v m0v 2m0v
По закону сохранения импульса:
dp1,ст dp 2m0v
p1 m0v
p2 m0v
dp
dp1,ст 2m0 v
23.
За время dt со стенкой S столкнутся N молекул– те, что в объеме dV и летят вправо.
1
N ndV
6
dV S v dt
24.
Получим итоговую формулу длядавления:
F dpст N dp1,ст
p
S S dt
S dt
1
nS v dt 2m0 v
6
1
2
p nm0 v
3
S dt
25.
Умножим и поделим на 2:2 m0 v
p n
3
2
m0 v
2
2
2
Wk - средняя кинетическая энергия
поступательного движения молекул
Основное уравнение МКТ:
2
p n Wk
3
26.
Физический смысл абсолютнойтемпературы
2
p n Wk 2
3
n Wk nkT
3
p nkT
3
Wk kT
2
Абсолютная температура идеального газа - это
величина, прямо пропорциональная средней
кинетической энергии поступательного движения
его молекул.
27.
Средняя квадратичная скорость молекулv кв
m0 v
2
Wk
2
Wk
3
kT
2
v
2
v
2
m v 2
3
0
kT
2
2
3kT
m0
28.
v квv кв
3kTN A
m0 N A
v кв
3kT
m0
kN A R
m0 N A M
3 RT
M
29.
Степени свободы телаЧисло степеней свободы тела - это число
независимых координат, которые
необходимо задать для определения
положения тела в пространстве.
i 1
i 2
30.
Степени свободы жестких молекулi 3
He, Ar , Ne...
i 5
O2 , H 2 , N 2 ...
i 6
H 2O, CO2 , NH 3 ...
31.
Распределение энергии постепеням свободы
Wk
m0 v
3
kT
2
2
m0 v
2
2
x
2
x
m0 v
2
m0 v
2
2
y
2
y
m0 v
m0 v
2
z
2
2
z
2
На одну степень свободы приходится энергия
1
1 kT
2
32.
Энергия многоатомной молекулыWk
i
kT
2
i iпост iвр 2iколеб
33.
Внутренняя энергия идеального газаВнутренняя энергия идеального газа – это
кинетическая энергия движения его молекул.
i
i
U Wk N kT N A RT
2
2
i
U RT
2
i
U pV
2































 Физика
Физика








