Похожие презентации:
Поли- и гетерофункциональность, как причина появления специфических свойств у гидрокси-амино и кетокислот. (Лекция 11)
1.
ЛЕКЦИЯ 11ПОЛИ- И ГЕТЕРОФУНКЦИОНАЛЬНОСТЬ КАК ПРИЧИНА
ПОЯВЛЕНИЯ СПЕЦИФИЧЕСКИХ
СВОЙСТВ У ГИДРОКСИ- АМИНОИ КЕТОКИСЛОТ
2.
ПЛАН11.1.Стереоизомерия соединений
одним центром хиральности
с
11.2.Стереоизомерия
соединений
двумя центрами хиральности
с
11.3.Стереоизомерия
соединений
с
двойной связью (π-диастереоизомерия)
11.4.Реакционная способность гетерофункциональных соединений
3.
11.1. Стереоизомерия соединений содним центром хиральности
Атом углерода в sp3-гибридизации имеет
тетраэдрическую конфигурацию. Если из
4 заместителей, хотя бы 2 одинаковые, то
для такой молекулы существует плоскость
симметрии, если же все заместители
различные, то симметрия исчезает
4.
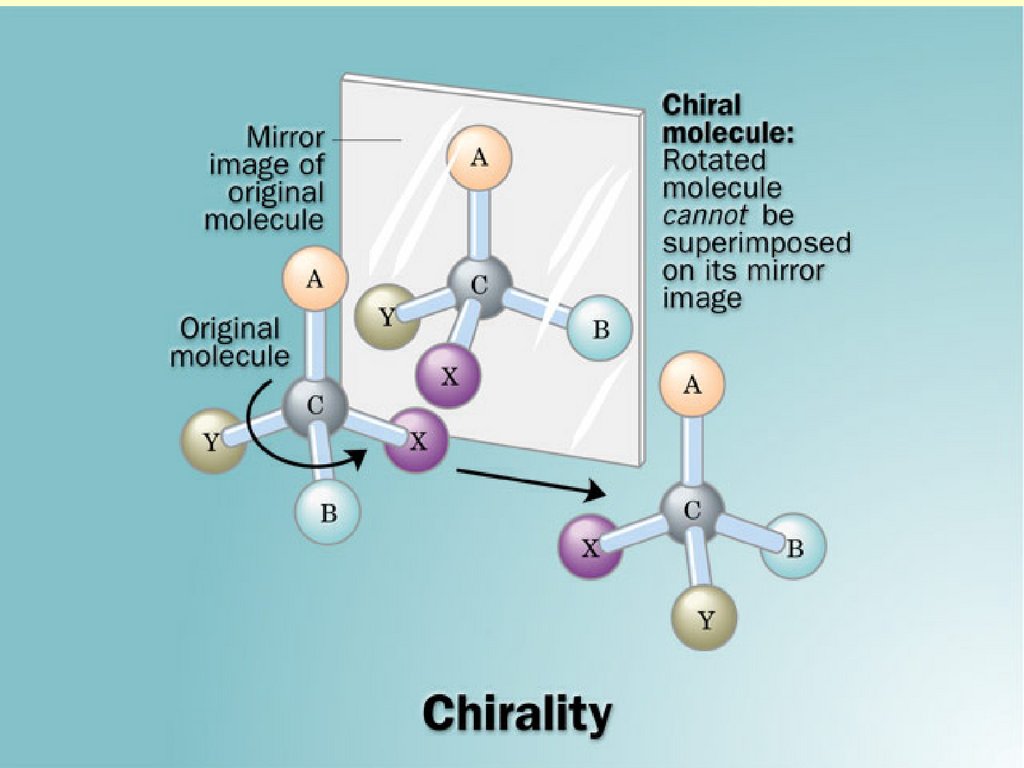
Это обстоятельство рождаетновое явление хиральность свойство молекулы
соединения не совмещаться со
своим зеркальным
отображением
5.
Хиральность присуща мируматериальных объектов - руки, левые и
правые спирали
Существует 2 типа соединений –
1-соединения, которые не могут быть
совмещены со своим зеркальным
отражением, хиральные
2- соединения, которые могут быть
совмещены со своим зеркальным
отражением - ахиральные
6.
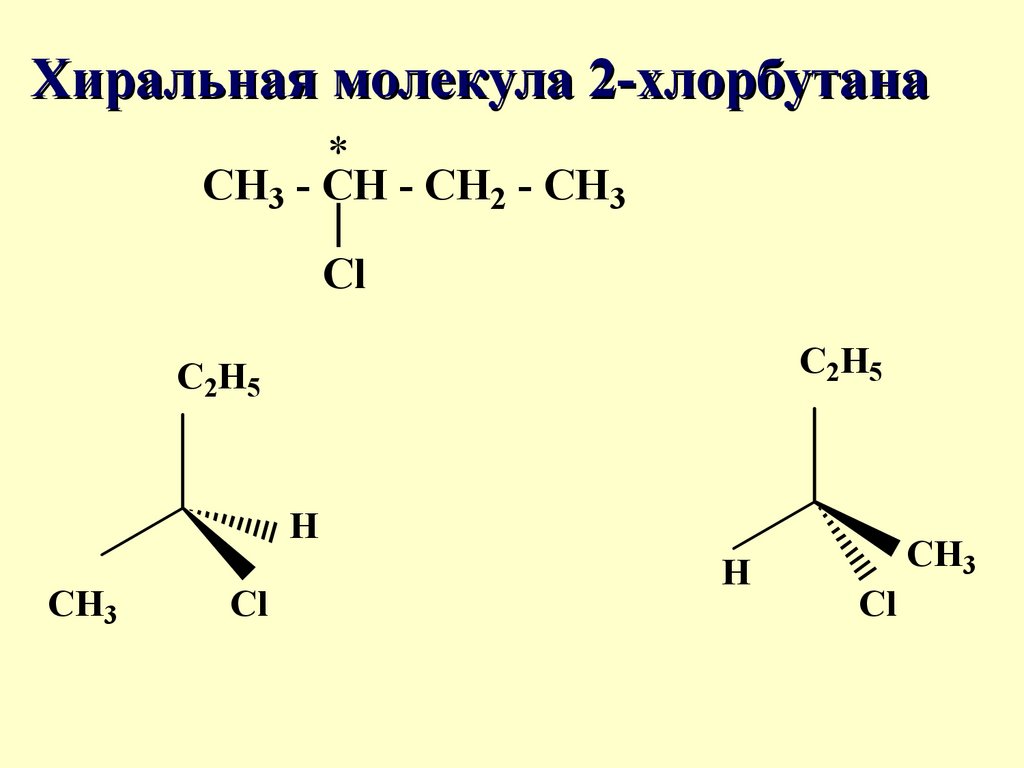
Хиральная молекула 2-хлорбутана*
CH3 - CH - CH2 - CH3
Cl
C2H5
C2H5
H
CH3
Cl
H
CH3
Cl
7.
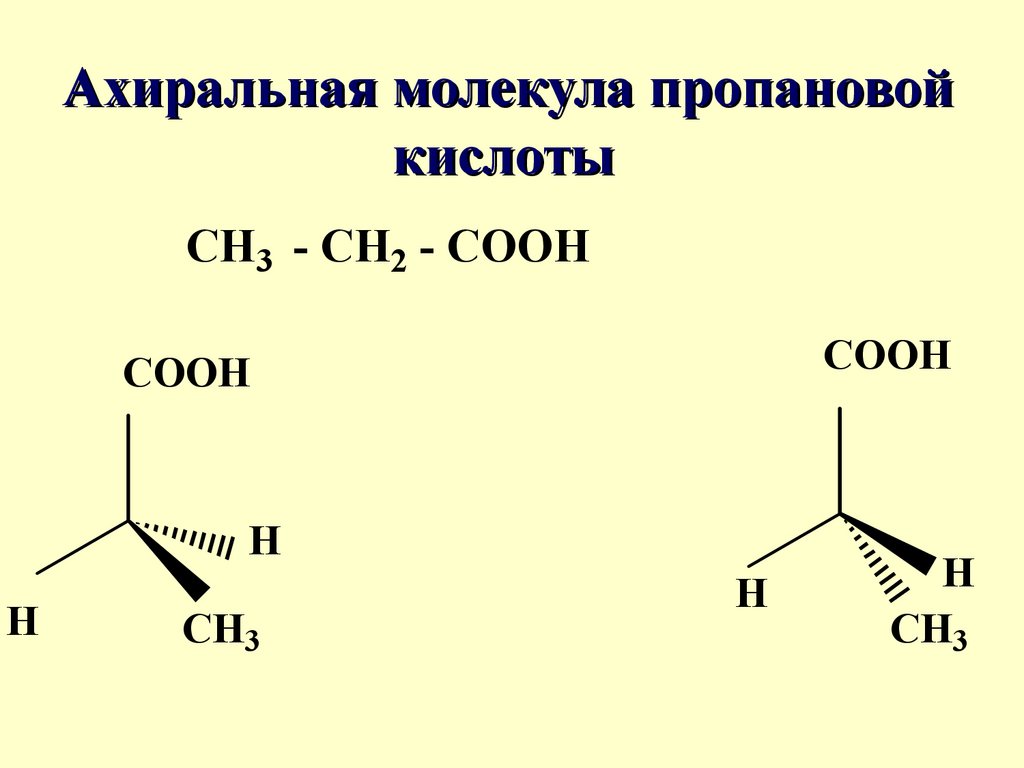
Ахиральная молекула пропановойкислоты
CH3 - CH2 - COOH
COOH
COOH
H
H
CH3
H
H
CH3
8.
Термин хиральность (отдревнегреческого «хир» - рука)
ввел английский физик Кельвин
в 1884 году для обозначения
объектов, которые подобно
правой и левой руке не
совмещаются друг с другом
9.
10.
11.
Простейший случайвозникновения хиральности наличие асимметрического атома
углерода - т.е. такого атома,
который связан с четырьмя
различными атомами или
группами
12.
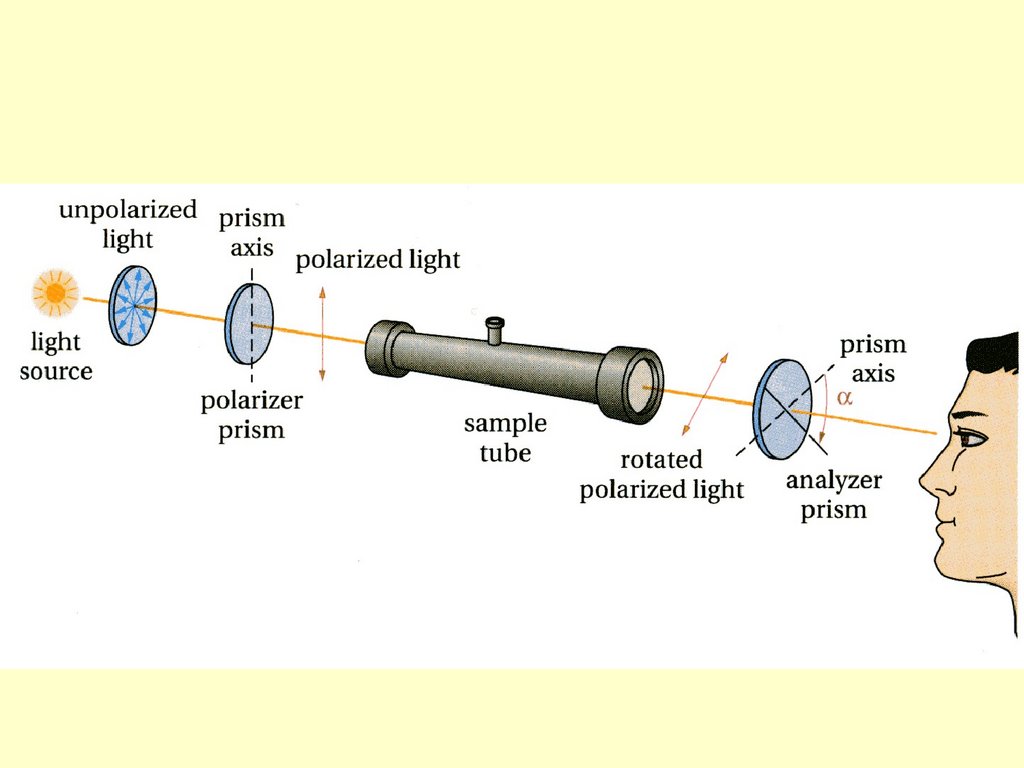
Характерное свойствохиральных соединений способность вращать
плоскость поляризации
поляризованного света.
Хиральные молекулы всегда
оптически активны
13.
14.
Геометрическое свойствомолекул - хиральность лежит
в основе деления конфигурационных и конформационных стереоизомеров на
энантиомеры и
диастереомеры
15.
Энантиомеры или оптическиеантиподы - это два хиральных
стереоизомера, которые
являются зеркальным
изображением друг друга
Энантиомеры относятся друг к
другу как предмет и
несовместимое с ним зеркальное
изображение
16.
Энантиомеры - оптическиеизомеры, оптические антиподы,
имеют одинаковые физические и
химические свойства:
температуры кипения,
плавления, растворимость,
показатели преломления,
спектральные характеристики,
ИК- и УФ-спектры
17.
Энантиомеры-различныесоединения с характерными
отличающимися свойствами
18.
1. Энантиомеры вращаютплоскость поляризации
поляризованного света на
один и тот же угол
вращения (α), но в
противоположных
направлениях
19.
Энантиомер, отклоняющийплоскость поляризации
поляризованного света влево
(против часовой стрелки)
называют левовращающим,
ему приписывают знак (-),
вправо (по часовой стрелке) правовращающим, ему
приписывают знак (+)
20.
2. Энантиомеры реагируют сдругими хиральными соединениями с различной скоростью,
что имеет большое значение для
биохимических процессов, так
как многие реагенты природного
происхождения (ферменты)
обычно вступают в реакции
только с одним из энантиомеров
21.
3. При смешении равныхколичеств двух энантиомеров
образуется оптически
неактивная смесь (рацемат).
Процесс превращения одного из
энантиомеров в рацемическую
форму называют рацемизацией,
а перевод одного из
энантиомеров в другой инверсией
22.
Стереоизомеры, неявляющиеся зеркальным
изображением один другого и
имеющие различные
физические и химические
свойства называются
диастереомеры
23.
Диастереомеры делятся на две группы- σ- и π-диастереоизомеры.
Стереоизомеры, у которых хиральный
центр связан с заместителями σсвязями называют
σ-диастереоизомерами, а
стереоизомеры, содержащие в
качестве стерического центра π-cвязь
- π-диастереоизомеры
24.
Стереоизомеры с одним центромхиральности
Молекулы, имеющие центры
хиральности на плоскости принято
изображать в виде проекционных формул
Фишера: в точке пересечения
горизонтальных и вертикальных линий
подразумевается нахождение
асимметрического атома углерода (без
написания его символа)
25.
Вверху располагают старшуюхарактеристическую,наиболее
окисленную группу, чаще всего
карбоксильную или альдегидную.
По горизонтали располагают
неуглеродные заместители: атом
водорода, гидроксильную группу,
амино-группу
26.
Абсолютную конфигурацию,отражающую истинное
расположение заместителей в
пространстве впервые
определили в 1951 году с
помощью
рентгеноструктурного анализа
для (+)-винной кислоты
27.
Относительнуюконфигурацию
определяют путем сравнения
с известным стандартом
Конфигурационный стандарт
- глицериновый альдегид
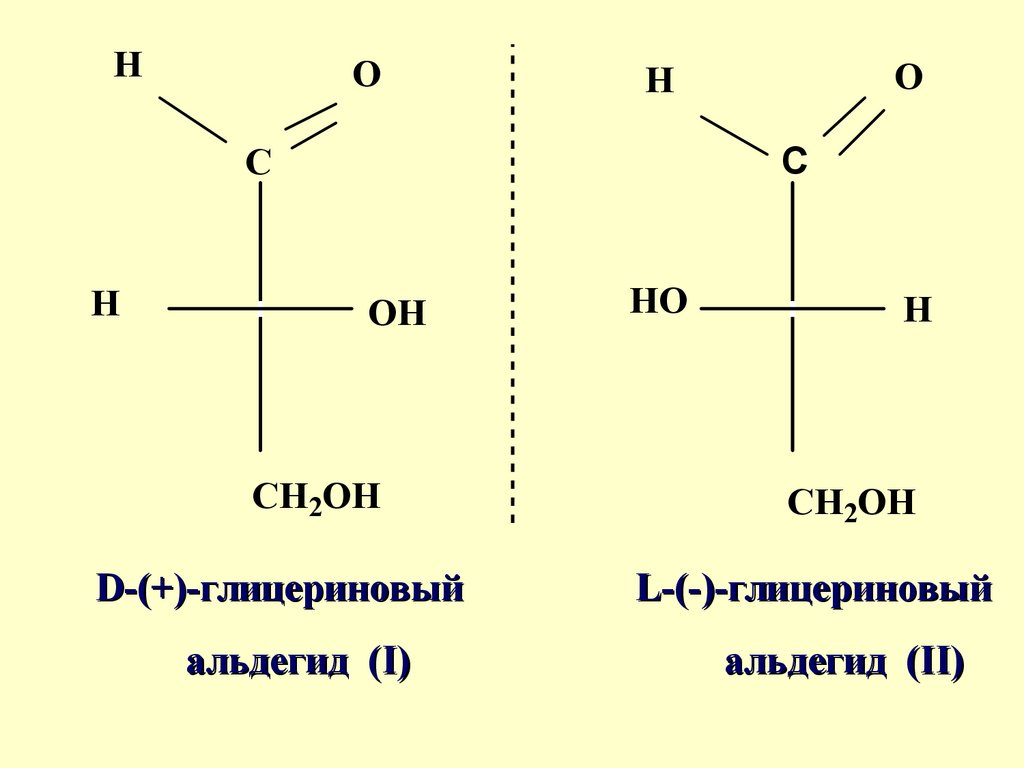
28.
Условно, правовращающемуглицериновому альдегиду
была приписана конфигурация
(I) и обозначена "D", а
левовращающему энантиомеру
- конфигурация (II),
обозначенная "L"
29.
HO
C
C
H
O
H
OH
CH2OH
D-(+)-глицериновый
альдегид (I)
HO
H
CH2OH
L-(-)-глицериновый
альдегид (II)
30.
В настоящее время действует R,Sноменклатура (Rректус, правый; S-синистер,левый)
31.
Соединениями с одним центром хиральности являютсянекоторые гидроксикислоты,
участвующие в биохимических
процессах:
молочная кислота (продукт
метаболизма глюкозы),
яблочная кислота (участник
ЦТК)
32.
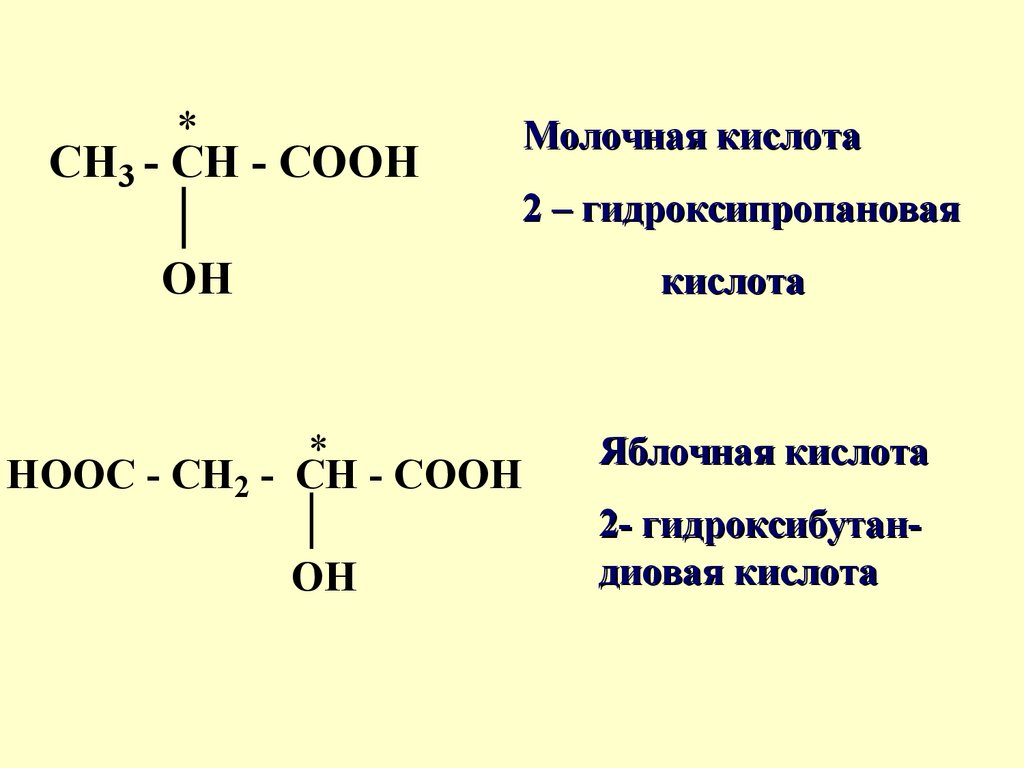
*CH3 - CH - COOH
Молочная кислота
2 – гидроксипропановая
OH
кислота
*
HOOC - CH2 - CH - COOH
OH
Яблочная кислота
2- гидроксибутандиовая кислота
33.
COOHH
COOH
HO
CH3
D-молочная кислота
HO
H
CH3
L-молочная кислота
34.
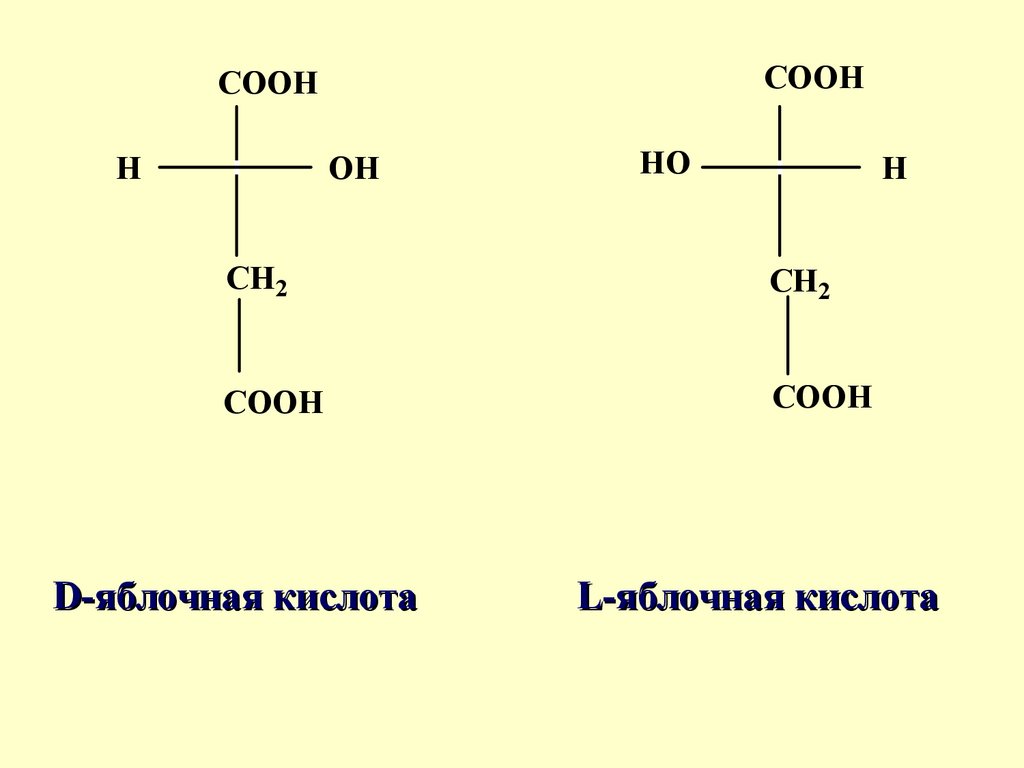
COOHCOOH
H
OH
HO
H
CH2
CH2
COOH
COOH
D-яблочная кислота
L-яблочная кислота
35.
11.2. Стереоизомерия соединений сдвумя центрами хиральности
Возрастание числа центров
хиральности и приводит к
появлению нового вида
стереоизомерии - диастереомерии.
Общее число стереоизомеров
соответствует формуле 2n, где n-число
асимметрических атомов
36.
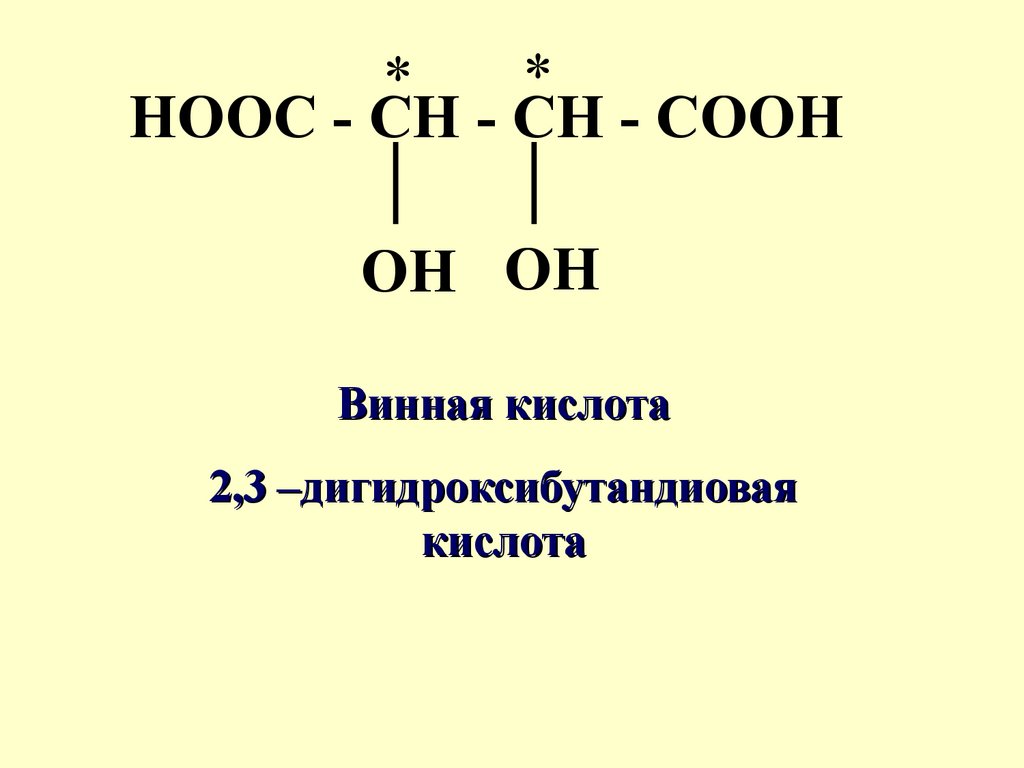
**
HOOC - CH - CH - COOH
OH OH
Винная кислота
2,3 –дигидроксибутандиовая
кислота
37.
Особый случай диастереомериивстречается в соединениях, у которых центры хиральности содержат
одинаковые заместители. Это приводит к тому, у молекулы может
появиться плоскость симметрии
(именно из-за одинаковых заместителей) и тогда такая молекула
перестает быть хиральной; ее
называют мезоформой. Мезоформы
оптически неактивны.
38.
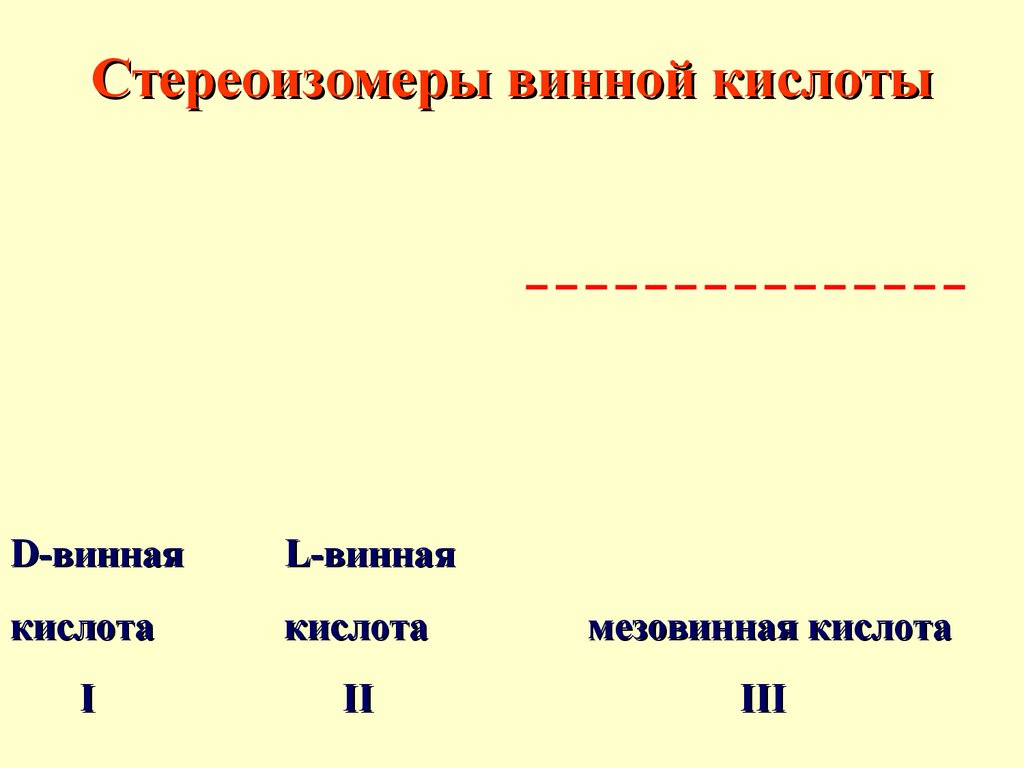
Стереоизомеры винной кислотыD-винная
L-винная
кислота
кислота
мезовинная кислота
I
II
III
39.
I и II - энантиомеры, I и III,II и III - диастереомеры.
В молекуле мезовинной
кислоты появилась плоскость
симметрии, поэтому она
оптически неактивна
40.
К соединениям с двумя центрамихиральности относят также и некоторые
аминокислоты, участвующие в
биосинтезе белков. Примером такой
аминокислоты служит треонин:
*
*
H3C - CH - CH - COOH
OH NH2
2-амино-3-гидроксибутановая кислота
41.
Стереоизомеры треонинаCOOH
COOH
COOH
H
NH2
H2N
H
H
NH2
H
OH
HO
H
HO
H
CH3
CH3
D-алло треонин L-алло треонин
I
II
COOH
H2N
H
H
OH
CH3
D-треонин
III
CH3
L-треонин
IY
42.
Энантиомеры - I и II; III и IYДиастереомеры - I и III; I и IY;
II и III; II и IY
Приставка алло используется для
той пары энантиомеров, L-изомер
которой не является структурным
элементом белков
43.
11.3. Стереоизомерия соединений сдвойной связью
(π-диастереоизомерия)
π-Диастереомеры относятся к
конфигурационным стереоизомерам.
Этот вид изомерии
наблюдается у соединений с
двойными связями (>C=C<, >C=N-,
-N=N-), строение которых исключает
свободное вращение вокруг двойной
44.
Молекулы π-диастереомеров ахиральны, поэтому для нихне может быть энантиомеров.
π-диастереомеры также
обозначают как цис- и трансстереоизомеры
45.
CH3COOH
C=C
C=C
H
COOH
H
H
CH3
H
Изокротоновая
Кротоновая
Кислота
кислота
46.
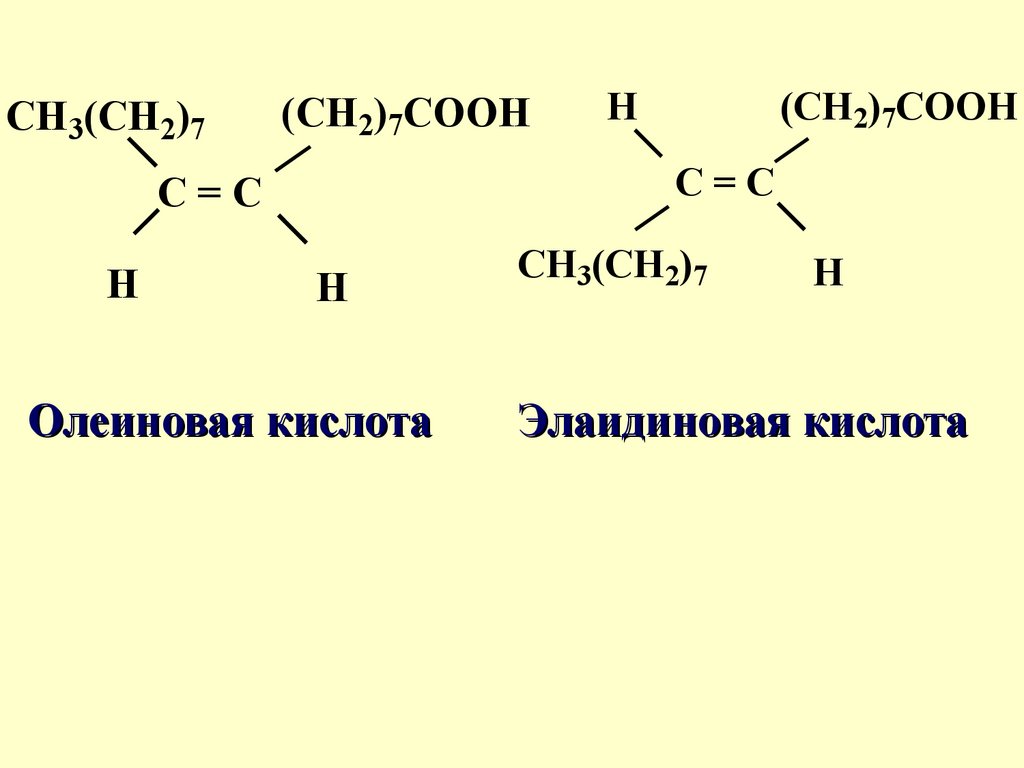
CH3(CH2)7(CH2)7COOH
(CH2)7COOH
C=C
C=C
H
H
H
Олеиновая кислота
CH3(CH2)7
H
Элаидиновая кислота
47.
Пространственное строениеорганических молекул тесно
связано с проявлением ими
биологической активности
или возможностью участия в
биологических процессах
48.
Следствием стереоселективностивзаимодействия живого с
оптическими изомерами
является, в частности, различие в
терапевтической активности
энантиомеров оптически
активных лекарственных
веществ
49.
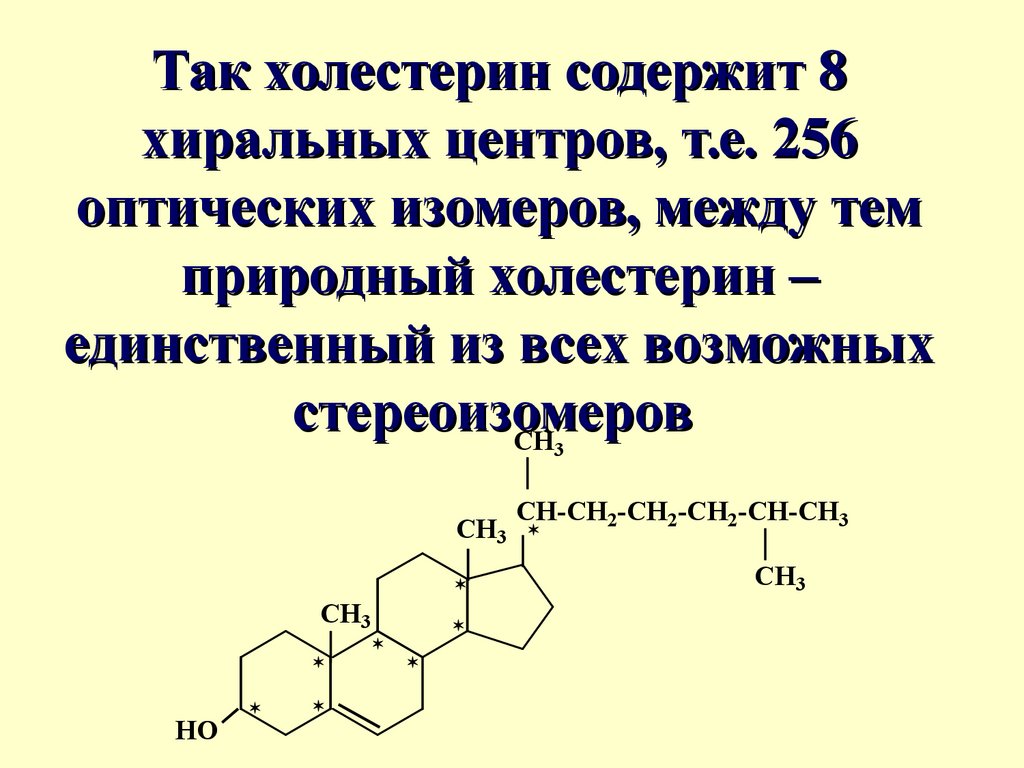
Так холестерин содержит 8хиральных центров, т.е. 256
оптических изомеров, между тем
природный холестерин –
единственный из всех возможных
стереоизомеров
CH
3
CH3
CH3
HO
CH-CH2-CH2-CH2-CH-CH3
CH3
50.
Из двух энантиомеров болеефизиологически активный
- называют эвтомер, второй
(менее или физиологически
неактивный) - дистомер
51.
В настоящее времяприблизительно 40 процентов
лекарственных веществ являются
хиральными и только ничтожная
часть этих соединений
представлена индивидуальными
энантиомерами. Энантиомеры
обладают и различающимся
фармакологическим действием
52.
11.4. Реакционная способностьгетерофункциональных соединений
К гетерофункциональным производным, участвующим в процессах
жизнедеятельности относят аминоспирты, гидрокси- и аминокислоты, альдегидо- и кетокислоты,
а также некоторые полигетерофункциональные соединения: двух- и
трехосновные гидроксикислоты
53.
Основные гетерофункциональныеалифатические производные
HO - CH2 - CH2 - NH2
CH3 - CH - COOH
-OH
-NH2
-COOH
-OH
аминоспирты
гидроксикислоты
OH
аминокислоты
54.
CH3 - C - COOH-COOH
= CO
кетокислоты
O
HOC - COOH
-COOH
-COH
альдегидокислоты
55.
Химические свойства этих соединений определяются свойствамисоответствующих монофункциональных производных, однако
наличие нескольких функциональных групп ведет к появлению
специфических химических
свойств, которые наиболее важны
для обеспечения биологических
функций
56.
Каждая гетерофункциональнаягруппа сохраняет свойственную ей
реакционоспособность, но
происходит и взаимное усиление
реакционной способности. В
зависимости от расположения эти
реакции могут протекать как внутри
одной молекулы
(внутримолекулярные), так и между
молекулами (межмолекулярные)
57.
α-расположениегетерофункциональных заместителей
приводит, как правило, к реакциям
межмолекулярной циклизации
O
COOH
H3C -CH
HO
+
OH
tC
CH - CH3
HOOC
C
o
- 2 H2O
O
CH - CH3
H3C - HC
O
C
O
Молочная кислота
Лактид молочной
58.
α-расположениеO
H2N
COOH
+
H3C -CH
NH2
HOOC
C
o
tC
CH - CH3
N
CH - CH3
H3C - HC
- 2 H2O
N
H
α-аланин
H
O
дикетопиперазин
59.
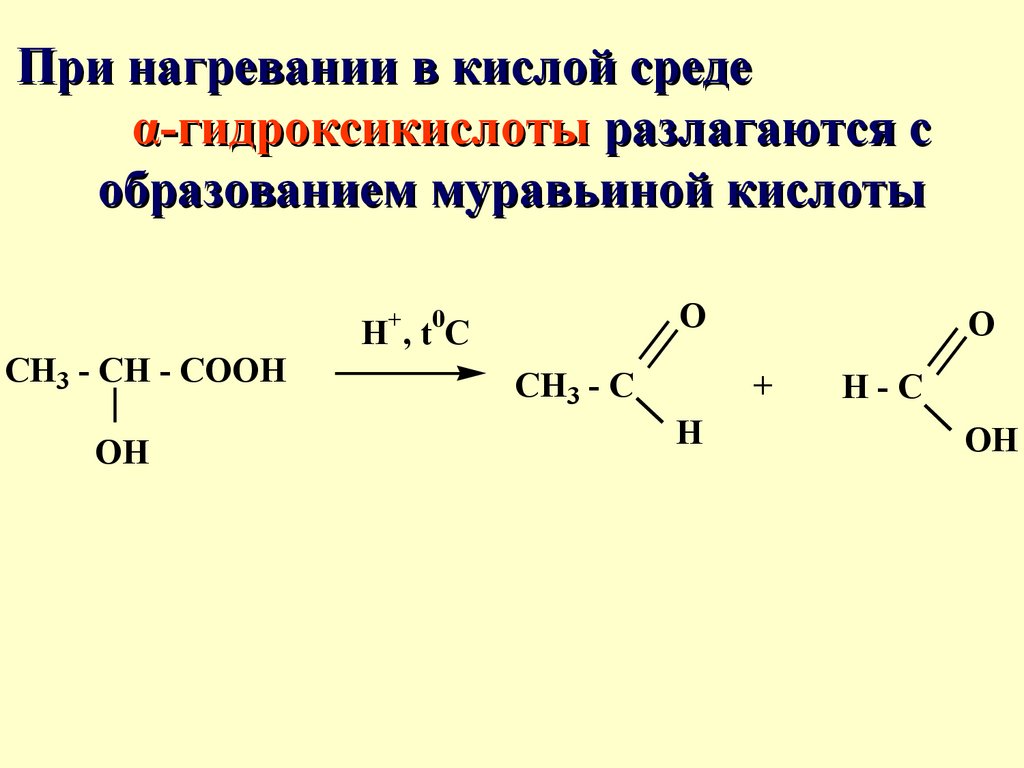
При нагревании в кислой средеα-гидроксикислоты разлагаются с
образованием муравьиной кислоты
+
CH3 - CH - COOH
OH
O
0
H ,t C
CH3 - C
O
+
H
H-C
OH
60.
β-расположениепредопределяет между
гетерофункциональными
группами достаточно
сильный СН- кислотный
центр благодаря влиянию ЭА
групп с двух сторон
61.
β-расположениепредполагает реакции
элиминирования
CH3 - CH
OH
CH
COOH
t0C
- H2O
CH3 - CH = CH - COOH
H
β-гидроксимасляная кислота
кротоновая
кислота
62.
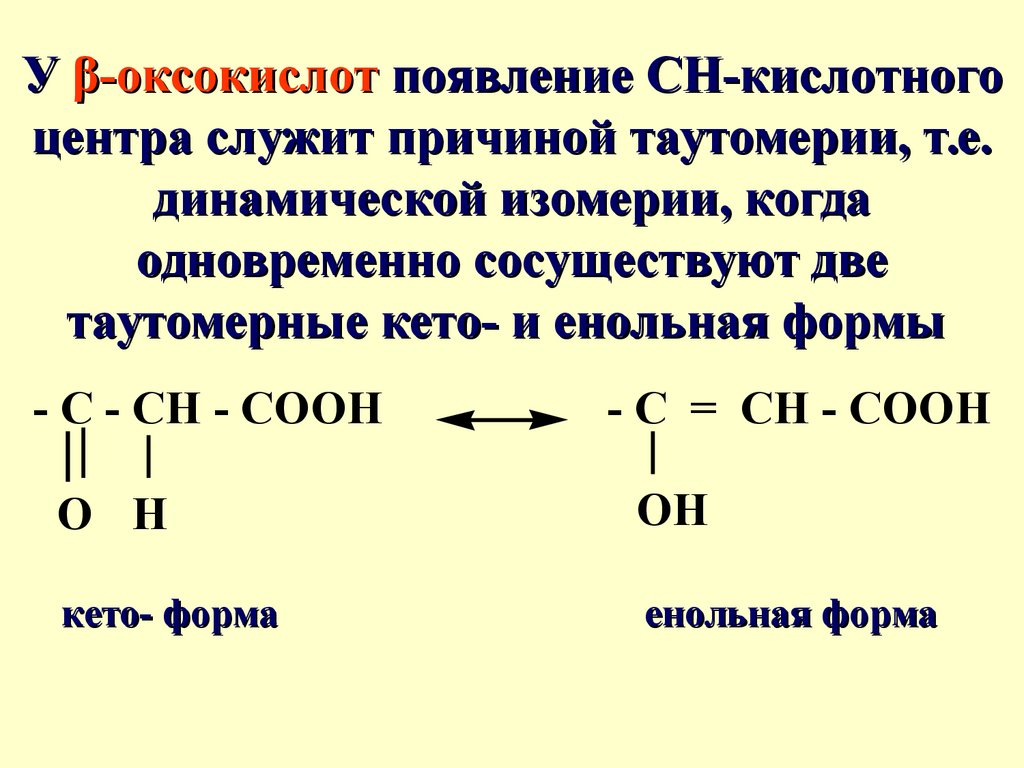
У β-оксокислот появление СН-кислотногоцентра служит причиной таутомерии, т.е.
динамической изомерии, когда
одновременно сосуществуют две
таутомерные кето- и енольная формы
- C - CH - COOH
- C = CH - COOH
O H
OH
кето- форма
енольная форма
63.
Кето-енольная таутомерия характернадля β-оксокислот. Наиболее удобно
рассмотреть кето-енольную таутомерию
на примере ацетоуксусного эфира
H3C - C - CH - COOC2H5
O H
Кето-форма (92,5%)
H3C - C = CH - COOC2H5
OH
Енольная форма (7,5%)
64.
Ацетоуксусный эфир используетсядля синтеза кетонов, карбоновых
кислот, гетерофункциональных
соединений, ЛС, причем при
действии на него какого либо
реагента в реакцию вступает один из
таутомеров и т.к. равновесие
постоянно будет смещаться в его
сторону , то таутомерная смесь
реагирует как единое целое
65.
Если по отношению к карбоксильнойгруппе в α- или β-положении находится
сильная ЭА группа, то такие соединения
способны к декарбоксилированию
O
0
tC
H3C - C - COOH
O
-CO2
H 3C - C
H
66.
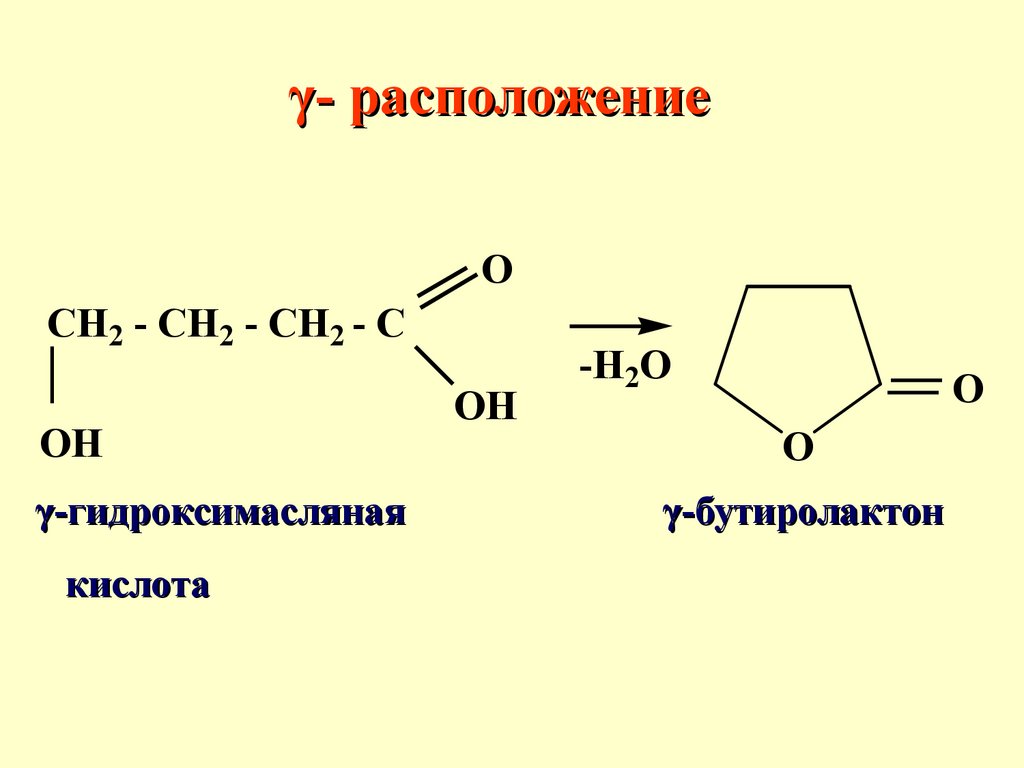
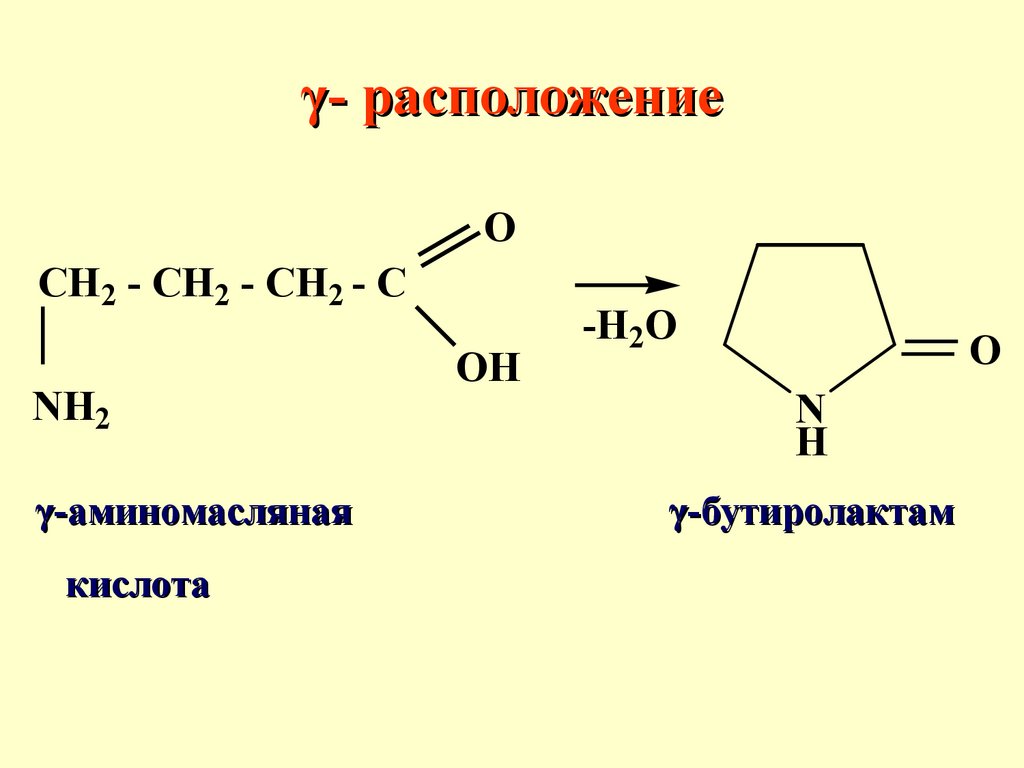
γ- расположениеспособствует реакциям внутримолекулярной циклизации, в
результате образуются циклические сложные эфиры или амиды. Определяющим фактором
является термодинамическая
устойчивость образующегося
цикла
67.
γ- расположениеO
CH2 - CH2 - CH2 - C
OH
γ-гидроксимасляная
кислота
OH
-H2O
O
O
γ-бутиролактон
68.
γ- расположениеO
CH2 - CH2 - CH2 - C
NH2
γ-аминомасляная
кислота
OH
-H2O
O
N
H
γ-бутиролактам
69.
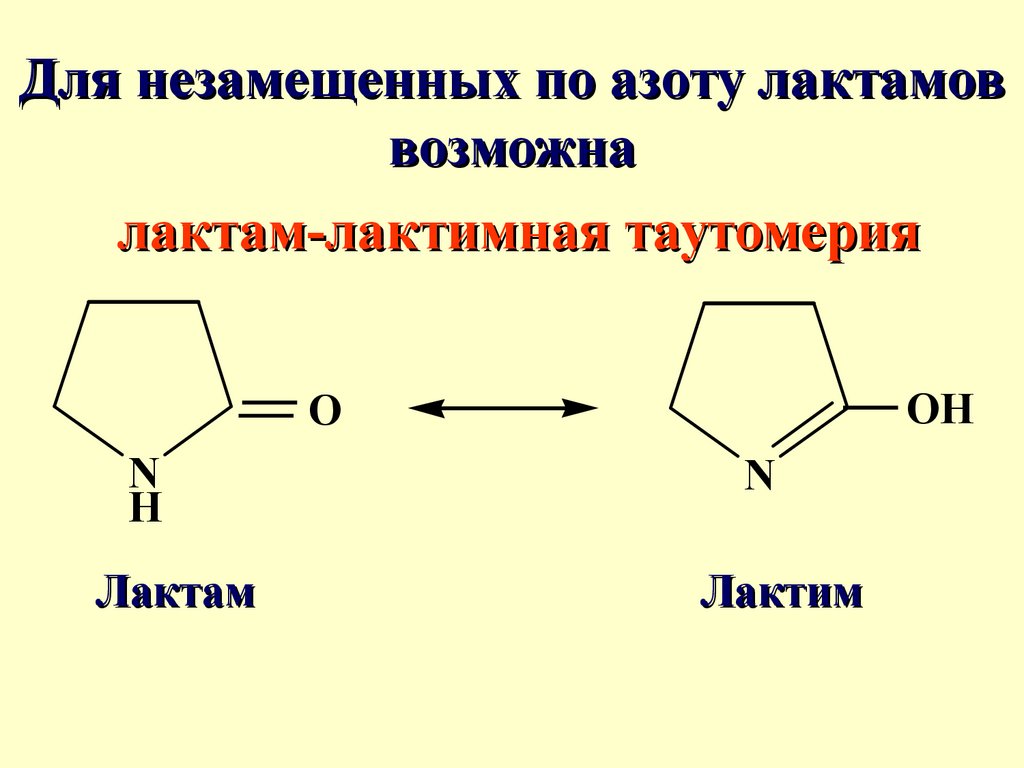
Для незамещенных по азоту лактамоввозможна
лактам-лактимная таутомерия
OH
O
N
H
Лактам
N
Лактим
70.
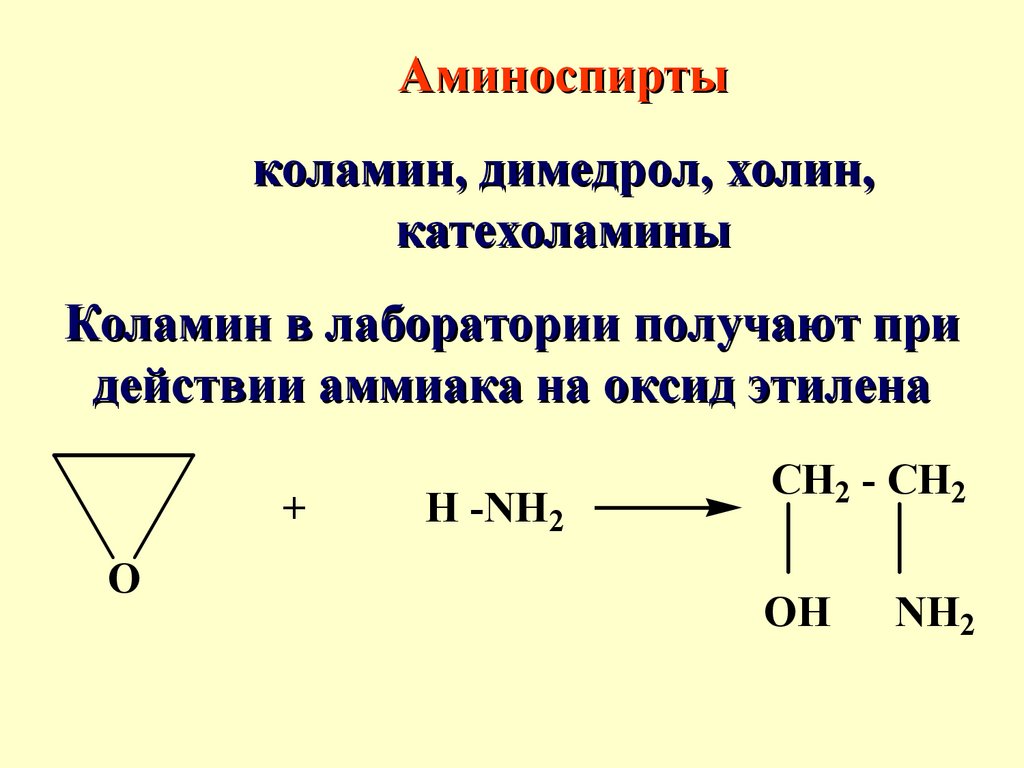
Аминоспиртыколамин, димедрол, холин,
катехоламины
Коламин в лаборатории получают при
действии аммиака на оксид этилена
+
O
H -NH2
CH2 - CH2
OH
NH2
71.
Коламин - густая жидкость схарактерным запахом аминов
Коламин обладает выраженными
основными свойствами
НО-СН2-CH2-NH2 + HCl →
НО-СН2-CH2-NH3+Cl-
72.
Холин - [HO – CH2 – CH2 – N(CH3)3]+OH- гидроксид триметил-2гидроксиэтиламмония входит всостав сложных липидов,
используется как витаминоподобное
вещество, регулирует жировой
процесс, понижает кровяное
давление
73.
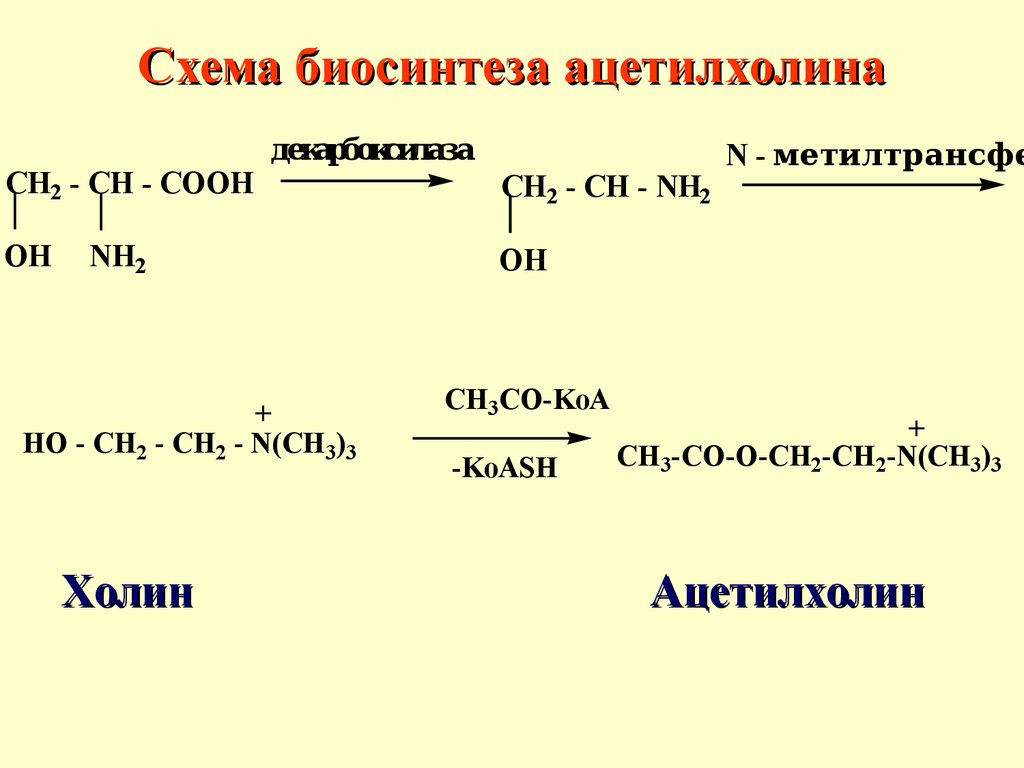
Схема биосинтеза ацетилхолинаCH2 - CH - COOH
OH
декарбоксилаза
NH2
+
HO - CH2 - CH2 - N(CH3)3
Холин
CH2 - CH - NH2
N - метилтрансфе
OH
CH3CO-KoA
-KoASH
+
CH3-CO-O-CH2-CH2-N(CH3)3
Ацетилхолин
74.
Катехоламиныдофамин, норадреналин и
адреналин, являются
биогенными аминами, которые
образуются в организме из
незаменимой аминокислоты
фенилаланина
75.
Схема биосинтеза катехоламиновCOOH
COOH
CH2 - CH - NH2
фенилаланин
CH2 -CH - NH2
тирозин
HO
гидроксилаза
гидроксилаза
HO
HO
COOH
CH2 - CH - NH2
декарбоксилаза
- CO2
76.
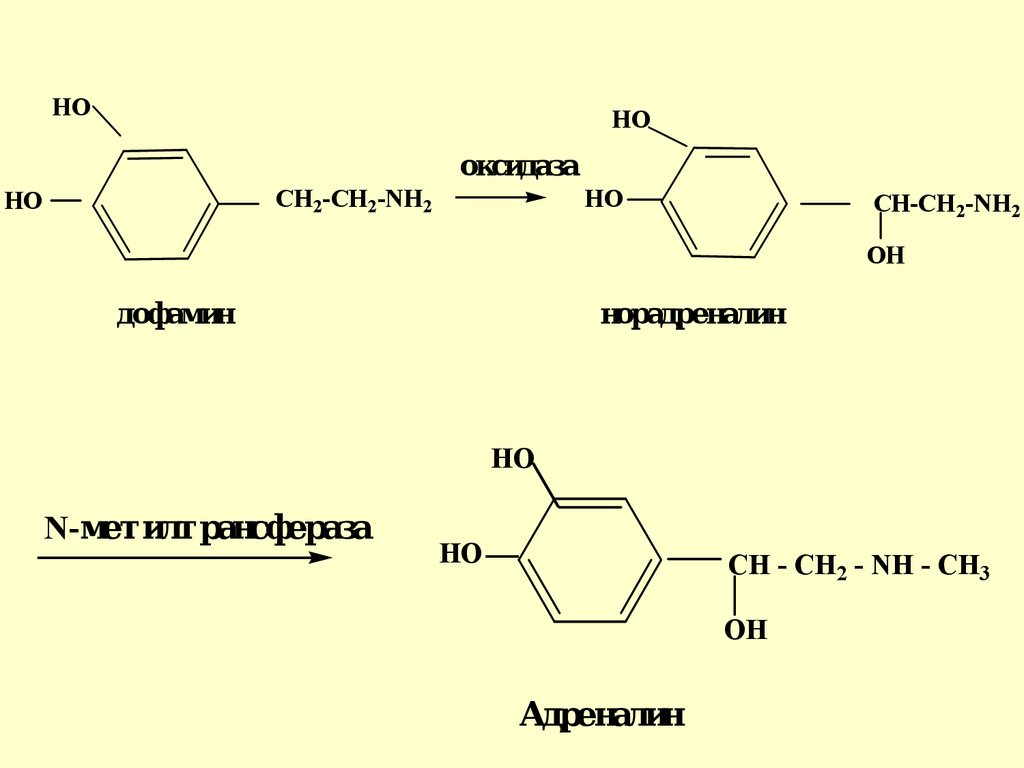
HOHO
оксидаза
CH2-CH2-NH2
HO
HO
CH-CH 2-NH2
OH
дофамин
норадреналин
HO
N-метилтрансфераза
HO
CH - CH2 - NH - CH3
OH
Адреналин
77.
Адреналин(метиламиноэтанолпирокатехин)
образуется в надпочечниках, является
гормоном, обладающим способностью
сужать кровеносные сосуды,
применяется в качестве
кровоостанавливающего средства
При стрессах в больших количествах
выделяется в кровь (гормон страха)
Активен только левовращающий
природный изомер
78.
Некоторым людям необходимдополнительный адреналин
79.
Гидроксикислотысодержат -ОН с -СООН группы
Различают α-,β-, и γгидроксикислоты
НОСН2СООН
2-гидроксиэтановая кислота ,
гликолевая кислота (α-кислота)
80.
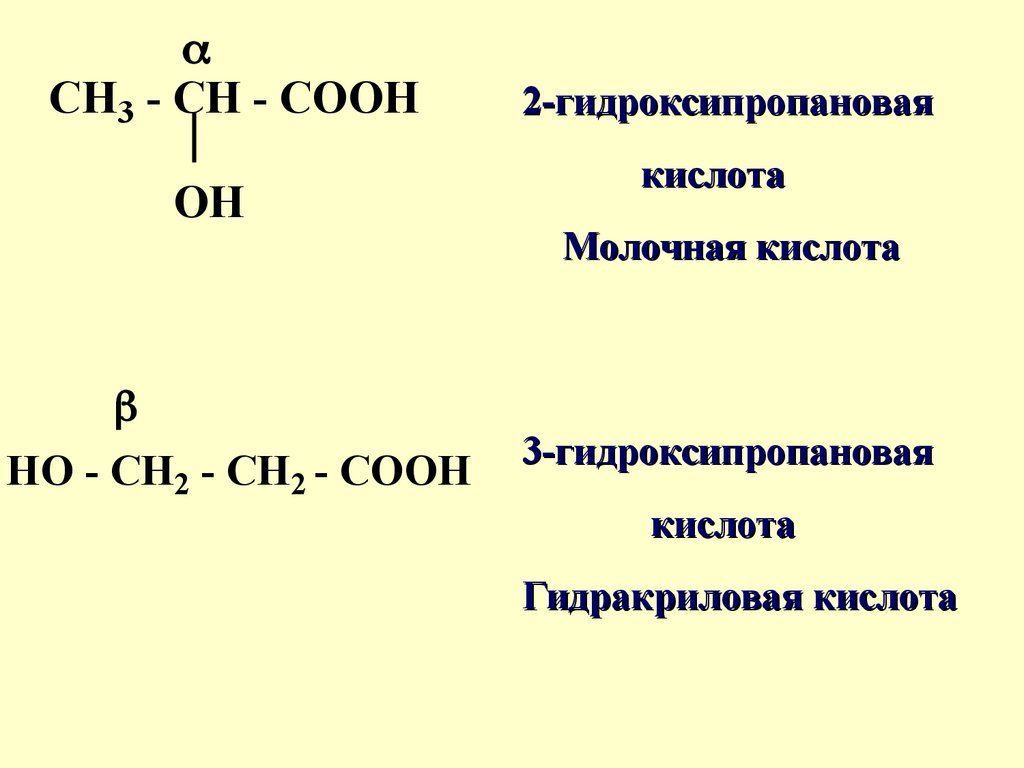
CH3 - CH - COOHOH
HO - CH2 - CH2 - COOH
2-гидроксипропановая
кислота
Молочная кислота
3-гидроксипропановая
кислота
Гидракриловая кислота
81.
3-гидроксибутановаяCH3 - CH - CH2 - COOH
кислота
OH
β- оксимасляная кислота
HO - CH2 - CH2 - CH2 - COOH
4-гидроксибутановая кислота
γ–оксимасляная кислота (ГОМК)
82.
Гидроксикислоты проявляютобщие свойства кислот и спиртов,
кроме этого для них характерны
специфические свойства,
связанные с взаимным
расположением спиртовой и
карбоксильной групп
83.
Кетоновые (ацетоновые) телапродукты окисления высших жирных
кислот, накапливаются в организме у
больных сахарным диабетом
CH3-CH-CH2-COOH CH3-C-CH2-COOH
OH
O
β-гидроксимасляная ацетоуксусная
кислота
кислота
CH3-C-CH3
O
ацетон
84.
ОксокислотыРазличают альдегидо- и кетокислоты
HOOC - COH
CH3 - C - COOH
O
Глиоксиловая кислота
Пировиноградная кислота
(ПВК)
85.
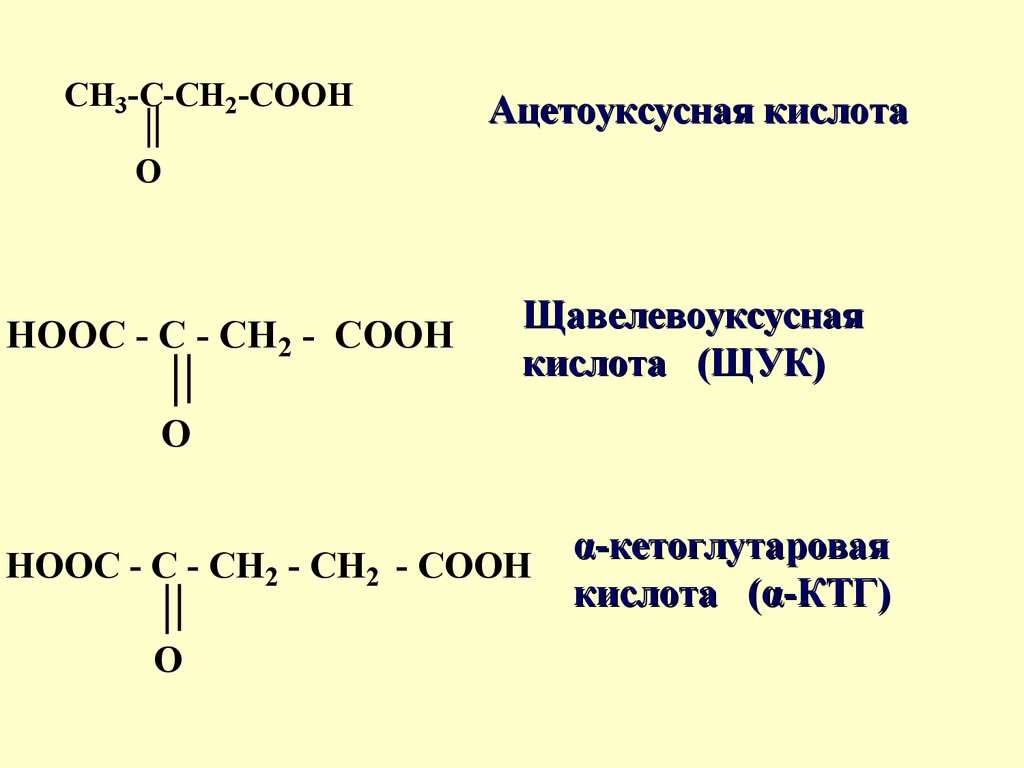
CH3-C-CH2-COOHАцетоуксусная кислота
O
HOOC - C - CH2 - COOH
Щавелевоуксусная
кислота (ЩУК)
O
HOOC - C - CH2 - CH2 - COOH
O
α-кетоглутаровая
кислота (α-КТГ)

































































 Биология
Биология








