Похожие презентации:
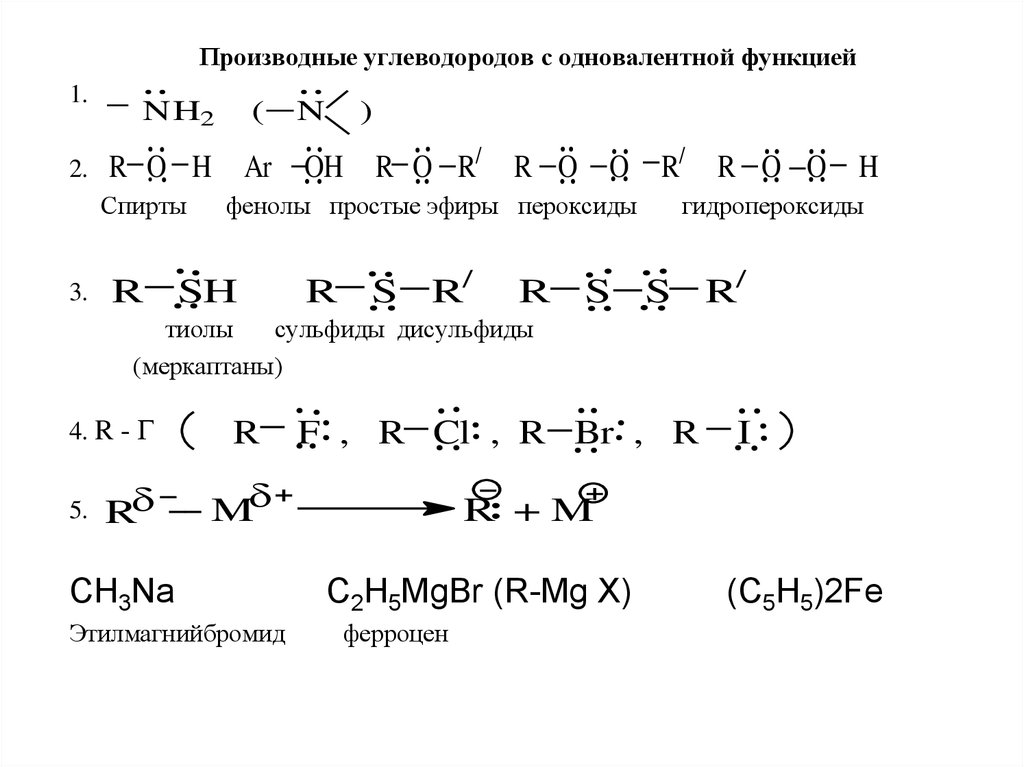
Производные углеводородов с одновалентной функцией
1.
Производные углеводородов с одновалентной функцией1.
2.
NH2
(
N
R O H
Ar
OH
Спирты
3.
)
R O R/
R O
O
фенолы простые эфиры пероксиды
R SH
R S R/
R/
R O O
H
гидропероксиды
R S S R/
тиолы
сульфиды дисульфиды
(меркаптаны)
4. R - Г
5.
R
R
F , R Cl , R Br , R
M
CH3Na
Этилмагнийбромид
I
R +M
C2H5MgBr (R-Mg X)
ферроцен
(C5H5)2Fe
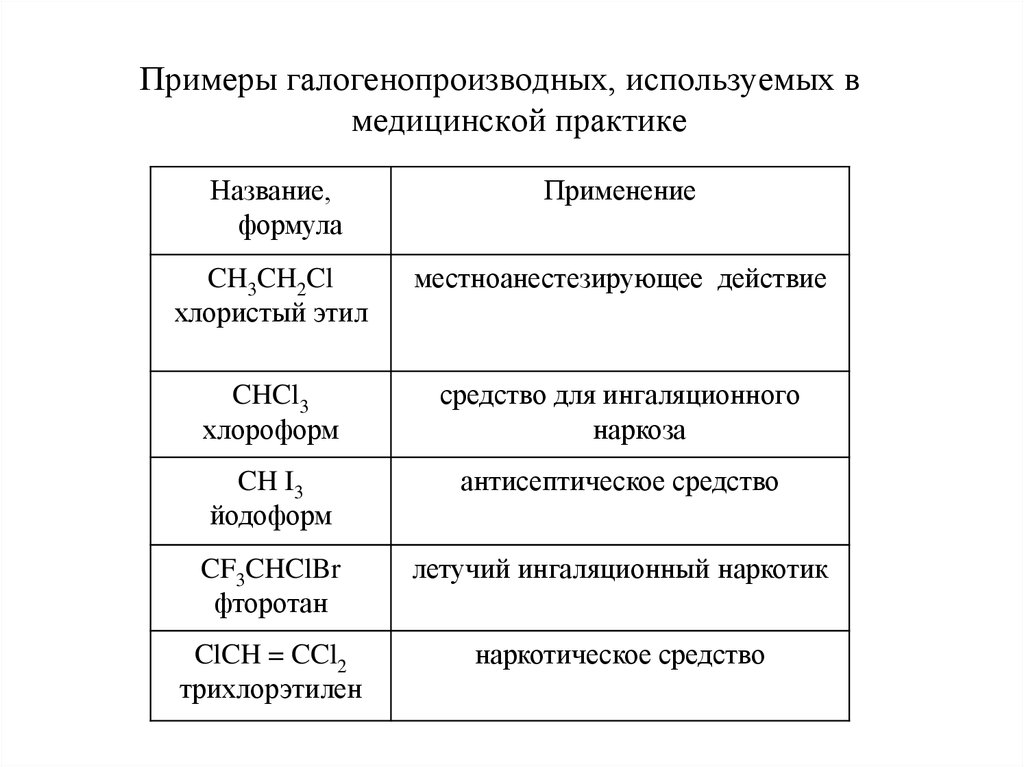
2.
Примеры галогенопроизводных, используемых вмедицинской практике
Название,
формула
Применение
CH3CH2Cl
хлористый этил
местноанестезирующее действие
CHCl3
хлороформ
средство для ингаляционного
наркоза
CH I3
йодоформ
антисептическое средство
CF3CHClBr
фторотан
летучий ингаляционный наркотик
ClCH = CCl2
трихлорэтилен
наркотическое средство
3.
Кислотно-основные свойства соединений.AH
B
R
O
H
R
S
NH
H
R
N
C
H
R
O
R
S
R
O
R
S
R
R
H
Base
H
H
R/
R/
По теории Беренстеда –Лоури кислоты - доноры протонов, основания –
акцепторы протонов.
В зависимости от природы элемента, с которым связан протон,
бренстедовские кислоты делятся на четыре типа:
O-H кислоты: карбоновые кислоты, фенолы, спирты;
S-H кислоты: тиолы;
N-H кислоты: амиды, амины, имиды;
C-H кислоты: углеводороды и их производные.
AH
Кислота
+
B
A
+
BH
Основание Сопряженное Сопряженная
основание
кислота
Сравнительный анализ силы кислот (оснований) проводят путем
сопоставления стабильности (устойчивости) соответствующих
сопряженных оснований (кислот)
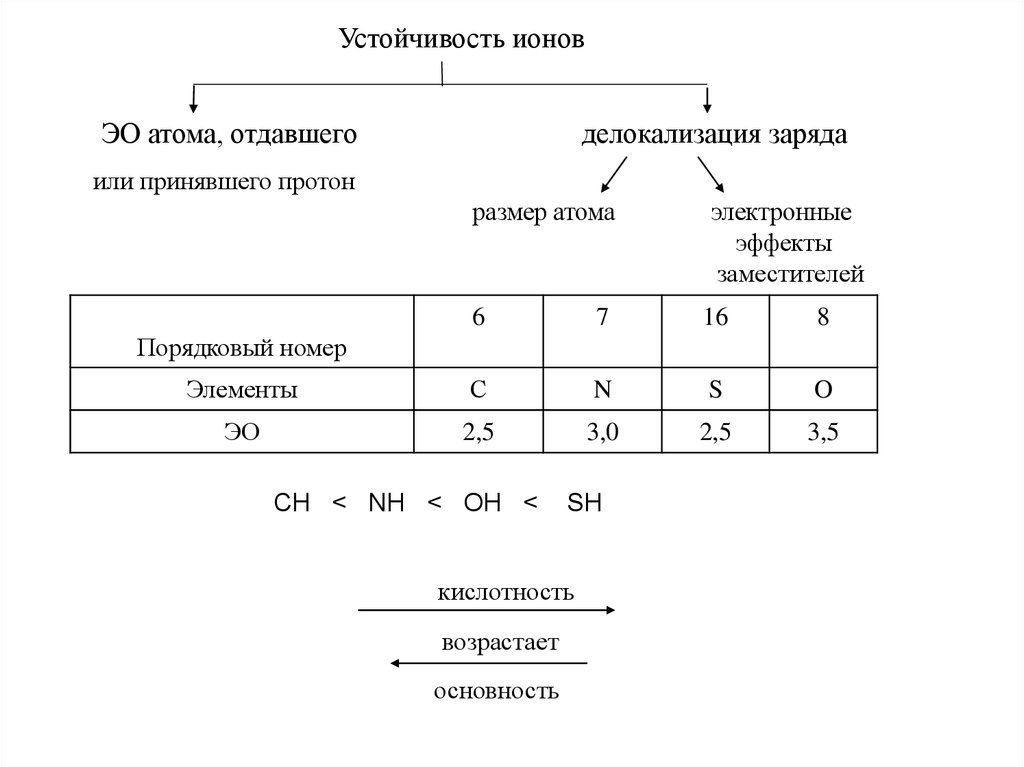
4.
Устойчивость ионовЭО атома, отдавшего
делокализация заряда
или принявшего протон
размер атома
электронные
эффекты
заместителей
6
7
16
8
Элементы
С
N
S
O
ЭО
2,5
3,0
2,5
3,5
Порядковый номер
CH < NH < OH <
SH
кислотность
возрастает
основность
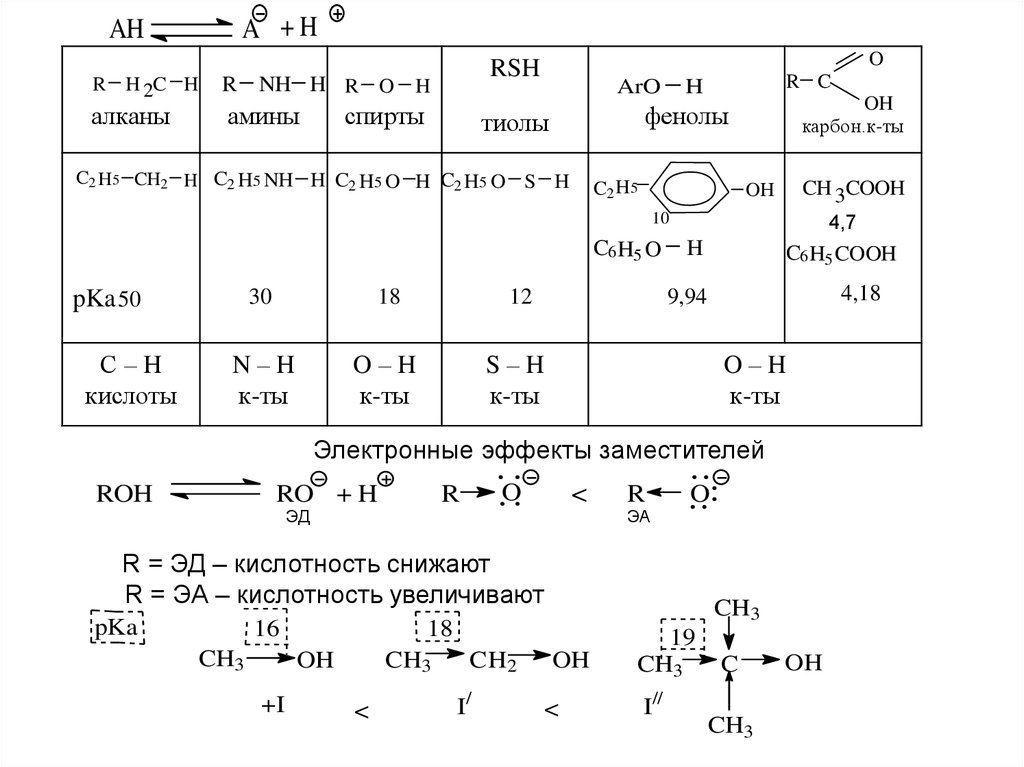
5.
A +HAH
R
H 2C H
алканы
R
NH H R O H
амины
O
RSH
спирты
ArO
OH
карбон.к-ты
фенолы
тиолы
C2 H5 CH2 H C2 H5 NH H C2 H5 O H C2 H5 O
R C
H
S H
C2 H5
CH 3COOH
OH
10
C6 H5 O
30
18
12
N–H
к-ты
O–H
к-ты
S–H
к-ты
pKa 50
С–H
кислоты
4,7
H
C6 H5 COOH
4,18
9,94
O–H
к-ты
Электронные эффекты заместителей
ROH
RO + H
O
R
ЭД
<
R
ЭА
O
R = ЭД – кислотность снижают
R = ЭА – кислотность увеличивают
pKa
16
CH3
OH
+I
CH3
18
CH3
<
CH2
I/
OH
<
19
CH3
I//
C
CH3
OH
6.
Уменьшение кислотных свойствСоединение
H
Ка
10 -16
O H
O H
C H3
10 -17
Cl
Cl
C
C H2
O H
10
-12
Эффект
+I CH3
- I CСl3
Cl
O
O2N
H
O H
10 -10
+ M OH
10 -7
+ M OH, - I NO2
7.
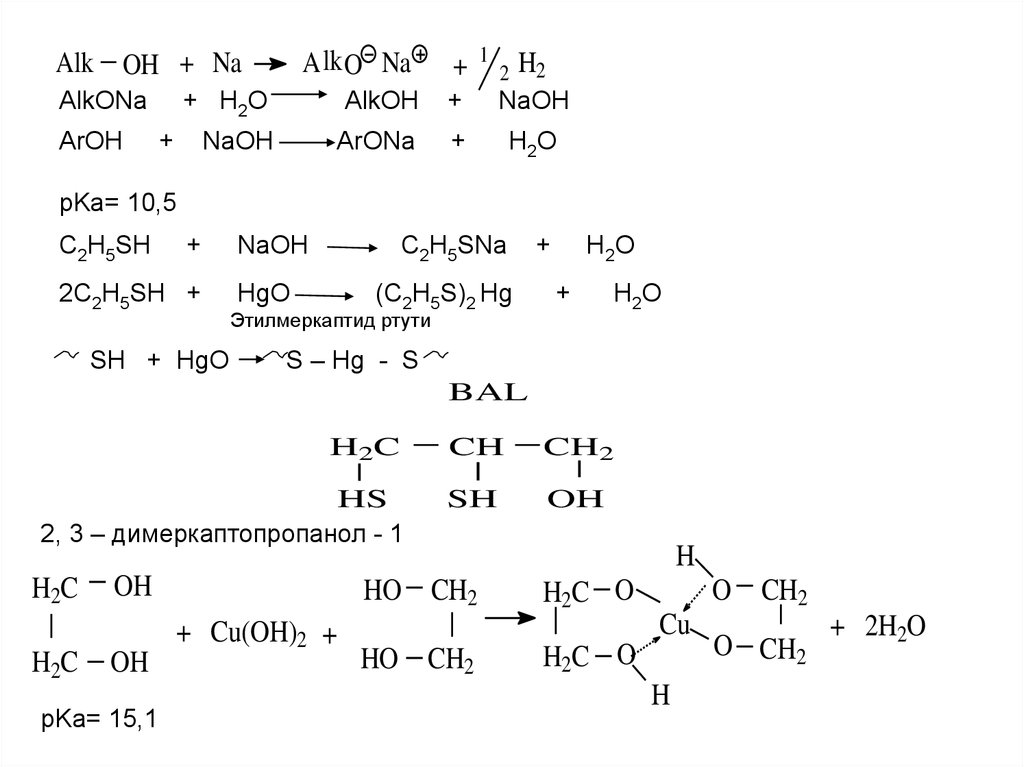
A lk O NaAlk OH + Na
AlkONa
ArOH
+
1
2
H2
+ H2O
AlkOH
+
NaOH
NaOH
ArONa
+
H2O
+
pKa= 10,5
C2H5SH
+
2C2H5SH +
SH + HgO
NaOH
C2H5SNa
HgO
(C2H5S)2 Hg
+
H2 O
+
Этилмеркаптид ртути
H 2O
S – Hg - S
BAL
H2C
CH
CH2
HS
2, 3 – димеркаптопропанол - 1
SH
OH
H2C
H2C
OH
OH
pKa= 15,1
HO CH2
+ Cu(OH)2 +
H
H2C O
O CH2
Cu
HO CH2
H2C O
H
O CH2
+ 2H2O
8.
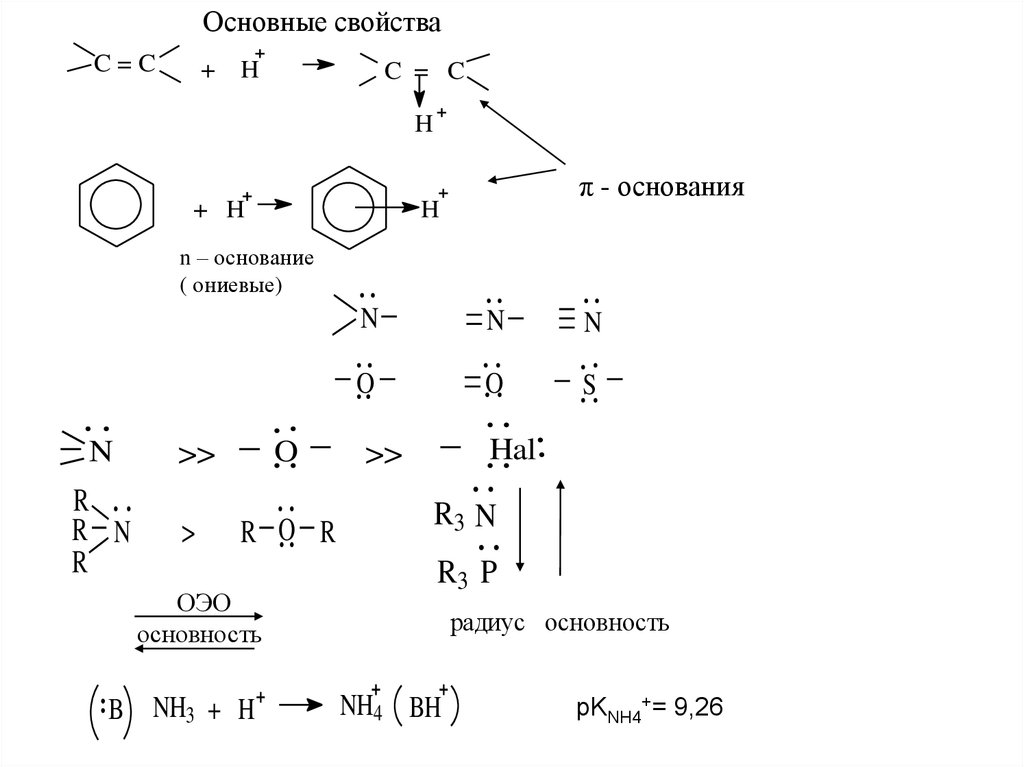
Основные свойстваC=C
+
H
C = C
H
+ H
π - основания
H
n – основание
( ониевые)
N
>>
O
R
R N
R
>
R O R
ОЭО
основность
B NH3 + H
N
N
N
O
O
S
>>
Hal
R3 N
R3 P
радиус основность
NH4 BH
pKNH4+= 9,26
9.
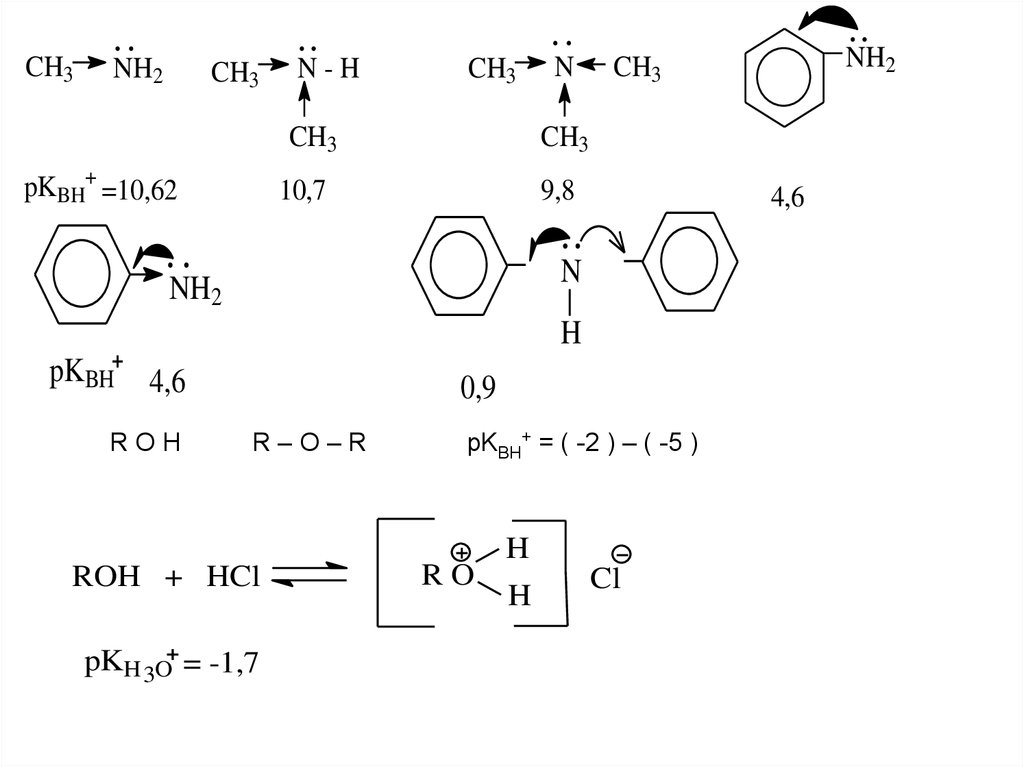
CH3NH2
CH3
N-H
CH3
CH3
pKBH+ =10,62
N
CH3
10,7
9,8
4,6
N
NH2
H
pKBH
4,6
ROH
0,9
R–O–R
ROH + HCl
pKH 3O = -1,7
NH2
CH3
pKBH+ = ( -2 ) – ( -5 )
RO
H
H
Cl
10.
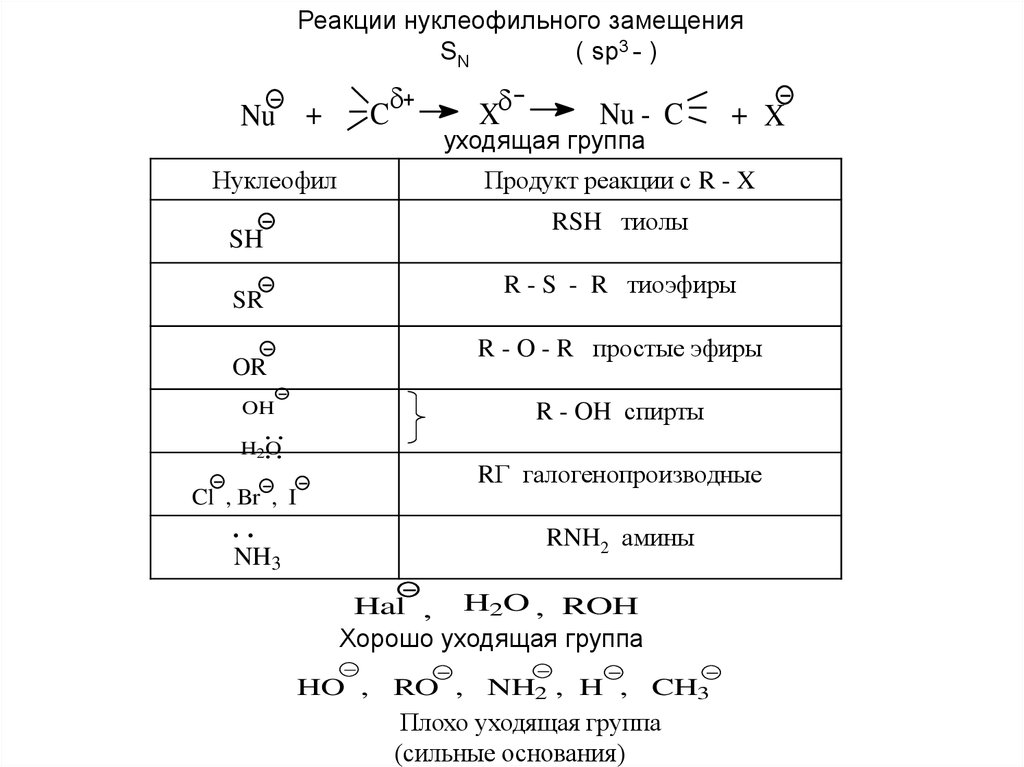
Реакции нуклеофильного замещенияSN
( sp3 - )
Nu +
C
X
Nu - C
уходящая группа
Нуклеофил
+ X
Продукт реакции с R - X
RSH тиолы
SH
R - S - R тиоэфиры
SR
R - O - R простые эфиры
OR
R - OH спирты
OH
H 2O
RГ галогенопроизводные
Cl , Br , I
RNH2 амины
NH3
Hal , H2O , ROH
Хорошо уходящая группа
HO ,
RO ,
NH2 , H ,
CH3
Плохо уходящая группа
(сильные основания)
11.
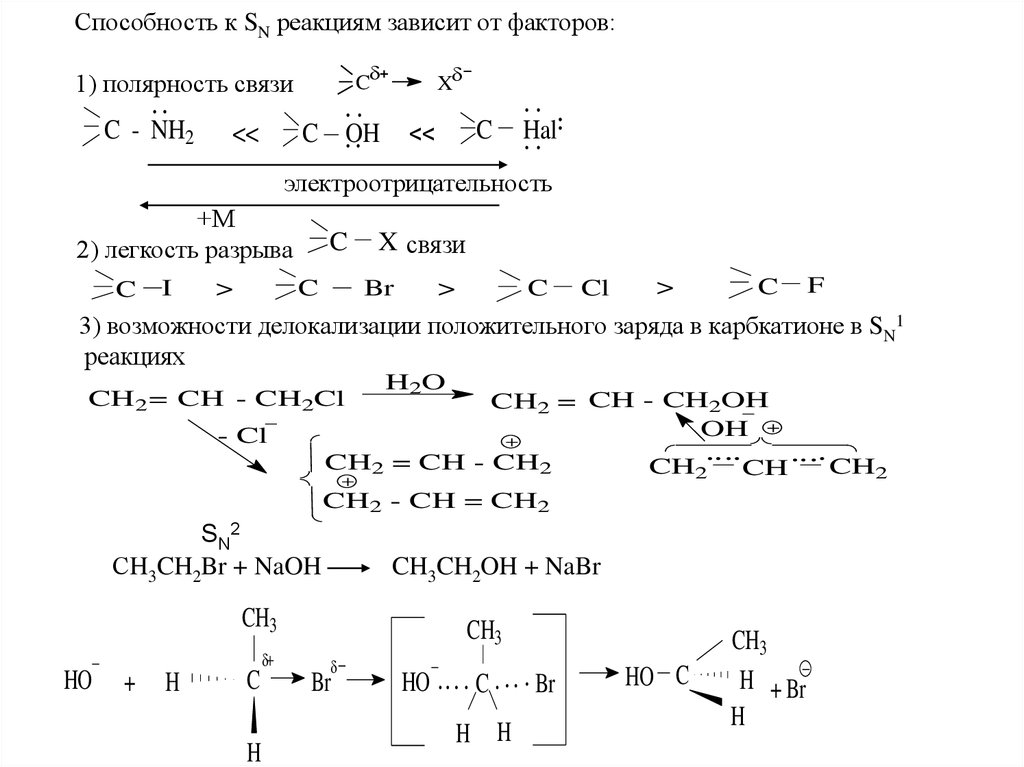
Способность к SN реакциям зависит от факторов:C
1) полярность связи
C - NH2
<<
C
X
OH
C
<<
Hal
электроотрицательность
+М
2) легкость разрыва
C
I
>
C
C
X связи
Br
>
C
Cl
>
C
F
3) возможности делокализации положительного заряда в карбкатионе в SN1
реакциях
CH2 = CH - CH2Cl
H2O
CH2 = CH - CH2OH
OH
- Cl
CH2 = CH - CH2
CH2
CH
CH2 - CH = CH2
SN2
СH3CH2Br + NaOH
CH3CH2OH + NaBr
CH3
HO
+
H
C
H
CH3
Br
HO
C
H H
Br
HO C
CH3
H + Br
H
CH2
12.
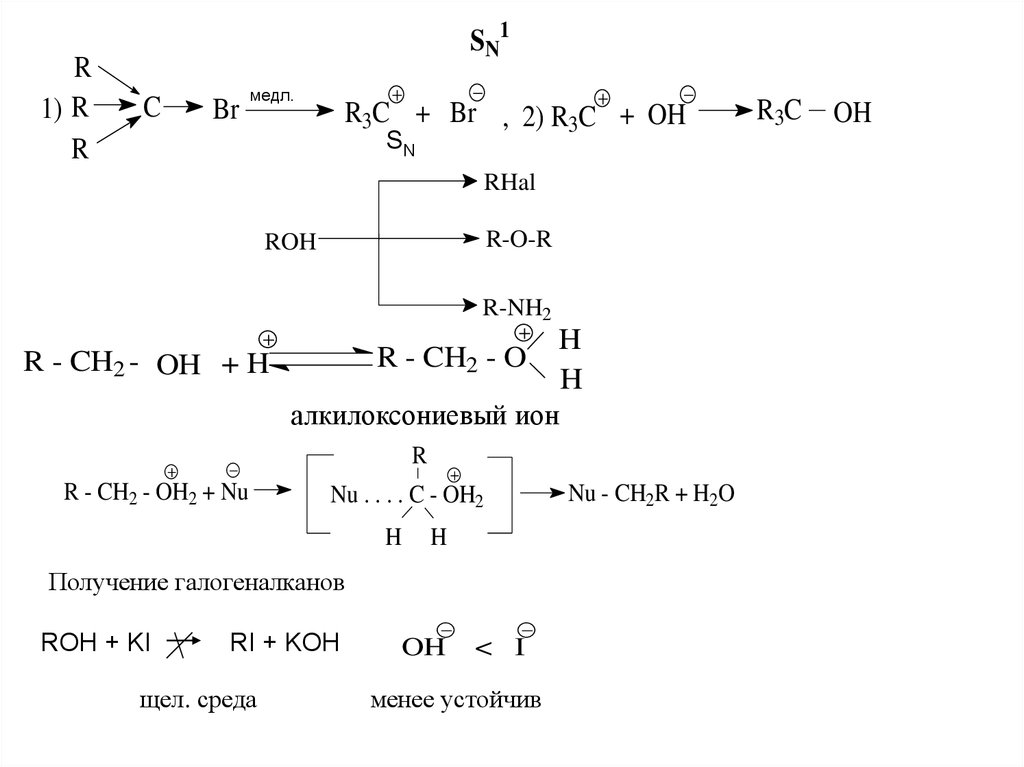
R1) R
R
SN1
C
Br
медл.
R3C + Br , 2) R3C + OH
SN
RHal
R-O-R
ROH
R-NH2
H
R - CH2 - OH + H
H
алкилоксониевый ион
R - CH2 - O
R
R - CH2 - OH2 + Nu
Nu . . . . C - OH2
H
H
Получение галогеналканов
ROH + KI
RI + KOH
щел. среда
OH
< I
менее устойчив
Nu - CH2R + H2O
R3C
OH
13.
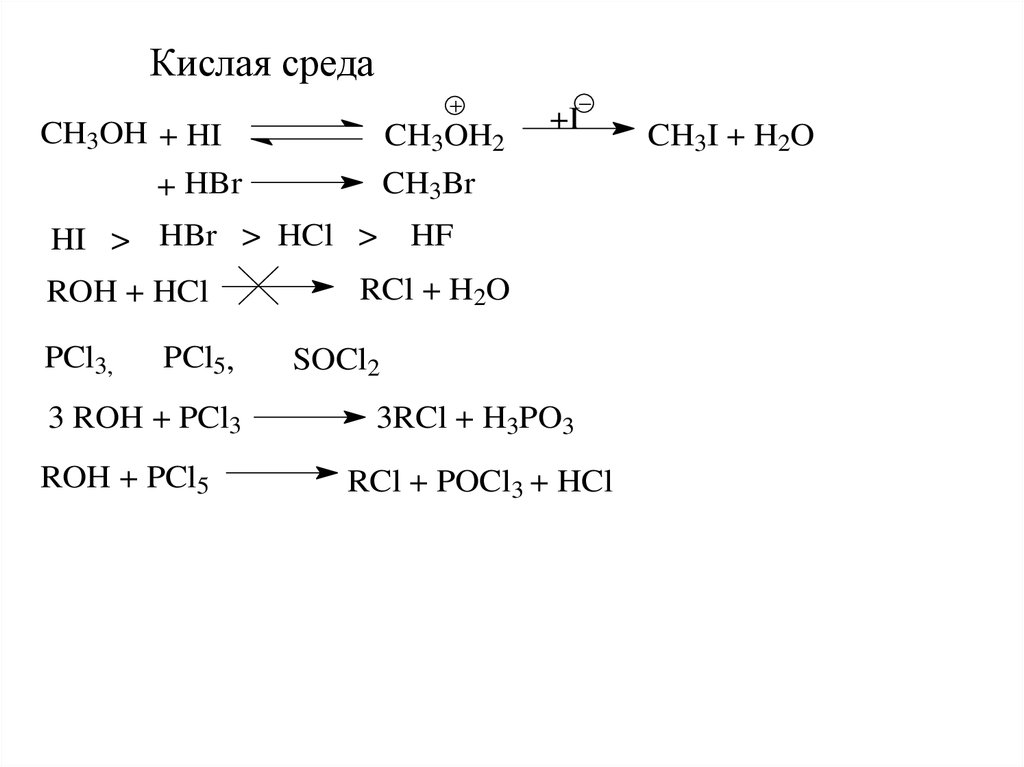
Кислая средаCH3OH + HI
CH3OH2
CH3Br
+ HBr
HI > HBr > HCl >
ROH + HCl
PCl3,
PCl5,
3 ROH + PCl3
ROH + PCl5
+I
HF
RCl + H2O
SOCl2
3RCl + H3PO3
RCl + POCl3 + HCl
CH3I + H2O
14.
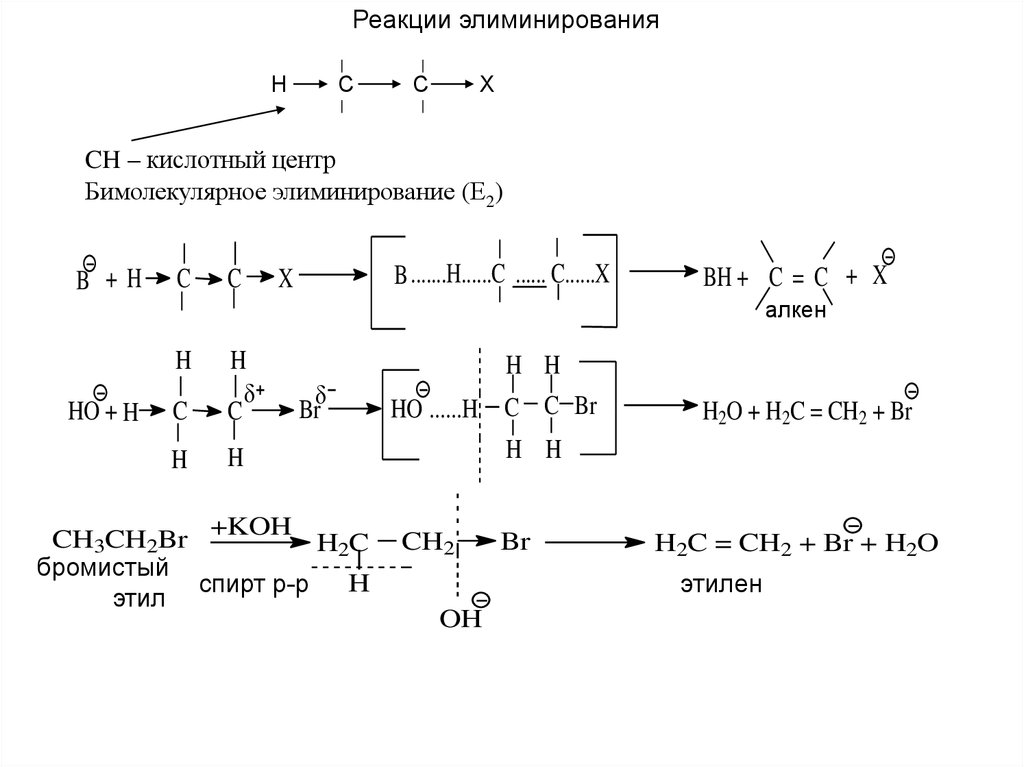
Реакции элиминированияH
C
C
X
CH – кислотный центр
Бимолекулярное элиминирование (Е2)
B +H
C
C
B .......H......C ...... C......X
X
BH + C = C + X
алкен
H
HO + H
C
H
C
H
H
Br
+KOH
CH3CH2Br
H2C
бромистый
H
спирт р-р
этил
H H
HO ......H C C Br
H2O + H2C = CH2 + Br
H H
CH2
Br
H2C = CH2 + Br + H2O
этилен
OH
15.
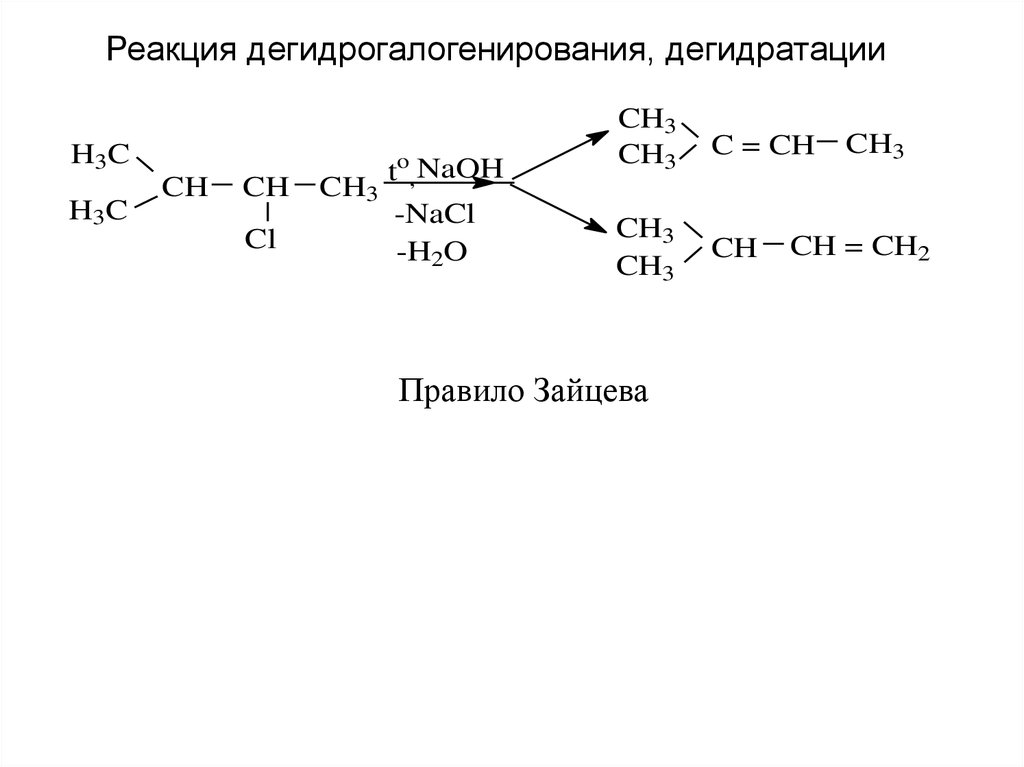
Реакция дегидрогалогенирования, дегидратацииH3C
H3C
CH
CH
Cl
CH3
to, NaOH
-NaCl
-H2O
CH3
CH3
C = CH
CH3
CH3
CH
Правило Зайцева
CH3
CH = CH2


 Химия
Химия








