Похожие презентации:
Альдегиды. Получение и применение. Общая формула альдегидов
1.
Известно, что спирты легкоокисляются. При их полном
окислении (горении) образуются
углекислый газ и вода. А под
действием различных окислителей
спирты способны окисляться до
более ценных продуктов, в том
числе и альдегидов.
2.
Н—
О
Н
—
—
Н—С—О—Н + [O]→ Н2О + Н—С
Н
Самым простым по составу является муравьиный альдегид,
который получают окислением метилового спирта.
3.
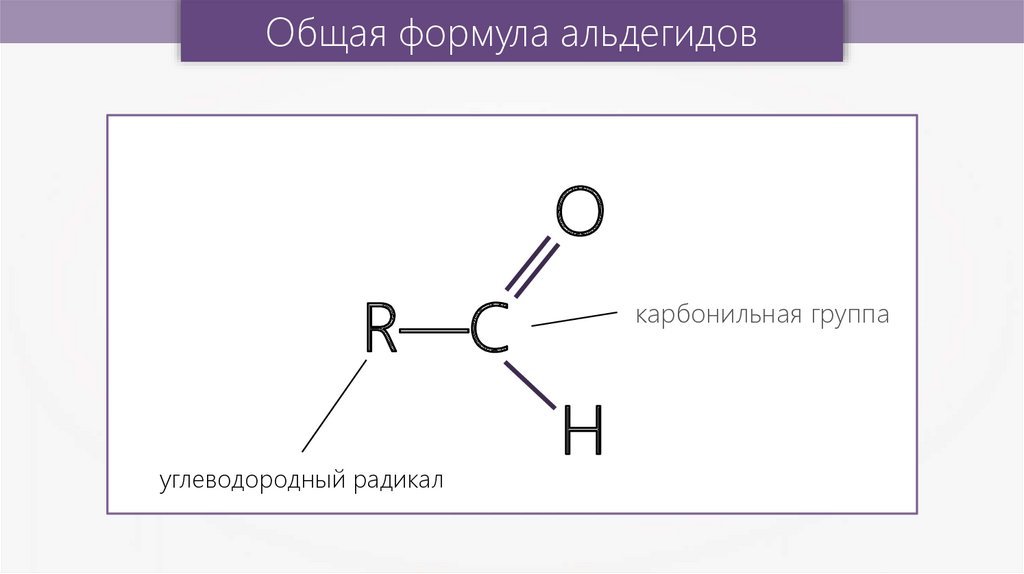
Общая формула альдегидовO
R—С
углеводородный радикал
карбонильная группа
H
4.
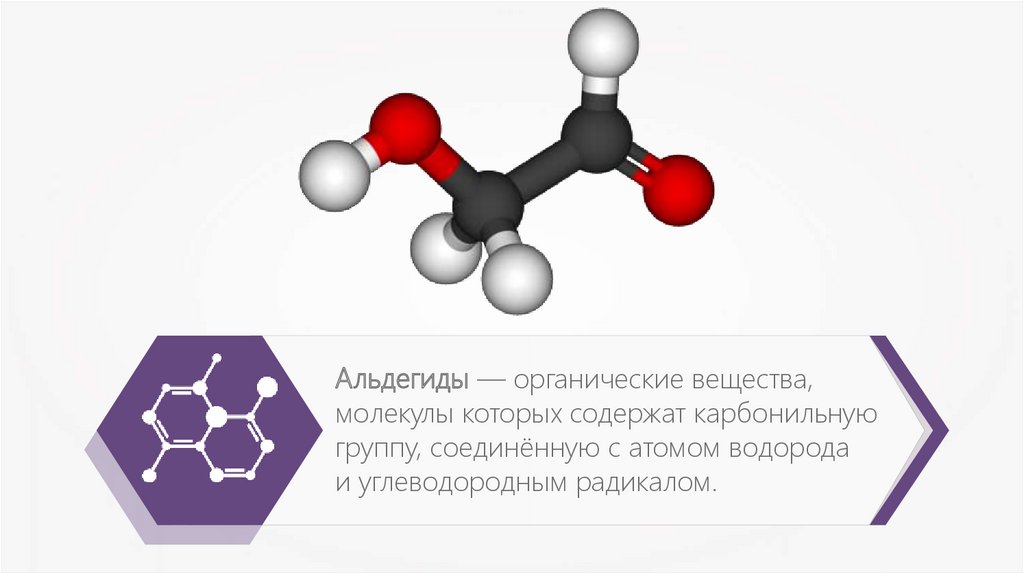
Альдегиды — органические вещества,молекулы которых содержат карбонильную
группу, соединённую с атомом водорода
и углеводородным радикалом.
5.
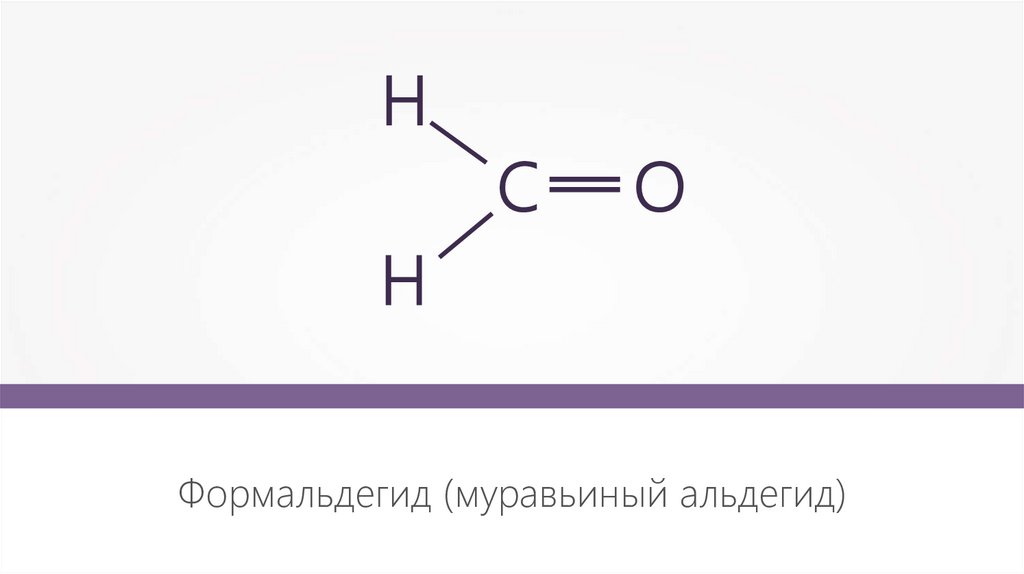
НС— О
Н
Формальдегид (муравьиный альдегид)
6.
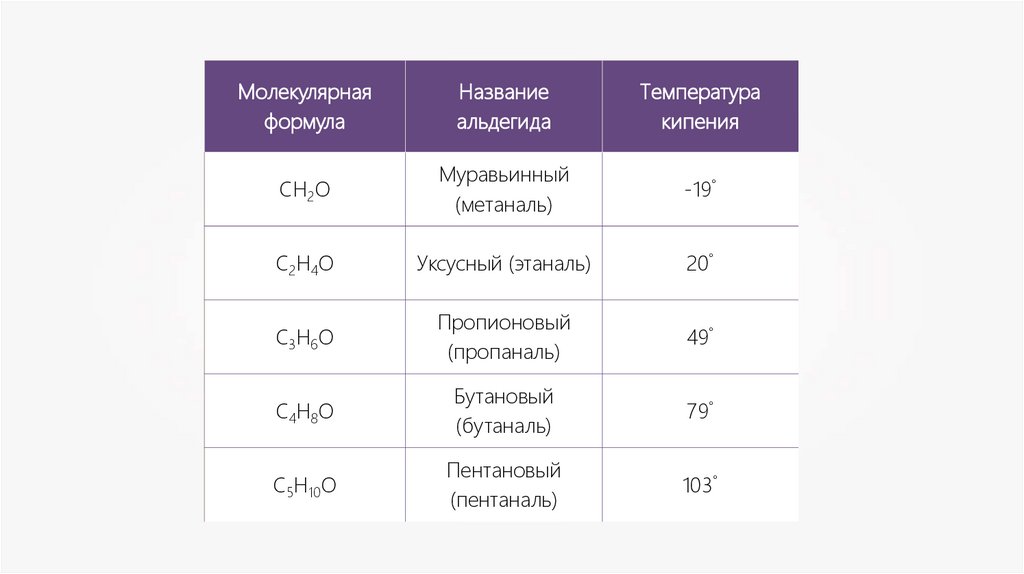
Молекулярнаяформула
Название
альдегида
Температура
кипения
СН2О
Муравьинный
(метаналь)
-19°
С2Н4О
Уксусный (этаналь)
20°
С 3 Н 6О
Пропионовый
(пропаналь)
49°
С4Н8О
Бутановый
(бутаналь)
79°
С5Н10О
Пентановый
(пентаналь)
103°
7.
этан + аль = этаналь,пропан + аль = пропаналь
При образовании названий по IUPAC наличие альдегидной
группы в молекуле обозначается
суффиксом -аль.
8.
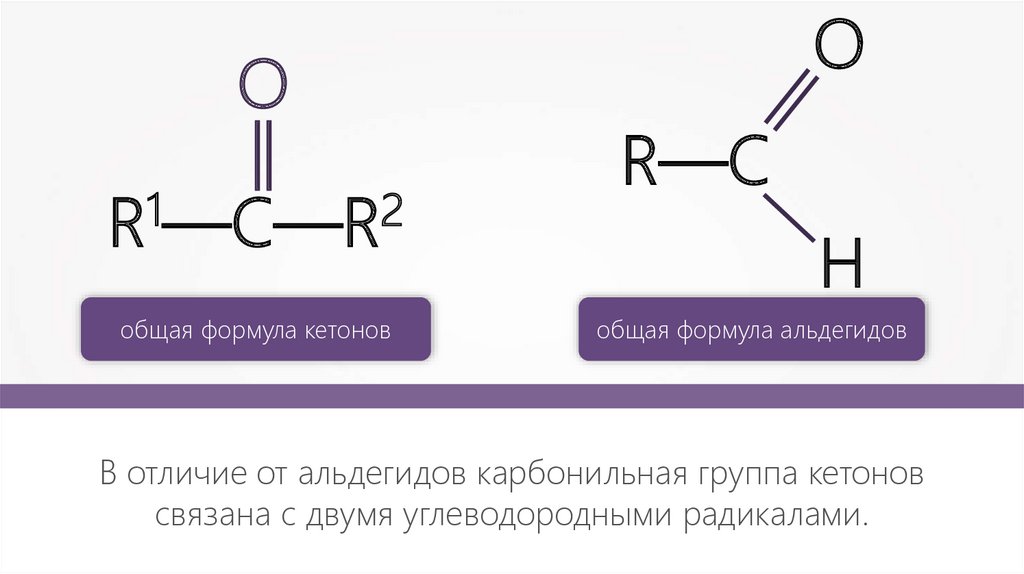
—О
1
2
R —С—R
общая формула кетонов
O
R—С
H
общая формула альдегидов
В отличие от альдегидов карбонильная группа кетонов
связана с двумя углеводородными радикалами.
9.
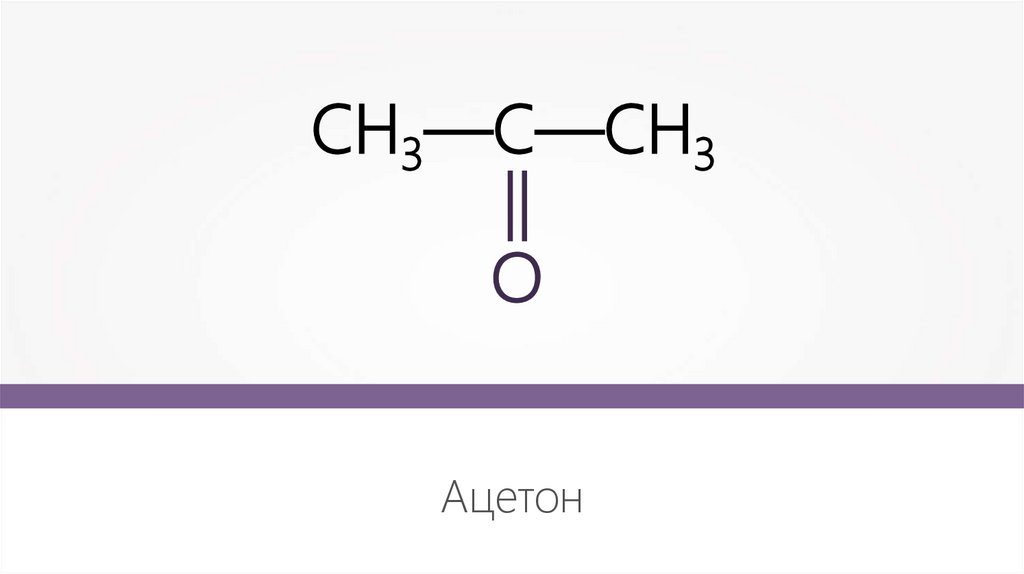
——
СН3—С—СН3
О
Ацетон
10.
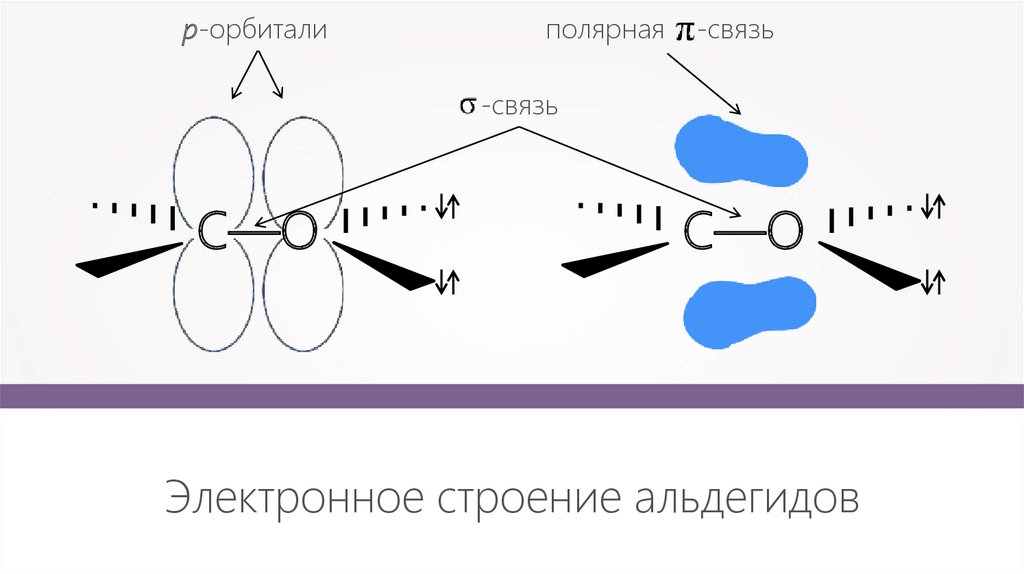
p-орбиталиполярная
-связь
-связь
С—О
С—О
Электронное строение альдегидов
11.
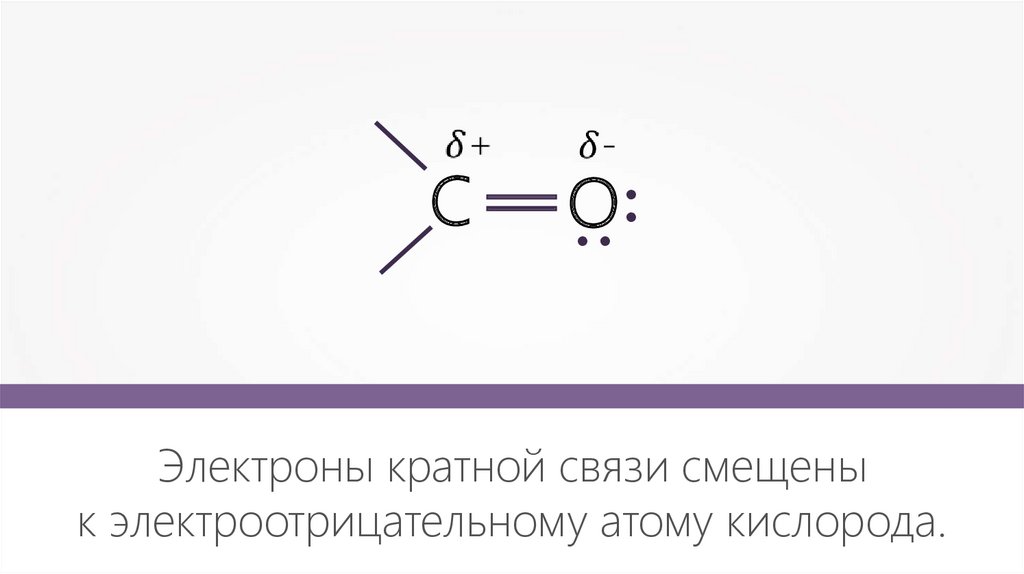
O꞉—
꞉
С
Электроны кратной связи смещены
к электроотрицательному атому кислорода.
12.
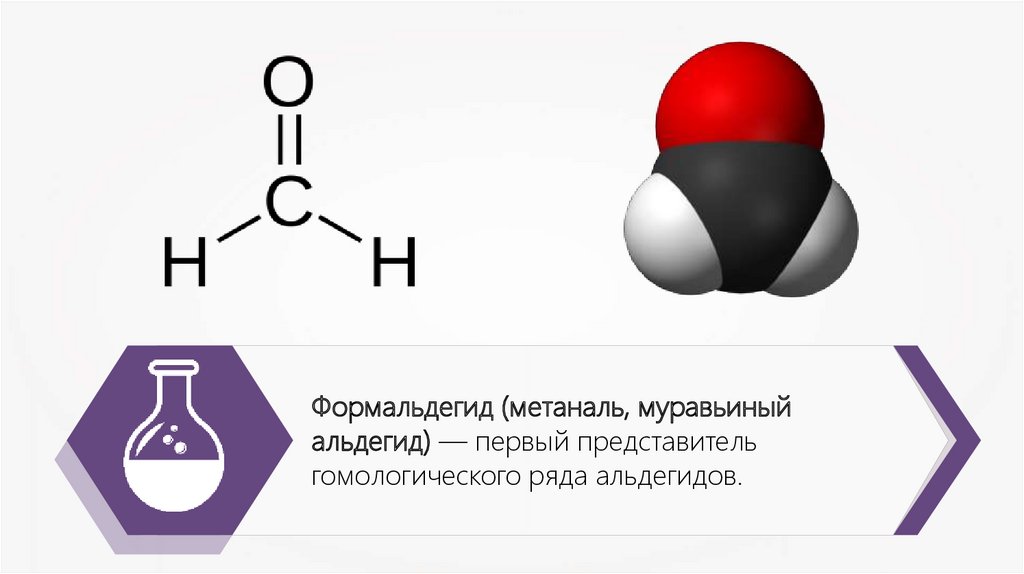
Формальдегид (метаналь, муравьиныйальдегид) — первый представитель
гомологического ряда альдегидов.
13.
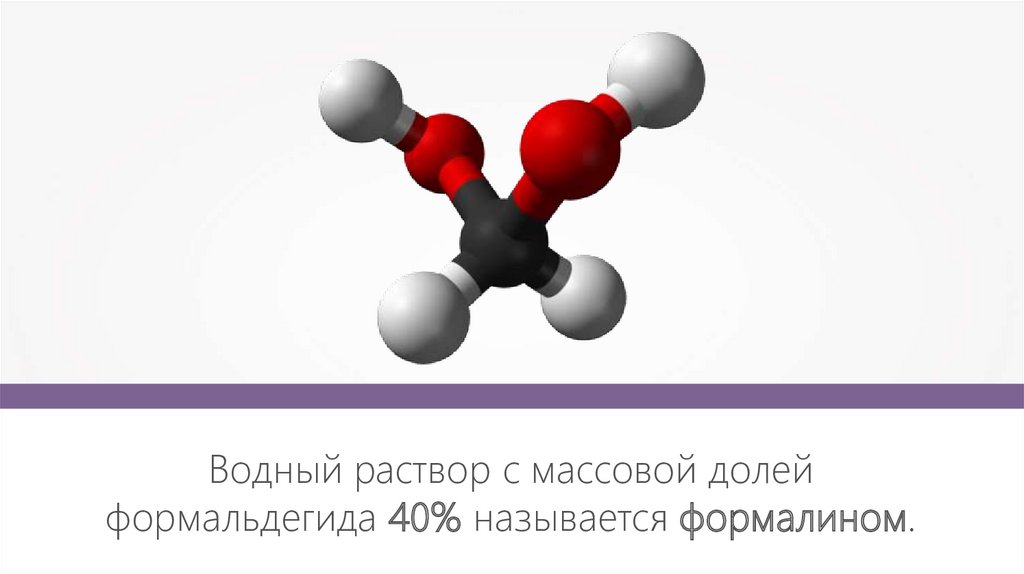
Водный раствор с массовой долейформальдегида 40% называется формалином.
14.
Реакции присоединения возможныв результате разрыва двойной связи
карбонильной группы.
15.
Присоединения водорода, котороепроисходит при пропускании смеси
формальдегида и водорода
под нагретым катализатором —
порошком никеля, приводит
к восстановлению альдегида в спирт.
RСН2OH
первичный спирт
16.
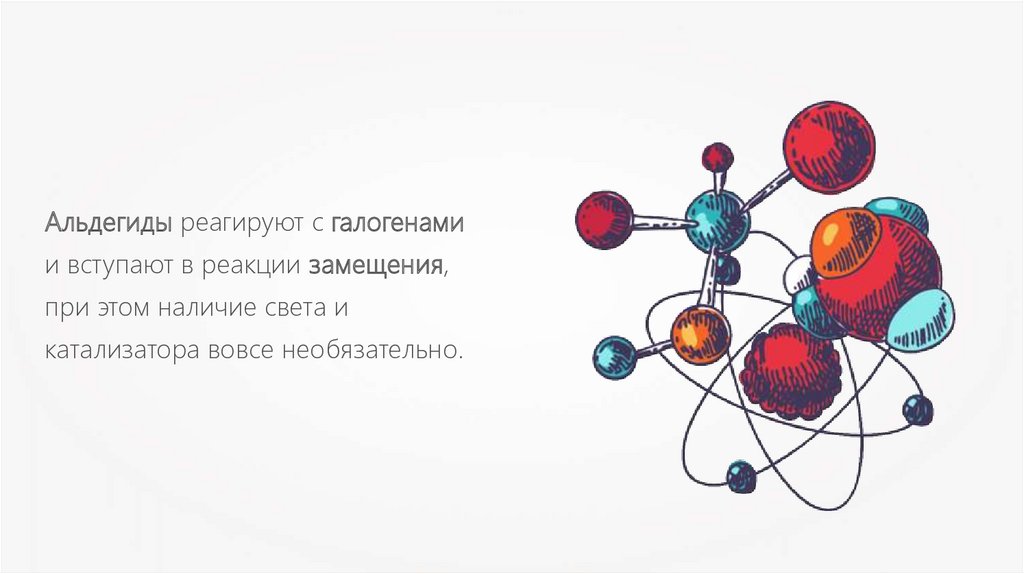
Альдегиды реагируют с галогенамии вступают в реакции замещения,
при этом наличие света и
катализатора вовсе необязательно.
17.
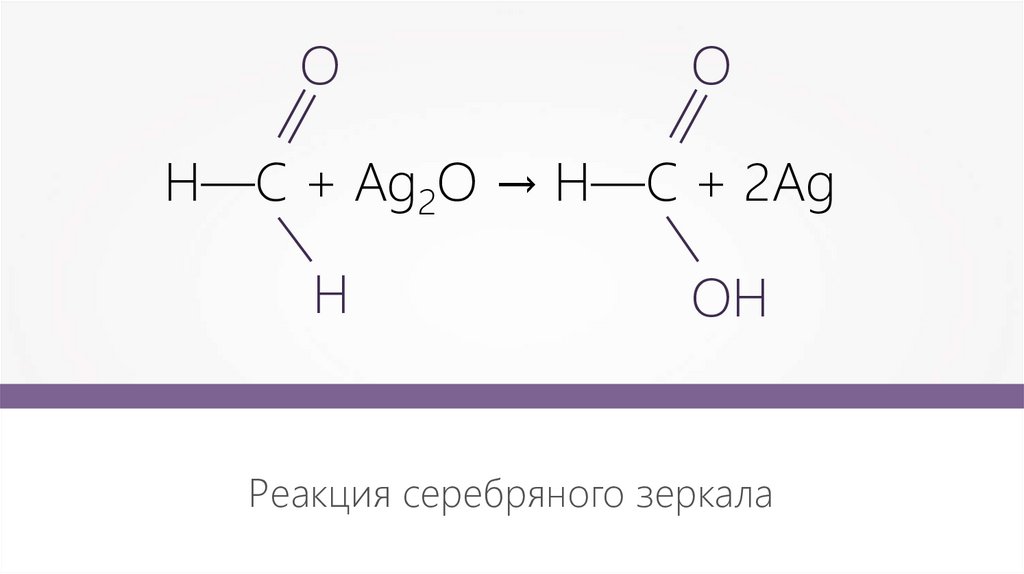
ОО
Н—С + Ag2O → Н—С + 2Ag
Н
ОН
Реакция серебряного зеркала
18.
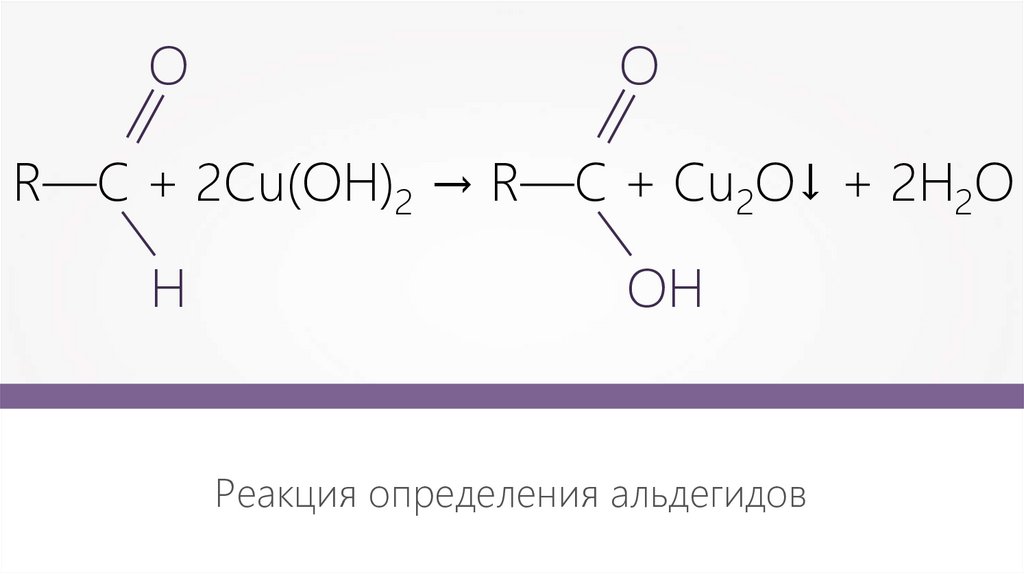
ОО
→
R—С + 2Cu(OH)2 → R—С + Cu2O + 2H2O
Н
ОН
Реакция определения альдегидов
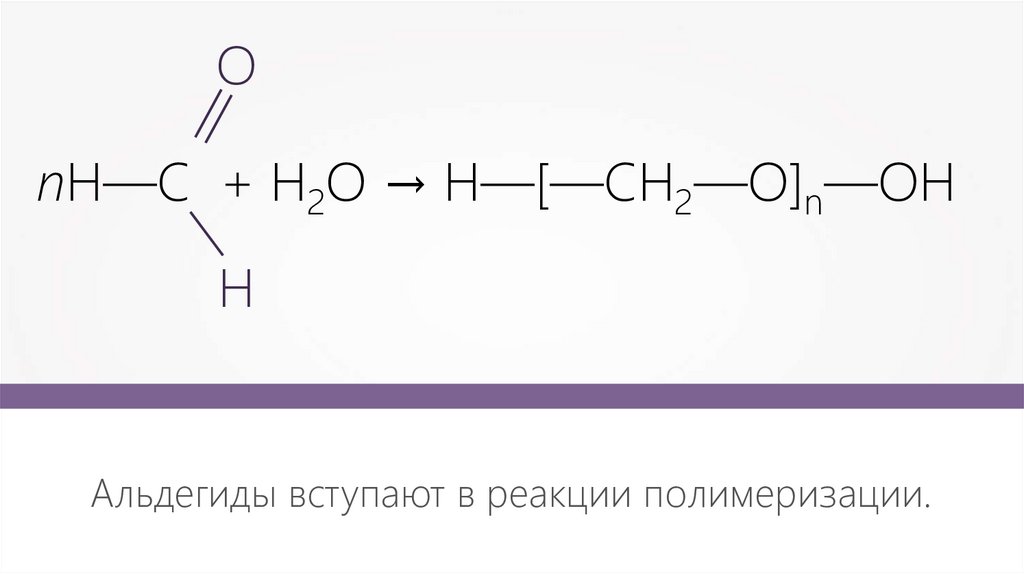
19.
ОnH—C + H2O → H—[—CH2—O]n—OH
Н
Альдегиды вступают в реакции полимеризации.
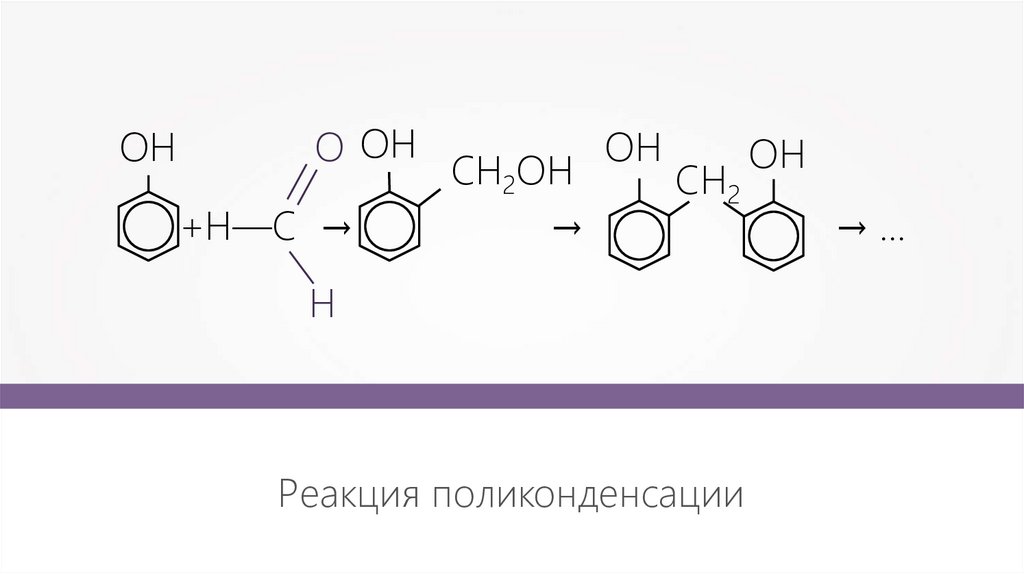
20.
OHО OH
+H—C →
CH2OH
→
OH
CH2
Н
Реакция поликонденсации
OH
→…
21.
Фенопласты — важнейшие заменителицветных и чёрных металлов во многих
отраслях промышленности.





 Химия
Химия








