Похожие презентации:
Общая характеристика металлов
1.
2.
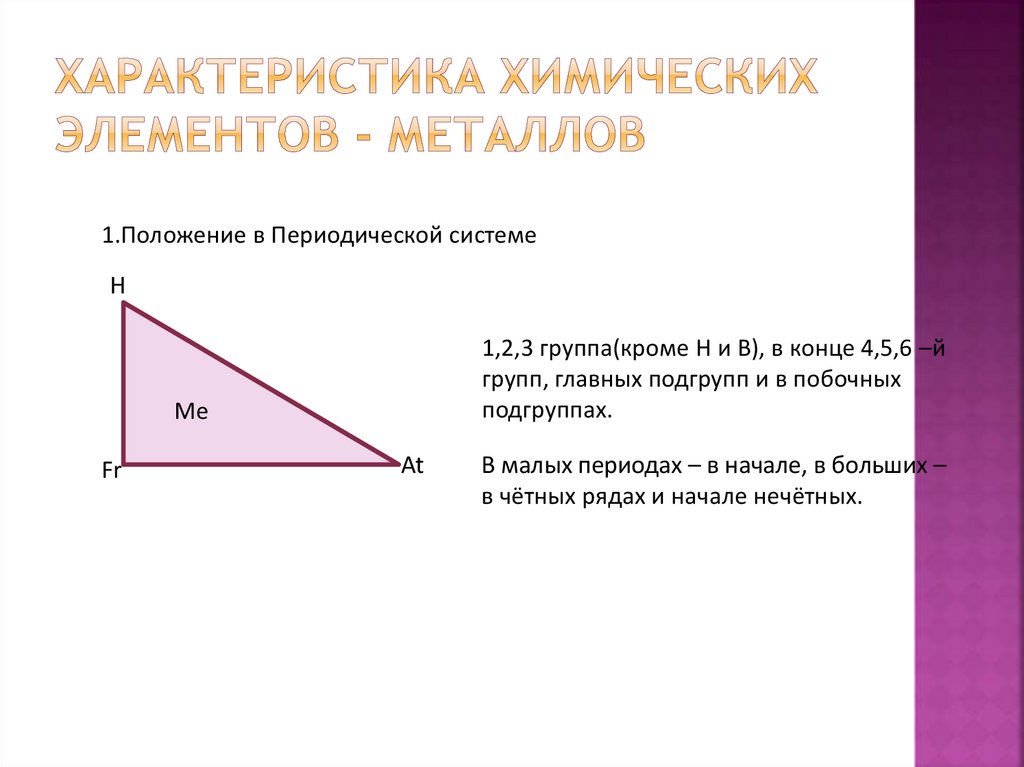
1.Положение в Периодической системеН
1,2,3 группа(кроме Н и В), в конце 4,5,6 –й
групп, главных подгрупп и в побочных
подгруппах.
Me
Fr
At
В малых периодах – в начале, в больших –
в чётных рядах и начале нечётных.
3.
+?Ме
Внешний слой от 1 до 3 е
Исключение составляют Ме IV-VII
групп главных подгрупп
Ra (Me) ›Ra (HeMe)
4.
0+n
Ме - ne→Ме
(окисление)
восстановитель
Степень окисления Ме :
0,+1,+2,+3 - низшая
+4,+5,+6,+7,+8 -высшая
5.
В периодеВосстановительные свойства уменьшаются, так
как увеличивается заряд ядра, увеличивается
число электронов на внешнем слое, частично
стягивается (уменьшается) Ra
В группе
В главной подгруппе восстановительные свойства
увеличиваются, так как увеличивается Ra
6.
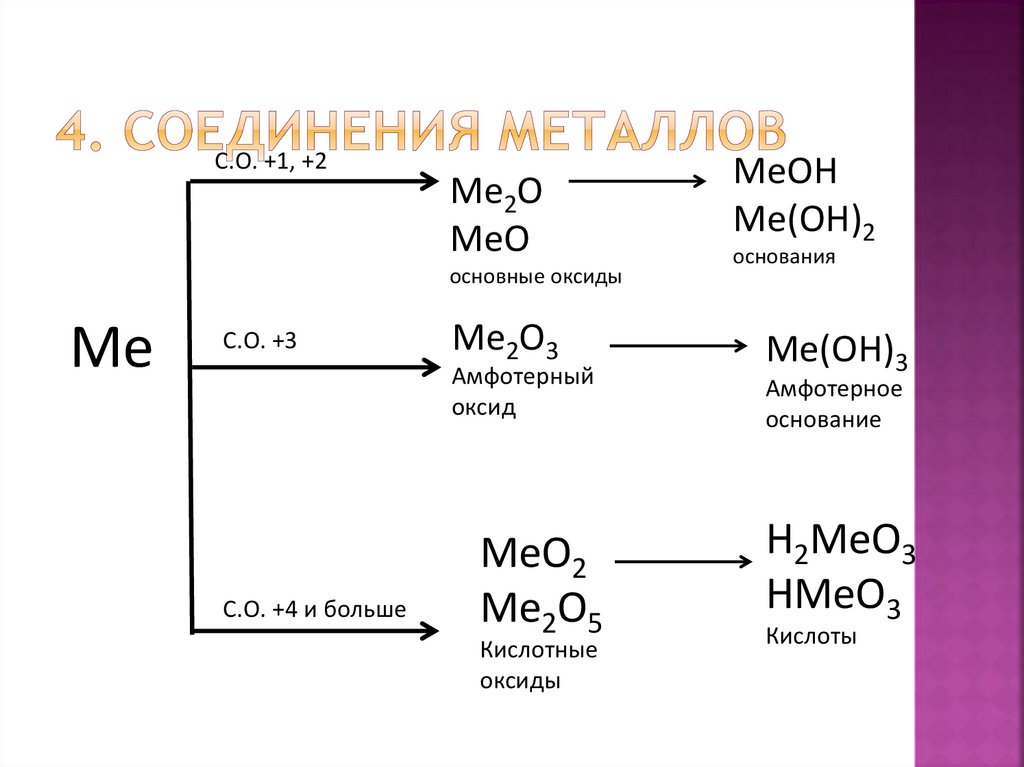
С.О. +1, +2Ме2О
МеО
основные оксиды
Ме
С.О. +3
Ме2О3
Амфотерный
оксид
С.О. +4 и больше
МеО2
Ме2О5
Кислотные
оксиды
МеОН
Ме(ОН)2
основания
Ме(ОН)3
Амфотерное
основание
Н2МеО3
НМеО3
Кислоты
7.
Самыйраспространённый Al,
затем Fe, Ca, Na, K…
Встречаются только в виде соединений, так как активные
8.
1. Состав и строение молекул металловМолекулы Ме – одноатомны.
Металлическая связь
Металлическая
кристаллическая решётка
9.
НеМеО2
+
Ме
Н2О
Оксид Ме
Оксид НеМе
?-? Основной оксид
?-? Амфотерный оксид
?-R(OH)n +H2
?-RO+H2
Mg+CuO→
Al+Fe2O3→
Mg+CO2→ C+?
кислота
Fe+HCl→
Особенности взаимодействия Ме с
азотной и серной кислотами
соль
Zn+CuCl2→







 Химия
Химия








